内毒素的量效和时效对人脐带间充质干细胞增殖的影响
2022-10-08孟明耀李欣欣熊晶晶侯宗柳黄永坤
袁 伟 ,孟明耀 ,李欣欣 ,熊晶晶 ,李 檬 ,曹 佳 ,刘 梅 ,侯宗柳 ,黄永坤
(1)昆明医科大学第一附属医院儿科,云南 昆明 650032;2)云南省肿瘤免疫防治研究重点实验室,云南 昆明 650051;3)昆明医科大学附属延安医院,云南 昆明 650051;4)云南省检验医学重点实验室,云南 昆明 650032)
干细胞移植是将干细胞处理后重新输入体内,以达到治疗疾病的一种新型生物疗法,在当前的再生医学时代,表现出广阔的前景。间充质干细胞(mesenchymal stem cells,MSCs)因具有天然的免疫抑制功能、强大的旁分泌功能及可向损伤组织迁移等特性[1],被视为一种较好的组织工程细胞和基因载体细胞。与其他来源的MSCs 不同,hUC-MSCs 来源于产妇分娩时的脐带,来源途径十分广泛,且排斥性低、获取手段简便,具有增殖率和克隆率高、体外细胞培养容易开展等生物学特性[2],可作为干细胞移植理想的种子细胞。随着hUC-MSCs 在临床治疗中的广泛应用,人们发现其增殖是影响临床疗效的重要生理因素,目前国内外学界对MSCs 的研究热点集中在激素[3]、离子[4]、年龄[5]等对其增殖的影响,然而干细胞移植部位周围的特殊炎性微环境才是影响其增殖的关键因素。
研究表明:LPS 会参与肝衰竭及各种并发症发生和发展的整个过程[6];在炎症性肠病患者的肠上皮病变部位,LPS 浓度升高[7];感染性骨不连骨折或骨缺损,其骨断端周围组织可检测出一定量的LPS[8],所以,利用hUC-MSCs 治疗疾病,过程中都将不可避免使hUC-MSCs 处于LPS 炎性微环境当中,与其发生接触,并影响其增殖。本研究通过探究最佳量效和时效的LPS 对hUCMSCs 增殖的影响,提供实验有效性依据,为进一步临床应用提供干细胞研究基础。
1 材料与方法
1.1 主要材料试剂与仪器
α-MEM 干细胞培养液(由昆明医科大学附属延安医院中心实验室提供),胰酶、胎牛血清FBS、磷酸盐缓冲液PBS(BI 公司),LPS(中国食品药品检定研究院中检所),96 孔板(无锡耐思生物科技有限公司),CCK-8 试剂盒(日本同仁,批号:2H779),细胞周期检测试剂盒(上海碧云天生物技术有限公司);CO2培养箱(Thermo 公司),倒置显微镜(奥特光学,BDS200 ),离心机(Eppendorf公司),酶标仪(Thermo 公司),流式细胞仪(贝克曼库尔特有限公司)。
1.2 主要方法
1.2.1 hUC-MSCs 的体外培养及传代本实验使用的hUC-MSCs 提取自昆明医科大学附属延安医院中心实验室干细胞库。在T75 的培养瓶中以1×106个/mL 的密度接种含10%FBS 的α-MEM干细胞,并放入37 ℃、5% CO2的恒温培养箱中进行培养。当细胞融合度达到80%左右时,弃上清,洗涤,胰酶消化,当细胞由长梭形转变为圆形时,弃胰酶,重悬后用台盼蓝稀释计数并继续在T75 的培养瓶中以上述密度及条件培养。用倒置显微镜观察到细胞24 h 内贴壁生长,呈长梭形,形态均一,当细胞融合程度达到约80%,排列成漩涡状、放射状、网格状时,培养成功。
1.2.2 LPS 的量效和时效对hUC-MSCs 增殖的影响选择第四代对数生长期细胞,常规洗涤消化后调整细胞密度为1.5×104个/mL,后接种于96 孔板,1 500 个/孔。在接种24h后更换为含LPS 终浓度为0.098、0.195、0.390、0.780、1.560、3.12、6.250、12.500、25.000 和50.000 EU/mL 的培养液。设不含LPS 的完全培养基为对照组,不含细胞及LPS 的完全培养基为空白组。分别于LPS 作用24h、48h、72 h 后更换培养液,加入每孔培养基总体积10% 的CCK-8 溶液,在37 ℃、5% CO2的培养箱中避光孵育1.5 h,用自动酶标检测仪在450 nm 的波长处测定吸光度(A 值)。
1.2.3 LPS 对hUC-MSCs 细胞周期的影响根据细胞增殖实验结果,选择促进hUC-MSCs 增殖的低浓度(0.098 EU/mL,实验组1)、中浓度(1.56 EU/mL,实验组2)和高浓度(25 EU/mL,实验组3)LPS、作用时间72 h 进行实验。取第四代对数生长期细胞,以0.5×106个/mL 密度接种于10 cm培养皿,细胞接种24 h 后分别更换为含LPS 浓度0.098 EU/mL、1.56 EU/mL、25 EU/mL 的条件培养基,以不含LPS 的完全培养基作为对照组。作用72 h 进行细胞周期检测:常规洗涤、消化后调整细胞密度为1×106个/mL,加入1 mL 细胞悬液至离心管内离心,弃上清;用70% 乙醇4 ℃进行细胞固定20 h,离心,弃上清后转移至流式管再次离心弃上清;在待检测样品中加入0.5 mL配置好的碘化丙啶染色液,37 ℃避光温浴30 min;用流式细胞仪在激光波长488 nm 波长处检测红色荧光,采用Modfit 软件进行细胞DNA 含量分析。
1.3 统计学处理
采用SPSS22.0 软件和GraphPadPrism5.0 软件进行统计学分析。正态分布的连续变量以均值±标准差()表示,2组之间的比较采用方差分析。检验水准α=0.05。
2 结果
2.1 LPS 的量效和时效对hUC-MSCs 增殖的影响
LPS 对hUC-MSCs 增殖的影响与LPS 的浓度及其作用时间均有关系,见表1 和图1A;不同条件下细胞增殖率见表2。在LPS 作用24 h 时(图1B),主要表现为抑制hUC-MSCs 的增殖,在浓度为0.78 EU/mL 时抑制作用最明显,随LPS 浓度降低或增高,其抑制作用均有减弱的趋势。作用48 h 时(图1C),抑制作用普遍减弱,高浓度组显示对细胞增殖无影响。作用72 h 时(图1D),LPS 表现出促进细胞增殖的趋势,且低浓度区域促进作用最显著,浓度增加其促增殖作用相对减弱。最高浓度组(50 EU/mL)在3 个时间点对细胞增殖均无显著影响。
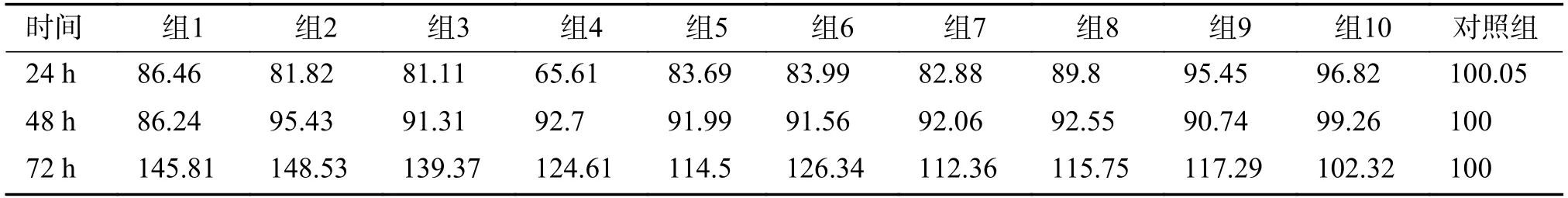
表2 LPS 不同浓度及不同作用时间hUC-MSCs 增殖率(%)Tab.2 Proliferation rates of hUC-MSCs at different dose-response and time-dependent of LPS(%)
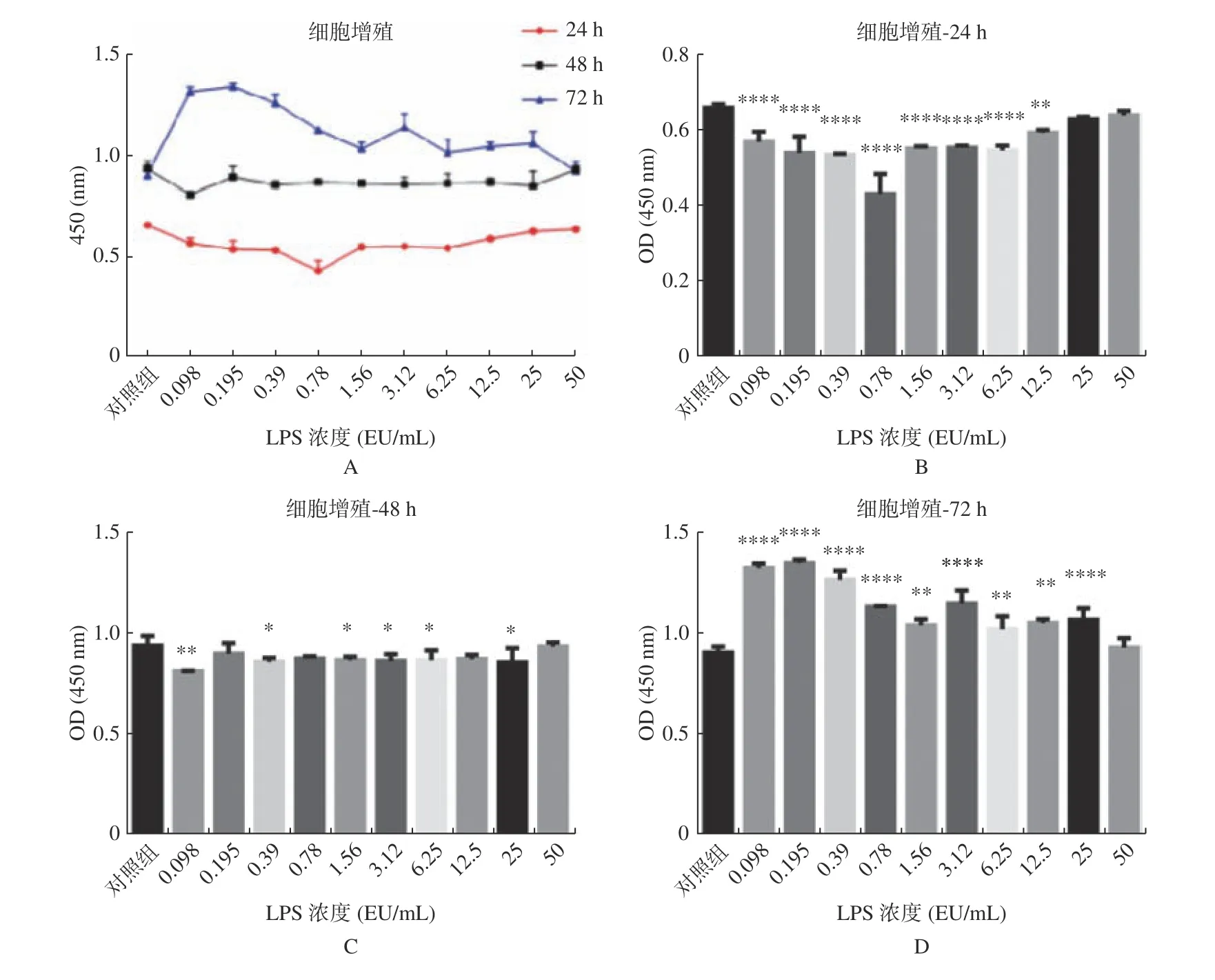
图1 不同浓度及不同作用时间的内毒素对hUC-MSCs 增殖的影响Fig.1 Effects of endotoxin with different concentrations and different time on the proliferation of hUC-MSCs
表1 LPS 不同浓度及不同作用时间hUC-MSCs 吸光度(A)值()Tab.1 Absorbance(A)of hUC-MSCs at different dose-response and time-dependent of LPS()
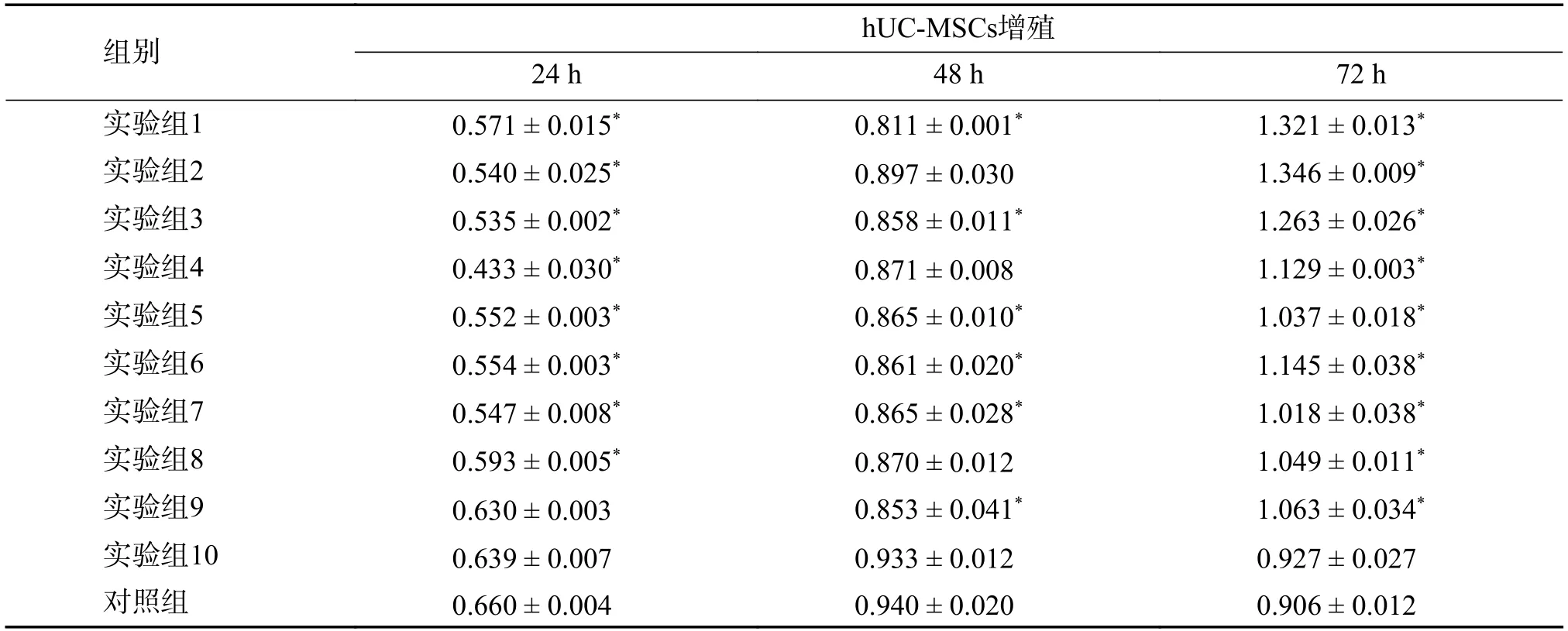
表1 LPS 不同浓度及不同作用时间hUC-MSCs 吸光度(A)值()Tab.1 Absorbance(A)of hUC-MSCs at different dose-response and time-dependent of LPS()
注:实验组1至10LPS终浓度依次为:0.098、0.195、0.39、0.78、1.56、3.12、6.25、12.5、25、50 EU/mL,表示分别在24 h、48 h、72 h时,与对照组相比,*P < 0.05。
2.2 LPS 对hUC-MSCs 细胞周期的影响
与对照组相比,当作用时间为72 h 时,实验组1 G0/G1 期的占比降低,S 期占比增高,G2/M期占比增高,实验组2 和实验组3 G0/G1 期的占比降低,S 期占比增高,G2/M 期占比与对照组比较,差异无统计学意义(表3、图2、图3)。
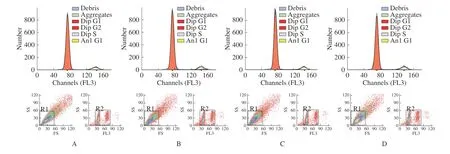
图2 LPS 刺激后流式细胞技术检测hUC-MSCs 细胞周期代表图例Fig.2 Cell cycle of hUC-MSCs tested by flow cytometry after LPS stimulation
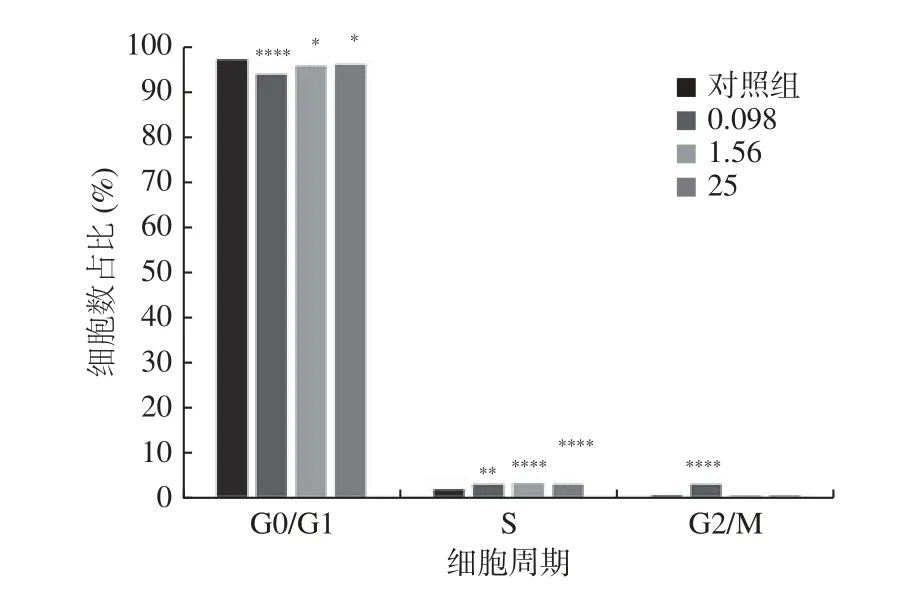
图3 不同浓度LPS 作用72 h 时hUC-MSCs 细胞周期比例Fig.3 Proportion of hUC-MSCs cell cycle after 72 h of LPS with different concentrations

表3 LPS 对hUC-MSCs 细胞周期的影响(%)Tab.3 Effect of LPS on huc-Mscs cell cycle(%)
3 讨论
LPS 是革兰氏阴性菌细胞壁中的一种成分,在菌体裂解后得以释放,是菌体中存在的毒性物质的总称。LPS 与许多慢性疾病的病理生理学有关,是其发病的重要原因,包括胃肠道疾病如肠易激综合征[9],心血管疾病如冠心病[10],中枢神经系统退行性疾病如帕金森病[11]等。在利用hUCMSCs 进行干细胞移植治疗疾病时,过程中都将不可避免接触LPS,并影响其增殖。
hUC-MSCs 的增殖是影响干细胞移植临床疗效的重要生理因素,对于LPS 对hUC-MSCs 增殖的影响,本研究通过CCK-8 增殖实验和流式细胞术进行探讨。首先CCK-8 检测结果提示,LPS 的量效和时效对hUC-MSCs 的增殖表现出不同的效应,仅当作用时间为72 h,才表现出增殖效应,且低浓度区域促进作用更显著,浓度增加其促增殖作用相对减弱,当作用时间为24、48 h,表现为抑制hUC-MSCs 增殖。为了进一步验证该结果,采用流式细胞术检测细胞周期。细胞周期包括G0 期(休眠期),G1 期(DNA 合成前期),S 期(DNA 合成期)以及G2 期(DNA 合成后期),分裂期又称为M 期。根据流式细胞术结果,低浓度LPS 处理72 h 后细胞周期的G0/G1 期占比降低,S 期占比增高,G2/M 期占比增高,提示促进hUCMSCs 增殖。
以上两项实验结果均提示低浓度LPS 且作用时间长时可促进hUC-MSCs 增殖,这可用预处理对细胞的保护作用解释,对此,侯玉森等[12]得到了相同的结论,低浓度LPS 预处理可促进hUCMSCs 增殖,提高细胞LPS 耐受性。目前已有大量不同学科及领域的研究证实预处理可减轻脏器损伤、减少细胞凋亡,起到良好的保护作用[13-16]。LPS 预处理对心[17]、肝[18]、脑[19]缺血再灌注损伤具有保护作用,而缺氧[20]、炎症因子[21]、红细胞生成素[22]、川芎嗪[23]预处理可促进MSCs 增殖。
综上所述,hUC-MSCs 的增殖与LPS 的量效和时效均有关系,根据实验结果,利用hUCMSCs 进行干细胞移植治疗疾病时,可根据这一特性提前用低浓度LPS 预处理hUC-MSCs,这样可增加细胞增殖率,减少凋亡,为干细胞移植应用于临床提供新思路。
