miR-125a-3p 对动脉粥样硬化斑块及M1/M2巨噬细胞、MMP-9 和VEGF 的影响
2022-10-08刘演龙光雪峰尹小龙戴海龙
刘演龙,光雪峰,尹小龙,戴海龙
(昆明医科大学附属延安医院心内科/云南省心血管疾病重点实验室/云南省心脏疾病临床医学中心,云南 昆明 650051)
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症主导的疾病,其首要驱动因素是巨噬细胞表型失调[1]。激活的巨噬细胞主要被极化成两种表型,经典激活的M1 和间接激活的M2 巨噬细胞,启动并促进炎症是M1 巨噬细胞的主要作用,而M2 巨噬细胞的主要作用为抑制炎症[2]。在炎症的早期启动中,由于各种炎症因子的诱导,M1 巨噬细胞被大量激活,能够有效清除病原体;随着炎症进展,激活了大量的M2 巨噬细胞,炎症反应被抑制[2-3]。Schmitz 等[4-5]发现,M2 巨噬细胞主要存在于稳定性动脉粥样硬化斑块中,而M1巨噬细胞主要存在于不稳定性动脉粥样硬化斑块中,提示斑块的不稳定可能是由于M1 和M2 之间失衡。
MicroRNA 在单核细胞向巨噬细胞分化过程中起着重要的调控作用。最近研究显示,随着单核细胞分化为M1 巨噬细胞,miR-125a-3p 和miR-125a-5 在此过程中也表达升高。M1 巨噬细胞比例的升高,M1/M2 巨噬细胞的分化失衡,导致不稳定斑块的形成[6-7]。研究发现MMP-9、VEGF 在不稳定斑块中呈高表达[8-9],并且MMP导致巨噬细胞积累,VEGF 将巨噬细胞诱导为M1巨噬细胞[10-11],表明MMP-9、VEGF 在不稳定斑块中起重要作用。笔者的研究[12]显示miR-125a-3p 在动脉粥样硬化斑块的不稳定及破裂中也起着重要的作用。本研究拟进一步在动物体内实验,观察miR-125a-3p 抑制剂对动脉粥样硬化斑块形成、M1/M2 巨噬细胞以及斑块组织中MMP-9 和VEGF 表达的影响,以探讨其在动脉粥样硬化斑块的稳定性中的作用,为不稳定斑块的防治提供新的药物靶点。
1 材料与方法
1.1 实验动物
15 只成年雄性健康日本大耳兔,体重2~2.5 kg,由昆明医科大学实验动物学部提供。本研究经医院伦理委员会审批,实验动物的处理符合实验动物相关要求。
1.2 主要试剂和仪器
牛血清白蛋白(Solarbio)、0.5% 胆固醇,l0%蛋黄,5% 猪油、miR-125a-3p 干扰慢病毒载体(广州复能基因有限公司)、生理盐水、甲醛溶液、70%乙醇、4% 中性福尔马林、油红O 染液、0.01M 的PBST、2%BSA、CD11c抗体(Affinity)、CD206抗体(Affinity)、VEGF抗体(Santa Cruz Biotechmology)、MMP-9 抗体(Solarbio)。Axio Lab A1 显微镜(蔡司)、Axio Observer A1 荧光显微镜(蔡司)。
1.3 实验方法
1.3.1 兔动脉粥样硬化模型的建立及miR-125a-3p 抑制剂干预15 只成年雄性健康日本大耳兔,给予普通饲料和水适应性喂养7 d,再将其随机分为3组,对照组、动脉粥样硬化模型组(AS 模型组)和miR-125a-3p 抑制剂干预组(miR-125a-3p抑制剂组)。对照组给以普通饲料喂养,动脉粥样硬化模型组和miR-125a-3p 干预组一次性静脉注射牛血清白蛋白(250 mg/kg),即日起给予(0.5% 胆固醇,l0% 蛋黄,5% 猪油)150 g/d 喂养2 周,给予动脉粥样硬化模型组和miR-125a-3p干预组第2 次注射牛血清白蛋白(250 mg/kg),并继续给予高胆固醇饲料喂养。期间,所有组提供充足干净水,定期打扫和清洗兔笼。分别于动脉粥样硬化建立4 周和8 周后,miR-125a-3p 干预组注射以miR-125a-3p 干扰慢病毒载体(5 mL/只),对照组和动脉粥样硬化模型组注射以等量生理盐水,12 周时耳缘静脉注射空气处死兔子,立即剖开胸、腹腔,游离主动脉全长,剥离外膜脂肪组织,纵行剖开,行以下述处理。
1.3.2 血管内膜油红“O”染色血管粥样斑块大体标本染色步骤(1)从甲醛溶液中取出标本,用流水洗15 min,剥去外膜,再用蒸馏水浸洗;(2)取储备液60 mL 加入蒸溜水至100 mL,混匀放置10 min 后染色,染色时间为2~4 min;(3)用70%乙醇浸泡标本至斑块呈红色,底色呈白色为止,最后用蒸馏水浸泡标本,浸入甲醛溶液中保存。油红O 染液的配制:储备液:油红O 0.5 g,98%异丙醇 100 mL。临用前取上液6 mL,加蒸馏水4 mL,静置10 min,过滤即可。
1.3.3 免疫组织化学方法检测斑块组织中MMP-9、VEGF主动脉经4% 中性福尔马林固定后,石蜡切片进行MMP-9、VEGF 表达测定(SP 法,阴性对照一抗用0.01 mol/L PBS 代替)。显微镜下拍照后用“Image Pro Plus 4.5”软件进行图像分析,测定阳性物质表达面积和积分光密度。
1.3.4 免疫荧光法检测M1 标志物CD11c、M2标志物CD206 石蜡切片经脱蜡、酒精脱水后,进行抗原修复,用0.01 M 的PBST 漂洗5 min,重复3 次;以2% BSA 于37 ℃湿盒内封闭30 min;标本片上滴加适当稀释的荧光标记抗体,放在湿盒中,37 ℃孵育30 min,0.01 mol/L PBS 漂洗5 min,重复3 次,不时震荡。缓存甘油封片,镜检。
1.4 统计学处理
SPSS 11.0 软件进行统计学分析。计量资料以均数±标准差表示,多组间均数比较应用方差分析,P< 0.05 为差异有统计学意义。
2 结果
2.1 血管内膜油红“O”染色结果
血管内膜油红“O”染色显示,动脉粥样硬化病变处被染成红色。血管内膜油红“O”染色统计结果显示动脉粥样硬化组病变区域远大于miR-125a-3p 抑制剂干预组,各组间的差异具有显著性(P< 0.01)(图1、图2)。结果表明:miR-125a-3p 抑制剂能减少动脉粥样硬化斑块的形成。
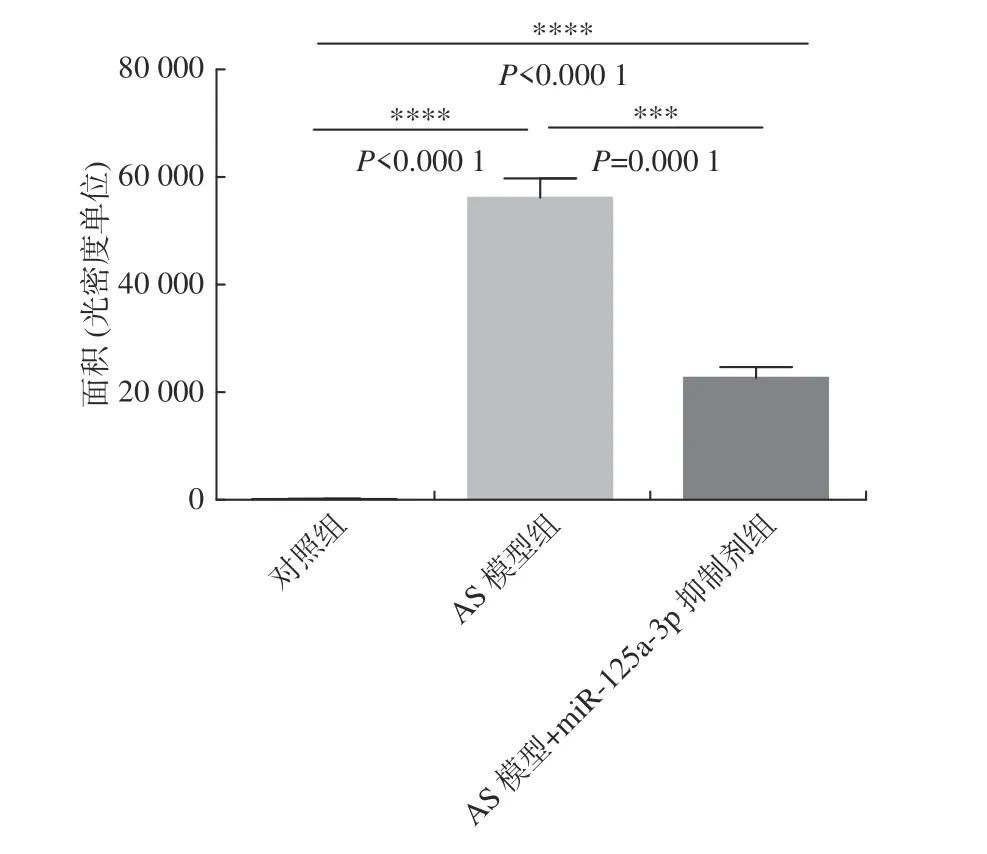
图1 血管内膜油红“O”染色各组动脉粥样硬化病变区域Fig.1 Vascular intima oil red "O" staining for atherosclerotic lesions in each group

图2 血管内膜油红“O”染色Fig.2 Vascular intima is stained with oil red "O" stain
2.2 免疫组织化学方法检测斑块组织中MMP9的结果
MMP-9 免疫组化染色结果显示,与对照组比较,AS 模型组的MMP-9 水平显著升高(P<0.001),与AS 模型组比较,miR-125a-3p 抑制剂干预后MMP-9 水平显著下降(P< 0.01)(图3、图4)。结果表明:miR-125a-3p 抑制剂干预后,降低了斑块组织中MMP-9 的表达。
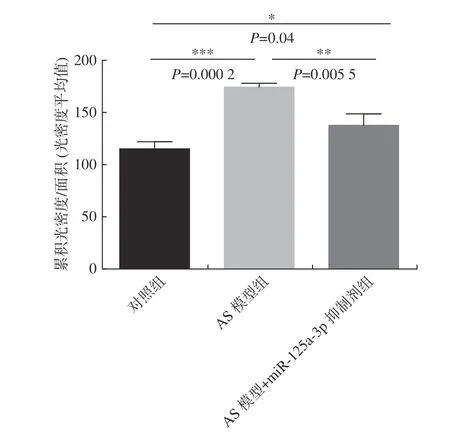
图3 免疫组化检测各组MMP-9 表达水平Fig.3 The expression level of MMP-9 was detected by immunohistochemistry
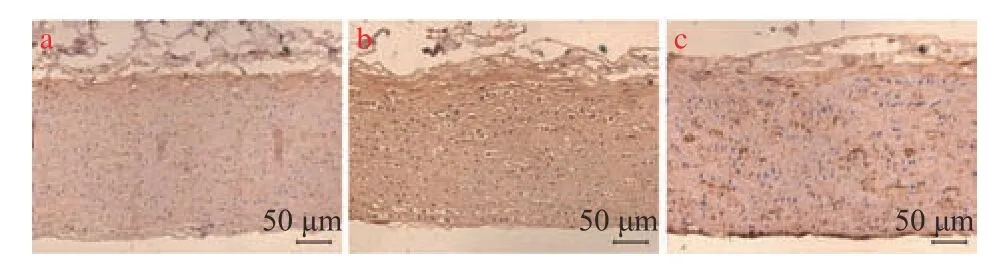
图4 MMP-9 免疫组化染色(×200)Fig.4 MMP-9 immunohistochemical staining(×200)
2.3 免疫组织化学方法检测斑块组织中VEGF 的结果
VEGF 免疫组化染色结果显示,与对照组对比,AS 模型组的VEGF 水平显著提高(P< 0.01);与AS 模型组对比,miR-125a-3p 抑制剂干预后VEGF 水平下降,(P< 0.01)(图5、图6)。结果表明:miR-125a-3p 抑制剂干预后,降低了斑块组织中VEGF 的表达。
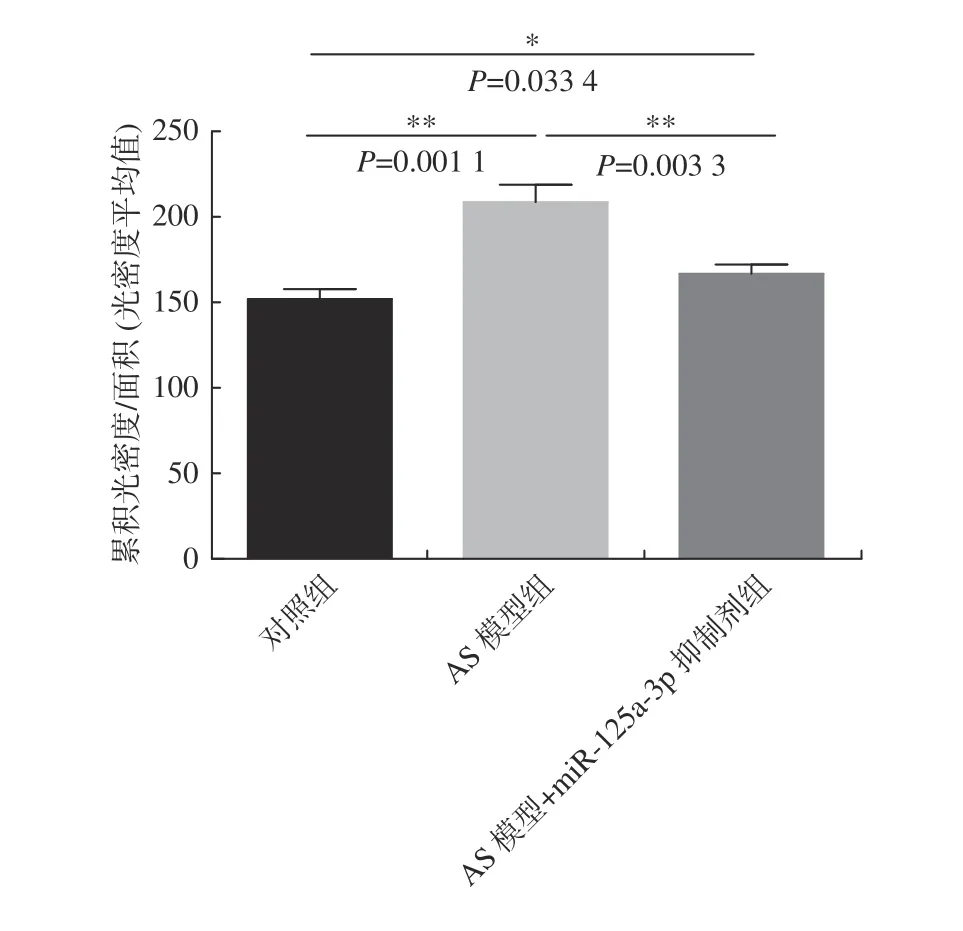
图5 免疫组化检测各组VEGF 表达水平Fig.5 Immunohistochemistry was used to detect VEGF expression levels in each group
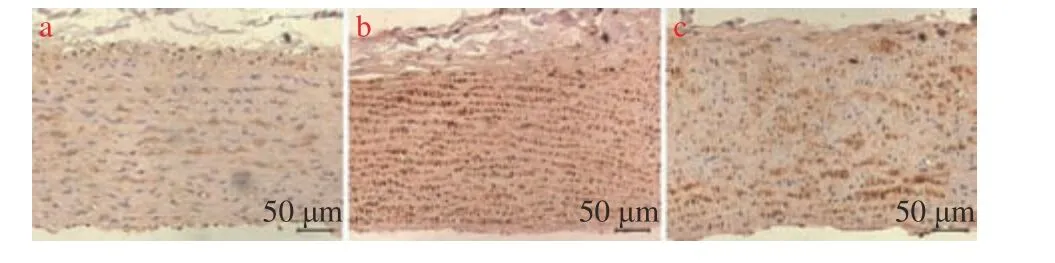
图6 VEGF 免疫组化染色(×200)Fig.6 VEGF immunohistochemical staining(×200)
2.4 免疫荧光染色检测M1 标志物CD11c 的结果
免疫荧光检测M1 标志物CD11c 染色结果显示:与对照组比较,AS 模型组的CD11c 水平有明显升高(P< 0.000 1);与AS 模型组比较,miR-125a-3p 抑制剂干预后CD11c 水平显著下降(P<0.000 1)(图7、图8)。结果表明:miR-125a-3p抑制剂减少了斑块组织中M1 巨噬细胞。
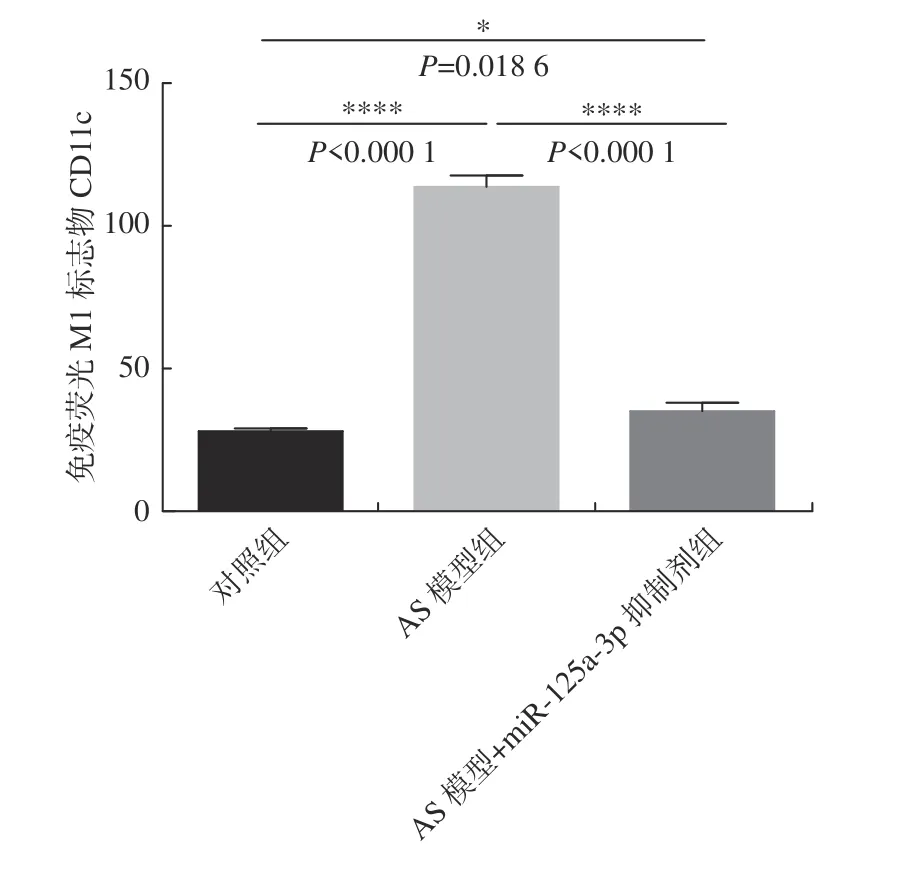
图7 免疫荧光检测各组M1 标志物CD11c 表达水平Fig.7 The expression level of M1 marker CD11c was detected by immunofluorescence
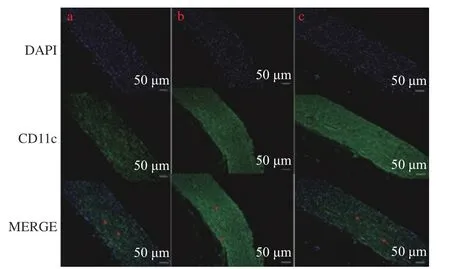
图8 M1 标志物CD11c 免疫荧光染色(×200)Fig.8 M1 marker CD11c immunofluorescence staining(×200)
2.5 免疫荧光染色检测M2 标志物CD206 的结果
免疫荧光检测M2 标志物CD206 染色结果显示,与对照组对比,AS 模型组的CD206 水平显著下降(P< 0.000 1),miR-125a-3p 抑制剂干预后CD206 水平明显升高(P< 0.000 1)(图9、图10)。结果表明:miR-125a-3p 抑制剂增加了斑块组织中M2 巨噬细胞。
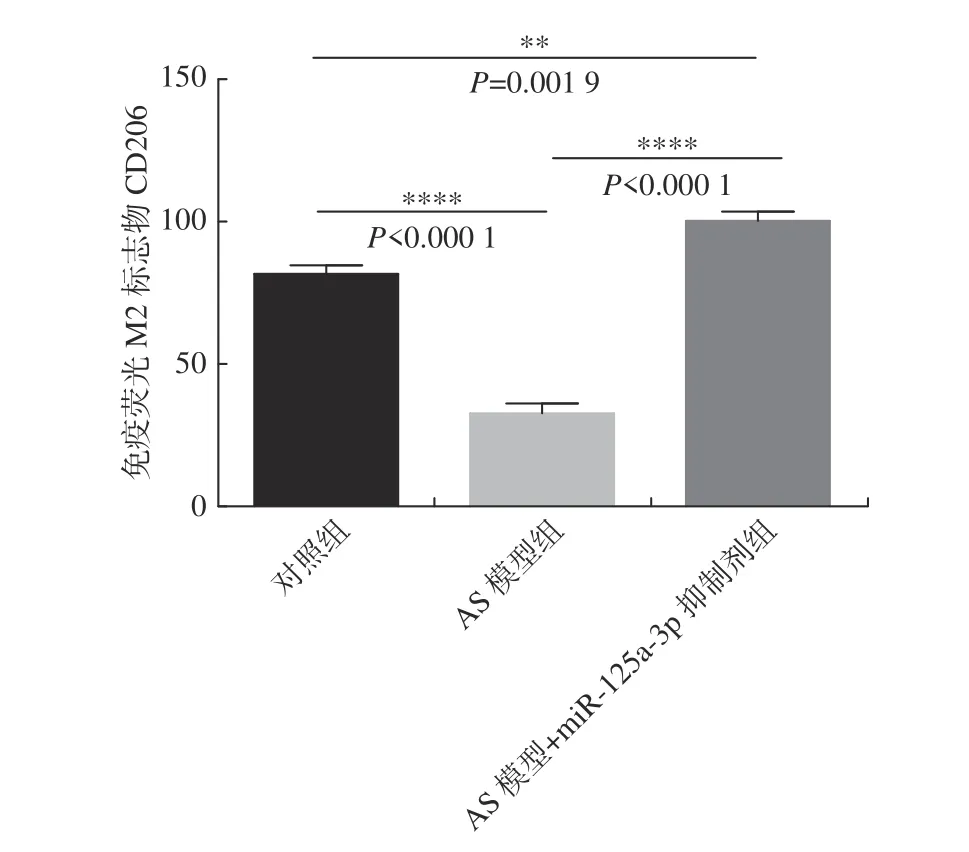
图9 免疫荧光检测各组M2 标志物CD206 表达水平Fig.9 The expression level of M2 marker CD206 was detected by immunofluorescence

图10 M2 标志物CD206 免疫荧光染色(×200)Fig.10 M2 marker CD206 immunofluorescence staining(×200)
3 讨论
AS 是一种慢性炎症性疾病,严重威胁人体健康。研究表明,不稳定AS 斑块容易导致不良心血管事件的发生[13-14]。巨噬细胞是AS 病变中主要的免疫细胞,在AS 整个病理生理过程中都发挥着重要作用[5]。在动脉粥样硬化中,当循环中的单核细胞进入内膜后,单核细胞会分化为巨噬细胞[15]。巨噬细胞和单细胞暴露在炎症细胞因子、氧化脂质、胆固醇晶体和其他因素中。所有这些刺激不仅诱导特定的转录反应,而且还广泛相互作用,导致动脉粥样硬化斑块中巨噬细胞的转录[7]。基于不同的激活方式,巨噬细胞主要分为两种表型,即经典激活的M1 和替代激活的M2 巨噬细胞[2-3]。M1 巨噬细胞能够开始并维持炎症反应,分泌促炎细胞因子,激活内皮细胞,并诱导其他免疫细胞募集到发炎组织中;另一方面,M2巨噬细胞促进炎症的消退,吞噬糖凋亡细胞,驱动胶原蛋白沉积,协调组织完整性,释放抗炎介质,主要参与组织修复,具有吞噬、促血管生成和促纤维化能力。M1 巨噬细胞在促进斑块不稳定方面发挥了重要作用,而M2 巨噬细胞则维持斑块的稳定,提示斑块的不稳定可能是M1 和M2亚型之间失衡的结果[6,16]。
miRNA 是一种小型、进化保守的非编码RNA,长度为18~25 个核苷酸,在基因调控中具有重要作用,转录后调控基因表达[17-18]。miRNA 可以抑制数千个目标基因并协调正常过程,包括细胞增殖、分化和凋亡[19]。同时,miRNA 对巨噬细胞的激活起到重要调节作用[7],例如Lin-Li Lv 等的研究表明[20],外体miR-19b-3p 调节的TEC 和巨噬细胞之间的通路,导致M1 巨噬细胞激活。由于M1 巨噬细胞加剧斑块的不稳定,因此,笔者可以推测miRNA 对不稳定斑块的发生起到了一定的作用。笔者的研究[12]也提示miR-125a-3p 在动脉粥样硬化斑块的不稳定及破裂中起着重要的作用。
VEGF 是一种有效的内皮细胞生长因子和血管生成诱导因子,对血管的完整性和血管功能具有重要意义。研究发现,VEGF 在不稳定斑块中发挥着重要作用,能在一定程度上加速动脉粥样硬化斑块的进展和不稳定性。其机制可能是VEGF 增加血管通透性,引起红细胞外渗,进而导致斑块内出血,加速动脉粥样硬化[21]。基质金属蛋白酶-9(MMP-9)属于MMP 家族,并已被广泛研究。随着MMP-9 活性的增加,MMP-9 可导致纤维帽变薄,从而导致斑块的不稳定[22]。
本研究结果显示,抑制miR-125a-3p 可使动脉粥样硬化斑块病变区域面积减少,斑块组织中M1 巨噬细胞、MMP-9,VEGF 表达减少,M2 巨噬细胞增加。提示miR-125a-3p 抑制可以减轻动脉粥样硬化斑块形成,平衡M1/M2 巨噬细胞,减少MMP-9,VEGF 表达,促进斑块稳定,miR-125a-3p 可能是治疗不稳定动脉粥样硬化斑块的新靶点。
