六种植物生长调节剂促进裂壶藻油脂和DHA积累的研究*
2022-10-04杨雨欣唐裕芳李玉芹张妙玲
张 剑,杨雨欣,唐裕芳,李玉芹,周 蓉,张妙玲
(湘潭大学 化工学院,湖南 湘潭 411105)
0 引言
二十二碳六烯酸(DHA)是一种对人体十分重要的ω-3多不饱和脂肪酸(PUFAs)[1],具有预防心血管疾病、健脑益智和抗癌、抗过敏等重要的生理功能,在保健食品、饲料、医疗等行业具有广泛的商业应用前景[2-3].DHA的传统来源是深海鱼油,但由于目前的海洋资源日益枯竭和环境污染造成鱼油产量和质量无法满足消费者对DHA的需求,因此,急需开发新的DHA绿色生产途径以解决现有问题.海洋微藻裂壶藻是DHA等PUFAs的初级生产者,因其生长的营养要求相对简单,生长环境可控,受到人们的广泛重视,已成为PUFAs 的替代来源.但是,微藻细胞较低的产量和较高的培养成本限制了PUFAs大规模使用.
提高PUFAs产量除了提高微藻中PUFAs含量,还需提高微藻的生物量.微藻中的油脂含量和组成会因环境胁迫而变化,如营养成分的缺乏、高盐度等非生物胁迫条件会促进微藻中油脂含量的增加,但非生物胁迫会抑制微藻的生长,造成微藻生物量减少[4-5].植物激素是植物体内产生的一类具有显著调控作用的小分子代谢产物,作为信号分子在介导多细胞植物的生长、发育和环境胁迫反应方面起着至关重要的作用[6-7].有研究报道植物生长调节剂能同时促进微藻生物量和油脂、碳水化合物等高价值产品积累.Salama等[8]研究表明外源添加植物生长调节剂DA-6可以提高斜生栅藻的生物量和代谢产物含量.朱尧[9]发现低浓度的吲哚-3-乙酸和己酸二乙氨基乙酯刺激斜生栅藻的生长和脂肪酸含量明显增加.但植物生长调节剂促进裂壶藻生长及油脂、DHA含量增长的研究报道较少.
因此,本研究探讨6种植物生长调节剂萘乙酸(NAA)、6-苄氨基嘌呤(6-BA)、赤霉素(GA)、己酸二乙氨基乙醇酯(DA-6)、2,4-二氯苯氧乙酸(2,4-D)、茉莉酸甲酯(MeJA)对裂壶藻生长、油脂和DHA含量的影响,旨在为裂壶藻获取更高产量油脂和DHA提供一种新的研究思路.
1 材料与方法
1.1 菌种及培养
实验菌种裂壶藻(Schizochytrium) ATCC20888,购买于广东省微生物菌种保藏中心.种子培养基配方为:葡萄糖50 g/L,酵母膏4 g/L,人工海水1 L,pH为6.5;发酵培养基配方为:甘油70 g/L,酵母膏4 g/L,人工海水1 L,pH为6.5.二级种子液分别接种到含有六种植物生长调节剂的发酵培养基中,培养温度为26 ℃,转速180 r/min,连续培养5 d,以不添加植物生长调节剂为阴性对照.每组实验设置三个平行.
1.2 生物量测定
取第5 d的发酵液置于已称重的离心管中,8 000 r/min离心10 min,弃去上清液,藻泥用蒸馏水洗涤三次,置于-80 ℃冰箱中冷冻4 h,然后于真空冷冻干燥机中冻干至恒重(约48 h),称冻干藻粉质量,根据式(1)计算裂壶藻生物量.

(1)
1.3 总脂测定
取裂壶藻藻粉0.5 g,加入30%的浓盐酸3 mL,重悬菌体,于80 ℃水浴锅中水浴1 h,油脂提取采用具体操作步骤见何文胜等[12].油脂含量和产量根据式(2)和(3)计算.

(2)
油脂产量(g/L)=油脂含量(%)×生物量(g/L).
(3)
1.4 DHA含量测定
脂肪酸甲酯化:取步骤1.3中提取的油脂,加入1 mL 0.5 mol/L NaOH-CH3OH,1 mg/mL内标物十九烷酸1 mL,于60 ℃水浴条件下皂化反应30 min,反应结束后加入2 mL 14% BF3-CH3OH,于60 ℃水浴条件下发生甲酯化反应30 min后冷却至室温,加入饱和NaCl溶液2 mL和正己烷3 mL,待混合溶液静置分层后,取上清液至棕色进样瓶中保存,然后用于气相色谱分析.气相色谱条件:毛细管柱HP-88(100 mm×250 μm×0.20 μm),程序升温:起始温度100 ℃,停留1 min后以40 ℃/min的速度升至200 ℃,再以8 ℃ /min的速度升至280 ℃并停留5 min.载气为氮气,进样口温度280 ℃,FID检测器温度为300 ℃.数据处理采用面积归一法.最后以DHA质量占裂壶藻生物量中百分比表示(%).
所有实验都重复3次,显著性分析采用“Waller-Duncan”.
2 结果与讨论
2.1 NAA对裂壶藻生长及油脂和DHA积累的影响
图1为添加不同浓度NAA后裂壶藻生物量及裂壶藻中的油脂和DHA含量、产量.从图1可以看出,植物生长调节剂NAA会影响裂壶藻的生长及细胞内油脂和DHA含量.如图1(a)所示,NAA浓度为0.02 mg/L时,裂壶藻的生物量达到最大,为35.79 g/L,显著高于不添加NAA对照组的生物量(31.20 g/L),相比对照组提高了1.15倍.当NAA浓度超过0.02 mg/L时,裂壶藻的生物量无显著增加.对裂壶藻中油脂含量和产量来说,随着NAA浓度增加呈现先上升后下降的趋势,均显著高于未添加NAA的对照组中油脂含量和产量.当NAA浓度为0.04 mg/L时,裂壶藻中油脂含量和产量达到最大,分别为36.6%和12.73 g/L,分别比对照组提高了1.30倍和1.45倍,其中油脂含量显著高于其他浓度组中油脂含量.对裂壶藻中DHA含量和产量来说(如图1(b)所示),也是随着NAA浓度增加呈现先上升后下降的趋势,当NAA浓度为0.04 mg/L时,裂壶藻中DHA含量和产量达到最高,分别达到16.31%和5.67 g/L,相比对照组分别提高了1.18倍和1.32倍.
2.2 6-BA对裂壶藻生长及积累油脂和DHA的影响
图2为添加不同浓度6-BA后裂壶藻生物量及裂壶藻中的油脂和DHA含量、产量.从图2可以看出,外加6-BA后,裂壶藻的生物量、油脂和DHA含量及产量均显著增加.从图2(a)可知,当6-BA的浓度为0.04 mg/L时,裂壶藻的生物量达到最高为34.11 g/L,相比对照组提高了1.09倍.当6-BA浓度为0.08 mg/L时,裂壶藻的油脂含量及产量达到最大,分别为39.32%和13.32 g/L,相比对照组,分别提高了1.39倍和1.52倍.从图2(b)可知,DHA含量和产量随着6-BA浓度增加呈现先增加后下降的趋势,当6-BA浓度为0.08 mg/L时,DHA的含量和产量最高,为19.20%和6.50 g/L,与对照组相比分别提高了1.40倍和1.51倍.
2.3 GA对裂壶藻生长及积累油脂和DHA的影响
图3为添加不同浓度GA后裂壶藻生物量及裂壶藻中的油脂和DHA含量、产量.从图3可知,添加GA后,裂壶藻的生物量以及裂壶藻中油脂和DHA含量、产量显著增加,随着GA浓度增加,呈现先上升后下降的趋势.从图3(a)可知,当GA浓度为0.5 mg/L时,裂壶藻的生物量最高,为35.55 g/L,与对照组相比提高了1.14倍.当GA浓度为0.5 mg/L时,裂壶藻油脂含量和产量达最高,分别为37.39%和13.29 g/L,与对照组相比分别提高了1.33倍和1.51倍.从图3(b)可知,当GA浓度为0.5 mg/L时,DHA的含量和产量达到最高,分别为15.38%和5.47 g/L,相比于对照组的DHA产量分别提高了1.12倍和1.28倍.
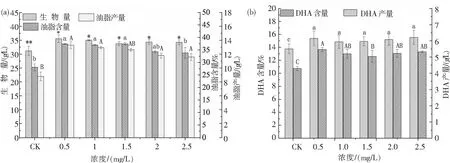
图3 不同浓度GA对裂壶藻生物量、油脂含量、油脂产量(a)及DHA含量、DHA产量(b)的影响Fig.3 Effects of different concentrations of GA on the biomass, lipid content, lipid yield (a) and DHA content, DHA yield (b) of Schizochytrium
2.4 2,4-D对裂壶藻生长及积累油脂和DHA的影响
图4为添加不同浓度2,4-D后裂壶藻生物量及裂壶藻中的油脂和DHA含量、产量.从图4可知,添加2,4-D后,裂壶藻的生物量以及裂壶藻中油脂和DHA含量、产量均显著增加.随着2,4-D浓度增加,油脂和DHA含量、产量均呈现先上升后下降的趋势.从图4(a)可知,当2,4-D浓度为1.5 mg/L时,裂壶藻的生物量高达32.54 g/L,相比对照组提高1.11倍,不同的2,4-D浓度下裂壶藻的生物量没有显著变化.当2,4-D的浓度为1.5 mg/L时,油脂含量和产量达到最大,分别为54.36%和17.69 g/L,与对照组相比分别提高了1.56倍和1.72倍.从图4(b)可知,当2,4-D浓度为1.5 mg/L时,DHA含量和产量达到最大,分别为21.33%和6.94 g/L,相比对照组分别提高了1.46倍和1.62倍.
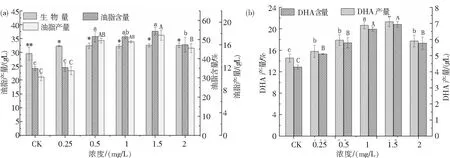
图4 不同浓度2,4-D对裂壶藻生物量、油脂含量、油脂产量(a)及DHA含量、DHA产量(b)的影响Fig.4 Effects of different concentrations of 2,4-D on the biomass, lipid content, lipid yield (a) and DHA content, DHA yield (b) of Schizochytrium
2.5 DA-6对裂壶藻生长及积累油脂和DHA的影响
图5为添加DA-6后裂壶藻生物量及裂壶藻中的油脂和DHA含量、产量.从图5可知,添加DA-6后,裂壶藻的生物量以及裂壶藻中油脂和DHA含量、产量均显著增加,且随着DA-6浓度增加均呈现先上升后下降的趋势.从图5(a)可知,DA-6浓度从0.01 mg/L增加1.0 mg/L,裂壶藻生物量未发生显著变化,当DA-6浓度为0.05 mg/L时,裂壶藻生物量达到最高,为33.07 g/L,相比未添加DA-6的对照组提高了1.12倍.当DA-6浓度为0.05 mg/L时,油脂含量和产量也达到最大,分别为57.66%和19.06 g/L,相比于对照组分别提高了1.65倍和1.85倍.从图5(b)可知,DA-6浓度为0.05 mg/L时,DHA含量和产量最高,分别为21.86%和7.23 g/L,与对照组相比分别提高了1.52倍和1.71倍.
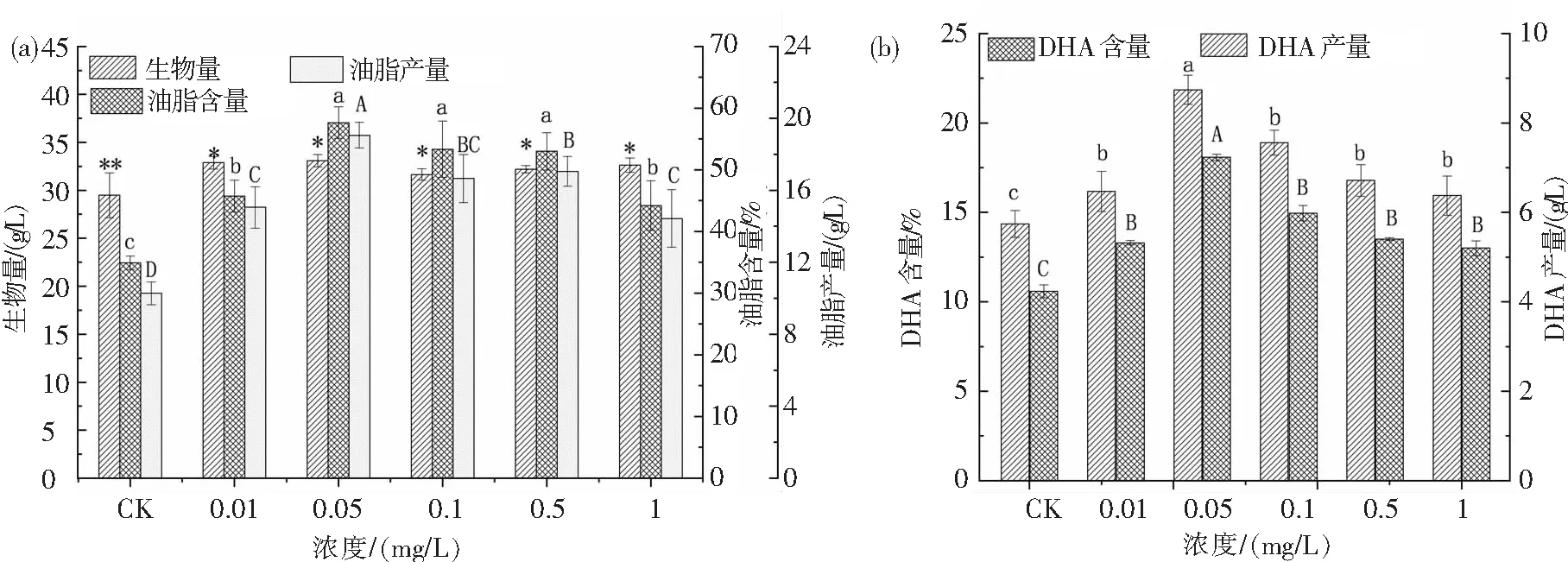
图5 不同浓度DA-6对裂壶藻生物量、油脂含量、油脂产量(a)及DHA含量、DHA产量(b)的影响Fig.5 Effects of different concentrations of DA-6 on the biomass, lipid content, lipid yield (a) and DHA content, DHA yield (b) of Schizochytrium
2.6 MeJA对裂壶藻生长及积累油脂和DHA的影响
图6为添加MeJA后裂壶藻生物量及裂壶藻中的油脂和DHA含量、产量.从图6可知,添加MeJA后,裂壶藻的生物量以及裂壶藻中油脂和DHA含量、产量均显著增加,且随着MeJA浓度增加均呈现先上升后下降的趋势.从图6(a)可知,当MeJA浓度为2.5 mg/L时,裂壶藻的生物量达到最高为34.04 g/L,相比于对照组的生物量提高了1.15倍.当MeJA浓度为15 mg/L时,其油脂含量和产量达到最高,分别为54.97%和18.19 g/L,与对照组相比分别提高了1.57倍和1.77倍.从图6(b)可知,当MeJA的浓度为15 mg/L时,DHA含量和产量达到最高,分别为21.83%和7.22 g/L,相比于对照组的DHA含量和产量分别提高了1.50倍和1.70倍.
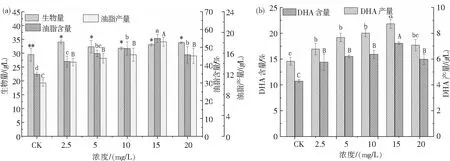
图6 不同浓度MeJA对裂壶藻生物量、油脂含量、油脂产量(a)及DHA含量、DHA产量(b)的影响Fig.6 Effects of different concentrations of MeJA on the biomass, lipid content, lipid yield (a) and DHA content, DHA yield (b) of Schizochytrium
2.7 讨论
以上6种植物生长调节剂均不同程度促进裂壶藻的生长及油脂和DHA积累,但是,适宜浓度的植物生长调节剂才能有效促进裂壶藻生长及油脂和DHA积累.添加植物生长调节剂等化学物质是一种不阻碍微藻生长又能促进代谢物产量增加的新措施.Vijay等[10]证实0.25 mmol/L激动素使斜生栅藻生物量增加1.6倍,吲哚-3-乙酸浓度大于50 mmol/L 显著促进斜生栅藻油脂含量增加.这可能是因为植物生长调节剂可作为细胞内化学信号分子,调节有丝分裂中涉及的信号通路以及调控代谢物产物的合成途径,通过刺激细胞周期进程来促进细胞的生长[11-12].而外源添加植物生长调节剂使油脂积累的原因可能是蛋白质和碳水化合物的降解,碳源分配方向发生了改变,从而为藻类的脂质积累提供碳源或能量[13].相比NAA、6-BA、GA三种植物生长调节剂,DA-6、2,4-D、MeJA三种植物生长调节剂更能促进裂壶藻生长以及油脂和DHA积累.这结果可能是因为不同植物生长调节剂对同一微藻的应激作用不同所致.Nazir等[14]在探讨萘氧乙酸、赤霉素、激动素、茉莉酸、水杨酸、脱落酸、褪黑素、乙醇胺8种植物生长调节剂对Aurantiochytriumsp.SW1生长和DHA积累的影响时也发现类似的结果:只有其中的赤霉素、激动素、茉莉酸显著促进Aurantiochytriumsp.SW1生长及DHA积累.同时,适宜浓度的植物生长调节剂才能最大幅度促进微藻生长和油脂或DHA积累.例如:相比对照组,2 mg/L激动素使Aurantiochytriumsp.SW1 生物量增加最大,增加27.9%,而4 mg/L GA和20 mg/L 茉莉酸才能使Aurantiochytriumsp.SW1生物量增加最大,分别增加20.2%和16.3%.对Aurantiochytriumsp.SW1中DHA含量来说,添加4 mg/L GA和20 mg/L 茉莉酸时增加幅度最大,分别达到5.1 g/L和5.3 g/L, 而添加2 mg/L激动素时,DHA的增加幅度最大,为4.8 g/L[14].另外,同一植物生长调节剂促进不同微藻菌株生长和油脂积累的最适浓度及促进效果可能均有差异.例如,Nazir等[14]发现萘氧乙酸不能显著促进Aurantiochytriumsp.SW1油脂积累,但Wang等[15]发现萘氧乙酸在最适浓度2 mg/L能使Schizochytriumsp.S31细胞中油脂含量显著增加11.16%.植物生长调节剂对微藻油脂积累的影响程度还与微藻的培养模式有关.非生物胁迫耦合植物生长调节剂会进一步促进微藻油脂积累[5, 16-17],这可能是因为植物生长调节剂会减缓非生物胁迫对微藻造成的氧化损伤和增强微藻细胞中的抗氧化防御系统,从而进一步促进油脂含量.另外,两种植物生长调节剂协同能进一步促进微藻中油脂积累[15, 18-19]或者植物生长调节剂与其他化学调节剂复配促进微藻中油脂或DHA增加[20].这些策略都可以借鉴到积累裂壶藻中油脂和DHA 积累.但是植物生长调节剂促进微藻油脂积累的详细分子机理尚需解析,机理分析将为利用微藻生物合成油脂并用于实践奠定理论基础.
3 结论
本文研究的6种植物生长调节剂在合适浓度均能显著促进裂壶藻生长及裂壶藻中油脂和DHA积累.其中DA-6、2,4-D、MeJA促进裂壶藻生物量及油脂、DHA产量增加的幅度高于其他三种植物生长调节剂促进裂壶藻生物量及油脂、DHA产量增加幅度.本研究实验结果表明,外加合适浓度的植物生长调节剂能促进微藻生长及细胞中油脂和DHA积累,并且较低浓度人工合成植物生长调节剂就能显著促进裂壶藻中油脂和DHA含量增加,投入成本低,具有潜在经济效益.该研究结果为开发促进微藻中油脂和DHA积累策略开辟新的思路.
