姜黄素干预肾上腺皮质癌SW-13细胞的miRNA调控机制▲
2022-10-01黄雪梅匡雅琪刘雨平林媛媛罗佐杰
黄雪梅 匡雅琪 刘雨平 林媛媛 罗佐杰
(1 广西南宁市第一人民医院内分泌科,广西南宁市 530022;2 广西医科大学第一附属医院内分泌科,广西南宁市 530021)
肾上腺皮质癌(adrenocortical carcinoma,ACC)是内分泌系统的恶性肿瘤,起病隐匿、恶性程度高、侵袭性强。ACC早期确诊率较低,大多数患者确诊时已出现局部或远处转移征象[1-2],而发生肿瘤转移的患者5年生存率不到15%[3]。手术切除原发肿瘤及转移病灶是目前ACC的主要治疗方法,但是手术治疗不能防止肿瘤的复发和远处转移。对于不能根治性切除肿瘤或无法手术者,常采用化疗、放疗和分子免疫治疗等辅助治疗[4-5]。米托坦是美国食品药品监督管理局唯一批准使用的ACC治疗药物,但治疗窗口窄,会出现神经毒性、肾上腺皮质功能不全和急性肝功能受损等严重的不良反应,其安全性和有效性仍存在争议[6-7]。而其他的化疗、放疗及免疫治疗等辅助治疗对ACC的治疗效果比较局限[8]。姜黄素是从姜科植物根茎中提取的化合物,具有较强的抗肿瘤活性[9-11]。本课题组前期研究表明,姜黄素可以抑制ACC细胞的增殖、迁移和侵袭,诱导ACC细胞凋亡,抑制SW-13细胞荷瘤裸鼠移植瘤的生长[12]。有学者发现姜黄素在发挥抗肿瘤作用时可导致miRNA表达谱发生改变[13-14]。然而,目前姜黄素干预ACC的miRNA调控机制尚不明确。因此,本研究通过高通量小RNA测序探讨姜黄素干预ACC SW-13细胞的miRNA调控机制。
1 材料和方法
1.1 试剂和仪器 姜黄素购于美国Sigma公司(批号:458-37-7),NucleoZOL试剂盒购自德国MN公司(批号:740404),miRNA 第一链 cDNA 合成试剂盒购自上海生工生物工程公司(批号:B532451),SYBR Green®Premix Ex TaqTMⅡ购自TaKaRa公司(批号:RR820A)。NanoDrop 2000c微量分光光度计购自美国Thermo Fisher Scientific公司,Agilent 2100生物分析仪购自美国Agilent Technologies公司。
1.2 细胞来源、培养和干预方法 人ACC SW-13细胞购自中国科学院典型培养物保藏委员会细胞库,使用含有10%胎牛血清的高糖PMEM培养。将细胞接种在6孔板(5×105个/孔)中,置于37 ℃、5% CO2的培养箱中培养过夜,次日细胞贴壁、细胞密度达80%时进行后续实验。将细胞分为对照组和姜黄素干预组,在对照组、姜黄素干预组细胞中分别加入基础培养基2 mL、50 μmol/L姜黄素溶液2 mL,放置在37 ℃、5% CO2的培养箱中继续培养24 h。使用NucleoZOL试剂盒提取两组细胞的总RNA,分别经NanoDrop 2000c微量分光光度计、Agilent 2100生物分析仪检测RNA纯度、完整性,将合格的总RNA用于文库构建和测序。实验重复3次。
1.3 小RNA文库构建、测序和数据分析 小RNA文库构建和测序分析均由上海生工生物工程公司完成。其中,采用NEXTseq 550测序仪(测序模式为SE75)进行测序;通过FastQC软件对用于测序的原始序列数据进行质量评估,使用Cutadap去除接头,Trimmomatic去除两端质量碱基和序列过滤;使用BLASTN进行序列与Rfam数据库的比对,以过滤掉样本中的 sRNA、tRNA、snoRNA、snRNA;使用Bowtie分别进行序列与人物种的外显子和内含子、参考基因组序列的对比、过滤,最后获得纯净序列。
1.4 miRNA的注释和新miRNA的预测 将获得的纯净序列与miRBase数据库(http://www.mirbase.org/)中收录的人物种已知miRNA序列和miRNA前体序列进行比对,得到序列的miRNA家族信息。使用miRDeep2软件,将在Repbase数据库(https://www.girinst.org/repbase/)过滤比对后剩余的序列与参考基因组序列进行比对后,进行miRNA的表达定量和二级结构分析,预测新的miRNA。
1.5 miRNA的差异性表达分析、功能和通路富集分析 使用edgeR软件对已知miRNA和新预测的miRNA进行差异性表达分析,采用RPM(reads per million mapped reads)将数据归一化处理,以P<0.05、|log2FC|>1作为标准,筛选出差异性表达的miRNA。在miRanda(http://www.microrna.org/microrna/home.do)数据库中,对差异性表达的miRNA进行靶基因预测。采用clusterProfiler软件对获得的miRNA靶基因进行基因本体论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析。
1.6 实时荧光定量PCR验证 采用实时荧光定量PCR对部分差异性表达的miRNA进行验证。所选miRNA的引物序列由上海生工生物工程公司合成,见表1。采用NucleoZOL试剂盒提取对照组和姜黄素干预组干预24 h后SW-13细胞的总RNA,检测 RNA 纯度、完整性后,采用miRNA第一链cDNA合成试剂盒将RNA反转录成cDNA,反转录反应条件为:37 ℃ 60 min,85 ℃ 5 min,于4 ℃保存。采用SYBR Green® Premix Ex TaqTMⅡ进行定量检测。反应体系共20 μL,包括TB Green Premix Ex Taq Ⅱ(2×)10 μL、ROX Dye Ⅱ 0.4 μL、上游引物0.8 μL、下游引物0.8 μL、cDNA 2 μL,RNase free H2O 6 μL。反应条件为:预变性95 ℃ 30 s,变性95 ℃ 5 s,退火60 ℃ 34 s,40个循环,熔解曲线95 ℃ 30 s,60 ℃ 15 s。以U6作为内参(由上海生工生物工程公司提供),采用2-ΔΔCt法计算miRNA的相对表达量,实验重复3次。
1.7 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料采用(x±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 姜黄素干预组和对照组miRNA的长度分布 对测序结果进行去除冗余接头、不相关、低质量序列的处理后,获得纯净序列。miRNA 长度为21~24 nt,在从对照组和姜黄素干预组细胞获得的序列中,长度为21~24 nt的序列占比分别为77.68%和80.67%。见图1。
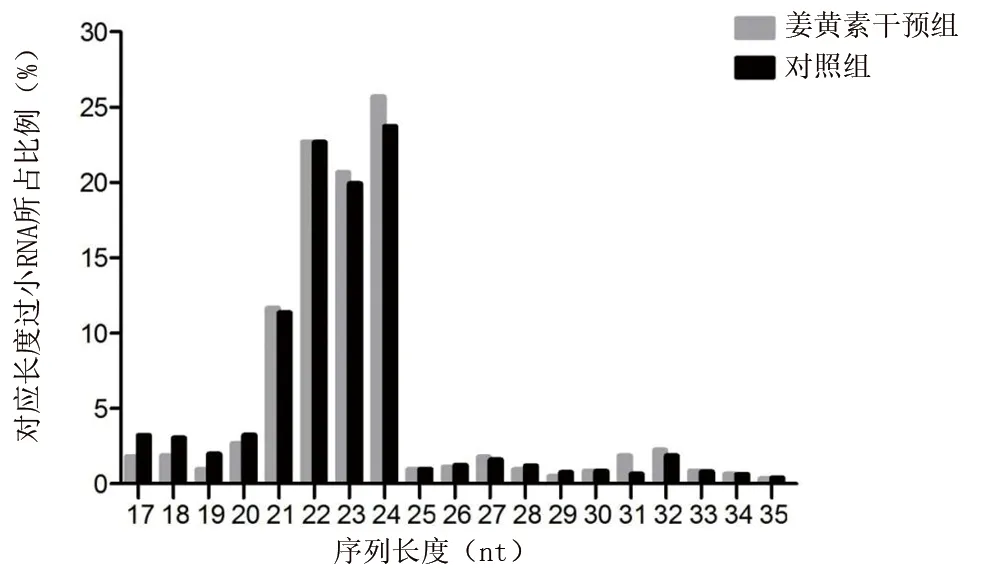
图1 姜黄素干预组和对照组miRNA的长度分布
2.2 miRNA的鉴定与差异性表达分析结果 对获得的miRNA进行差异性表达分析,筛选出44个差异性表达的miRNA,其中21个miRNA在姜黄素干预后表达上调,23个miRNA表达下调。见图2。

图2 差异性表达miRNA 的火山图
2.3 miRNA靶基因的功能富集分析 预测有靶基因且有功能的miRNA共9个,见表2。GO功能分析结果显示,靶基因富集的生物学过程有21个,主要富集于细胞增殖、细胞迁移、细胞分化和凋亡等生物学过程;靶基因富集的细胞成分有11个,主要为细胞质、细胞核和细胞膜等细胞成分;靶基因富集的分子功能有17个,主要参与DNA结合、RNA结合、三磷酸腺苷(adenosine triphosphate,ATP)结合作用和催化作用等分子功能,见表3。在GO注释分类的基础上进行KEGG信号通路富集分析,结果显示靶基因主要富集在癌症途径、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、内质网应激信号通路、细胞周期和凋亡途径等19条信号通路,见表4。
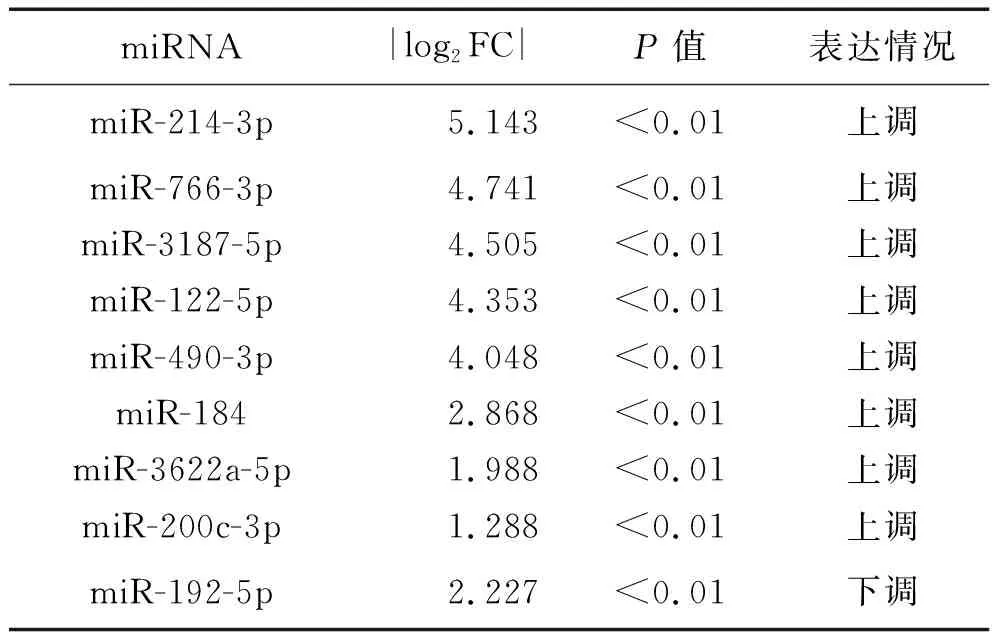
表2 具有功能的差异性表达miRNA

表3 miRNA靶基因显著富集的12个GO条目

表4 miRNA靶基因显著富集的前5个KEGG条目
2.4 实时荧光定量PCR验证结果 为了进一步验证miRNA测序所获得的结果,随机选取6个miRNA(miR-184、miR-490-3p、miR-766-3p、miR-200b-3p、miR-200c-3p、miR-3622a-5p)采用加尾法荧光定量的方法检测其相对表达量。结果显示,miRNA的相对表达量与小RNA测序数据结果基本一致。见图3。
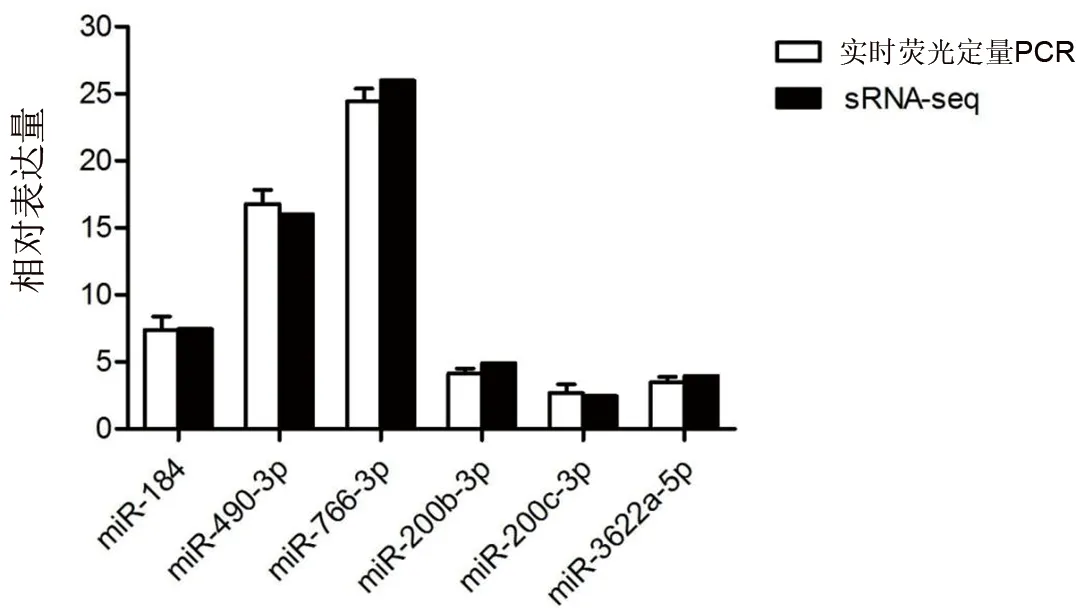
图3 差异性表达miRNA的实时荧光定量PCR验证结果
3 讨 论
miRNA与肿瘤的发生、发展密切相关,可以通过与靶基因mRNA碱基配对实现降解mRNA或抑制mRNA的翻译表达,调控靶基因的表达[15-16]。小RNA测序不仅可以鉴定保守的miRNA和预测新的miRNA,还能分析miRNA的表达特征[17]。本研究采用高通量小RNA测序分析姜黄素作用SW-13细胞时的miRNA调控机制,筛选出44个显著差异性表达的miRNA,其中21个miRNA在姜黄素干预后表达上调,23个miRNA表达下调,共有9个差异性表达的miRNA有靶基因且有功能;采用实时荧光定量PCR对其中6个miRNA进行验证,结果显示这些miRNA的相对表达量与小RNA测序分析结果趋势基本一致。miRNA作为致癌因子或肿瘤抑制因子,可成为肿瘤诊断、预后和评估治疗效果的生物学标志物[18-19]。Xu等[20]研究发现,miR-122-5p在胃癌组织和胃癌BGC-823细胞中呈低表达,miR-122-5p过表达可以抑制BGC-823细胞的迁移和侵袭性。miRNA可以靶向相关基因调控细胞的增殖、迁移和侵袭,例如miR-214-3p可以通过靶向调控Twist家族bHLH转录因子1来抑制子宫内膜癌细胞向上皮-间充质转化和转移[21];Zou等[22]亦发现miR-192-5p通过靶向作用含三联基元44以抑制肺癌的增殖、迁移和侵袭。本研究的小RNA测序分析结果显示,经姜黄素干预后,SW-13细胞中miR-122-5p、miR-184、miR-214-3p、miR-490-3p、miR-200c-3p、miR-3187-5p、miR-3622a-5p和miR-766-3p表达上调,miR-192-5p表达下调,这些差异性表达的功能miRNA将为姜黄素的抗ACC作用机制研究奠定更多的理论基础。
GO是国际标准化的基因功能分类体系,其可全面描述生物体中基因和基因产物的属性。GO功能富集分析包括3个本体,分别为描述基因的分子功能、细胞成分和生物学过程。本研究中,GO功能富集分析结果显示,姜黄素干预SW-13细胞后,差异性表达miRNA的靶基因主要富集在细胞增殖、细胞迁移、细胞分化和凋亡等生物学过程。有研究显示,姜黄素可以通过miRNA 的特异性靶向作用抑制肿瘤细胞的生长、侵袭和转移[23-24];Gallardo等[25]研究发现,姜黄素可以通过调控miR-34a的表达来抑制乳腺癌细胞的迁移和侵袭。由此可见,姜黄素也可能通过调控上述miRNA来抑制细胞增殖、迁移、分化和凋亡,从而发挥抗ACC的作用。本研究KEGG信号通路富集分析结果显示,姜黄素干预SW-13细胞后,差异性表达miRNA的靶基因显著富集在癌症途径、MAPK信号通路、内质网应激信号通路、细胞周期和凋亡通路等。Liu等[26]研究发现,姜黄素通过调节miR-21以调控磷酸酶张力蛋白同系物/磷脂酰基醇3-激酶/蛋白激酶B通路,从而发挥其抗肿瘤作用。本课题组的前期研究显示,姜黄素可以诱导ACC细胞凋亡,抑制肾上腺皮质癌SW-13裸鼠移植瘤的生长[12]。由此推测,姜黄素可能通过相关miRNA调控上述信号通路,从而发挥抗ACC的作用。
综上所述,姜黄素可能通过miR-184、miR-490-3p、miR-766-3p、miR-200c-3p、miR-3622a-5p等miRNA参与调控癌症途径、MAPK信号通路、内质网应激信号通路、细胞周期和凋亡途径等信号通路,以抑制细胞增殖、迁移、分化和凋亡,从而发挥抗ACC的作用,这或可为姜黄素治疗ACC提供理论依据。
