外源性去除神经对结肠炎大鼠的治疗作用及可能作用机制▲
2022-10-01全莹禹
张 京 董 琦 全莹禹
(1 海南省妇女儿童医学中心普外肿瘤外科,海南省海口市 570312;2 海南省人民医院儿科,海南省海口市 570311)
结肠炎是一种由多种原因引起的慢性、复发性结肠炎症,目前大多数学者认为免疫因素在结肠炎的发生和发展中起重要作用。结肠受外源性神经和内源性神经共同支配,神经元是肠壁神经系统和高级中枢神经系统相互联系的纽带,可动态地调节结肠的功能和维持结肠的正常生理状态[1-3]。 游离状态下的肠道可通过诱导处于增殖状态的T淋巴细胞发生S期阻滞,直接抑制T淋巴细胞的增殖,同时减少致炎性Th(Th1、Th2、Th17)和具有免疫抑制性的调节性T淋巴细胞在病变黏膜中的浸润,从而抑制促炎因子和抗炎因子的过度分泌,调节细胞因子网络平衡,最终钝化适应性免疫应答,全面抑制炎症性肠病发展过程中的攻击性免疫反应[4]。肠道在游离状态下不受神经支配,去神经手术同样使结肠不受神经支配,由此我们推测去神经手术可影响肠道的免疫功能。故本文使用葡聚糖硫酸钠诱导建立大鼠结肠炎模型后予行去神经术,通过检测结肠组织中分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)、白细胞介素(interleukin,IL)-1β、IL-18的表达水平及外周血巨噬细胞M1/M2比值,探讨去神经对结肠炎大鼠的治疗作用和可能作用机制。
1 材料与方法
1.1 实验动物 32只SD大鼠由南方医科大学实验动物中心提供[许可证SCXK(鄂)2019-0001,武汉华联科生物技术有限公司],雌雄各半,150~180 g,周龄7~8周。将大鼠在湿度为50%、温度为24 ℃左右条件下适应性喂养1周。
1.2 主要试剂和仪器 葡聚糖硫酸钠(上海翌圣生物科技股份有限公司,货号:60316EA25),HE染液(北京索莱宝科技有限公司,货号:G112),蛋白质裂解液(武汉博士德公司,批号:SNl09),二喹啉甲酸试剂盒(碧云天生物技术研究所,批号:C0105),兔源SIgA单克隆一抗(英国Abcam公司,货号:ab245115),GAPDH抗体(北京同立海源生物科技有限公司,货号:BC025840),辣根酶标记羊抗兔SIgA二抗(北京中杉金桥生物技术有限公司,货号:GAl014),SIgA免疫组化试剂盒[杭州联科美讯生物医药技术有限公司,货号:(IM)-(01)-0208],IL-1β、 IL-18 ELISA试剂盒(武汉恩菲生物科技有限公司,货号:EH0185,EH0036),FcR-block(碧云天生物科技有限公司,批号:ab153521),CD86抗体(eBioscience公司,批号:20190516),CD163抗体(eBioscience公司,批号20200819)。GS-15R型离心机(美国Beckman公司),BIOBASE-EL10A型酶标仪(山东博科再生医学有限公司),CX23型生物显微镜(日本Olympus公司),CytoFLEX流式细胞仪(美国BD公司)。
1.3 分组和建模方法 采用随机数字表法将32只大鼠分为正常组、结肠炎组、去神经组、去神经+结肠炎组,每组8只。实验前,各组大鼠均正常饮食,适应性喂养1周后开始实验。首先构建结肠炎大鼠模型,使用纯净水将葡聚糖硫酸钠配制成3%的溶液,作为结肠炎组和去神经+结肠炎组大鼠的日常饮水,其余组大鼠均正常饮用纯净水。如大鼠出现肉眼血便、黏液样便、腹泻,同时毛色变差、活动度下降、进食量减少、体重下降,则判定结肠炎大鼠模型建模成功。本研究中结肠炎组和去神经+结肠炎组所有大鼠均建模成功。建模1周后,采用戊巴比妥钠溶液50 mg/kg通过腹腔注射麻醉去神经组和去神经+结肠炎组大鼠,麻醉成功后模拟结肠手术过程,即在保留近肠壁系膜血管弓的前提下,离断部分结肠系膜,使其失去外源性神经的支配。正常组、结肠炎组未给予手术干预。
1.4 收集标本 术后14 d处死大鼠,抽取腹腔主动脉血3 mL,3 000 r/min离心10 min后取上清,置于-70 ℃冰箱中保存备用,并留取大鼠结肠组织备用。
1.5 组织病理学观察 取结肠炎组、去神经+结肠炎组大鼠病变结肠组织,其他组均取相对应的结肠组织,制成石蜡切片,行HE染色后观察大鼠结肠组织黏膜及肌层形态变化。
1.6 结肠组织中SIgA表达情况的检测 (1)免疫组化检测:取结肠炎组、去神经+结肠炎组大鼠病变结肠组织,其他组均取相对应的结肠组织,制成石蜡切片,采用免疫组化试剂盒检测各组大鼠结肠组织SIgA表达情况,其中棕色细胞为阳性细胞,随机选取3个视野,在×200倍视野下计算阳性细胞数,取平均值。(2)Western blot检测:取结肠炎组、去神经+结肠炎组大鼠病变结肠组织,其他组均取相对应的结肠组织,加入蛋白质裂解液提取总蛋白,按照二喹啉甲酸试剂盒说明书进行蛋白定量。取煮沸变性后的蛋白质30 μg,行SDS-PAGE后,将蛋白移至PVDF膜,置于5%脱脂奶粉溶液中在室温的条件下封闭1 h,缓冲液洗膜3次后加入一抗(1 ∶1 000),在4 ℃的环境下孵育过夜,使用缓冲液清洗3遍后加入二抗(1 ∶5 000),室温条件下孵育1h后再次用缓冲液清洗3遍,进行ECL发光显色。以GAPDH为内参蛋白,使用Quantity One软件计算目的蛋白相对表达水平。
1.7 血清炎症指标的检测 采用ELISA试剂盒检测血清中IL-1β、IL-18水平,严格按照试剂盒说明书进行操作。
1.8 外周血巨噬细胞的检测 取5 mL血液标本,通过Ficoll密度梯度离心法分别获取小鼠外周血单个核细胞。按照说明书操作,首先使用3 mL浓度为4%的FcR-block孵育5 min,接着依次加入5 μL浓度为20 μg/mL的CD86抗体和5 μL浓度为20 μg/mL的CD163抗体,室温避光孵育20 min后,1 000 r/min离心5 min,弃去上清后用PBS洗两次,最后用0.5 mL PBS重悬细胞,经滤纱过滤后,使用流式细胞仪检测M1型巨噬细胞(CD86)和M2型巨噬细胞(CD163)比值,即M1/M2比值。
1.9 统计学分析 采用SPSS 21.0软件进行统计分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠结肠组织病理学变化 正常组大鼠肠黏膜上皮完整,黏膜下血管正常,腺体结构排列规则,无充血水肿,无糜烂溃疡。结肠炎组大鼠结肠黏膜上皮破溃、脱落,腺体被破坏,存在大量炎性细胞浸润、血管明显扩张充血、肉芽组织增生、溃疡及不同程度灶性糜烂形成的现象,进一步提示建模成功。去神经组大鼠结肠组织可见少量炎性细胞浸润,以及轻微溃疡形成。去神经+结肠炎组大鼠结肠组织的炎性细胞浸润现象及溃疡程度均较结肠炎组大鼠有所改善。见图1。
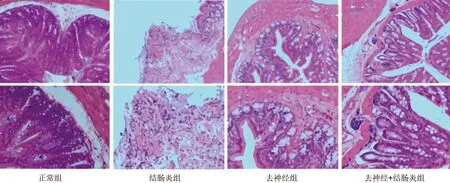
图1 4组大鼠结肠组织形态变化(HE染色;上、下图放大倍数分别为×100、×200)
2.2 各组大鼠结肠黏膜中SIgA的表达情况 (1)免疫组化染色显示,与正常组相比,结肠炎组、去神经组大鼠结肠黏膜中SIgA表达阳性的细胞均减少(均P<0.05);与结肠炎组相比,去神经+结肠炎组大鼠结肠黏膜中的SIgA表达阳性的细胞增加(P<0.05)。见表1和图2。(2)Western blot实验结果显示,与正常组相比,结肠炎组、去神经组的SIgA蛋白表达水平均降低(均P<0.05);与结肠炎组相比,去神经+结肠炎组的SIgA蛋白表达水平升高(P<0.05)。见表1和图3。

表1 4组大鼠结肠黏膜SIgA蛋白表达水平的比较(x±s)
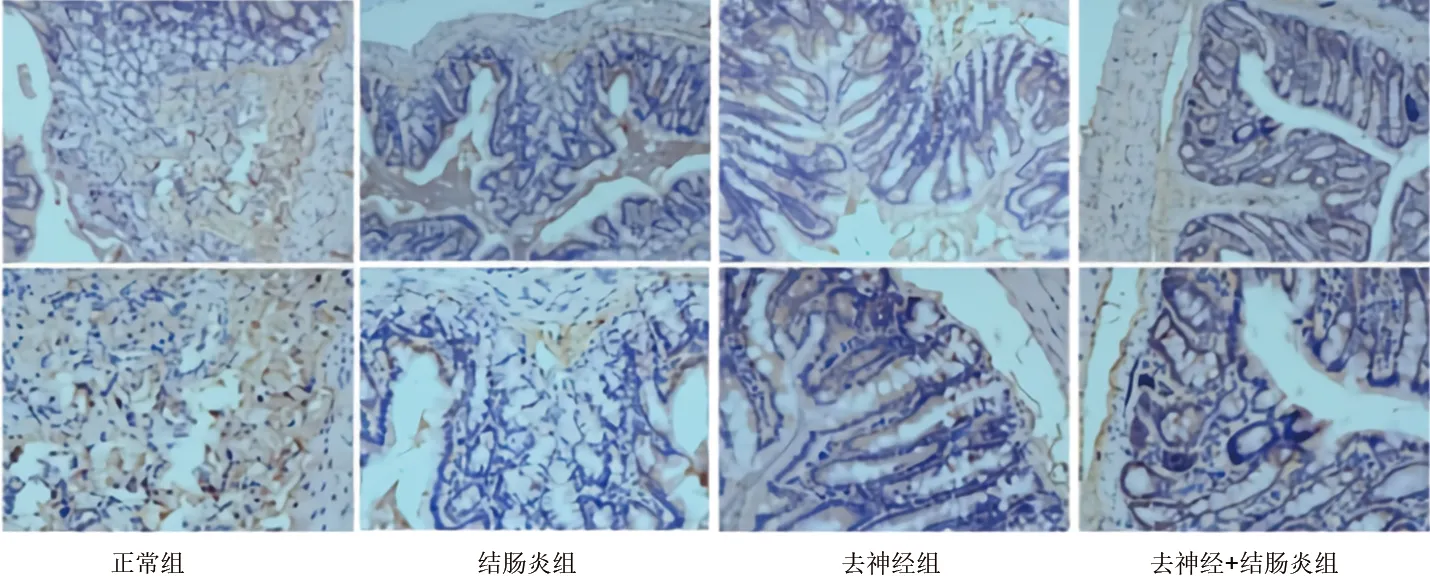
图2 4组大鼠结肠黏膜中SIgA表达的免疫组化检测结果(上、下图放大倍数分别为×100、×200)

图3 各组大鼠结肠黏膜组织SIgA表达水平的Western blot检测结果
2.3 各组大鼠血清IL-1β和IL-18水平的比较 与正常组相比, 结肠炎组、去神经组、去神经+结肠炎组的血清IL-1β和IL-18水平均增加(均P<0.05);与结肠炎组相比,去神经+结肠炎组的IL-1β和IL-18水平均降低(均P<0.05)。见表2。

表2 4组大鼠血清IL-1β与IL-18水平的比较(x±s,pg/mL)
2.4 各组大鼠外周血巨噬细胞分化情况的比较 与正常组相比, 结肠炎组、去神经组、去神经+结肠炎组外周血M1/M2比值均增加(均P<0.05);与结肠炎组相比,去神经+结肠炎组外周血M1/M2比值降低(均P<0.05)。见表3和图4。

图4 4组大鼠外周血中M1型和M2型巨噬细胞分化的情况

表3 4组大鼠外周血M1/M2比值的比较(x±s)
3 讨 论
在生理状态下,结肠接触大量的抗原,为维持正常的生理功能,其免疫耐受和防御方面须保持平衡,而过强或减弱的免疫应答都会导致结肠出现病理状态[5]。神经系统与免疫系统之间存在脑-肠轴的反馈作用体系,该体系在调节免疫应答中起到重要作用。外源性神经和内源性神经共同调节结肠的运动、免疫、分泌、吸收等各项生理功能。其中外源性神经由交感神经和副交感神经组成,通过释放神经递质并作用于内源性神经上的受体来实现调控,当外源性神经损伤时必定会导致神经递质数量和受体敏感性发生变化[6]。而失去了外源性神经支配,结肠正常的免疫调控必定受到影响。
本研究采用3%葡聚糖硫酸钠代饮水建立结肠炎大鼠模型,并参照相关文献[7]对大鼠进行模拟结肠手术处理,利用HE染色观察各组大鼠肠组织结构变化,结果显示与正常组相比,结肠炎组大鼠的结肠腺体被破坏,可见大量炎性细胞浸润,而与结肠炎组相比,去神经+结肠炎组大鼠结肠组织可见少量炎性细胞浸润,腺体结构较为规则。这提示去神经手术能够改善结肠炎大鼠结肠组织的病理情况,对结肠炎大鼠有治疗作用。
SIgA是肠黏膜表面的主要抗体,其在阻止病原菌的入侵中发挥着关键性的作用。SIgA进入肠道后能选择性地包被革兰阴性菌,形成抗原-抗体复合物,阻碍细菌与上皮细胞受体结合;同时其可刺激肠道黏液分泌并加速黏液层的流动,从而有效地阻止细菌对肠黏膜的黏附[7]。此外,SIgA对某些病毒、细菌具有抗体活性,能抑制病毒繁殖,是消化道黏膜防御系统的主要成分[8-9]。通过检测SIgA的分泌表达情况及结肠组织中T淋巴细胞亚群的分化情况,可评估结肠黏膜免疫屏障功能[10]。本研究的免疫组化和Western blot检测结果显示,与正常组相比,结肠炎组大鼠结肠组织的SIgA表达水平降低,而去神经+结肠炎组结肠组织的SIgA表达水平较结肠炎组有所升高(P<0.05)。这说明结肠炎发生后肠黏膜的SIgA表达下调,而去神经手术能够在一定程度上提高结肠炎大鼠肠道的SIgA水平,从而发挥保护肠道黏膜的作用。
IL-1β能介导结肠炎早期的炎症反应,刺激其他细胞因子和炎症介质的产生,还能反馈性地促进巨噬细胞和T淋巴细胞分泌IL-2,进而加速炎症反应[11]。IL-1β还可通过促进白细胞黏附分子的表达,使趋化中性粒细胞等炎性细胞进入肠道病变部位,引发肠道的炎症反应,导致肠组织破坏[12]。IL-18具有促进IL-1和粒细胞-巨噬细胞集落刺激因子产生,刺激肿瘤坏死因子α和多种趋化因子合成,以及诱导Th1产生Ⅰ型干扰素等多种生物学功能[13]。结肠炎的发病与免疫调节功能紊乱有关,特别是细胞因子的异常表达,IL-18作为一种炎性反应前细胞因子,可诱导单核巨噬细胞释放γ-干扰素,其在结肠炎的免疫异常及炎性反应中可能发挥重要作用[14]。且研究表明,IL-1β和IL-18具有一定的免疫调节作用,可影响结肠炎的发展[15]。巨噬细胞是一群异质细胞,根据其功能和表型主要可分为M1型及M2型。肠黏膜中存在大量巨噬细胞,其可在不同因素的刺激下分化成两种不同的类型——经典活化巨噬细胞和替代活化巨噬细胞,从而产生不同的生物学效应。M1型及M2型巨噬细胞的失衡是肠道炎症发生的关键[16]。本研究结果显示,结肠炎组大鼠血清炎症因子IL-1β和IL-18水平、外周血巨噬细胞M1/M2比值均升高,而去神经手术能够有效降低结肠炎大鼠血清炎症因子水平及外周血巨噬细胞M1/M2比值(P<0.05)。由此可见去神经手术能够明显改善结肠炎大鼠结肠组织的病理情况,对大鼠的免疫功能也具有显著的调节作用。 原因可能是结肠炎发生时,体内炎症因子会呈瀑布式释放,引起结肠道损伤[17];而外源性去除神经可通过抑制结肠的免疫反应来减轻这种炎性反应,从而发挥治疗结肠炎的作用。机制可能是,T淋巴细胞是一个由多种相互关联、相互制衡的亚群细胞组成的群体,结肠炎症的实质就是T淋巴细胞中各亚群比例失调所引起的、以自身组织为攻击目标的免疫反应造成的结果。外源性去除神经对结肠炎的治疗作用可能与其直接的免疫抑制作用有关,即外源性去除神经可通过直接阻滞Th增殖,以及减少Th各亚群(如Th1、Th2)在病变黏膜中的浸润,而抑制促炎因子γ-干扰素、IL-4、IL-12p70、IL-17和抗炎因子IL-10的分泌,最终全面抑制结肠炎发展过程中的攻击性免疫反应。
值得注意的是,本研究中,与正常组相比,去神经组大鼠结肠组织可见少量的炎性细胞浸润,SIgA表达水平降低,血清炎症因子IL-1β和IL-18水平、巨噬细胞M1/M2比值水平均升高。这说明去神经手术可对正常结肠组织造成一定的影响,在一定程度上降低了保护性抗体SIgA的水平,并增强正常结肠的炎症反应。因此,外源性去除神经或许可成为治疗急性结肠炎的潜在手段,但需在明确诊断和适应证后实施,以免对正常结肠组织造成伤害。
综上所述,外源性去除神经对结肠炎大鼠有一定的治疗作用,其可能通过上调保护性SIgA的表达、抑制外周血巨噬细胞向M1型分化和炎症因子的表达,来调控机体的免疫炎症反应,从而发挥治疗作用。这或可为外源性去除神经在临床上的应用,以及成为治疗急性结肠炎的潜在手段,提供了一定的实验基础。
