青花椒精油抑制蜡样芽孢杆菌的活性与机理
2022-09-30张凤菊陈善波赵跃军黄志标朱永清李治华
赵 驰,董 玲,张凤菊,陈善波,胡 文,赵跃军,黄志标,朱永清,李治华,*
(1.四川省农业科学院农产品加工研究所,四川 成都 610066;2.四川省农业科学院食物与营养健康研究所,四川 成都 610066;3.四川省林业科学研究院,四川 成都 610081;4.汉源县花椒产业发展中心,四川 雅安 625399;5.幺麻子食品股份有限公司,四川 眉山 620360;6.四川广安和诚林业开发有限责任公司,四川 广安 638019)
蜡样芽孢杆菌()是一种普遍存在于食物、土壤和人体皮肤等环境中的革兰氏阳性食源性病原菌,其能够产生溶血素BL(hemolysin BL,HBL)、非溶血性肠毒素(nonhemolytic enterotoxin,Nhe)、细胞毒素K(cytotoxin K,CytK)和致吐毒素等引起腹泻和呕吐的细胞毒素和酶。据统计,全世界1.4%~12%的食物中毒事件由该菌引起,蜡样芽孢杆菌已经对食品安全和人类健康造成了严重的威胁。目前应对食源性病原菌对食品污染最为常用的一种手段是添加化学防腐剂,但是其造成的安全性问题正日益突出。而植物精油是由植物根、茎、果实等部位提取的生物活性物质,其抑菌能力已经得到证实,同时其还具有安全和不易产生抗药性等诸多优点,使其具有开发为天然防腐剂的潜力。
青花椒属芸香科(Rutaceae)花椒属()植物,其广泛种植于中国西南部地区,具有悠久的历史,是一种重要的经济作物。其果皮因具有独特的香气和麻味而作为一种调味料广泛应用于中餐的烹饪中。同时,青花椒已经被正式列入《中国药典》,被用作多种中医处方药的有效成分,用于治疗腹痛、呕吐、牙疼等多种疾病。此外,花椒的抑菌能力也得到了广泛的关注,其中花椒挥发油的抑菌能力已经得到证实,其能够抑制大肠杆菌()、金黄色葡萄球菌()和枯草芽孢杆菌()等多种食源性病菌。但是现有研究主要关注其抑菌活性,对其抑菌机理还鲜有报道。
本研究首先对青花椒精油的化学组成进行分析,随后以蜡样芽孢杆菌为研究对象,通过理化、形态学和代谢组学的方法对其抑菌机理进行探讨,以期为青花椒资源的充分利用和进一步开发以青花椒为原料的新型抗菌药物提供参考。
1 材料与方法
1.1 菌株、材料与试剂
蜡样芽孢杆菌菌株购自广东省微生物菌种保藏中心(Guangdong Microbial Culture Collection Center,GDMCC),菌株编号GDMCC 1.602。
青花椒购自四川省川珍实业有限公司。
碱性磷酸酶(alkaline phosphatase,AKP)活力试剂盒南京建成生物工程研究所;钙磷脂结合蛋白V-荧光素APC/碘化丙啶(annexin V-fluorescein APC/propidium iodide,Annexin V-APC/PI)细胞凋亡检测试剂盒上海元牧生物科技有限公司;营养肉汤(nutrient broth,NB)培养基 青岛海博生物科技有限公司;吡啶(分析纯)、甲氧铵盐(分析纯)、双(三甲基硅烷基)三氟乙酰胺(含有1%(质量分数)三甲基氯硅烷)美国Sigma公司;琼脂粉、戊二醛、乙醇、异丙醇、乙睛(均为分析纯) 上海源叶生物科技有限公司。
1.2 仪器与设备
Intuvo 9000-MSD 5977B型气相色谱-质谱联用仪(gas chromatography-mass spectrometry,GC-MS) 美国安捷伦公司;New Brunswick Innova 43恒温摇床、Centrifuge 5418 R离心机 德国Eppendorf公司;JEM-1400FLASH透射电子显微镜 日本电子株式会社;Inspect扫描电子显微镜 美国FEI公司;EM TP组织处理机、EM KMR3玻璃制刀机 德国徕卡公司;SynergyHTX多功能酶标仪 美国BioTek公司;Cytoflex流式细胞仪 美国Beckman Coulter公司;FDU-2110冷冻干燥机 日本东京理化器械株式会社。
1.3 方法
1.3.1 青花椒精油制备及其化学组成分析
参考文献[15]的方法稍作修改进行青花椒精油提取。将青花椒粉碎过40 目筛。称取40 g青花椒粉和400 mL水,置于1 L的圆底烧瓶中加热煮沸,循环提取4 h后过滤提取液,然后用无水硫酸钠脱水得到青花椒精油(回收率为5.35%),-80 ℃保存备用。
参考文献[16]采用GC-MS分析青花椒精油的化学组成。色谱柱:HP-5MS石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:初始温度50 ℃,以10 ℃/min升至180 ℃,最后以8 ℃/min升至220 ℃,并保持15 min。载气(He)流速1 mL/min;进样口温度250 ℃;进样量1 μL;分流比1∶20。质谱条件:电离方式为电子电离,电子能量为70 eV;扫描范围/35~600;传输线和离子源温度分别为280 ℃和230 ℃。
数据处理:使用LECO Chroma TOF软件将原始数据与NIST 17L数据库进行匹配(匹配度>70%),同时采用LECO Chroma TOF软件计算化合物的保留指数(retention index,RI),并与NIST Chemistry WebBook数据库(https://webbook.nist.gov/chemistry/)比对,进行化合物鉴定。使用面积归一法进行化合物的相对定量。
1.3.2 青花椒精油的抑菌活性
参考文献[14]测定青花椒精油对蜡样芽孢杆菌的最小抑菌质量浓度(minimum inhibitory concentration,MIC)和最小杀菌质量浓度(minimum bactericidal concentration,MBC)。取0.1 g冻存的蜡样芽孢杆菌加入新鲜NB培养基中,37 ℃培养48 h进行活化,然后以接种量0.1%添加至新鲜NB培养基中,37℃培养24 h后用于后续实验。用新鲜NB培养基调整蜡样芽孢杆菌浓度至1×10CFU/mL,加入青花椒精油(终质量浓度分别为16.0、8.0、4.0、2.0、1.0、0.5、0.25 mg/mL)。将蜡样芽孢杆菌置于恒温摇床(37 ℃、180 r/min)培养48 h后,培养液保持澄清的青花椒精油最小质量浓度为MIC。用灭菌后的接种环蘸取培养液,然后在NB固体培养基(NB培养基含1.5%(质量分数)琼脂)上划线,在37 ℃下培养48 h,以没有菌落出现的最低青花椒精油质量浓度为MBC。
1.3.3 AKP活力测定
将含有MIC和MBC青花椒精油的蜡样芽孢杆菌悬液(1×10CFU/mL)置于摇床(180 r/min、37 ℃)中孵育3 h。以不含青花椒精油的菌悬液作为空白对照。孵育结束后12 000 r/min、4 ℃离心5 min收集上清液。然后根据AKP检测试剂盒说明书测定AKP活力。
1.3.4 Annexin V-APC/PI染色
取1.3.3节孵育3 h的蜡样芽孢杆菌悬液4 ℃、4 000 r/min离心5 min,弃去上清液,用磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.2~7.4,0.01 mol/L)洗涤2 次,得到菌体沉淀。采用Annexin V-APC/PI试剂盒进行染色,通过流式细胞仪进行荧光检测。
1.3.5 蜡样芽孢杆菌形态观察
取1.3.3节孵育3 h的蜡样芽孢杆菌悬液4 ℃、1 000 r/min离心5 min,弃去上清液,随后加入1 mL质量分数3%戊二醛溶液以固定细胞。
扫描电子显微镜观察:取固定的细胞依次用不同体积分数(30%、50%、70%、80%、90%、95%、100%)乙醇溶液进行梯度洗脱,每次10 min,随后进行临界点干燥,真空镀金,最后使用扫描电子显微镜观察蜡样芽孢杆菌的立体形态。
透射电子显微镜观察:取固定细胞依次用不同体积分数(分别为30%、50%、70%、80%、90%、95%、100%)丙酮溶液进行梯度洗脱,每次10 min,然后包埋、切片、染色,最后用透射电子显微镜进行剖面观察。
1.3.6 青花椒精油对蜡样芽孢杆菌胞内代谢的影响
参考文献[17]的方法并略作修改,探究青花椒精油对蜡样芽孢杆菌胞内代谢的影响。将含有0.5 MIC青花椒精油的蜡样芽孢杆菌悬液(1×10CFU/mL)置于摇床(180 r/min、37 ℃)孵育3 h,以未加入青花椒精油的菌悬液作为空白对照。孵育结束后12 000 r/min、4 ℃离心5 min收集菌体,然后进行冷冻干燥,将冻干后的菌体研磨成粉。然后将100 mg菌粉置于1.5 mL离心管中,并加入1 mL异丙醇-乙腈-水溶液(体积比为3∶2∶2)振荡提取1 min。提取后12 000 r/min、4 ℃离心5 min,吸取200 μL上清液进行冷冻干燥。在冻干后的固体中加入100 μL甲氧铵盐试剂(20 mg/mL),并在30 ℃水浴孵育90 min,然后加入50 μL双(三甲基硅烷基)三氟乙酰胺,在37 ℃水浴孵育30 min。然后取1 μL进行GC-MS分析。
GC-MS条件:柱温箱起始温度为80 ℃,保持2 min,随后以10 ℃/min升高到300 ℃,保持6 min,其余条件与1.3.1节相同。
化合物鉴定和相对定量方法与1.3.1节相同。采用MetaboAnalyst 5.0(https://www.metaboanalyst.ca)数据处理平台对代谢物的相对含量进行正交偏最小二乘-判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA),选取变量投影重要度(variable importance in the projection,VIP)≥1,差异倍数≥1.5,≤0.05的代谢物作为差异代谢物,并对其进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析及注释。
1.4 数据统计与分析
所有实验均重复3 次,结果用平均值±标准差表示。采用Excel软件进行数据处理。采用Origin 2018软件进行数据分析及作图。
2 结果与分析
2.1 青花椒精油的化学组成
青花椒精油的化学组成如表1所示、共鉴定出18 个化合物、占总峰面积的89.22%。其中主要包括芳樟醇((30.69±0.17)%)、-柠檬烯((14.55±0.12)%)、伪柠檬烯((9.08±0.24)%)、4-松油烯醇((3.95±0.14)%)、-月桂烯((3.88±0.10)%)、-松油醇((3.69±0.08)%)、橙花叔醇((3.34±0.07)%)、大牛儿烯D((2.84±0.10)%)、乙酸芳樟酯((2.83±0.07)%)和-蒎烯((2.67±0.03)%)。相似地,Diao Wenrui、Yang Xiaogen等的研究也表明芳樟醇和-柠檬烯是青花椒精油中主要的挥发性成分。青花椒精油中的多种化合物已经被证实具有抑菌活性。其中芳樟醇已被报道能够通过破坏细胞膜,扰乱胞内代谢,影响关键酶活力等方式抑制铜绿假单胞菌()和腐败希瓦氏菌()。由茶树叶和末端小枝分离得到的4-松油烯醇能够对多种人类致病性念珠菌()产生抑制效果。-柠檬烯具有广谱的抑菌特性,能够抑制大肠杆菌、金黄色葡萄球菌、沙门氏菌()等多种病原菌,同时也对黄曲霉()、黑曲霉()和酿酒酵母()等多种真菌具有抑制作用。此外,-蒎烯、-水芹烯、4-蒈烯、-松油醇和石竹烯均被证明具有抑菌活性。综上,青花椒精油的化学组成是其具有抑菌能力的基础。
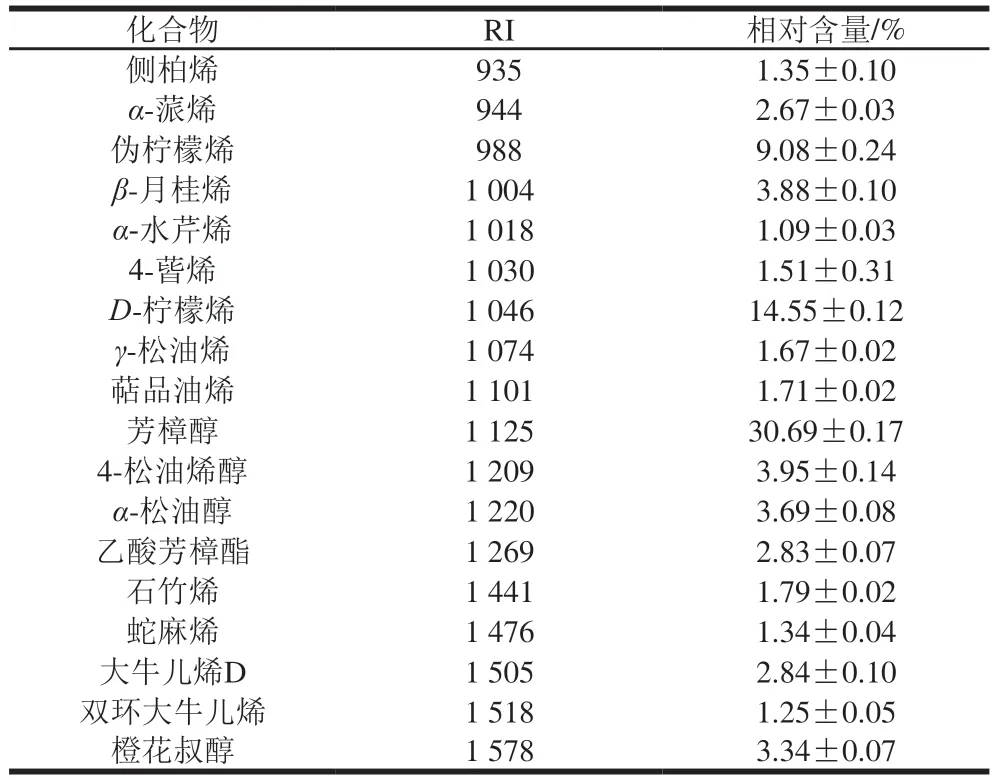
表1 青花椒精油的化学组成Table 1 Chemical composition of green huajiao essential oil
2.2 青花椒精油对蜡样芽孢杆菌的抑菌活性
分别采用终质量浓度16.0、8.0、4.0、2.0、1.0、0.5、0.25 mg/mL青花椒精油处理蜡样芽孢杆菌,结果显示青花椒精油对蜡样芽孢杆菌的MIC和MBC分别为2.0、4.0 mg/mL。Diao Wenrui等发现青花椒精油对表皮葡萄球菌()和枯草芽孢杆菌(均为革兰氏阳性菌)的MBC均为5.0 mg/mL,但对鼠伤寒沙门氏菌()和大肠杆菌等革兰氏阴性菌的抑菌能力较差,推测与细菌的细胞膜结构有关,革兰氏阴性菌外膜具有良好的亲水表面,导致亲脂化合物很难渗透。
2.3 青花椒精油对蜡样芽孢杆菌细胞壁的影响
细胞壁对微生物在环境中的强度和活力起着至关重要的作用。AKP是一种位于细胞壁和细胞膜之间的胞内酶,当细胞壁被破坏时,AKP会泄漏到细胞外。已有报道证实精油及相关成分通常先对细菌的细胞壁和细胞膜造成不可逆的损伤,从而起到抑菌作用。AKP活力测定结果如图1所示,当使用MIC和MBC青花椒精油处理蜡样芽孢杆菌后,AKP活力分别为(0.24±0.04)、(0.30±0.03)U/10cells,与空白组((0.05±0.01)U/10cells)相比活力升高,表明青花椒精油对蜡样芽孢杆菌的细胞壁造成了损伤,从而导致AKP外泄。相似地,Tang Hui等研究发现黑胡椒提取物能够破坏单核细胞增生李斯特菌()和鼠伤寒沙门氏菌的细胞壁,从而导致AKP活力上升。
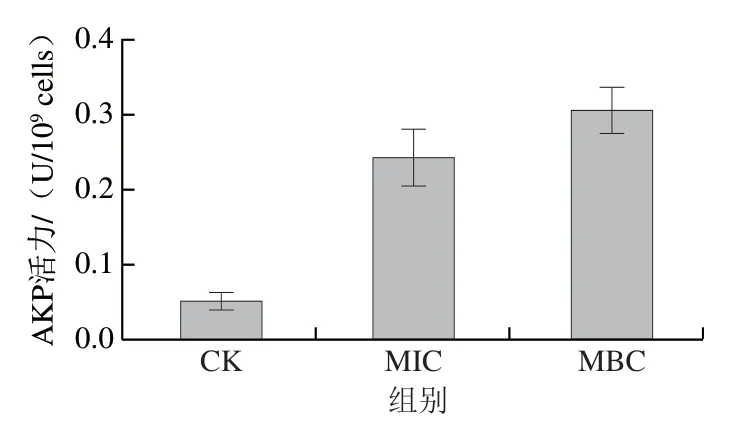
图1 青花椒精油对蜡样芽孢杆菌胞外AKP活力的影响Fig. 1 Effect of green huajiao essential oil on extracellular AKP activity of Bacillus cereus
2.4 青花椒精油对蜡样芽孢杆菌细胞膜的影响
Diao Wenrui等报道青花椒精油能够使表皮葡萄球菌细胞膜裂解,胞内物质流出,从而抑制其活性。本实验采用Annexin V-APC/PI双染色法对不同质量浓度青花椒精油处理的蜡样芽孢杆菌进行流式细胞仪分析。如图2所示,荧光信号主要集中在Q2和Q3象限,表明蜡样芽孢杆菌未能与Annexin V-APC结合,这可能与革兰氏阳性细菌的细胞壁较厚有关。此外,CK组、MIC处理组和MBC处理组的坏死细胞比例(APC/PI)分别为(2.15±0.32)%、(97.77±0.98)%和(98.93±0.26)%。本研究结果表明,MIC和MBC青花椒精油处理能够破坏细胞膜完整性,并杀死绝大部分蜡样芽孢杆菌。
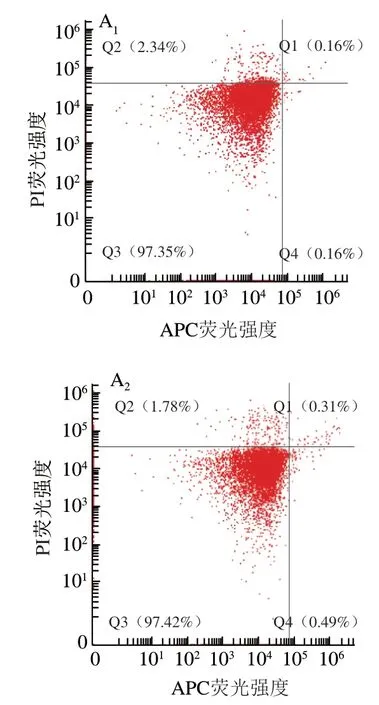
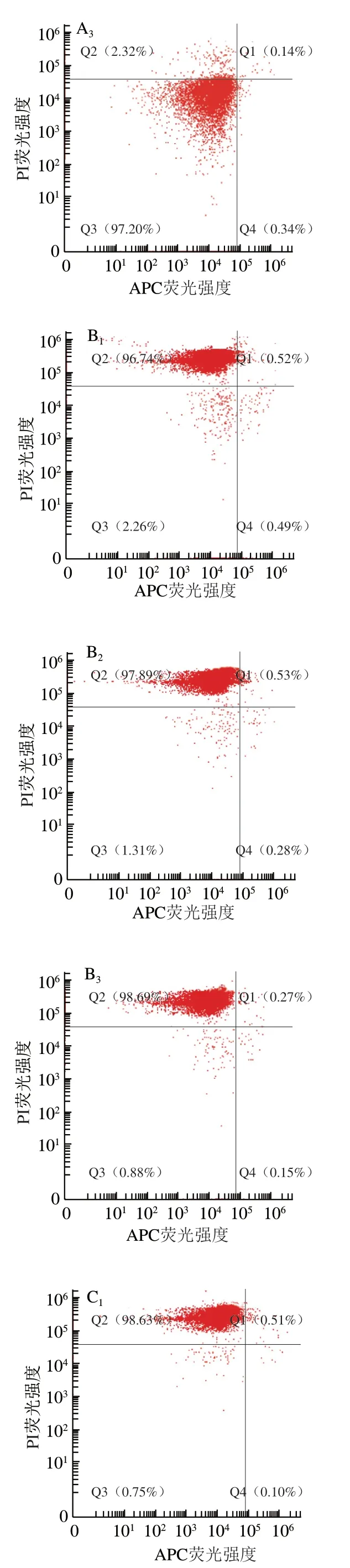
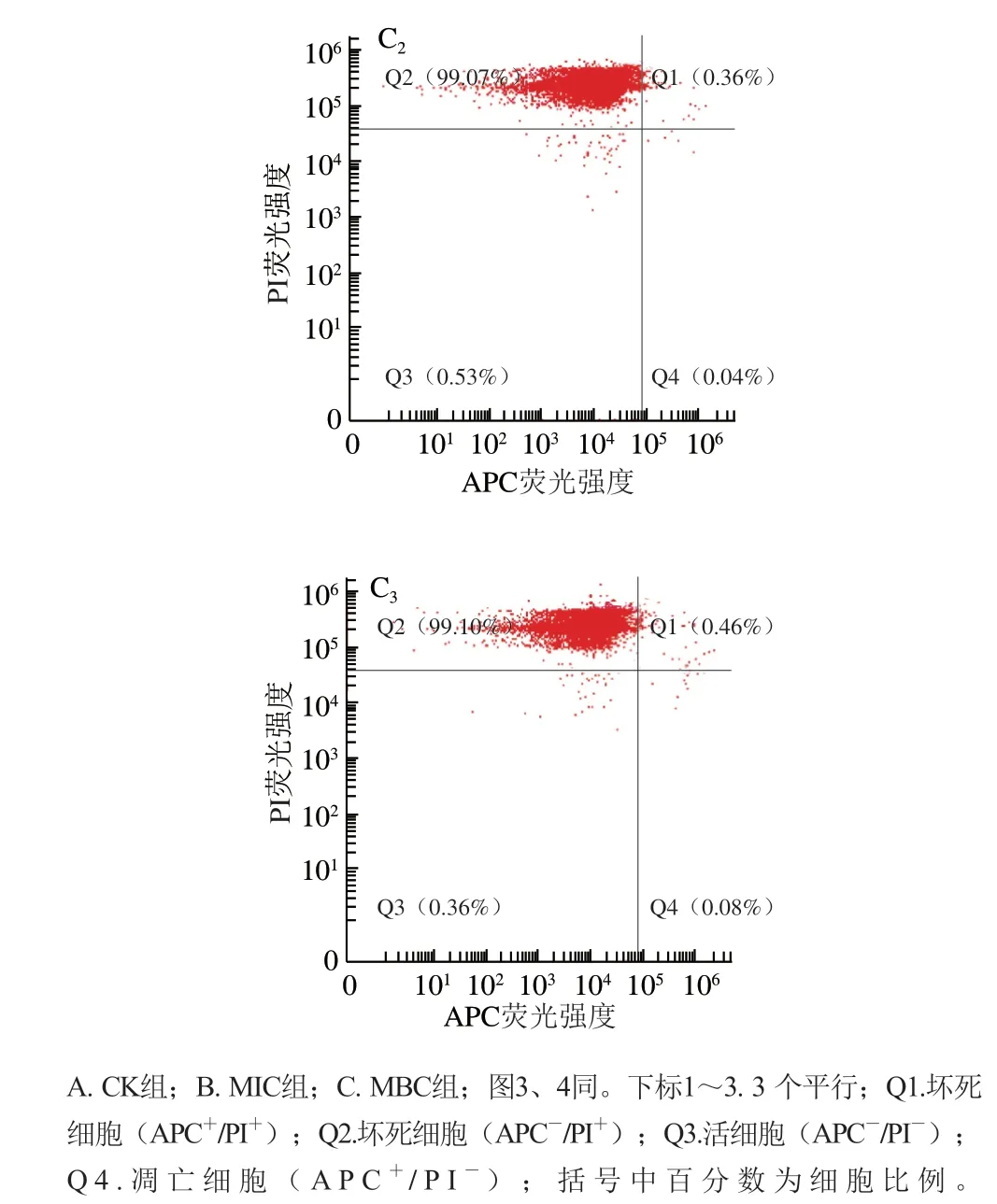
图2 青花椒精油处理蜡状芽孢杆菌细胞的流式细胞术测定结果Fig. 2 Flow cytometric analysis of B. cereus cells treated with green huajiao essential oil
2.5 青花椒精油对蜡样芽孢杆菌形态的影响
扫描电子显微镜观察结果如图3所示,CK组的蜡样芽孢杆菌细胞排列紧密,细胞膜和细胞壁结构完整。而经MIC青花椒精油处理后,细胞严重皱缩,细胞膜破裂。经MBC青花椒精油处理后,蜡样芽孢杆菌细胞膜破损严重,细胞边界模糊不清,出现大量聚集。

图3 青花椒精油处理蜡状芽孢杆菌细胞的扫描电子显微镜图Fig. 3 Scanning electron microscopic images of B. cereus cells treated with green huajiao essential oil
透射电子显微镜结果如图4所示,未使用青花椒精油处理的蜡样芽孢杆菌细胞结构完整。当经过MIC处理后,细胞壁和膜破损,胞内物质流出严重,但是其内生孢子仍具完整的结构。当质量浓度提高到MBC时,细胞破损严重,细胞壁和细胞膜脱落,且内生孢子出现孔洞。推测高质量浓度的青花椒精油能够对蜡样芽孢杆菌的内生孢子结构造成影响。
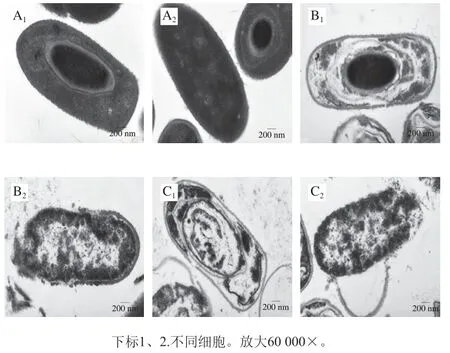
图4 青花椒精油处理蜡状芽孢杆菌细胞的透射电子显微镜图Fig. 4 Transmission electron microscopic images of B. cereus cells treated with green huajiao essential oil
2.6 青花椒精油对蜡样芽孢杆菌胞内代谢的影响

图5 青花椒精油对蜡样芽孢杆菌胞内代谢的影响Fig. 5 Effect of green huajiao essential oil on intracellular metabolism of B. cereus
2.6.1 细胞膜损伤相关代谢物分析结果
流式细胞术和微观结构观察结果已经证明青花椒精油能够对蜡样芽孢杆菌的细胞膜造成损伤。细胞膜损伤相关代谢物相对含量变化如图6所示,从代谢水平上分析,当使用0.5 MIC青花椒精油处理蜡样芽孢杆菌后,其胞内的脯氨酸相对含量相较于对照组,上升5.03 倍(图6L)。脯氨酸是一种具有多种功能的代谢物,其在渗透调节、活性氧清除和膜完整性保护等方面发挥着重要作用。该结果间接表明了青花椒精油能够对蜡样芽孢杆菌细胞膜造成影响。此外,与CK组相比,0.5 MIC处理组未检测到鸟氨酸(图6M),推测鸟氨酸在环脱氨酶的作用下转变为脯氨酸以应对细胞膜损伤。相似地,Liu Miaomiao等发现耐甲氧西林的金黄色葡萄球菌经过涩柿单宁处理后,细胞膜遭到破坏,胞内脯氨酸含量及相关基因显著上调。
此外,脂肪酸是细胞膜的重要组成部分,其除了作为能量来源外,还具有重要的生物和结构作用。如图6A~K所示,共检测出11 种脂肪酸,其中包括9 种饱和脂肪酸和2 种不饱和脂肪酸,其相对含量均明显下降。已有研究发现,细胞膜的通透性和流动性取决于细胞膜所含脂肪酸的饱和性。虽然本研究中所有脂肪酸的相对含量均下降,但是总不饱和脂肪酸与总饱和脂肪酸相对含量的比值由0.054 3增加到0.145 9,表明青花椒精油能够改变蜡样芽孢杆菌中脂肪酸组成,从而影响细胞膜的流动性和通透性。相似地,di Pasqua等发现肉桂醛处理大肠杆菌后,其胞内不饱和度升高,推测肉桂醛通过上调去饱和酶将饱和脂肪酸转化成不饱和脂肪酸,引起细胞膜流动性的增加。


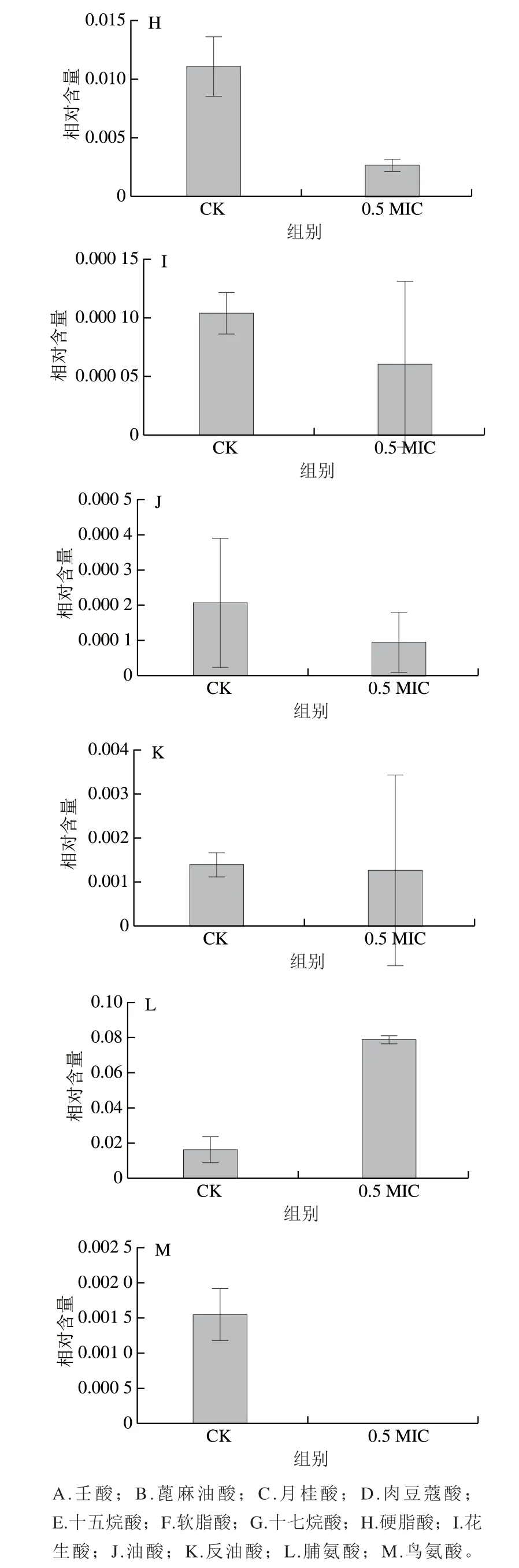
图6 细胞膜损伤相关代谢物相对含量变化Fig. 6 Changes in cell membrane damage-related metabolites
2.6.2 能量代谢限制
糖酵解、柠檬酸循环和电子传递链是细胞提供能量的重要途径。其中柠檬酸循环是大多数代谢通路的主要中枢途径,为糖类、脂肪酸和氨基酸的氧化分解等代谢过程提供前体。在本研究中,柠檬酸和苹果酸的相对含量降低,而琥珀酸和谷氨酸的相对含量上升(图7),表明青花椒精油处理后蜡样芽孢杆菌胞内的柠檬酸循环发生紊乱。琥珀酸是柠檬酸循环中重要的中间产物,其在琥珀酸脱氢酶的作用下转换为富马酸。在本研究中,琥珀酸的相对含量升高可能是青花椒精油抑制了蜡样芽孢杆菌琥珀酸脱氢酶活力,导致其暂时性积累。此外,谷氨酸相对含量的升高也表明柠檬酸循环受到了影响,通常情况下谷氨酸与柠檬酸循环产物-酮戊二酸呈高度平衡状态,柠檬酸循环的抑制会导致谷氨酸积累。乳酸是糖酵解的最终产物,其含量能够反映糖酵解活性。在本研究中,乳酸相对含量降低,表明青花椒精油对蜡样芽孢杆菌胞内糖酵解途径具有抑制作用。

图7 青花椒精油对蜡状芽孢杆菌柠檬酸循环通路的影响Fig. 7 Effect of green huajiao essential oil on the citric acid circulation pathway of B. cereus
2.6.3 氨基酸代谢紊乱
此外,如图8所示,青花椒精油处理蜡样芽孢杆菌胞内氨基酸的合成和代谢途径也受到了干扰。与对照组相比,在被鉴定到的15 种氨基酸中有10 种相对含量降低,5 种相对含量升高。KEGG富集结果显示青花椒精油显著影响了氨酰tRNA生物合成的中间体。氨酰tRNA参与核糖体依赖蛋白质的合成和基本初级代谢过程,其作为适配体分子,连接mRNA的密码子和指定的氨基酸,在蛋白质的生物合成中起关键作用。对氨酰tRNA合成途径影响相关蛋白合成途径造成干扰,就会导致细胞增殖和信号转导受到影响。与对照组相比,青花椒精油处理蜡样芽孢杆菌胞内亮氨酸、缬氨酸和异亮氨酸3 种支链氨基酸的相对含量降低。支链氨基酸是代谢活动中不可缺少的代谢产物,在新分子和细胞的生物合成过程中提供能量和前体。Shu Huizhen等也发现3-蒈烯能够扰乱荧光假单胞菌()胞内的支链氨基酸的代谢。Hu Zhenyang等通过转录组测序发现使用紫苏精油处理黄曲霉会导致与3 种支链氨基酸降解相关的基因表达上调,推测缬氨酸和异亮氨酸降解导致丙酸产生,从而损伤黄曲霉孢子。
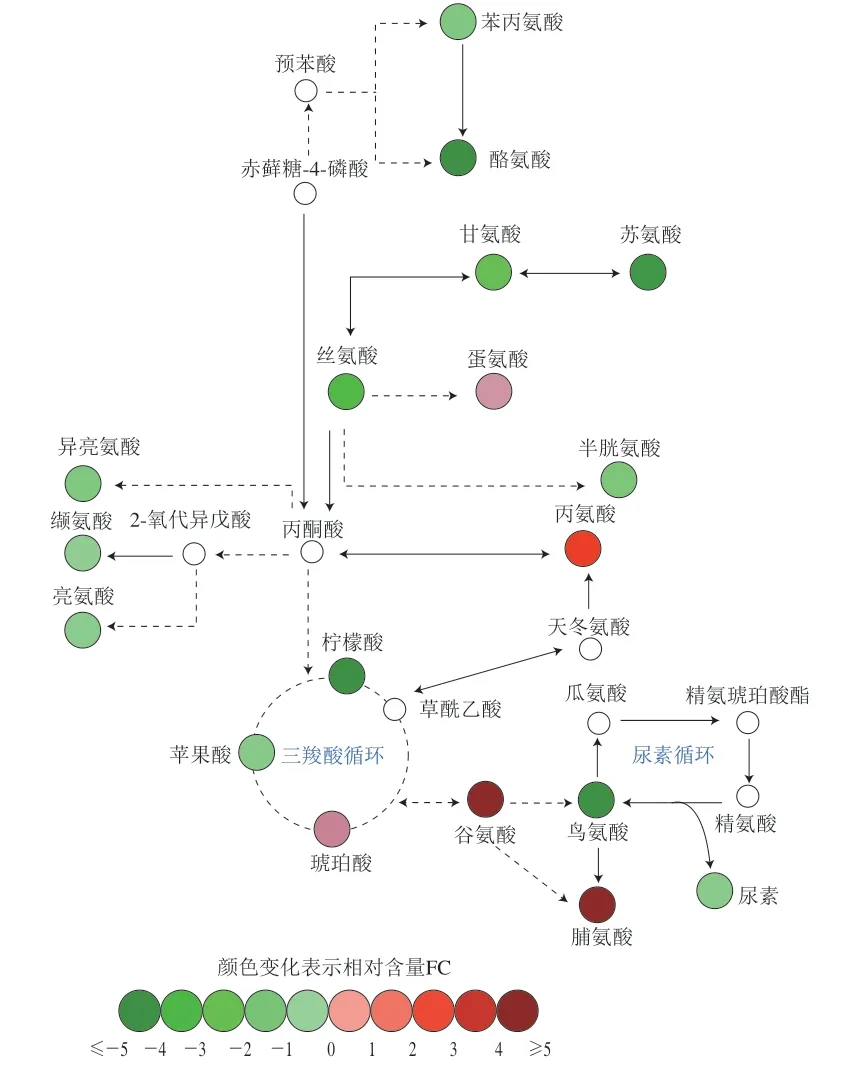
图8 青花椒精油对蜡状芽孢杆菌氨基酸代谢相关通路的影响Fig. 8 Effect of green huajiao essential oil on amino acid metabolism pathways of B. cereus
3 结 论
本研究通过多种技术方法对青花椒精油的化学组成及抑菌活性及机理进行了探讨。GC-MS分析结果表明烯、醇和酯类物质是青花椒精油化学组成中的主要成分,其中多种化合物已被报道具有抑菌活性。以蜡样芽孢杆菌作为研究对象时,青花椒精油表现出良好的抑菌效果,其MIC和MBC分别为2.0、4.0 mg/mL。为了探究其抑菌机理,本实验首先测定AKP活力,结果发现经过青花椒精油处理后,AKP活力上升,表明蜡样芽孢杆菌的细胞壁被破坏。同时,本实验进行了Annexin V-APC/PI双染色法流式细胞术分析以及透射电子显微镜和扫描电子显微镜观察,结果发现青花椒精油能够破坏蜡样芽孢杆菌细胞壁和细胞膜的结构,导致胞内大分子物质流出,且MBC青花椒精油处理还能对内生孢子产生显著影响。本实验基于衍生化的方法在代谢水平上阐释了青花椒精油潜在的抑菌机制,结果显示青花椒精油能够显著影响蜡样芽孢杆菌脂肪酸的组成,进而改变其细胞膜的通透性,此外,其还能使蜡样芽孢杆菌能量代谢和氨基酸代谢紊乱,从而起到抑菌效果。这些结果可为青花椒资源的充分利用和进一步开发以青花椒为原料的新型抗菌药物提供参考。
