离子迁移谱-质谱技术及其在蛋白质糖基化研究中的应用
2022-09-29梁宇颖陆豪杰
付 彬,梁宇颖,陆豪杰,2
(1.复旦大学生物医学研究院和化学系,上海 200032;2.复旦大学卫健委糖复合物重点实验室,上海 200032)
糖基化是一种重要的蛋白质翻译后修饰。蛋白质糖基化是指在酶的催化下,蛋白质与多糖共价结合的过程,在生物体内有着重要的生理意义,在细胞黏附、细胞增殖、细胞信号传输和免疫应答中起着重要的作用[1]。例如,免疫细胞能够识别微生物表面的“糖衣”,启动免疫应答[2]。细胞表面的受体大多数是糖蛋白,这些糖蛋白是胞间交流和病原体入侵的主要参与者[3]。根据糖苷键的类型,蛋白质糖基化可分为N-糖基化、O-糖基化、P-糖基化、C-糖基化、S-糖基化和糖基磷脂酰肌醇化等类型,其中前两者最为常见。N-糖基化是指聚糖连接在满足特定氨基酸序列的天冬酰胺上(Asn-X-Ser/Thr,其中X不能为Pro),是细胞壁和胞外基质的重要组成部分,影响稳定性[4-6]和溶解性[7]等蛋白质理化性质,并且在免疫细胞表面辅助免疫细胞的转移[7]。O-糖基化是指聚糖连接在Ser或Thr的氧原子上,在识别异物、控制细胞代谢以及提供软骨和肌腱的灵活性方面发挥着重要的作用[8]。
按照研究对象,可将蛋白质糖基化分为3个层面:对完整糖蛋白的研究、对蛋白酶酶解产生糖肽的研究、对从糖蛋白上释放得到糖链的研究。得益于液相色谱高效的分离能力和质谱极高的灵敏度,液相色谱-质谱(LC-MS)已成为蛋白质糖基化研究最常用的分析方法[9]。然而,不同于磷酸化、泛素化等其他蛋白质翻译后修饰,糖基化复杂的异质性及大量同分异构体的存在使得包括液相色谱在内的传统分离方法很难实现对聚糖或糖肽异构体的完全分离。此外,虽然串联质谱(MS/MS)技术可以辅助糖结构的解析,但对于聚糖异构体来说,仅凭碎裂离子的质量仍然难以对同分异构体进行区分。
离子迁移谱-质谱(ion mobility-mass spectrometry, IM-MS)是一种能够根据离子在气相中的淌度进行分离,并分析分离后离子质荷比的技术。近年来,研究者们开始逐渐重视IM-MS在区分聚糖异构体方面的潜力[10]。本文将总结IM-MS在蛋白质糖基化研究中的应用进展,并对未来的研究方向及挑战进行展望。
1 糖基化研究的意义和挑战
1.1 糖基化的复杂性及其挑战
因为聚糖结构的高度复杂性,糖组学常被称为“最具挑战性”的组学研究[11]。聚糖的结构示于图1,其复杂性来源于:1) 单糖的多样性。在脊椎动物中常见的单糖有9种,包括半乳糖(Gal)、葡萄糖(Glc)、甘露糖(Man)、N-乙酰半乳糖胺(GalNAc)和N-乙酰葡糖胺(GlcNAc)等。其中很多单糖的相对分子质量完全相同,仅某个羟基的连接方式不同。在组成聚糖后,这些单糖还可能发生不同的修饰,进一步生成更多的聚糖结构。2) 单糖异头碳(环状葡萄糖的C-1)上的羟基存在α、β型2种不同的立体异构。当C-1和C-5具有相同的构型(R或S)时,称为α型,反之称为β型。α型和β型异头碳上的羟基在形成糖苷键时会形成不同的立体异构体。3) 单糖除异头碳羟基外,所有羟基都有可能与其他单糖的异头碳羟基形成糖苷键,从而形成丰富的连接异构体。4) 与线形结构的肽段不同,1个单糖可以与多个其他单糖形成糖苷键,从而形成复杂的分支结构。除聚糖的复杂结构外,糖基化有着复杂的微观异质性和宏观异质性。其中,微观异质性是指在同一个蛋白糖基化位点上可能存在不同的糖型,而宏观异质性是指同一蛋白质存在不同的糖基化位点[11]。以上因素给糖基化研究带来了挑战。
1.2 糖基化的主要研究方法
早期的糖基化蛋白检测通常采用基于抗原抗体结合的免疫测定法,以及联合抗体和凝集素的荧光基团连接的免疫吸附测定法。这些方法依赖于昂贵的抗体,并且在没有相应抗体时无法开展实验。现代糖基化研究最常用的检测手段是基于质谱的检测技术,包括LC-MS和毛细管电泳-质谱(capillary electrophoresis mass spectrometry, CE-MS)。在糖基化研究中,常用的液相色谱分离模式包括多孔石墨化碳(porous graphitic carbon, PGC)吸附色谱、反向色谱(reversed phase liquid chromatography, RPLC)以及亲水作用色谱(hydrophilic-interaction chromatography, HILIC)。现也有研究将液相色谱替换成毛细管电泳(capillaryelectrophoresis, CE),将CE的高分辨率和MS的高灵敏度相结合,在糖基化研究中取得了良好的结果[12-13]。此外,核磁共振(nuclear magnetic resonance, NMR)技术也被很多研究者用来辅助聚糖结构的解析[14-15]。

注:a.常见的单糖;b.异头碳羟基的α,β异构;c.聚糖会形成分支结构;d.单糖的多个羟基都可能与其他单糖形成糖苷键图1 聚糖的复杂结构Fig.1 Complex structure of glycans
然而,上述方法都存在一些缺陷[9]。即使在抗体很容易获得的情况下,由于基质效应和交叉反应的存在,免疫测定无法精准分析非常复杂的生物样本。虽然液相色谱高效,但在区分异构体方面能力不足;NMR 能够提供详细的结构信息,但由于对样品纯度要求苛刻,不适合分析复杂的生物样品。
2 离子迁移谱-质谱技术
2.1 质谱技术基本介绍
自1912年 Thomson[16]发明质谱以来,质谱技术逐渐成为最常用的检测分析手段之一。得益于灵敏度高、检出限低、检测速度快等优点,质谱被广泛应用于有机化学、无机化学等领域。在离子化时,电子轰击源和化学电离源离子化技术会将离子碎裂成碎片,不适合研究生物大分子。基质辅助激光解吸离子化(matrix-assisted laser desorption ionization, MALDI)[17]和电喷雾离子化(electron spray ionization, ESI)[18]等软电离技术的出现,使质谱分析生物大分子成为可能。MALDI和ESI的离子化条件相对温和,在离子化过程中主要形成准分子离子,往往不会碎裂分子,近年来被广泛应用于蛋白质组学[19]、糖组学[20]和代谢组学[21]的研究。
虽然质谱能够提供精确的质荷比,但复杂的生物样品不加预分离往往会产生难以解析的复杂谱图。因此,通常将质谱与气相色谱或液相色谱联用,通过对复杂样品进行预分离以减少谱图的复杂度。LC-MS 作为组学研究最常用的分析技术,虽然能够对复杂的生物样本进行质谱前预分离,但在分析具有复杂异构现象的糖组样品时仍存在困难。
2.2 离子迁移谱基本原理
离子迁移谱(IM)是一种利用离子在气相中淌度的不同实现分离的技术。淌度是衡量气相中离子在电场力和中性分子阻力作用下的移动能力。气相中的离子在电场作用下与中性气体相对位移时发生碰撞,由于离子所带电荷和自身立体结构,其受碰撞产生的阻力大小不同。当电场强度足够低,以至于离子的漂移速度vd远小于离子的热运动速度vT时,离子淌度常数K与离子碰撞截面积(collision cross section, CCS)Ω的关系满足Mason-Schamp公式[22]:
(1)
式中,q是离子所带电荷,N是中性缓冲气体的粒子数密度,k是玻尔兹曼常数,T是开尔文温度,m是中性缓冲气体的分子质量,M是离子质量,Ω是离子的碰撞截面积。Ω的本质是“动量转移碰撞积分”,即离子和中性分子之间的动量转移对所有离子-分子相对热速度的积分。Ω的大小同时与离子的性质和缓冲气体的性质有关[23]。
常用的离子迁移谱包括漂移管离子迁移谱(drift tube ion mobility spectrometry, DTIMS)[24]、高场不对称离子迁移谱(high-field asymmetric ion mobility spectrometry, FAIMS)[25]、行波离子迁移谱(travelling wave ion mobility spectrometry, TWIMS)[26]和捕集离子迁移谱(trapped ion mobility spectrometry, TIMS)[27]。DTIMS作为最早出现的,也是最常用的离子迁移谱,常被简称为 IMS。
目前为止,DTIMS是唯一能够直接通过漂移时间计算离子淌度常数K的技术[23]。
(2)
式中,l是漂移管长度,td是离子从漂移管一端运动到另一端所需的时间,E是电场强度。对于TWIMS和TIMS来说,CCS可以由DTIMS获取的CCS值经校准得到[28-30]。与DTIMS不同,FAIMS在高电场强度下对离子进行了无法确定的能量转移,以至于离子的温度无法确定,故无法通过Mason-Schamp公式计算淌度常数。因此,FAIMS通常只作为一种高效的分离手段。
3 离子迁移谱-质谱技术在糖基化研究中的应用
根据研究对象的不同,基于IM-MS技术的糖基化研究可分为对聚糖、糖肽和完整糖蛋白的研究三类。
3.1 聚糖研究
3.1.1IM-MS对聚糖离子检测的优化 质谱的发展已步入超高分辨时代,包括飞行时间质谱(time of flight, TOF)和Orbitrap在内的高分辨质量分析器已经被普遍应用于主流的商用质谱仪器中。然而,对具有较长发展历史的质谱而言,离子迁移谱的分辨能力有时并不能满足聚糖研究的要求(平均~1%误差[31])。为了克服这一困难,研究者们分别从糖链衍生化、改变和优化加合离子、发展离子迁移谱仪器等方面尝试提高IM-MS对聚糖离子的分辨能力。
在分析聚糖时,通常需要进行衍生化处理。通过同位素标签可以在不同样本的聚糖上引入1个固定的质量差,从而辅助定量。Butler等[32]研究了“同位素聚糖酰肼标签标记的个体归一化”(individuality normalization when labeling with the isotopic glycan hydrazide tags, INLIGHT)技术对N-糖IM-MS分析的影响,发现该技术中的NAT(nature,天然状态)和SIL(stable isotope label,稳定同位素标签)不仅不会影响聚糖的漂移时间,还能够提高IM分辨率。全甲基化修饰是另一种常用的聚糖衍生化,是指将所有与O原子和N原子相连的H原子用甲基取代。全甲基化可以抑制聚糖的中性丢失,提高离子化效率,并在串联质谱中产生利于结构解析的诊断碎片离子[33]。Dumontier等[34]发现,在对N-糖进行全甲基化修饰后,其在IM中的半峰宽变窄,说明全甲基化能够减弱N-糖的构象变化。在IM中通常无法区分构象异构体和同分异构体,构象异构体常干扰同分异构体的判断,而该研究证明全甲基化能够为IM-MS提供更好的异构体分辨能力。荧光标签可以为本身没有荧光发射的聚糖引入荧光基团,便于色谱检测。虽然在LC-MS中作为检测器的质谱不需要荧光基团辅助检测,但荧光标签能够改善聚糖在液相色谱上的分离能力,并且提高质谱的离子化效率[33]。Manz等[35]将常用的荧光标签2-AA、2-AB和ProA(procainamide)用于聚糖的IM-MS检测,发现荧光标签会增大聚糖的CCS值,增大的程度与携带荧光标签的大小呈正相关,并且可以提高聚糖在IM中的分辨率。
使用特殊的金属离子或阴离子与聚糖形成特殊的加合物,从而可提高IM对聚糖的分辨能力。例如,Ca2+、Co2+等二价金属离子能够明显提高聚糖离子在IM中的分辨率[36-38],与卤素离子的共加合(如[M+Ca+I]+或[M+Ca+Cl]+)可以进一步提高分辨率[36-37]。然而,聚糖与二价金属离子形成的加合离子可能存在不同的形式:1个聚糖和1个金属离子、1个聚糖和2个金属离子、2个聚糖和1个金属离子、2个聚糖和2个金属离子等。包含2个聚糖的二聚体可能由2个不同的聚糖组成,在MS1中可能会形成与其他单体重叠的峰,从而导致MS/MS谱图质量下降,难以准确分析[39-40]。Morrison等[41]证明,由于相同m/z的二聚体和单体在IMS中的到达时间分布差距较大,IMS能够排除质谱分析中二聚体的干扰。
用低分辨离子迁移谱很难实现聚糖异构体的直接分离。Quaranta等[42]发现,TWIMS无法区分相同单糖数的聚糖。因此,除了使用不同的衍生化或加合离子来改善分辨率外,直接使用高分辨离子迁移谱也是一种选择。含有无损离子操作结构的离子淌度谱(structures for lossless ion manipulations ion mobility spectrometry, SLIM-IM)是一种新型的离子淌度技术,能够在较小的空间范围内极大地提高离子的有效路径长度,从而提高离子迁移谱的分辨率[43]。有报道[44]成功地将具有拓展蛇形超长路径(serpentine ultra-long path with extended routing, SUPER)的SLIM-IM-MS用于区分聚糖阳离子,实现了α, β端基异构体的分离。TIMS采用较为巧妙的方法延长了离子运动的有效路径。在TIMS中,与常规离子在静止缓冲气体中的运动形式不同,缓冲气体有一定的流速,而离子相对于漂移管静止。这种设计使TIMS能够在很小的空间内实现超高的分辨能力。Wei等[45]利用TIMS-MS/MS分析了22对N-糖异构体,其中有14对能够被区分,证明了TIMS的优势。环状离子迁移谱(cyclic ion mobility mass spectrometer, cIMS)是一种高分辨离子迁移谱,通过重复利用环状的离子轨道,延长离子的有效路径长度,从而提高分辨率。Ujma等[46]用Q-cIM-MS实现了对3种五聚糖混合物的分离,并识别出α, β端基异构体。
有研究[32,47-48]尝试将IM-MS与现有的分离技术联用,利用不同分离技术的正交性克服IM分辨率不足的问题。由于离子迁移谱是对气相中的离子进行分离,需要放在离子源后,因此可以作为一种模块化组件方便地加入常用的LC-MS 中,而不影响液相色谱的分离。此外,IM的分离发生在ms尺度,而液相色谱的分离发生在min尺度,两者可以形成很好的嵌套关系。最后,由于液相色谱和离子迁移谱的分离存在一定的正交性,离子迁移谱能够将液相色谱共流出的组分进一步分离,以简化质谱图[32]。有研究[47]尝试将毛细管区带电泳(capillary zone electrophoresis, CZE)与IM-MS相结合,发现CZE-DTIMS-MS能够实现单独使用DTIMS-MS和CZE-MS时无法实现的N-糖异构体的完全分离,并在区分唾液酸连接异构体上有着出色的表现。Zheng等[48]将IM-MS与固相萃取(solid-phase extraction, SPE)相结合用于分离分析O-糖异构体,证明了其区分α, β 端基异构体和不同分支结构的能力[48]。
除与其他分离技术联用外,IM-MS还可以与常用的质谱碎裂模式结合。Harvey等[49-50]开展了一系列研究探究碰撞诱导解离(collision induced dissociation, CID)与IM-MS相结合的潜力,离子通过IM分离后被碎裂,并进行MS/MS分析。他们利用不同电荷的离子在漂移时间(drift time, DT)对m/z所作图上会形成不同趋势线这一性质,实现了对m/z相近但电荷不同的母离子的区分,简化了MS/MS谱图。在另一些研究中,IM被用于分离分析不同类型的N-糖(包括多甘露糖型N-糖[51]、岩藻糖基化N-糖[52]、复杂型N-糖[53])的CID碎裂离子,通过不同的母离子形成的子离子会有指纹特性的到达时间分布(arrival time distributions, ATDs)或CCS值分布(CCS distributions, CCSDs),以实现对异构体的分离。同样,Torano等[54]采用IM-MS/MS得出了类似的结论,证明了岩藻糖的结构信息可以通过CID子离子特殊的ATDs来获取。Hoftmann等[55]发现CID碎裂离子的ATDs可以用来区分Lewis结构和血型聚糖异构体。相比于CID,紫外光解离(ultraviolet photodissociation, UVPD)在碎裂聚糖时能够诱导更利于结构解析的跨环碎裂。然而,由于未衍生的聚糖只有很弱的紫外吸收,UVPD对聚糖的碎裂效率较弱。Morrison等[38]发现,使用Co2+离子加合物可以提高聚糖 UVPD 的离子化效率和聚糖在 DTIMS 中的分辨率。
3.1.2IM-MS CCS值用于区分聚糖异构体
目前,在IM-MS中通常使用CCS作为区分不同结构聚糖的依据。CCS值的理论计算大多使用分子动力学模拟的方式。Re等[56]采用分子动力学与 IM-MS 结合研究N-糖在气相中CCS 值的决定因素,发现N-糖携带质子的状态及其构象组合对 CCS 值的影响较大,大部分质子化聚糖以球状或棍状的构象存在,其 CCS值分布为较窄的单峰,且其CCS值的差异足以用于区分异构体。由于理论计算仍存在较大偏差,目前通常使用在DTIMS上测得的CCS值(DTCCS)作为标准值。近年来,已有研究者尝试构建聚糖CCS值数据库,其中以GlycoMob最为典型。GlycoMob[57]是聚糖、寡糖及其碎片CCS值的数据库,截止2022年,共收录了1 008个离子。GlycoMob为校准 TWIMS 提供了极大的便利,同时为基于CCS值的聚糖结构解析提供了支持。如Dumontier 等[34]用TWIMS-MS和ESI-MS/MS研究了三角苜蓿(P.tricornutum)蛋白的N-糖,发现与其他微藻类硅藻不同的是,三角苜蓿能够产生一种在哺乳动物中常见的Man-5异构体(二者具有相同的CCS值),表明三角苜蓿有合成复杂N-糖的潜力,可以用于生物制药。Lucas等[58]结合多种分析手段,包括 Western blot、TWIMS-MS、nanoLC-ESI-MS和ESI-MSn,分析了莱茵衣藻(C.reinhardtii)的木糖基化N-聚糖。Barroso等[59]通过CCS值的差异实现了阴离子模式下α2-3、α2-6唾液酸连接异构体的区分。Vanier等[60]通过CCS值发现莱茵衣藻体内复杂型N-糖和哺乳动物N-糖存在结构差异,不同于哺乳动物中的支链结构,莱茵衣藻中的Man5 GlcNAc2具有线性结构,揭示了莱茵衣藻不同的复杂型N-糖合成路线。
对于DTIMS来说,虽然可以直接通过到达时间计算CCS值,但在实际操作中,由于Mason-Schamp公式中的许多参数存在误差,直接计算所得的CCS误差较大。Stow等[22]提出DTIMS的多场矫正和单场矫正方法,提高了DTIMS的到达时间转化为CCS值的准确性。多场矫正是指用同一标准物质在漂移管长度、漂移管内气压或电场强度梯度变化时得到的AT-CCS校准曲线,其中变化电场强度的做法最常见、最准确;而单场矫正是指测定多个标准物质在同一实验条件(包括电场条件)下的到达时间,从而得到AT-CCS校准曲线。有报道[32,39]使用单场校准方法取得理想效果。TWIMS无法直接从到达时间计算CCS值,需要用已知CCS值的标准物质进行校准。目前,最常用的TWIMS CCS值计算方法是由Smith等[28]提出的校准方法,Hofmann等[30]和Pagel等[29]将这一方法扩展到聚糖上。
CCS值分布也能作为分析指标。糖肽或聚糖可能出现多种同分异构体,而每种同分异构体在气相中可能会出现多种构象异构体。因此,糖肽或聚糖的异构体离子会出现不同的ATDs,其可转化成CCS分布,从而得以区分异构体[47,51,54]。Torano等[10]提出了从多糖DTIMS-MS的ATDs推算多糖的构象分布(conformation distributions, CDs),从而辅助多糖鉴定的方法。他们用 DTIMS-MS/MS 测定了15种常见的免疫相关N-糖的ATDs,证实了m/z相近的多糖,甚至是m/z相同的连接异构体(包括唾液酸 α2-3和α2-6连接异构体),可以通过阴离子模式下特异性的ATD指纹图谱得以区分。此外,作者还用从牛胎球蛋白酶解产生的多糖验证了通过ATDs辅助多糖结构鉴定的可行性,证明在拥有完整多糖ATDs指纹图谱数据库的情况下,仅通过IMS-MS一级质谱进行结构鉴定是可行的。质子化的聚糖在IM中通常只以中心对称的单峰形式存在,而在阴离子模式下,聚糖通常会在IM中出现复杂且具有指纹特性的ATDs[10]。因此,基于IM-MS的糖基化异构体研究通常是在阴离子模式下进行[42,49-50,59]。Zheng 等[48]发现,虽然聚糖在阴、阳离子模式下的IM谱图有较大差别,但不同的聚糖在不同模式下可能会有更好的分离效果,不应一概而论。
3.1.3IM-MS用于分析岩藻糖和唾液酸聚糖
值得注意的是,在聚糖中往往要关注一些具有重要生理意义的单糖异构体或连接位置。岩藻糖和唾液酸是2种重要的单糖。岩藻糖在聚糖中存在着不同的连接方式,可能起到不同的生理作用。岩藻糖基化的N-糖介导包括白细胞黏附[61]、受精[62]、组织发育[63]和肿瘤转移[64]在内的各种生理过程。Harvey等[52]在对含Lewis x和Lewis y结构的岩藻糖基化N-糖分别进行CID前后的IM表征发现,该技术能够很好地识别岩藻糖在哪个天线上,以及每个天线上各有多少岩藻糖。Hoftmann等[55]用IM-MS/MS实现了对Lewis结构和血型聚糖异构体的区分。他们首先通过IM-MS测得一些血型和Lewis三聚糖、四聚糖完整离子以及CID碎裂离子的CCS值和m/z,以此构建聚糖碎片指纹数据库;随后,在人类腮腺组织N-糖和乳汁寡糖样品中验证了CCS指纹谱数据库,用于鉴定Lewis结构和血型结构的可行性。此外,岩藻糖基N-糖在碎裂时会发生岩藻糖的转移重排[65],给N-糖的结构解析带来很多困难。Torano等[54]利用IM-MS/MS研究了岩藻糖的转移规律,发现岩藻糖重排时会生成各种不同位置异构的子离子,在DTIMS中形成不同的ATDs,从而得以表征岩藻糖的重排行为。研究还发现,岩藻糖基残基会迁移到N-乙酰神经氨酸的乙酰氨基部分、乙酰氨基残基和异头标签的亲核位点,产生特定的异构片段离子。与之前研究结论不同的是,该研究没有发现岩藻糖向羟基重排的现象。此外,Manz等[35]发现2-AA或2-AB等荧光标签会阻止岩藻糖的重排。
唾液酸通常以α2-3或α2-6的连接方式与半乳糖(Gal)相连,与包括免疫细胞追踪[66]、微生物附着[67]、凝血[68]和炎症稳态[69]在内的多种生理过程有关。α2-3或α2-6异构体在不同的细胞事件(例如病毒感染)中具有选择识别性[70]。此外,在一些癌症的发展过程中,两者的变化水平也会呈现不同的趋势[71]。由于LC往往难以充分分离唾液酸连接异构体,因此,基于LC-MS研究唾液酸连接异构体通常采用连接异构体特异性衍生的方法,如将α2-3和α2-6异构体间引入1个质量差[71-72]。而一些研究者利用IM-MS区分同分异构体的能力,在不衍生的情况下实现了对唾液酸连接异构体的分离分析。Torano等[10]通过DTIMS-MS/MS测定了15种免疫相关N-糖(包括唾液酸连接异构体)的ATDs,发现m/z相近的多糖,包括唾液酸α2-3和α2-6连接异构体,都可以通过阴离子模式下的ATD指纹图谱进行区分。Lane等[73]发现,在向FAIMS的缓冲气体中加入适量的甲醇蒸汽,可以实现对唾液酸连接异构体的完全区分。理论计算表明,α2-3连接异构体有更负的补偿电压,表明α2-6连接异构体和甲醇有更强的结合能量,即α2-3连接异构体与甲醇分子的结合能力更强。此外,Jooss等[47]在α2-3唾液酸苷酶的辅助下,利用CZE-DTIMS-MS实现了 α2-3、α2-6唾液酸连接异构体的区分。
3.2 糖肽研究
以聚糖作为研究对象时,其位点信息会随着糖链从糖蛋白或糖肽上的释放而丢失。因此,位点特异的糖基化研究具有重要意义。完整糖肽通常是指糖蛋白经过蛋白酶酶解后产生的带有糖基化修饰的肽段,同时保留聚糖和聚糖连接位点的信息。研究表明[74-75],IM-MS/MS策略可以更好地进行糖肽的结构解析。Pallister等[76]将液相色谱-荧光-离子迁移谱-质谱(LC-FLR-IM-MS)用于分析N-糖肽的异构体,采用TWIMS分离分析完整离子和碎片离子。对于完整离子的分析,获取IM-MS数据后,将数据与数据库中的谱图进行比对以实现结构鉴定;对于碎片离子的分析,母离子碎裂为子离子产生MS/MS谱图和子离子IM数据,通过比对数据库进行结构鉴定。上述2种策略均可有效区分糖肽异构体,该研究首次实现了在阳离子模式下对糖肽异构体的IM分析。Campbell等[77]采用FAIMS-MS/MS实现了糖肽异构体MUC5AC-3和MUC5AC-13的分离,并提出结合碰撞诱导解离(collision-induced dissociation, CID)或电子捕获解离(electron capture dissociation, ECD)可以在无需标准物质的情况下利用MS/MS谱图对IM谱图中的峰进行归属。
在基于串联质谱的糖肽解析中,通常会同时使用包括CID、电子转移解离(electron transfer dissociation, ETD)在内的多种碎裂模式,或使用电子转移/高能碰撞解离(EThcD)、电子转移/碰撞诱导解离(ETciD)等混合碎裂模式,以实现对肽段和糖链部分的碎裂。Kolli等[78]提出了一种基于IM的新型碎裂模式,可以对同一批母离子同时进行CID和ETD碎裂。在此流程中,带n个正电荷的母离子被四极杆选择后,短暂地与负电自由基反应离子反应,此时部分母离子发生电子转移反应(ET),另一部分离子不反应(NR)。随后,ET离子和NR离子由于淌度的较大差异经由IM分离。经淌度分离的2组离子在离开淌度分离室后经过振动激活,导致NR离子发生CID碎裂,而ET离子发生ETD碎裂。因为NR和ET离子的漂移时间差异很大,所以这2个解离过程在时间上是分离的,所有子离子随后经由TOF MS分析。此流程利用传统ETD过程中未反应的离子获取CID谱图,极大地提高了离子利用率。
本课题组[79]提出了一种用IM-MS对α2-3和α2-6唾液酸连接异构的N-糖肽进行定性和定量分析的方法,示于图2。该方法中的每个样本需要2次进样:第1次进样中,糖肽在富集后通过LC-MS/MS分析和鉴定,此时各个糖肽母离子的m/z和保留时间被记录下来,得到1个样本中所含糖肽母离子数据库;第2次进样采用LC-CID-IM-MS的分析模式,满足特定m/z和保留时间的母离子被四极杆分离出来并进行CID碎裂,产生的离子经由IM-MS分析。在CID碎裂后,m/z657.24的B3离子在IM上出现2个峰,分别对应2种唾液酸连接异构体。B3离子在IM中的曲线下面积可以用于该唾液酸连接异构体的定量。这种方法不需要额外的衍生化处理,减少了在衍生化步骤中可能引入的误差。本课题组将该方法成功用于肝细胞癌和健康对照血清触珠蛋白N-糖肽的分析,共鉴定到42对唾液酸连接异构的糖肽,其中9对具有显著差异,有望作为肝细胞癌的潜在标志物。
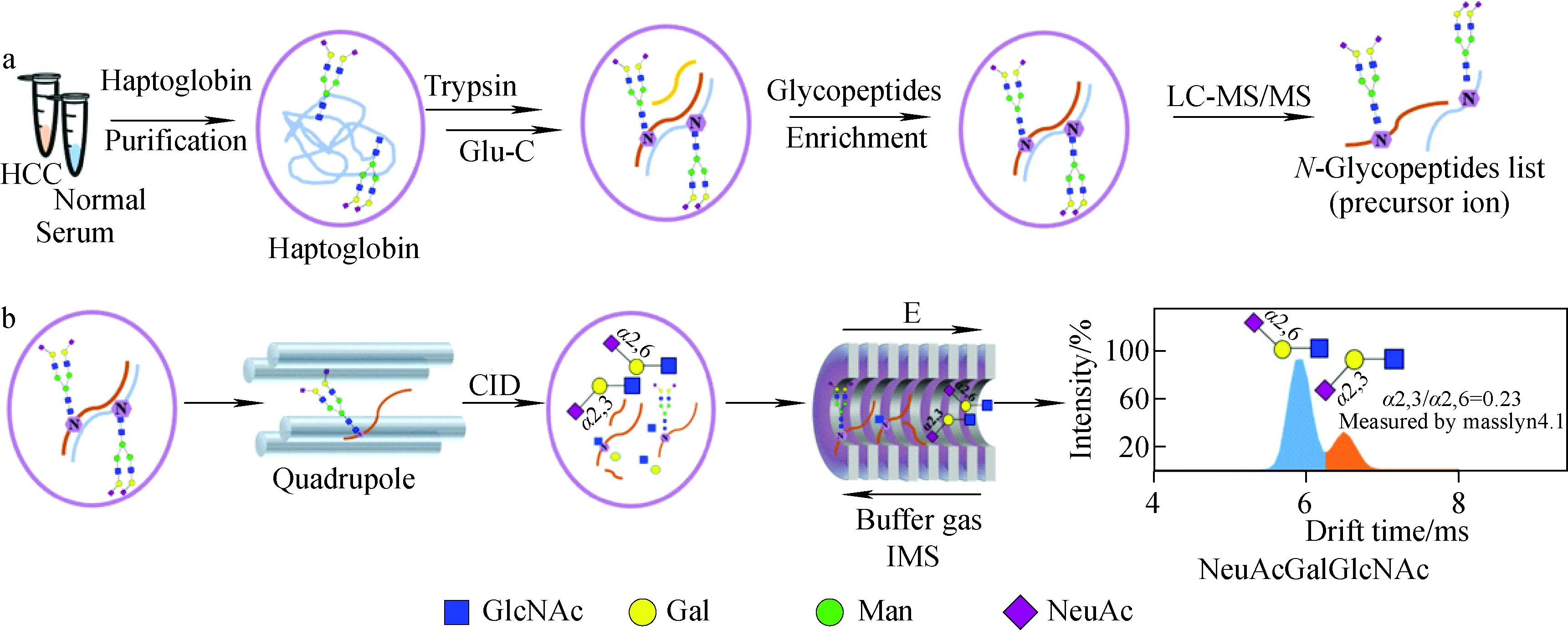
注:a.通过LC-MS/MS鉴定N-糖肽;b.通过LC-CID-IM-MS得到α2-3和α2-6唾液酸连接异构体的比例图2 通过IM-MS对α2-3和α2-6唾液酸连接异构的N-糖肽进行定性和定量分析的方法[79]Fig.2 A new strategy for qualitative and quantitative analysis of N-glycopeptide α2-3 and α2-6 linkage isomers by IM-MS[79]
目前,基于质谱的完整糖肽研究在极大程度上依赖于以糖为中心的糖肽富集[80]。糖肽富集可以减小色谱中共流出的非糖基化肽段的离子信号抑制[81]。两性离子亲水作用液相色谱(ZIC-HILIC)是糖肽富集最常用的技术之一,HILIC表面的“水层”能够与糖肽亲水的糖链发生亲水相互作用,从而富集糖肽。然而,HILIC对较大的糖结构有偏向性[82],且在O-糖肽的富集上表现较差[83]。Ahmad等[84]对比了传统HILIC+LC-MS/MS和无需HILIC富集的FAIMS-MS/MS 2种分析细菌糖蛋白质组的方法,证明了FAIMS在糖蛋白质组分析中的优势。实验以3种伯克霍尔德氏菌的糖蛋白质组为研究对象,发现较短的O-糖肽在HILIC富集过程中会丢失,而FAIMS-MS/MS却可以检测到这些糖肽,且HILIC和FAIMS鉴定到的糖肽具有一定的互补性,通过FAIMS-MS/MS鉴定到的糖肽数量增加了25%。Fang等[85]发现使用FAIMS可将LC-MS/MS分析中含有糖鎓离子的谱图数提高76%,且在人类DG75细胞中鉴定到的N-糖肽数是未使用FAIMS时的3.6倍。
除单个蛋白的精准分析,也有研究将IM-MS技术用于糖蛋白质组学研究。Veith等[75]通过 LC-FAIMS-MS/MS研究连翘坦纳氏菌(T.forsythia)细胞膜的糖基化蛋白质组,鉴定到13种糖链,以及在145个糖蛋白上的312个糖基化位点。Cain等[86]用平行多蛋白酶酶解、ESI-MS/MS和FAIMS-MS/MS分析空肠弯曲菌的糖蛋白质组,发现了142个糖基化位点,其中32个是首次发现的新位点。Sanda等[74]用LC-MS/MS研究SARS-CoV-2刺突蛋白表面的N-糖基化和O-糖基化,并确定了9个N-糖肽和17个O-糖肽及其异构体。实验中使用高分辨的环状离子迁移谱(cIMS)对碎裂后的离子进行分离,以排除肽段骨架的干扰并辅助糖结构的鉴定。
Gelb等[87]结合理论计算与实验,系统地分析了不同聚糖结构和氨基酸序列的N-糖肽形成不同电荷的质子化离子在TWIMS-MS中CCS值的规律。研究发现,糖肽的CCS值与减少分子内的库仑排斥(使得肽段更舒展)和增大电荷的溶剂化作用(使得肽段更紧凑)这2种稳定过程有关。体积较大的聚糖有助于溶剂化作用,使得肽段更紧凑,从而有较小的CCS值。
3.3 糖蛋白研究
在传统的质谱组学研究中,将完整糖蛋白作为研究对象的“自上而下”的研究较少,主要是由于质谱在高质量区的分辨率较低,且完整糖蛋白的四级结构较复杂等原因。IM-MS以其能够识别离子在气相中结构的优势,在完整糖蛋白研究中发挥着不可替代的作用。IM-MS应用于完整糖蛋白的研究主要可以分为糖基化对蛋白质稳定性的影响、蛋白-糖蛋白或糖蛋白-糖蛋白的相互作用、以及完整糖蛋白的结构分析三类。
碰撞诱导展开(collision induced unfolding, CIU)是一种表征蛋白稳定性的常用手段。在CIU中,被分离出来的离子(例如蛋白质离子)在中性气体(例如氩气)碰撞下内能升高,使得其在气相中发生构象变化,但内能升高的程度不足以断裂共价键。CIU过程通常使用IM-MS进行分析,通过离子CCS的变化得到构象变化信息,并通过MS或MS/MS进行定性和定量分析[88]。Li等[4]用非变性离子淌度质谱(native IM-MS)通过CIU测定唾液酸修饰对转铁蛋白化学稳定性、构象稳定性和拓扑学稳定性的影响,证明了唾液酸对转铁蛋白有着稳定作用,但会阻止其发生二聚。Yen等[5]用IM-MS结合CIU研究糖基化微观异质性和宏观异质性对SARS-CoV-2病毒受体蛋白DC-SIGN稳定性的影响,发现糖的类别对蛋白稳定性的影响不大,而糖的数量却对其有着很大影响。
有报道将IM-MS用于研究糖蛋白-蛋白之间的相互作用。Zhao等[89]用Q-TWIMS-TOF研究糖蛋白细胞环形受体1(Robo1)和硫酸肝素(HS)的相互作用,重点研究了Robo1-HS相互作用时的构象变化,以及N-糖基化对Robo1构象和结合能力的影响。Wang等[90]开发了一种多步ESI-MS流程用来研究糖蛋白和聚糖结合蛋白之间的相互作用。流程如下:1) CaRIMS-ESI-MS:在捕获和释放分析中,通过调节条件使糖蛋白和聚糖结合蛋白结合,然后通过IM分离出相互作用的蛋白复合体,再改变条件破坏其相互作用使糖蛋白被释放,最后通过MS分析糖蛋白与聚糖结合蛋白的结合。2) 亲和力Ka由竞争配体和ESI-MS分析获得。3) 从糖蛋白上释放的N-糖通过ESI-MS进行定性分析,以确定聚糖结合蛋白识别的聚糖类型。
有报道利用IM-MS在结构分析方面的优势研究气相中完整糖蛋白离子的结构。Upton等[91]使用 IM-MS系统地评估了从不同厂家购买的3批Herceptin、2个单克隆抗体标准品和1个完整的Fc铰链片段。数据显示,在气相中,N-糖将每个单抗的构象扩散降低了10.5%~25%。Tian等[6]用Q-TWIMS-TOF MS结合CIU技术研究单克隆抗体的糖基化修饰,通过与CIU指纹图谱对比,可以区分单克隆抗体糖基化的细微差异,证明了在没有高分辨质谱的情况下,快速的CIU分析也可以用来对单克隆抗体上Fc区域的N-糖进行准确的定性和定量分析。Roberts等[92]用TIMS-MS/MS和FTICR-MS/MS研究SARS-CoV-2刺突蛋白受体结合域(S-RBD)上的蛋白质糖基化修饰。非变性的TIMS-MS/MS能够分离不同的S-RBD构象异构体,揭示其在气相中的结构异质性;而FTICR-MS/MS用于分析糖基化结构和位点。该研究首次报道了8个S-RBD O糖的完整结构信息,包括1个此前未被报道的核心岩藻糖基化修饰多糖结构,以及这些O糖的相对分子含量。
Liu等[93]研发了新型的TIMS/TIMS,实现了类似于串联质谱的串联离子迁移谱分析,并用TIMS/TIMS-MS分析抗生物素蛋白的结构和序列信息。研究发现,串联TIMS能够保持完整的、非变性的抗生物素蛋白四聚体结构,并且能够保留包裹在结构内的溶剂分子。此外,在TIMS/TIMS界面引入的低能量CID可以产生完整的三聚体离子,且该三聚体离子与折叠起来的四聚体中的三聚体结构相同。在高能量CID下,四聚体解离成单体或二聚体有助于结构分析。该研究证明,带有CID碎裂的TIMS/TIMS-MS是一种很好的分析完整糖蛋白的方法,可以高效地解析糖蛋白组成。
4 总结与展望
近年来,IM-MS在蛋白质糖基化研究中表现出巨大的潜力。IM-MS可以利用离子淌度分离降低质谱图的复杂度,也可以利用聚糖或糖肽结构中的诊断离子特征信息进行快速的糖结构识别,对区域异构体和立体异构体具有出色的分辨能力。此外,IM-MS还具有分析时间短、消耗样品量少等优点。随着更多成熟的IM-MS商用仪器的出现,相信IM-MS会逐渐成为糖基化研究的重要分析工具之一。
然而,IM-MS在分析蛋白质糖基化方面仍存在一些问题。首先,由于IM只基于气相离子形状进行分离,一些形状特别相近的异构体无法得到很好的区分。有研究尝试将IM-MS和其他分离分析技术进一步结合,包括红外光谱(IR)[94]、毛细管区带电泳(CZE)[47]等,均取得了良好效果。随着组学实验数据规模的增大(例如高通量筛选标志物的实验),数据处理难度急剧增加。研究者需要能够将CCS和MS数据进行整合并发展自动化的软件用于聚糖或糖蛋白的鉴定,来代替繁杂的手动解谱工作。此外,规范化的CCS值数据发表和收集流程对未来的IM-MS研究有很大的帮助。“糖组学实验所需的最少信息”(minimum information required for a glycomics experiment, MIRATE)计划已经针对常用的糖组学研究手段提供了指导方针,包括质谱[95]、液相色谱[96]和毛细管电泳[97]等。如果基于IM的糖组学分析也能够有类似的标准,将会为未来的研究带来极大的便利。例如,一些文献在发表时已经在使用“仪器CCS载气”的格式来表示CCS值(例如,DTCCSHe代表在DTIMS上以氦气为载气时的CCS值)[98],标注了测量CCS值时的条件,使数据更具参考意义。最后,为了更好地进行分离分析,仍需要开发分辨率更高的离子迁移谱仪器。一些研究已经在此方面做出了尝试,包括用具有拓展蛇形超长路径的IM-MS(SLIM SUPER IM-MS)[44]、循环离子迁移率质谱(cIMS)等技术实现了超高分辨的IM-MS糖基化研究[74]。将来,随着分析仪器硬件和相应软件的进步,相信离子迁移谱-质谱技术将会在蛋白质糖基化研究中发挥越来越重要的作用。
