短链合成抗菌肽对犬皮肤致病菌的体外抗菌作用
2022-09-29唐琪宇杨春燚王维新
唐琪宇 , 杨春燚 , 王维新 , 张 迪
(中国农业大学动物医学院 , 北京 海淀 100193)
犬小孢子菌和伪中间葡萄球菌是引起犬皮肤感染最主要的病原。随着抗生素的大量使用,伪中间型葡萄球菌对传统抗菌药物的耐药性增加,促使人们寻求抗生素的替代品[1]。犬小孢子菌感染治疗周期长,而抗真菌药物易引起肝、肾毒性,寻找毒副作用小、杀菌机制独特的抗菌剂迫在眉睫[2]。抗菌肽(Antimicrobial peptide,AMP)是一类由多个氨基酸残基组成的具有广谱抗菌活性的多肽,毒副作用小,不易产生耐药性,是一种理想的传统抗菌剂替代品[3]。人工化学合成短链AMP,生产成本相对较低,具有大规模生产的可能性以及广泛的市场应用前景[4]。提取自独角仙、大鲵和模棘蜈蚣的独角仙素(Allomyrinasin)、大鲵血素(Andricin B)和模棘蜈蚣素(Pinipesin),以及2种人工设计的Nigrocin-HLM和Hs02因其优良的抗菌性能而受到关注。本试验通过研究独角仙素、大鲵血素、模棘蜈蚣素、Nigrocin-HLM和Hs02共5种短链AMP对伪中间型葡萄球菌、科氏葡萄球菌和犬小孢子菌等犬常见皮肤病原菌的体外抗菌作用,评价其抗菌效果,以期为小动物临床新型抗菌制剂的开发提供科学依据。
1 材料与方法
1.1 抗菌肽 独角仙素、大鲵血素、模棘蜈蚣素、Nigrocin-HLM和Hs02(氨基酸序列分别为:AAVTRRILCWFA、GLTRLFSVIK、VAEARQGSFSY、GLLSGILGAGKKIVF和KWAVRIIRKFIKGFIS),均由吉尔生化生物科技有限公司通过标准固相方法合成,反相高效液相层析检测纯度均为99%以上。
1.2 菌株 分离自脓皮症患犬和皮肤真菌感染患犬的伪中间型葡萄球菌、科氏葡萄球菌和犬小孢子菌临床分离菌株。
1.3 主要试剂 米勒-欣顿二氏(Mueller-Hinton,MH)培养基、脑心浸出液(Brain heart infusion,BHI)培养基、沙氏葡萄糖(Sabouraud dextrose,SD)培养基,均购自北京奥博星技术有限公司;阿莫西林三水物、盐酸特比萘芬、氯化三苯基四氮唑(Triphenyltetrazolium chloride,TTC)和3,3′-[1-(苯氨酰基)-3,4-四氮唑]-二(4-甲氧基-6-硝基)苯磺酸钠[2,3-bis(2-methoxy-4-nitro-5-sulfophenyl)-5-[(phenylamino)carbonyl]-2H-tetrazolium hydroxide,XTT],均购自北京索莱宝科技有限公司;RPMI-1640培养基,购自Gibco公司。
1.4 药液配制 将5种AMP和阿莫西林固体粉末溶于去离子水,分别配制成浓度为4 096 μg/mL和2.5 mg/mL的储备液;用无水乙醇将盐酸特比萘芬固体粉末溶解配制成浓度为50 mg/mL的储备液;将TTC和XTT固体粉末用无菌水溶解配制成浓度为2 g/mL的储备液。过滤除菌后置于4 ℃保存备用。
1.5 菌悬液制备
1.5.1 细菌 活化细菌在BHI液体培养基37 ℃振荡培养12 h,10倍倍比稀释后,菌液涂布于BHI固体培养基。37 ℃培养24 h后进行菌落计数,推算原菌悬液浓度。最后使用生理盐水调节浓度至1×105CFU/mL。
1.5.2 真菌 活化真菌在SD琼脂培养基30 ℃培养6~8 d,冲洗并刮取培养基表面菌苔,过滤取上清液于血细胞计数板,在光镜下观察,计算原液真菌孢子浓度,调节浓度至1×103CFU/mL。
1.6 最小抑菌浓度(Minimum inhibitory concentration,MIC)测定
1.6.1 微量稀释 (1)细菌:将AMP储备液稀释成浓度为1 024 μg/mL的工作液。在96孔板第1~12孔中加入40 μL MH液体培养基后,取40 μL AMP工作液加入第1孔,连续2倍倍比稀释至第10孔,使每孔药物浓度为512~1 μg/mL。第11孔加入40 μL阿莫西林溶液作为阳性对照,第12孔加入40 μL生理盐水作为阴性对照。最后向第1~11孔分别加入40 μL细菌悬液,于37 ℃培养18~24 h。(2)真菌:在96孔板第1~12孔中加入40 μL RPMI-1640培养基。预试验确定AMP工作液的初始浓度为10 μg/mL。AMP工作液倍比稀释方法以及阳性、阴性对照设置同上。最后向第1~11孔分别加入40 μL 1×103CFU/mL真菌悬液,于30 ℃培养6 d。
1.6.2 结果判定 (1)细菌:培养18~24 h后,肉眼观察记录是否出现液体浑浊或孔底菌落沉淀。加入2% TTC 5 μL,37 ℃培养3~4 h后观察结果。以未见液体浑浊、孔底菌落沉淀或液体红色孔对应的最小AMP浓度作为该AMP对该受试细菌的MIC。(2)真菌:培养6 d后,肉眼观察记录是否出现液体浑浊或孔底真菌菌落。以未见液体浑浊或孔底真菌菌落孔对应的最低AMP浓度作为该AMP对该受试真菌的MIC。
1.7 最小杀菌浓度(Minimum bactericidal concentration, MBC)测定
1.7.1 平板培养 (1)细菌: 取40 μL无菌生长孔溶液平板划线接种于BHI固体培养基,于37 ℃培养18~24 h后观察结果。(2)真菌:取40 μL无菌生长孔溶液平板划线接种于SD固体培养基,于30 ℃培养6 d后观察结果。
1.7.2 结果判读 无菌生长平板所对应最低浓度为MBC。
1.8 杀菌曲线测定 取5份100 μL含菌量约为5×105CFU/mL的MH液体培养基,分别加入等量0.5×MIC、1×MIC、2×MIC、4×MIC抗菌肽和生理盐水,37 ℃振荡培养,分别于0 min、20 min、40 min、60 min、80 min、100 min、2 h、3 h、5 h取菌悬液,进行10倍倍比稀释后涂板计算原菌悬液浓度,计算平均值并作出时间杀菌曲线图[5]。
1.9 最低生物膜抑制浓度(Minimum biofilm inhibitory concentration, MBIC)测定 (1)细菌:在96孔板第1~12孔中加入40 μL MH液体培养基,AMP溶液倍比稀释方法以及阳性、阴性对照设置同1.6.1。向第1~11孔加入40 μL细菌悬液后37 ℃培养18~24 h,用无菌生理盐水将每孔洗涤3次,在超净台中倒置晾干。向第1~11孔中加入80 μL MH液体培养基和20 μL TTC溶液,37 ℃避光培养5 h后,470 nm测定吸光度。以吸光度测定值最小孔所对应AMP浓度作为该AMP对该受试细菌的MBIC。(2)真菌:在96孔板第1~12孔中加入40 μL SD液体培养基,AMP溶液倍比稀释方法以及阳性、阴性对照设置同1.6.1。向第1~11孔加入40 μL真菌悬液后30 ℃培养6 d,每孔洗涤晾干后,向第1~11孔中加入80 μL SD液体培养基和20 μL XTT溶液,30 ℃避光培养24 h后,测定吸光度。以吸光度测定值最小孔所对应AMP浓度作为该AMP对该受试真菌的MBIC[6-8]。
1.10 最低生物膜清除浓度(Minimum biofilm eradication concentration, MBEC)测定 (1)细菌:在96孔板第1~12孔中加入40 μL MH液体培养基后,每孔加入等量细菌悬液(1×107CFU/mL),37 ℃培养48 h后获得成熟生物膜。无菌生理盐水洗涤并倒置晾干后采用倍比稀释法设置AMP浓度梯度,方法同1.6.1。37 ℃恒温培养20~24 h后,重复洗涤操作。最后向第1~11孔中加入80 μL MH液体培养基和20 μL TTC溶液,37 ℃避光培养5 h后,470 nm测定吸光度。以吸光度测定值最小孔所对应AMP浓度作为该AMP对该受试细菌的MBEC。(2)真菌:在96孔板第1~12孔中加入40 μL SD液体培养基后,每孔中加入等量真菌悬液(1×103CFU/mL),30 ℃培养6 d后获得成熟生物膜。无菌生理盐水洗涤并倒置晾干后采用倍比稀释法设置AMP浓度梯度,方法同1.6.1。30 ℃恒温培养24 h后,重复洗涤操作。向第1~11孔中加入80 μL SD液体培养基和20 μL XTT溶液,30 ℃避光培养24 h后,测定吸光度。以吸光度测定值最小孔所对应AMP浓度作为该AMP对该受试真菌的MBEC[6-8]。
1.11 联合用药试验 (1)细菌:在96孔板第1~12孔中加入40 μL 细菌悬液(1×105CFU/mL)后,加入1/4×MIC的AMP溶液(该浓度AMP单独作用不抑制病原生长)。联合用药所用另一种受试药物浓度梯度及阳性对照和阴性对照设置方法同1.6.1。于37 ℃培养18~24 h后观察结果。(2)真菌:在96孔板第1~12孔中加入40 μL真菌悬液(1×103CFU/mL)后,加入1/4×MIC的AMP溶液。联合用药所用另一种受试药物浓度梯度及阳性对照和阴性对照设置方法同1.6.1。于30 ℃培养6 d后观察判定结果。依次计算分级抑制浓度(Fractional inhibitory concentration, FIC)和分级抑制浓度指数(Fractional inhibitory concentration index, FICI),计算公式如下。
FICI=FIC(A)+FIC(B)
结果判定:FICI≤0.5,药物A和B具有协同作用;FICI=1,药物A和B具有相加作用;FICI≥4,药物A和B具有拮抗作用;0.5≤FICI<4,药物A和B具有无关作用[9]。
2 结果
2.1 MIC和MBC测定 独角仙素、大鲵血素、模棘蜈蚣素、Nigrocin-HLM和Hs02对伪中间型葡萄球菌、科氏葡萄球菌、犬小孢子菌的MIC和MBC如表1所示。独角仙素和大鲵血素对伪中间型葡萄球菌和科氏葡萄球菌的抗菌活性较强,明显优于模棘蜈蚣素、Nigrocin-HLM和Hs02。5种受试AMP均对犬小孢子菌有较强的抗菌活性。
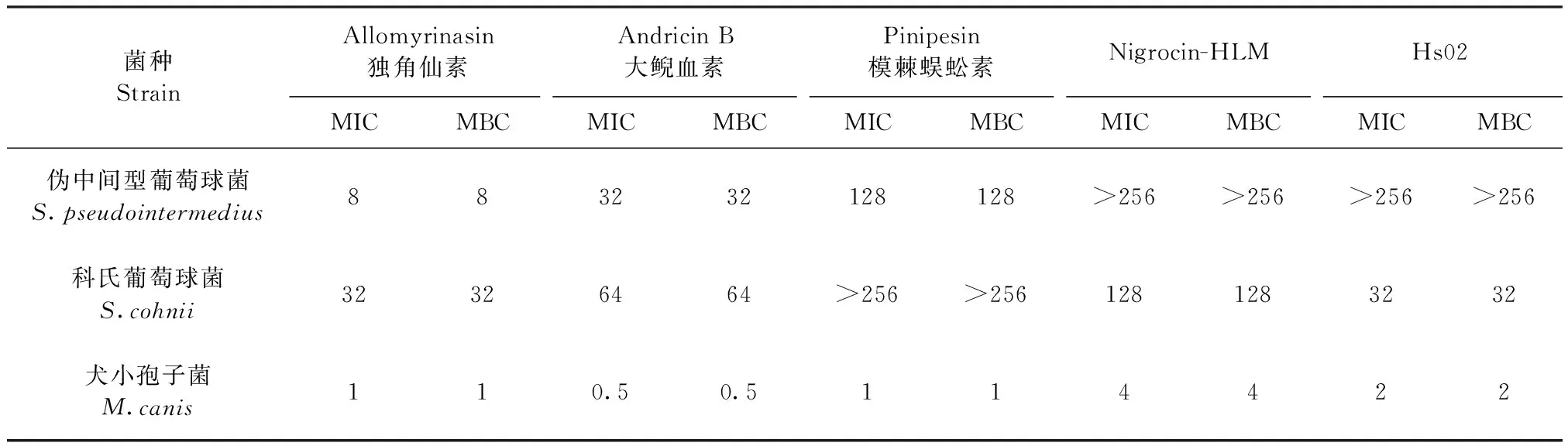
表1 MIC与MBC试验结果Table 1 Results of MIC and MBC (μg/mL)
2.2 杀菌曲线测定 由于独角仙素和大鲵血素均表现出了对犬常见皮肤感染病原的优良抗菌活性,所以挑选两者进行后续试验。杀菌曲线结果如图1所示,2种受试AMP均能完全清除受试菌株;4×MIC 独角仙素表现出了快速杀菌性能,在作用100 min和3 h后可完全杀死伪中间型葡萄球菌和科氏葡萄球菌;2×MIC独角仙素在作用3 h和5 h后可完全杀死受试菌,表明独角仙素的杀菌性能存在明显的剂量、时间依赖效应;低浓度(0.5×MIC)独角仙素可抑制受试菌生长;4×MIC和2×MIC大鲵血素分别在作用3 h和5 h后完全杀死伪中间型葡萄球菌和科氏葡萄球菌;>0.5×MIC 独角仙素和大鲵血素均在作用2 h后表现出了强效抗真菌活性,且不同浓度的受试AMP在作用5h后均能完全清除犬小孢子菌。
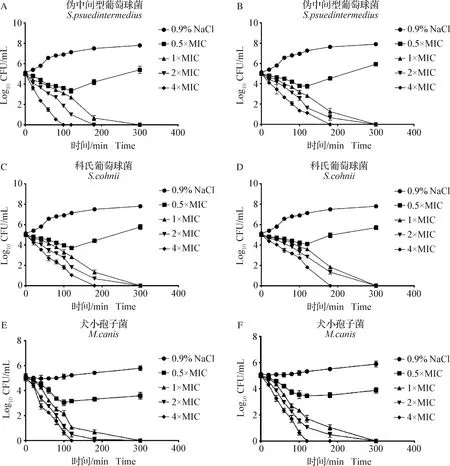
图1 杀菌曲线结果Fig.1 Results of time-kill curveA,C,E:独角仙素杀菌曲线; B,D,F:大鲵血素杀菌曲线A,C,E: Time-kill curve of allomyrinasin; B,D,F:Time-kill curve of andricin B
2.3 MBIC和MBEC测定 独角仙素和大鲵血素对伪中间型葡萄球菌和科氏葡萄球菌的MBIC和MBEC如表2所示。独角仙素和大鲵血素相比模棘蜈蚣素能有效抑制细菌生物膜形成和清除成熟生物膜;独角仙素对伪中间型葡萄球菌、科氏葡萄球菌生物膜作用比模棘蜈蚣素强;独角仙素和大鲵血素能够抑制犬小孢子菌生物膜形成和清除成熟生物膜。
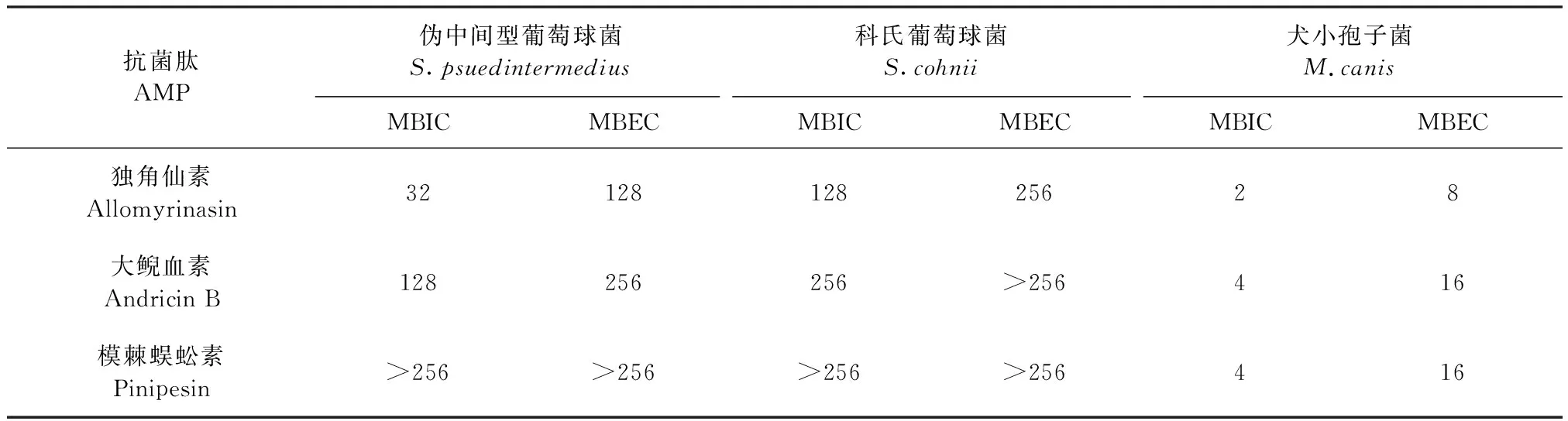
表2 MBIC和MBEC测定结果Table 2 Results of MBIC and MBEC (μg/mL)
2.4 联合用药 独角仙素和大鲵血素均表现出优越抗菌活性,与抗生素阿莫西林和特比萘芬的联合给药对伪中间型葡萄球菌、科氏葡萄球菌和犬小孢子菌的作用效果如表3所示。独角仙素与大鲵血素联合用药,表现出了对伪中间型葡萄球菌、科氏葡萄球菌和犬小孢子菌的协同抗菌作用。独角仙素与阿莫西林联合用药,对受试伪中间型葡萄球菌、科氏葡萄球菌具有协同抗菌作用。大鲵血素与阿莫西林联合用药,对科氏葡萄球菌表现出协同抗菌作用,对伪中间型葡萄球菌呈无关作用。此外,独角仙素和大鲵血素分别与特比萘芬联合用药,均对犬小孢子菌具有协同抗菌作用,表明其相对优越的抗菌效能。
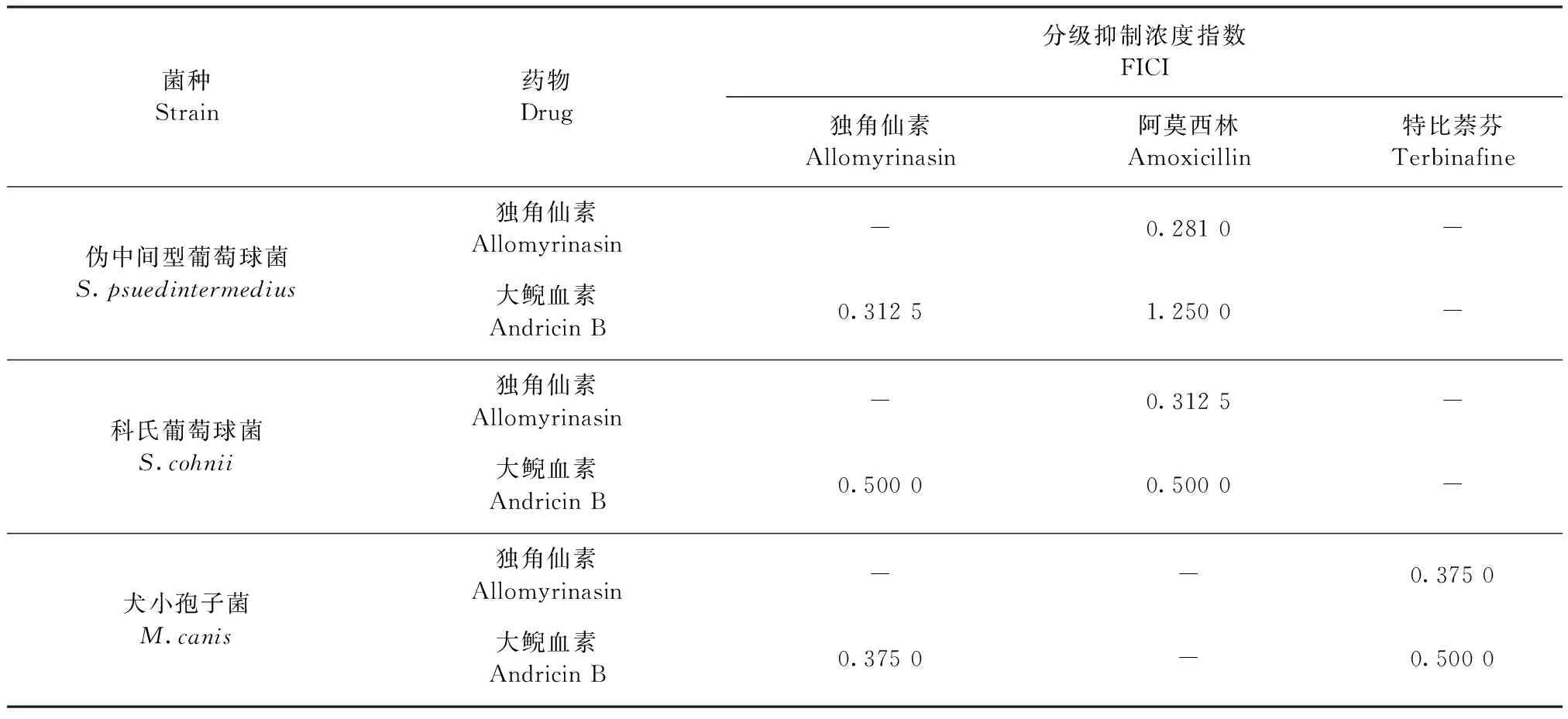
表3 联合用药结果Table 3 Results of combination therapy analysis
3 讨论
从昆虫等动物中提取的AMP是一种重要的杀菌物质,能有效清除细菌、真菌等多种病原[3]。本试验选取昆虫、动物提取分离的短链独角仙素、大鲵血素和模棘蜈蚣素及人工设计的Nigrocin-HLM和Hs02,经化学固相合成后进行体外抗菌研究。
本试验选取的5种短链AMP对引起皮肤及软组织感染的金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌和白色念珠菌等病原有着理想的抗菌活性[10]。本试验结果显示,独角仙素和大鲵血素对伪中间型葡萄球菌、科氏葡萄球菌和犬小孢子菌有着较强的抗菌活性,同时能够抑制细菌生物膜的形成和清除成熟的生物膜,并有着与临床传统抗菌药阿莫西林、抗真菌药特比萘芬协同作用的优势,提示其具有作为临床治疗犬常见感染性皮肤病药物的潜力。
MIC试验结果显示,尽管独角仙素、模棘蜈蚣素、大鲵血素、Nigrocin-HLM和Hs02在前期试验对葡萄球菌等革兰阳性菌表现出优良的抗菌活性,但对伪中间型葡萄球菌、科氏葡萄球菌等临床分离株表现出一定的选择性,可能与结构和抗菌活性结构域相关[11]。
独角仙素和大鲵血素与特比萘芬联用均具有协同作用。有研究表明,使用高剂量的特比萘芬,容易产生肝肾毒性,所以使用低浓度的药物以尽可能减少其副作用[2]。此外,在受试AMP与抗菌药物之间没有发现拮抗作用。总的来说,联合使用AMP和抗菌药物产生协同作用,可能是AMP与抗菌药物不同的作用机制所致。AMP通常作用于病原的细胞膜导致其裂解或增加细胞膜的通透性,以至于抗菌药物能够更多地进入细胞,加强杀菌作用[12-13]。对于受试AMP对病原的作用机制,有待进一步研究。
结果表明,独角仙素和大鲵血素对伪中间型葡萄球菌、科氏葡萄球菌和犬小孢子菌有着良好的抗菌活性,且能够抑制伪中间型葡萄球菌生物膜的形成,提示独角仙素和大鲵血素具有作为临床治疗犬常见感染性皮肤病药物的潜力。
