DPPH·和ABTS+·比较研究毛建草多酚、黄酮和多糖的抗氧化协同作用
2022-09-29李慧卿曹叶霞黄坊娇
李慧卿,曹叶霞,黄坊娇
(忻州师范学院 化学系,山西 忻州 034000)
毛建草属于唇形科,是全草具有香味的多年生草本植物[1],在山西北部广泛分布。毛建草中含有丰富的的类多酚、类黄酮和多糖化合物[2-4]等,具有抗氧化、降血脂降胆固醇、抗衰老、抗肿瘤[5-9]等多种功能。随着人们日益对地方经济作物的开发,毛建草被较大范围人工种植,其中的抗氧化组分被分离提取,开发食品产品。本文就其含有的多酚类、黄酮类、多糖等主要抗氧化物质为研究对象,通过其清除DPPH·和ABTS+·以探索这些共存的组分是否可以协同发挥作用。 DPPH·和ABTS+·常被用来研究食品、蔬菜、水果提取物质的抗氧化性,但由于两者不同的结构及自由基消除机理的差别[10],对于供试物的抗氧化能力得出的结论会有差别。对于协同作用的研究,目前有显 著 差 异法[11]、Isobologram 分 析 法[12-13]、Hou-Talalay 中效原理[14]等等,其中Isobologram 更为研究者普遍认同。 本研究拟通过比较DPPH·和ABTS+·方法研究其组分间的协同抗氧化作用,旨在为DPPH·和ABTS+·方法研究抗氧化协同作用提供方法依据,同时也为开发其混配产品提供试验基础。
1 材料和方法
1.1 试验材料
毛建草采摘于山西宁武,为自然风干的全草;芦丁BR,成都市科龙化工试剂厂;没食子酸AR,福林酚试剂BR,天津市光复精细化工研究所。
1.2 主要仪器与设备
UV-2450 型紫外可见分光光度计:配有Thermo Insight 数据处理系统,上海精密科学仪器有限公司;RE-52AA 型旋转蒸发仪 上海亚荣生化仪器工厂;SHZ-D 循环水式真空泵 巩义市予华仪器有限公司。
1.3 试验方法
1.3.1 抗氧化组分提取
(1) 多糖的提取
参考文献方法[15],取一定量粉碎、过80 目筛的毛建草粉末,以料液比1∶20 加入二次水,温度80℃回流2 h。抽滤去茶渣,得深棕色滤液,3500 r·min-1离心5 min,取上清液,于70℃下旋蒸至原溶液体积的三分之一,使用体积比为4∶1 的氯仿/正丁醇混合溶液,振荡10 min,离心,脱去蛋白。所得水相于70 ℃旋蒸去部分水,得到的多糖粗品溶液中加入一定量无水乙醇,于冰箱中过夜。过滤,无水乙醇洗涤,最后得到的固体于60 ℃下烘干,得到毛建草多糖。
(2) 多酚的提取
参考文献方法[16]一定量过筛毛建草粉末,加入20 倍量的清水,在90 ℃下搅拌浸提15 min。趁热过滤后,滤渣再浸提2 次;合并3 次滤液,加人等体积的氯仿搅拌萃取30 min,静置分层后,取水相,加入3 倍量乙酸乙酯,抽提3 次,每次20 min。静置分层,收集水相,浓缩至干,冷却后冷冻干燥得粉状产品。
(3) 黄酮的提取
称一定量毛建草粉末,料液比1∶20 加入无水乙醇,超声。功率280 W,温度50 ℃,时间30 min。控制温度在左右,超声结束后,80 ℃回流提取2 h,抽滤,滤渣重复提取1 次,合并两次滤液,用真空旋转蒸发器在40 ℃减压下除去乙醇,真空干燥,得固体粉末。
1.3.2 多糖、多酚、黄酮含量测定
(1) 多糖含量测定
0.04 g·L-1的葡萄糖标准溶液,分别量取葡萄糖溶液0.0,0.1,0.3,0.6,0.9 mL 置10 mL 比色管中,补水2 mL,分别加入新配的6%的苯酚溶液1 mL,再分别及时加入浓硫酸5 mL,摇匀,静置5 min,之后沸水浴加热15 min,加热结束后,冷水迅速冷却。室温放置20 min,最后在波长490 nm 测吸光度[17]。标准曲线y=0.011 7x+0.079 8,R²=0.995 4。提取多糖样品代替葡萄糖用上述方法检测。
(2) 多酚含量测定
配制0.1 g·L-1的没食子酸标准溶液,分别量取没食子酸溶液0.0,0.1,0.2,0.3,0.4,0.5,0.6 mL置于10 mL 比色管,加2.5 mL 蒸馏水和0.25 mL的福林酚试剂,静置,加入0.75 mL(C=75 g·L-1)的碳酸钠溶液,定容,水浴加热(75℃,10 mim),765 nm 处 测 定 吸 光 度[18]。 回 归 方 程 为:y=98.86x+0.066,R2=0.999 9。多酚样品代替没食子酸用上述方法检测。
(3) 黄酮含量测定
配制0.2 g·L-1的芦丁标准溶液,分别量取芦丁溶液0.0,1.0,3.0,6.0,9.0 mL 置于25 mL 比色管,分别加入5%的亚硝酸钠1 mL,静置5 min 后,再加入10%的硝酸铝1 mL,摇匀,静置5 min,最后加入1 mol·L-1的氢氧化钠溶液5 mL,30%的乙醇溶液定容,摇匀,静置10 min。波长507 nm 处测定吸光度。回归方程:y=9.020 5x+0.013 4,R²=0.998 1。黄酮样品代替芦丁用上述方法检测。
1.3.3 毛建草中各组分的抗氧化活性的研究
(1) 多酚、黄酮和多糖清除DPPH·自由基的效果
准确称取一定量的相应固体产品配置溶液,分别量取不同体积的溶液于10 mL 的比色管中,各加入5 mL 的DPPH·自由基(浓度20 μmol·L-1)溶液,定容至刻度线,置于避光处40 min,在波长为525 nm 处测定吸光度A。另准备干净的10 mL的比色管,加入与上述相同浓度的提取液,定容至刻度线,在波长525 nm 处测定吸光度A1。取5 mL的DPPH·溶液于比色管,定容至刻度线,测定吸光度A0[19]。清 除率的计 算公式:

式中,A1与A分别为样品及样品加入DPPH·时的吸光度;A0为DPPH·溶液的吸光度。
(2) 多酚、黄酮和多糖清除ABTS+·自由基效果精确量取不同体积的提取液置于10 mL 的比色管中,加入4.9 mLABTS+·(浓度20 μmol·L-1)溶液,定容,水浴加热(30 ℃),静置10 min。在波长752 nm 下测吸光度。清除率计算使用公式(1)。
(3) 多酚、黄酮和多糖的协同抗氧化活性研究
采 用Isobologram 分 析 法[20],根 据 单 组 分 的IC50值,分别按质量浓度最接近整比的比例关系选择2.5∶1、1∶1 和1∶2.5 三种复配比例混合液研究其对DPPH·和ABTS+·自由基的清除效果,根据拟合曲线求出IC50mix值,按照公式(2)计算IC50add值。
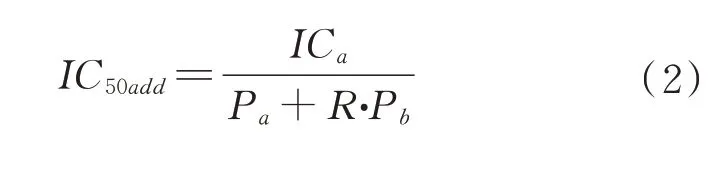
式中,IC50add—理论复配组的IC50值,IC50a—a 组分单独作用时的IC50值;Pa,Pb—分别为a,b 在复配组分中占有的比例;R—a,b 两组分单独作用时IC50的比值,即R=IC50a/IC50b。如果IC50add<IC50mix,说明各组分之间具有拮抗作用;如果IC50add>IC50mix,说明具有协同作用。

按照公式(3)来计算相互作用的指数γ,评价复配组分间相互作用的强弱程度。γ=1 表明组分间具有相加作用;γ>1 表明组分间具有拮抗作用,而且γ 值越大,拮抗作用就越强;γ<1 表明组分间具有协同作用,而且γ 值越小,其协同作用就越强。
1.4 数据统计
将试验所得多酚、黄酮和多糖的IC50值及95%可信线作为横坐标,多酚、黄酮和多糖的IC50值及95%可信线作为纵坐标,将IC50值连接成相加线,绘制出95%置信区与IC50值。如果复配体系的效应点落于相加线及95%置信区内,就表明该复配组合为相加作用;如果落于相加线左侧,就表明该复配组合为协同作用;如果落于右侧,就表明该复配组合为拮抗作用。
2 结果与分析
2.1 毛建草各组分的单抗氧化研究
2.1.1 毛建草各组分对DPPH·和ABTS+·自由基的清除效果
毛建草中多酚、黄酮、多糖分别对DPPH·自由基清除效应见图1A,随着各组分的浓度的增加,对自由基清除效应逐渐增强,并在较高浓度呈现出减缓趋势。拟合各曲线,得多酚、黄酮、多糖的IC50分别为0.280、0.311、0.764 mg·L-1,得出对DPPH·自由基的清除效应:多酚>黄酮>多糖。

图1 毛建草各组分对DPPH·(A)和ABTS+·(B)自由基的清除效应Fig.1 Scavenging abilities of antioxidant components in D.rupestre on DPPH·(A)and ABTS+·(B)
各组分对ABTS+·自由基清除效应见图1B,清除趋势与DPPH·类似,拟合得多酚、黄酮、多糖的IC50值依次为0.204、0.243、0.584 mg·L-1,清除效应为多酚>黄酮>多糖。
比较对2 种自由基的清除效应,各组分对ABTS+·的清除能力都明显优于DPPH·,如果毛建草组分的抗氧化性强弱依据为对自由基的清除百分数,从ABTS+·得出的结论明显强于从DPPH·得出的结论。清除自由基主要途径是通过抗氧化剂转移电子或转移氢给自由基。电子转移迅速,氢转移较慢,需要一定的时间达到平衡[21]。ABTS+·既可以通过转移电子也可通过氢转移实现消除,DPPH·消除则主要是通过抗氧化剂转移氢给自由基,只在强氢键溶剂如甲醇中电子转移才会占主导地位[22]。即使在充分考虑了反应时间的影响,忽略动力学因素,抗氧化组分也对ABTS+·表现出更强活性。而且两亲的ABTS+·的苯并噻唑结构比DPPH·的疏水的芳环结构更容易使之与多酚类物质发生电子或氢转移。而多酚与黄酮类对自由基的清除能力优于多糖,则可能是多酚、黄酮类与自由基间的疏水作用或芳环间π-π 堆积作用,以及毛建草多酚或黄酮与自由基芳环更匹配的空间结构[23-24]使然。
2.2 毛建草各组分之间的协同抗氧化研究
2.2.1 Isobologram 分析法分析复配液清除DPPH·自由基的能力
根据多酚、黄酮、多糖各组分的IC500.280、0.311、0.764 mg·L-1,分别按质量浓度最接近整比的比例关系1∶1∶2.5,组分两两复配,其复配后清除DPPH·自由基的结果如表1~表3,拟合后的IC50mix值、IC50add值和γ 值如下表4。
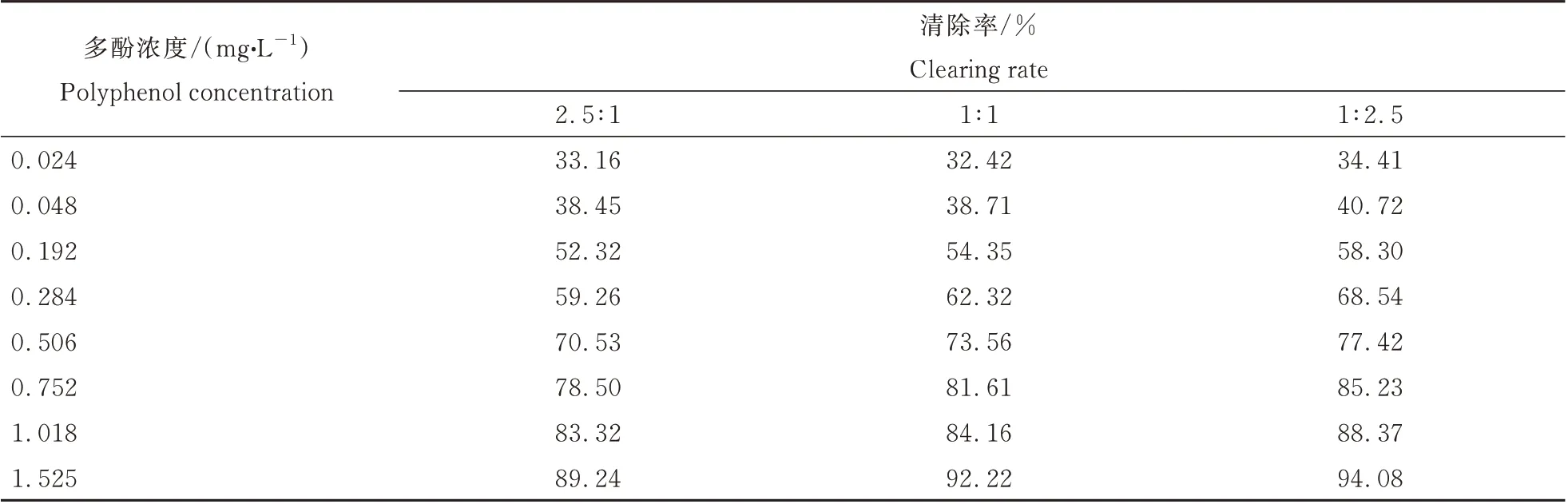
表1 毛建草多酚与黄酮复配后清除DPPH·自由基的能力Table 1 DPPH·scavenging abilities of the mixture of polyphenols and flavonoids from D.rupestre
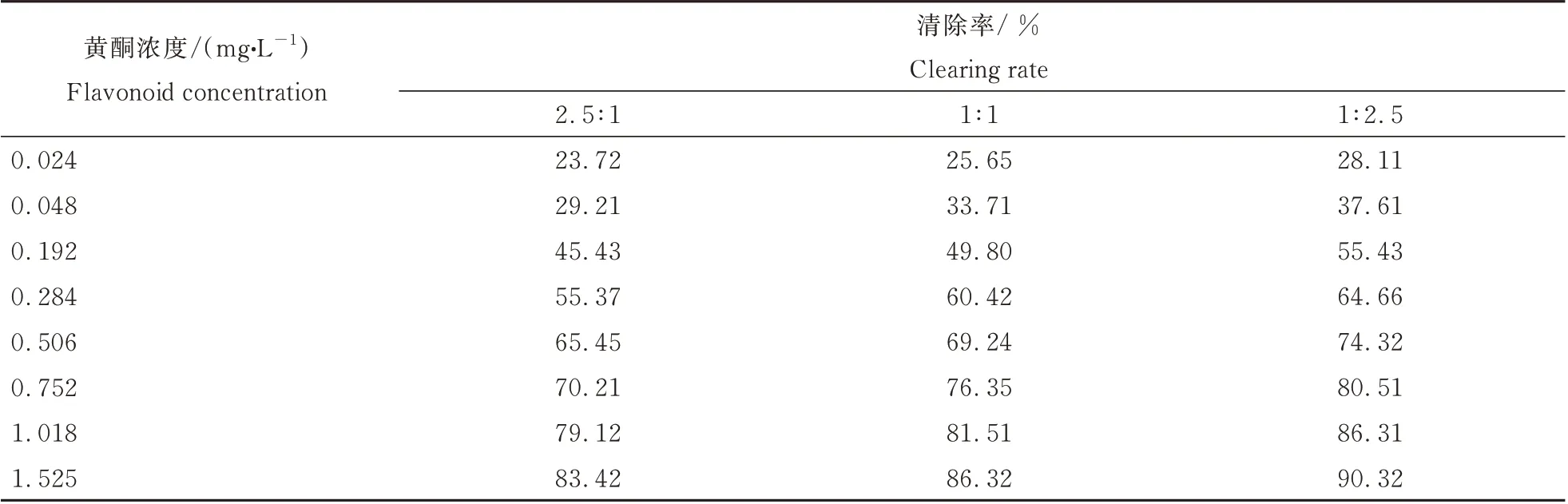
表2 毛建草黄酮与多糖复配后清除DPPH·自由基的能力Table 2 DPPH·scavenging abilities of the mixture of flavonoids and polysaccharides from D.rupestrece
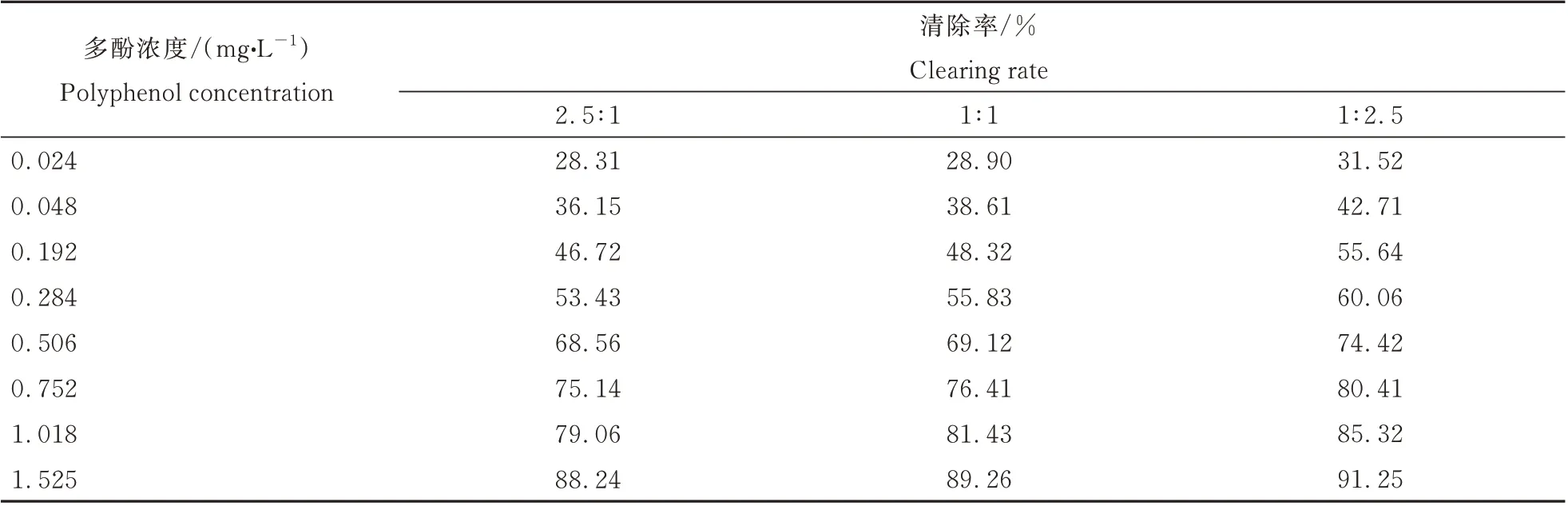
表3 多酚与多糖复配后清除DPPH·自由基的能力Table 3 DPPH·scavenging abilities of the mixture of polyphenols and polysaccharides from D.rupestre
由表4 可见,不同比例的多酚与黄酮复配后对DPPH·清除率的IC50mix值均小于IC50add,表明复配组合之间存在协同抗氧化作用。同理,黄酮与多糖复配后,多酚与多糖复配后均有较好的协同抗氧化作用。多酚与黄酮按2.5∶1、1∶1、1∶2.5 复配后的相互作用指数γ 分别为0.909,0.850,0.954,黄酮与多糖复配后的γ 值分别为0.938,0.886,0.912,多酚与多糖复配后的γ 值分别为0.910,0.909,0.954,其γ 值均小于1,亦表明了各组分的复配组合间均存在协同抗氧化作用,在各组分复配比例为1∶1 时,γ 值达到最小,表明此时各组分的协同抗氧化效果最好,并且此时协同作用的强弱程度为多酚-黄酮>黄酮-多糖>多酚-多糖。

表4 毛建草各组分复配之后清除DPPH·自由基的IC50mix值、IC50add值和γ 值Table 4 IC50mix,IC50add and γ values of DPPH·scavenging by the mixture from D.rupestre
2.2.2 Isobologram 分析法分析各组分复配后清除ABTS+·自由基的能力
各组分两两复配后清除ABTS+·自由基拟合后 的IC50mix值、IC50add值 和γ 值 如 下 表5。由 表5 可知,不同比例的多酚与黄酮复配后对ABTS+·清除率的IC50mix值均小于IC50add,表明复配组合之间存在协同抗氧化作用。同理,黄酮与多糖复配后,多酚与多糖复配后均有明显的协同作用。多酚与黄酮按2.5∶1、1∶1、1∶2.5 复配后的相互作用指数γ值均小于1,亦表明了各组分的复配组合间均存在协同抗氧化作用,在各组分复配比例为1∶1 时,γ 值达到最小,表明协同抗氧化效果最好,并且此时协同作用的强弱程度为多酚-黄酮>黄酮-多糖≈多酚-多糖。

表5 毛建草各组分复配之后清除ABTS+·自由基的IC50mix值、IC50add值和γ 值Table 5 IC50mix,IC50add and γ values of ABTS+·scavenging by the mixture from D.rupestre
毛建草抗氧化组分复配对ABTS+·和DPPH·自由基的清除效果是一致的,多酚与黄酮复配后协同作用最佳。多酚与黄酮都具有芳环结构,复配后,两者间的相互作用譬如疏水作用和芳环的π堆积,可能使它们与存在相类结构的自由基间的电子或氢转移更易实现。而多糖与之复配,也存在协同,但相应效果弱些。比较多酚与黄酮相同比例复配的各γ 值,ABTS+·并没有表现出比DPPH·更明显的协同效应(γ 偏离1)。
2.2.3 统计学分析各组分复配之后对DPPH·和ABTS+·自由基的清除效果
图2A~C 为黄酮-多酚、黄酮-多糖、多酚-多糖清除DPPH·自由基按相应的效果图。各比例复配后的效应点均在置信区间和相加线的下方,表明复配组分间都存在协同抗氧化作用,并且效应点距离相加线的距离为1∶1 最大,显示该比例下协同效应更强。 图3A~C 是相应复配后清除ABTS+·自由基效果图,结论与清除DPPH·一致。ABTS+·并没有表现出比DPPH·更明显的优势。

图2 毛建草复配组分清除DPPH·自由基的Isobologram 分析Fig.2 Isobologram analysis of DPPH·scavenging by the mixture from D.rupestre
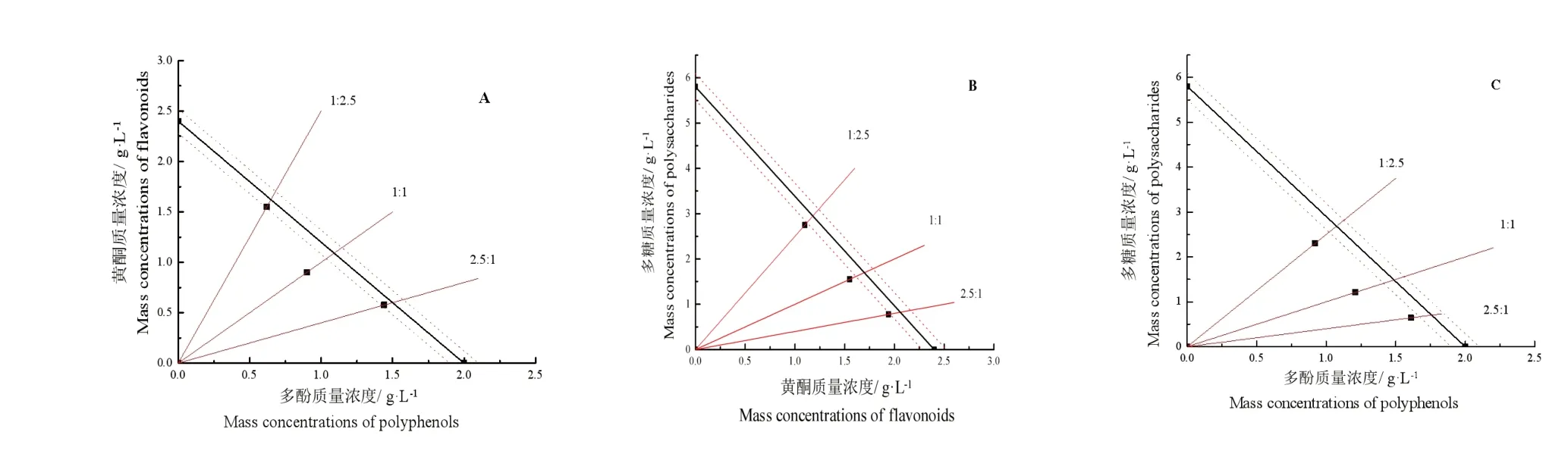
图3 毛建草复配组分清除ABTS+·自由基的Isobologram 分析Fig.3 Isobologram analysis of ABTS+·scavenging by the mixture from D.rupestre
Isobologram 分析图比数据更直观地表明抗氧化组分间明显的协同性。但在实验条件下,改变组分比例,协同差异性变化不突出。推测来自黄酮(多酚或多糖)成分多样化,没有哪种成分含量突出或存在某种突出的协同反应优势。这一方面的探讨需要进一步分离纯化产品以进行分析。
3 讨论
多酚、黄酮、多糖为植物组分中抗氧化物质,都有清除体内自由基、抗氧化、抗衰老的功效。毛建草中3 种组分对2 种自由基DPPH·和ABTS+·都有明显的清除效应,IC50都比较小,但多酚和黄酮对两种自由基的清除作用明显优于多糖。比较ABTS+·法和DPPH·法,从ABTS+·得出的组分的抗氧化性明显优于从DPPH·得出的结论。这与ABTS+·两亲的结构及既可以通过转移电子也可通过氢转移实现自由基消除有关,而DPPH·消除则主要是通过抗氧化剂转移氢给自由基。实验结果提供了一种区别抗氧化剂抗氧化性的优选方法,采用ABTS+·效果会更明显。
组分复配时,无论是用ABTS+·还是DPPH·,相互作用指数γ 均偏离1,可以得出组分间存在协同作用。但当组分复配清除自由基时,虽然每种复配组分对ABTS+·的清除效应仍然优于对DPPH·的清除,但由于相互作用指数γ 涉及到各组分混合时的和单组分时的IC50的比值(公式3),混配时,ABTS+·相对于DPPH·的优势并不明显,用ABTS+·反映出来的γ 值并没有更偏离1,从而得出更强的协同效应。这应该和分析协同作用采用的Isobologram 方法有关,后续可以探讨多种协同作用分析方法比较,从而进一步识别结论的适用性。
多酚、黄酮、多糖作为植物组分中抗氧化物质,共存于植物体内,是独立地发挥作用,还是协同增效,不仅对于探讨植物生物功能具有重要的意义,也为开发利用天然植物的产品有指导意义。如毛建草多酚、黄酮类可以提取用以化妆品、食品添加成分开发新功能。并且可以多种组分配伍使用,协同增效,使产品具有应用优势。而对ABTS+·、DPPH·自由基清除的差异性,则对研究体外抗氧化性及协同抗氧化性具有参考意义。
4 结论
毛建草中的3 种主要组分多酚、黄酮、多糖对自由基ABTS+·、DPPH·都有显著的清除作用,清除能力两者得出的结论一致,都为多酚>黄酮>多糖,但采用ABTS+·自由基,提取成分的抗氧化性更突出。通过Isobologram 分析法、统计方法分析研究3 种组分两两复配后对2 种自由基的清除的协同效应,结果显示在对ABTS+·和DPPH·清除过程中,组分两两间都体现出协同效应,且当各组分复配比例为1∶1 时,协同效应最强。协同效应方面,采用ABTS+·没有比DPPH·表现出更明显协同作用。DPPH·和ABTS+·比较为研究组分抗氧化或协同抗氧化提供了方法依据,复配产品的协同作用则为混配毛建草组分开发产品提供了相应的理论参考。
