转录组和代谢组联合分析在植物中的应用研究
2022-09-29薛守宇朱涛李冰冰李涛涛
薛守宇,朱涛,李冰冰,李涛涛*
(1.河南城建学院 生命科学与工程学院,河南 平顶山 46700;2.长江大学 生命科学学院,湖北 荆州 434023)
植物对人类的生存极为重要。如绿色植物可以净化空气并产生氧气,农作物可以解决人类食物来源问题,一些中药植物对人类疾病的治疗起到关键作用等,因此探索植物生物学机制对于人类生存发展至关重要。鉴于研究各种植物复杂生物学机制的需要,各种组学技术应运而生,事实证明在环境和生理胁迫背景下,组学方法通过分析DNA、转录本、蛋白质、代谢物和矿物质养分等不同层面的变化分析,为探索植物发育和遗传分子机制提供了便利[1-2]。迄今为止,主要的组学方法包括基因组学、转录组学、翻译组学、蛋白质组学和代谢组学等[3-4],它们从不同层次诠释生物体生长发育过程,但单一的组学技术难以充分描述复杂的植物生物学过程,多组学方法通过整合不同组学水平信息,从深层次挖掘候选关键因子。多组学方法整合基因水平、转录水平、蛋白水平和代谢水平等不同层面之间信息,构建基因调控网络,深层次理解各分子之间的调控及因果关系,从而更深入的认识植物在不同生理和环境压力下的基因功能和互作网络[5]。
在此背景下,本文综述了转录组学与代谢组学联合分析的方法在植物逆境胁迫和生长发育方面的应用,提供转录组与代谢组联合分析一般思路,分析其在无参考基因组植物分子机理研究中的重要性,并对今后发展进行展望。
1 转录组学
自21 世纪初人类基因组计划完成以来,生命科学领域进入后基因组时代。随着越来越多物种基因组测序完成,基因组学研究不断完善,与此同时,随着人们对生物体生命活动的探索不断深入,基因组学研究逐渐显示出其局限性,由4 种脱氧核苷酸编码的序列如何影响最终的生命活动和现象,很难直接从基因组水平进行解释,为了系统研究基因表达调控规律及其对生命活动的影响,转录组学应运而生。
转录组学(Transcriptomics)一词最早在20 世纪90 年代提出,是指一门在整体水平上研究细胞中基因转录的情况及转录调控规律的学科[6],其研究对象是全基因组尺度下所有转录本(Transcript),又称转录产物,即转录组(Transcriptome)。转录组分为广义转录组和狭义转录组,其中细胞或组织所转录出来的RNA 总和被称为广义转录组,细胞中参与翻译蛋白质的所有mRNA 的总和称为狭义转录组[7]。通常所说的转录组学研究主要是mRNA。转录组测序和分析是转录组学研究重点,根据物种特点转录组测序分析分为真核生物和原核生物两方面,其中真核生物转录组测序分析可以分为有参考基因组转录组测序分析和无参考基因组转录组测序分析,在定量层面,有参转录组可以对基因进行定量分析,无参转录组只能对Unigene(优化的转录本)进行定量分析,并进行下游的差异基因分析和功能注释等;在结构层面,有参考转录组分析可进行可变剪切、SNP 分析、基因结构优化、新基因预测;总的来说,转录组测序和分析可以用于发现低丰度转录本、寻找多态性标记、深度挖掘新基因、绘制转录图谱、鉴定基因家族、调控可变剪切、确定代谢途径以及进化分析等[8-9],已被广泛应用于生物学、医学、农学等许多领域。目前转录组学测序分析常用技术包括基于杂交的技术,如DNA 微阵列(DNA microarray);基于标签的技术,如基因表达序列分析(SAGE);以及基于直接测序技术,如转录组测序(RNAseq)等[10],其中,DNA 微阵列技术成熟,数据库庞大,但只适用于检测已知序列,检测灵敏度低;SAGE 技术能够大量获取基因组范围基因表达的类别与丰度,从而应用于特异组织或细胞的转录组和mRNA 群体间差异表达基因鉴定,但对mRNA 需求量较大,而RNA-seq 无需已知序列、能够在单核苷酸水平对任意物种的整体转录活动进行检测,在分析转录本的结构和表达水平的同时,还能够发现稀有转录本和未知转录本,提供最全面的转录组信息。随着研究深入,第三代测序和单细胞测序等新技术也推动转录组学研究进一步发展[11-13]。近年来高通量测序以其高灵敏度、高准确性和低运营成本优势逐渐成为该领域主流研究方法。
虽然对植物进行转录组分析可得到大量差异基因和复杂调控网络,但由于基因与表型难以直接关联,结果往往找到几十个途径,难以确定关键途径、重要结构和调控基因。近年来,转录组学和其他组学联合分析已广泛应用于复杂的生物学问题研究,有助于全面解析植物信息传递过程和功能形成机制。
2 代谢组学
人类基因组测序工作完成使人们对生命过程的理解有很大提高,研究热点转移到基因功能和多个“组学”研究,研究代谢产物变化和代谢途径的代谢组学就是其中之一[14]。代谢组学(Metabonomics)一词最早是由英国理工大学Jeremy Nicholson 于1999 年首次提出,指的是通过分析生物的体液,组织中的内源性代谢产物的变化来研究整体的生物学状况和基因功能调节的现代生物医学分支学科[15],是功能基因组学和系统生物学的补充技术,它在基因功能注释以及对细胞、分子、生物和非生物应激反应的理解中起着关键作用[16],被广泛认为是最接近表型的组学学科[17]。为了能在自然栖息地生存和成功繁殖,生物体需要调整它们的形态和生理特征以适应不同环境条件,以及与其他生物体的相互作用。这些生态生理调节可以用代谢组学技术识别和量化。代谢组学的最大优点是它可以应用于任何物种,而不需要事先知道某物种生化或遗传组成[18],目前已运用于临床诊断、新药研发、营养食品学、毒理学、环境学以及植物学等领域[19]。代谢组学常用分析技术包括气相色谱-质谱(GC-MS)、液相色谱-质谱(LCMS)和核磁共振(NMR)[20],其中核磁共振是一种基于外部磁场变化引起的原子核能量吸收和再发射原理的光谱技术,具有快速和选择性的特点,但灵敏度较低,只能检测到最丰富的物质并且检测物质种类少;质谱方法(GC-MS、LC-MS)对样品中各组分进行电离,利用电场进行加速和质量分析器得到不同组分的质荷比并通过质荷比的强度进行定量和半定量,具有良好选择性和灵敏度,但分析时间较长,因此需要根据分析目的不同以及实验条件选择合适的分析方法。
在植物代谢研究方面,代谢组学提供从对单一或少数代谢物研究飞跃到对整体或某个层面大量代谢物同时研究的技术手段,突破了分析层面窄和数据信息不足的局限性[21]。但由于植物体内代谢物极其复杂且相关数据库还不够完善,故由代谢组学研究提供的数据只能覆盖植物代谢组的一部分。因此将基因组学、蛋白组学、转录组学等技术和代谢组学相结合,对基因、蛋白表达和代谢物变化进行综合分析,可构建更加全面的植物代谢物生物学信息网络[22]。
3 转录与代谢组学联合分析
转录组学和代谢组学联合分析是实现基因和代谢产物全谱分析的试验方法,转录组可以揭示不同条件下差异表达基因,代谢物是基因-转录-翻译的终产物,是基因与表型的桥梁,两组学联合分析可以从“原因”和“结果”两方面探讨植物中各种生物学问题。转录组与代谢组关联分析方法主要包括GO 和KEGG 的注释和富集分析、基于皮尔逊的相关性分析和基于降维的模型构建确定关联关系。转录组通过FDR<0.05 等筛选条件得到差异表达基因,代谢组通过P<0.05,VIP≥1 等筛选标准得到差异代谢物,将差异基因和差异代谢物进行KEGG 通路注释,两组学数据相互验证,确定关键变化的代谢通路。差异基因或差异代谢物进行KEGG 通路注释往往注释到较多通路,需要进行富集分析,筛选P<0.05 的通路进行重点关注,从而找到变化最相关的通路信息;有时对于一些没有通路注释的代谢物和基因,仅靠KEGG 注释和富集分析,往往漏掉关键信息,基于皮尔逊(Pearson/Spearman)相关性分析可以计算基因和代谢物之间的相关性,筛选相关性系数R>0.8,相关显著性检验P<0.05 的基因代谢对进行后续相关性聚类热图、九象限图和网络图分析,将基因和代谢物相关性直接展示出来;而基于降维的模型即基于O2PLS 模型,用于两个数据组间的整合分析,一方面可反映不同数据组间的整体影响,另一方面可直接体现不同变量在模型中的权重。对转录组和代谢组进行O2PLS 模型分析,通过挑选两组学数据中关联部分分别绘制载荷图,初步判断不同数据组中相关性和权重都比较高的变量,进而筛选出影响另一组学的重要变量。本文主要从转录组和代谢组联合分析在逆境胁迫和生长发育方面的应用进行总结。
3.1 逆境胁迫
由于植物固着生长的特性,不像动物那样通过迁移来适应生存环境,因此很容易受到各种环境胁迫影响。植物逆境胁迫主要分为两类:非生物胁迫和生物胁迫,前者主要由外界环境变化引起,包括盐碱、干旱、低温、高温、水淹等[23-27],后者主要由感染和竞争引起,主要包括病原菌侵染和虫害等[28-29]。在受到逆境胁迫后,植物体内某些基因表达、代谢物水平会产生相应的变化以使植物适应不利的生存环境。
3.1.1 非生物胁迫
在非生物胁迫方面,温度是影响植物生长的重要因素,温度过高容易使细胞脱水,影响植物的生理代谢活动;温度过低易使植物器官或组织受冻,引起细胞内水分结冰而破裂,最终导致细胞死亡。在低温胁迫下,Hu 等[30]对烟草进行转录组分析,通过差异基因分析鉴定出两种烟草差异COR(冷反应基因)主要参与胁迫回应、转录因子合成、蛋白质修饰和降解等过程,并表明AP2/ERF、bHLH、HSF、MYB、WRKY 和bZIP 等转录因子家族在烟草抵御冷胁迫期间的重要作用。Jin 等[31]对两种低温敏感差异型烟草进行转录组和代谢组联合分析发现在冷胁迫下WRKY、AP2-EREBP、NAC、MYB、HSF、bHLH、UPB 和bZIP 转录因子家族基因发生大幅度变化,且差异基因主要富集在植物激素信号转导等途径,代谢组检测得到乙烯和水杨酸在2 个烟草品种中差异表达,与差异基因富集情况相符,且没有检测到脱落酸(ABA)积累。除此之外,还发现一种香料(苯)和尼古丁也受低温调控,表明2 个不同株系烟草中可能存在不同冷调节通路,进而从基因调控和代谢途径两方面解释2 种烟草冷胁迫下敏感性差异机制。Xu等[32]对冷胁迫前后烟草叶片进行转录组和代谢组联合分析,发现除碳水化合物、氨基酸、TCA 代谢过程中转录本与代谢物在冷胁迫下发生变化外,冷胁迫也明显影响苯丙酸生物合成,导致木质素和类黄酮大量积累,表明其在冷胁迫中具有重要调节作用;在高温胁迫下植物会积累糖类、脂类、激素和氨基酸等物质,但其积累机制和调控模式尚不明确[33-35],Hu 等[36]对两种温度敏感型不同的高羊茅进行转录组和代谢组分析,发现高温下高羊茅碳水化合物代谢途径中12 个酶相关基因转录丰度显著增加,糖类和脂类随着热处理时间增加不断积累,在脂肪酸代谢中,DESA1、ACOX1、MECR、ACSL等基因的差异表达可能是造成2 种高羊茅温度敏感差异的原因(表1);Hiromoto 等[37]通过代谢物分析在水稻中发现γ-氨基丁酸(GABA)在高温条件下被诱导,表明氨基酸在植物热胁迫响应中具有重要作用,转录组分析揭示除酪氨酸、色氨酸、天冬酰胺和组氨酸以外氨基酸的氨基酰tRNA 合成酶基因在高温下表达受到抑制,证实高温胁迫下GABA 的积累。但在番茄中,高温对脯氨酸和GABA 水平没有明显的影响[38],进一步说明高温诱导植物氨基酸代谢变化具有物种差异性。Guo 等[39]发现糯玉米授粉10 d 后,高温导致水杨酸含量降低,但在25 d 后含量增加,11 个ABA 响应基因在高温下表达上调。Xiang 等[40]通过转录组和代谢组联合分析甜玉米幼苗在极端温度下挥发性物质和植物激素动态变化,其中低温胁迫显著影响20 种挥发性物质,脱落酸(ABA)和水杨酸(SA)积累,生长素(IAA)和茉莉酸(JA)减少,阐明了VP14和ABF基因在低温胁迫下对脱落酸积累和信号转导的调控模式;而高温胁迫影响31 种挥发性物质,导致玉米素、SA、JA 和IAA含量下降,ARR-B基因上调增强了其在高温胁迫下对玉米素信号转导的作用。有趣的是,极端温度下IAA 和JA 含量下降,ABA、SA 在低温条件下积累,而高温下SA 含量降低,表明SA 与其它激素具有不同调控模式。
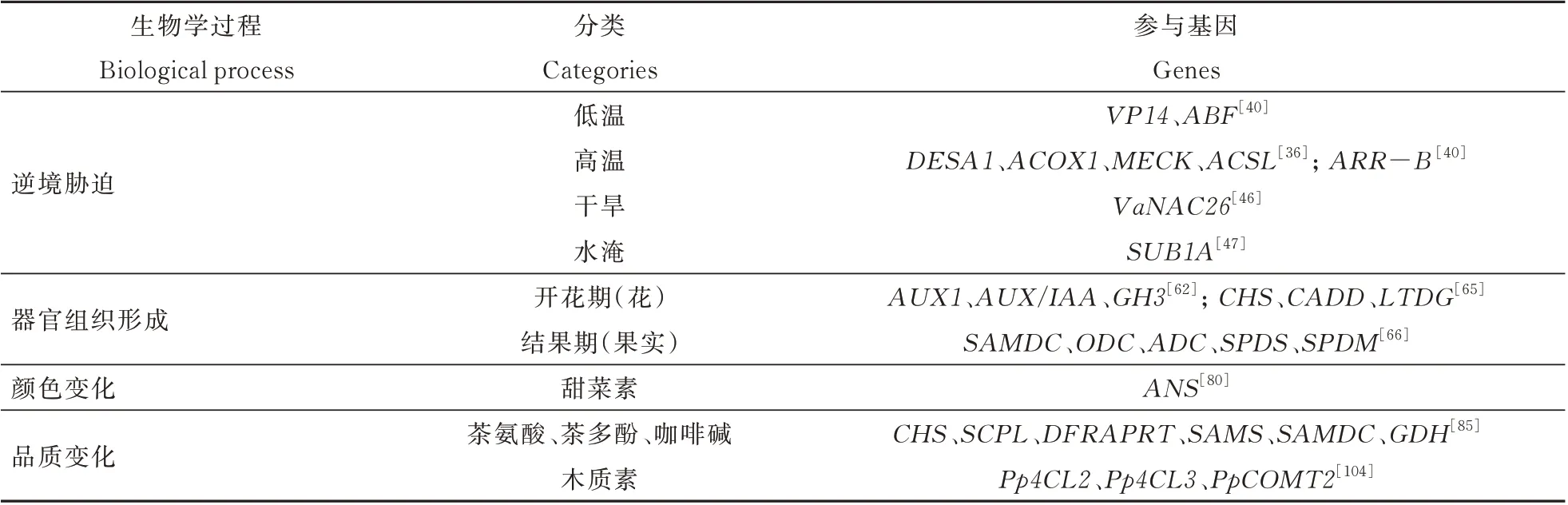
表1 不同生物学过程参与相关基因列表Table 1 List of genes involved in different biological processes
为适应高盐胁迫,植物通常会增加自身K+含量,保持高K+/Na+水平,并通过积累糖类物质参与渗透调节[41]。Xu 等[42]通过代谢和转录进一步解析燕麦对盐胁迫的适应性,发现耐盐品种盐胁迫下淀粉和糖的代谢相关基因上调表达,致使糖异生等代谢途径增强;K+转运基因被上调,阳离子/H+逆向转运蛋白表达降低,导致在高盐环境下低浓度Na+和高浓度K+,从而更好适应逆境。NAC转录因子家族在植物干旱胁迫中发挥着重要作用,已在水稻[43]、橘子[44]、葡萄[45]等多种植物中鉴别到该家族成员,但其调控机制尚不明确。Fang等[46]以山葡萄、野生型和转基因型拟南芥为实验材料,以基因VaNAC26(一个胁迫响应基因)为出发点构建转基因株系进行转录组和代谢组分析,发现在拟南芥VaNAC26过表达株系中,与野生型相比,其JA 合成关键基因以及JA 信号通路相关基因均显著上调,JA 合成含量也显著提高。另外,在干旱条件下山葡萄叶片中JA 含量同样显著上升,进一步揭示VaNAC26通过茉莉酸途径调控植株抗旱性的分子机理,从而丰富植物抗旱调控网络,为研究植物抗旱机制提供新思路。另外,也有研究表明SUB1A是一种乙烯响应因子类基因,其特异性等位基因SUB1A-1能够赋予水稻较强耐淹性[47],但其调控机理尚不明确。Anna 等[48]联合转录组和代谢组研究水稻亚致死性淹没事件后24 h内SUB1A 改善生理功能的机制,发现SUB1A基因渗入株系影响约1400 个转录本丰度,并在整个恢复期对代谢物含量、稳态恢复产生持续性影响;由SUB1A 调控的海藻糖-6-磷酸、编码关键酶和信号蛋白的动态变化支持淹水和恢复过程中低能量感知的参与,对快速可逆地管理耐淹水稻碳和氮代谢至关重要,为水淹胁迫相关研究提供新方向。除上述研究外,转录组与代谢组关联分析在UV 辐射[49-50]、缺磷[51]以及环境有机物质污染[52]等非生物胁迫条件下植物响应机制和应对措施的探索中也起到非常重要的作用。
3.1.2 生物胁迫
在生物胁迫方面,Liu 等[53]对二化螟虫侵染前后的水稻进行转录组和代谢组分析,发现上调基因伴随着该通路主要代谢物含量的升高,和对照组相比,二化螟虫侵染后24~72 h 水稻植物上调的DEGs 主要参与细胞壁、脂质、和次生代谢过程,而下调基因主要参与光反应,转录本和代谢谱的综合结果为水稻防御机制提供新的见解,并为抗虫水稻品种的发展提供线索。Moritz 等[54]以是否菌根共生和是否暴露于叶甲虫下为差异因素对杨树叶片进行转录组、代谢产物以及挥发性物质的检测,发现菌根杨树叶片中氮分配发生变化,酚类物质含量下降以及防御系统相关物质上调表达,包括蛋白酶抑制剂和几丁质酶。与非菌根杨树相比,菌根杨树对叶甲虫的反应具有更有效的防御机制,证明植物地下部分-微生物共生系统在减轻地上生物胁迫方面的重要性。除了虫害,转录组与代谢组联合分析在病原菌侵染机制研究上也有广泛应用。Ashish 等[55]为了探究大豆抵御核盘菌侵染机制,利用转录组学、代谢组学和基因组学等多种组学方法,从基因和代谢物角度揭示大豆抑制核盘菌侵染主要与苯丙烷途径、ROS 清除和茉莉酸途径相关,并且一些苯丙烷途径代谢物能够抑制核盘菌生长,进而揭示大豆抗性品种抗病机理是通过对苯丙烷途径重编程,以及靶向抑制核盘菌麦角固醇生物合成来抑制核盘菌生长。Kong等[56]利用4 个不同亚种的禾谷镰刀菌并以水为介质分别接种苏麦3 号叶片组织,接种后第4 天进行代谢组和转录组数据采集,通过联合分析发现禾谷镰刀菌侵染刺激类黄酮生物合成途径,其中16个基因水平上调,激活IAA、SA 和JA 信号转导途径,分别有55、15 和22 相关基因在感染后显著富集,诱导酚酰胺和色胺衍生物积累,表明山奈酚和芹菜素等类黄酮物质可提高小麦赤霉病抗性,而生长素受体TIR1 负调控禾谷镰刀菌的防御。
3.2 生长发育
植物生长发育是一个极其复杂的过程,包括各种组织器官形成、颜色形成和品质形成。植物需要大量基因以及代谢物发挥功能,因此阐明一种特定调控机制是一个巨大挑战[57],而综合转录组与代谢组的多组学分析方法已在探索植物生长发育过程中得到广泛应用。
3.2.1 器官组织形成
植物激素几乎参与调控植物从种子休眠、萌发、生长、生殖、成熟和衰老每个过程,花发育是被子植物生长发育过程中的重要转折时期,植物激素是影响花器官形态发生的关键因子。在苹果中发现细胞分裂素(CK)、ABA 和赤霉素(GA)参与调控花器官发育[58];百子莲中发现GA 促进开花,而IAA 对开花有延迟作用[59];番茄中发现JA 在暂时抑制乙烯产生、防止雄蕊过早干燥和确保花发育适当时机方面起着至关重要作用[60]。近30 年遗传和分子分析使人们对花发育中发生的许多过程有详细的了解,并确定了大量控制这些过程的关键调控基因,尽管取得重大进展,但被子植物花发育调控的许多问题仍然没有答案[61]。通过转录组分析,Liu 等[62]发现在番荔枝成花转变和花发育过程中有32 个关键基因与ABA 信号通路相关,16 个基因与GA 信号通路相关,21 个基因与CK 信号通路相关。基于ULFC-MS/MS 检测花发育过程激素变化,发现除ABA 外,GA、CK、IAA 浓度在开花过程均显著下降,这与其相关基因表达趋势一致。Wang 等[63]基于LC-MS、RNA-seq 分析和RT-qPCR 验证,发现“金巴”菊花花瓣伸长过程中IAA 信号转导途径中差异表达基因最多,其中AUX1、AUX/IAA和GH3基因显著上调,此外MADS、TCP、bHLH 等转录因子也参与调控菊花花瓣发育,各种基因和转录因子的鉴定,使得激素调控菊花花瓣伸长机制得以阐明,并为花瓣发育研究提供新思路。另外,糖代谢、脂多糖生物合成、碳转化和次生代谢变化对于阐明花发育过程中能量供应机制以及代谢网络调控机制至关重要。He 等[64]对铁皮石斛早中期花芽和开放的花朵进行转录组测序和代谢谱分析,鉴别出8019 个差异表达基因和239 个差异代谢物,不仅阐明参与叶绿素和类胡萝卜素生物合成基因表达与代谢产物积累模式的强相关性,而且发现35 个MIKC 型MADS-box基因中有18 个在3 个花发育阶段表现出不同表达模式,黄酮和多糖生物合成相关基因在花发育过程中处于活跃状态,有趣的是,IAA 和ABA 在花发育过程中的积累趋势相反,总体而言,差异基因和代谢物鉴定有助于厘清兰花发育的重要调控网络和分子机制。Tan 等[65]对甘蓝型油菜花柱中花粉萌发和花粉管伸长过程进行转录组和代谢物综合分析,发现相对于成熟花粉,花柱中含有较高水平的多种营养物质,在授粉后1 h,参与细胞壁合成和养分运输的基因在花柱中特异表达;授粉后2 h,随着花粉萌发和花粉管伸长,花柱中大部分营养物质,特别是细胞壁合成和能量代谢相关代谢物水平迅速下降。Yang 等[66]在对药用植物金银花中次生代谢物调控花发育机制探索中,分析了金银花5 个发育阶段(JBS:幼蕾期、TGS:第三绿期、CWS 全白期、SFS 银花期和GFS:金花期)的基因、蛋白质、代谢物变化情况,在苯丙素途径中,CHS和CADD基因在JBS、TGS 和CWS 中上调,而LTDG基因在JBS 中上调;在次生代谢物分析中,TGS 中苯丙氨酸含量约为其它阶段4 倍,4-香豆酸在TGS 和CWS 中显著积累,而在JBS、TGS和CWS 中绿原酸的强度高于SFS 和GFS,JBS 中与苯丙素相关的芹菜素和新橙皮苷的表达强度高于其它4 个阶段,这可能归功于LTDG的上调。此外,黄酮类化合物木犀草素在早期(JBS、TGS、CWS)积累,在发育后期(SFS、GFS)减少;槲皮素和槲皮素3-O-葡萄糖苷仅存在于JBS 中。由此可见,转录组与代谢组联合分析既可以检测花发育过程中起关键作用的基因、激素、相关代谢物,也能将他们进行联合联系,发现代谢物时空特异性表达并检测它们的动态变化趋势,有助于阐明植物组织器官生长发育机制。
在植物果实发育机制研究中,Guo 等[67]对草莓成熟过程中7 个发育阶段进行转录组学和代谢组学分析,基于转录本与代谢物的变化提出在草莓果实发育中,高Put(腐胺)含量抑制成熟并促进早期果实生长。随着果实成熟开始,高表达水平的SAMDC(腺苷甲硫氨酸脱羧酶基因)通过与ODC(鸟氨酸脱羧酶基因)、ADC(精氨酸脱羧酶基因)、SPDS(亚精胺合成酶基因)和SPDM(精氨合成酶基因)协同表达促进Put 转化为Spd(亚精胺),然后转化为Spm(精胺),高Spm 含量促进ABA 积累和信号传导,抑制IAA 和乙烯积累,同时促进IAA信号传导但抑制乙烯信号传导,最终导致软化,但花青素和糖相关基因的表达增加,从而促进成熟,进而揭示多胺通过调节ABA、IAA 以及乙烯来调节草莓果实发育的机制。Xu 等[68]通过LC-MS 发现在苹果果实4 个发育阶段中糖类积累水平大多呈上升趋势,有机酸,包括三羧酸循环(TCA)中间产物积累水平呈明显下降趋势,糖和次生代谢物之间存在显著负相关,表明初生代谢与次生代谢之间存在串扰关系。转录组分析发现参与TCA循环的大多数差异表达基因在果实早期至成熟前期上调,类黄酮途径调控基因的广泛下调可能是导致果实早期类黄酮含量迅速下降的原因。除花和果实发育外,转录组学与代谢组学还被应用于研究叶子发育过程中激素和代谢物运输、种子萌发机制探索和表皮毛形成调控机制等[69-71]。
植物生长发育过程中基因表达以及代谢产物含量和种类不断变化,从而导致很难对其进行全面分析。Li 等[72]通过整合20 个不同发育阶段及不同组织样本的时空高分辨率转录组和代谢组数据,构建了小番茄代谢网络数据集(MMN),不仅验证了之前已知的主要代谢调控网络,还鉴定了甾体类糖苷生物碱与类黄酮生物合成过程重要的转录因子。相似的,在对黄瓜挥发性物质化合物生物合成及分子调控机制研究中,采用固相微萃取-气相色谱-质谱联用和转录组测序技术对整个发育时期23 个黄瓜组织进行分析,共产生85 种挥发性成分以及21 788 个转录本,论证了对非靶标挥发性图谱和转录组数据综合分析可以用于快速阐明感兴趣的植物物种中挥发性有机化合物生物合成途径。另外,黄瓜SSUI 蛋白增加了单一植物根和花两个组织中GPP 供应,为我们理解SSUI 蛋白功能提供新的见解[73]。
通过转录组和代谢组联合分析植物生长发育过程,有助于从分子角度解释植物不同发育时期不同组织形成过程和形态变化,并能发现一些新的转录因子或者关键基因,其往往与许多代谢物相对应,一方面弥补单个转录组或代谢组的一些不足之处,从而可以从基因和代谢物两个层面同时分析,有助于全面理解整个生物学过程。另一方面,其中所形成的代谢网络数据集、信号通路以及重要代谢物合成途径可为以后相关方面研究提供理论基础。
3.2.2 颜色变化
植物在生长发育过程中常伴随着各种器官或组织颜色改变,其中色素的种类和含量是决定这些变化的关键[74],主要包括叶绿素、类黄酮、类胡萝卜素和生物碱等四大类物质[75]。
在色泽方面,Wang 等[76]取青皮与紫皮无花果的幼果和成熟果进行转录组学和代谢组学分析,发现3 种矢车菊素在紫皮和青皮成熟果中含量差异巨大,表明其是主导颜色变化的重要花青素,为无花果颜色突变提供了花青素以及黄酮通路的变化信息,从而揭示了无花果果实紫色变异的机理。相似的,Hu 等[77]选 用白色和紫色籽粒玉米的3 个发育时期比较了种子发育和成熟阶段不同籽粒颜色的2 个品种中转录组和代谢组的动态变化,发现总花青素和鞣红前体物质差异变化通路,揭示紫色玉米发育过程中类黄酮代谢通路,为进一步提高作物品质提供研究基础。除此之外,在烟草花色[78]、枣果果皮[79]以及猕猴桃果肉的[80]转录组和代谢组联合分析中也发现类似类黄酮变化趋势,表明类黄酮物质在植物颜色变化中的关键作用。在石竹属植物中决定颜色变化代谢物为甜菜色素,Asaph 等[81]对石竹属5 个科8 种植物进行代谢物检测,然后对其中富含甜菜色素以及缺乏甜菜色素的组织进行转录组测序,识别其中与甜菜色素合成相关候选基因,表明石竹属中甜菜色素与花青素不共存是因为花青素合酶基因ANS缺失,导致蛋白不能表达,从而解释在石竹属植物中为什么甜菜色素对颜色变化起决定性作用。类胡萝卜素决定了木瓜果皮和果肉的颜色,Shen 等[82]选择有颜色差异的4 个时期木瓜为实验材料,通过转录组和代谢组联合分析阐明木瓜果皮和果肉中类胡萝卜素差异代谢途径,为果实外观品质改良奠定了基础。
3.2.3 品质变化
农作物指具有经济价值而被人们种植的植物,包括粮食作物、经济作物两大类。农作物的品质主要包含风味、营养、质地三部分(图1)。茶叶风味物质是评价茶叶品质的重要指标之一,Zhang等[83]使用GC-MS 结合感官技术鉴定不同茶叶中影响风味的特征性成分主要为黄酮类物质;Wang等[84]对茶叶进行转录组与代谢组分析,发现类黄酮生物合成相关差异基因显著下调,萎凋过程中儿茶素(类黄酮)水平下降,总挥发物含量和数量增加,游离氨基酸含量随着水分流失增加,进一步揭示不同类型茶叶风味和适口性形成原因;Gao等[85]利用转录组学与代谢组学联合分析茶树在不同氮素条件下的转录本与代谢物,发现缺氮茶树积累多种黄酮类化合物,其相关基因表达上调,与缺氮相比,供氮茶树显著增加了脯氨酸、谷氨酰胺和茶氨酸,进而表明不同氮源条件下茶树幼枝中氮素再分配有明显差异,以致茶叶风味不同。Gong 等[86]利用转录组与代谢组联合进一步分析茶叶 中 儿 茶 素(CHS、SCPL和DFR)、咖 啡 因(APRT、SAMS)和茶氨酸(SAMDC、GDH)合成基因表达 与AP2/ERF-ERF、WRKY 和bHLH 转录因子家族高度相关,增强了我们对转录因子、基因表达和代谢物富集之间相互作用的理解。在果蔬中,Liu 等[87]以西瓜为研究材料研究其发育过程中的风味变化,通过结合转录组与代谢组数据揭示糖酵解途径中糖含量和基因表达具有相似表达趋势,为果实发育过程中味道形成提供分子方面的见解。果实质地变化包括果实软化和木质化[88]。果实软化涉及细胞壁变化和植物激素调节[89],其中,细胞壁降解受聚半乳糖醛酸酶和果胶酯酶作用[90-91],而植物激素调节以乙烯生物合成最为关键[92]。Xu 等[93]对山梨进行LC-MS/MS 以及RNA-seq 分析,通过比较差异基因及代谢物,进一步揭示甘油磷脂代谢与梨采后软化密切相关。另外,在香蕉成熟过程中发现糖代谢、活性氧和能量代谢相关基因表达以及代谢物含量在果肉软化过程中也发生不同程度变化,从而揭示一些能量物质在果实软化中也起到重要作用[94]。果实木质化主要是由于木质素积累[95],与木质素合成相关的酶主要有苯丙氨酸解氨酶(PAL)、肉桂酸-4-羟化酶(C4H)、4-香豆酸辅酶A 连接酶(4CL)、对香豆酸-3-羟化酶(C3H)、咖啡酰-CoA-3-o-甲基转移酶(CCOMT)、肉桂醇脱氢酶(CAD)、肉桂酰辅酶A 还原酶(CCR),羟基肉桂酰转移酶(HCT)、过氧化 物 酶(POD)等,已 在 梨[96~100]、枇 杷[101,102]、葡萄[103]、莲雾[104]等水果中被广泛研究。转录组学和代谢组学研究发现桃果实的软化和木质化可能是由于苯丙烷代谢途径分支差异而产生的不同结果[105],在“Bail”桃果实中,其木质素合成相关基因表 达 较 高 ,特 别 是Pp4CL2、Pp4CL3和PpCOMT2,促进果实由苯丙氨酸到对香豆酸的生物合成,激活下游木质素生物合成和乙烯前体合成,引起果实木质化。“Hongl”桃中编码查尔酮合成酶的表达量升高,正调控苯丙氨酸到南瓜皂苷查尔酮的生物合成,导致类黄酮合成活跃从而通过积累花青素来调节果实软化。另外,其中乙烯代谢相关基因与木质素合成相关基因呈正相关,但与细胞壁重构相关基因的相关性是可变的,说明乙烯对桃果实质地有双重影响,表明木质化可能是影响桃果实质地的主要因素。
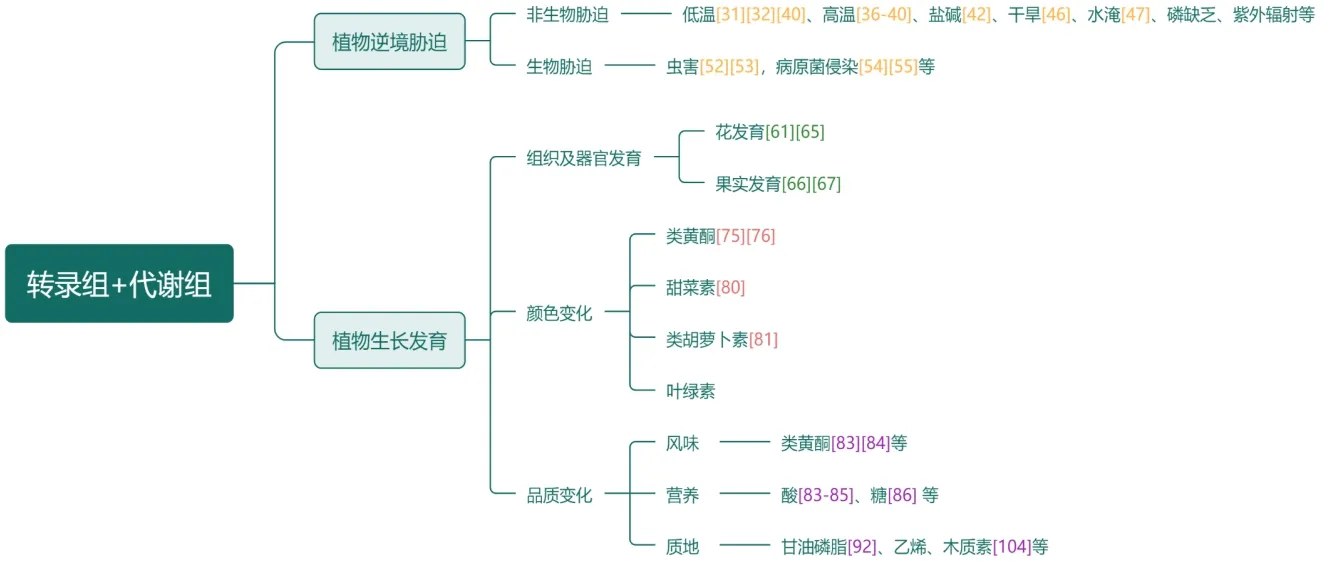
图1 转录组学与代谢组学联合分析在植物中的应用Fig.1 Application research of combined transcriptome with metabolome in plants
综合转录组与代谢组的多组学方法,可以根据基因表达和代谢物含量动态变化解释各种果蔬、作物颜色形成机制,分析果实质地差异分子和代谢机理,果蔬的色泽品质对其商业价值有很大影响,其颜色和品质形成机制阐明有助于提高果蔬品质和培育优良品种。另外,类黄酮在植物颜色变化和风味改变中都起到重要作用,研究表明类黄酮还是一种抗氧化物,可以抵抗癌症[106-107]。因此通过转录组与代谢组联合分析植物中不同类黄酮合成及调控机制,对类黄酮有效提取和抗癌药物研发起一定推动作用。
4 结论和展望
转录组和代谢组联合分析可从大量转录信息中发掘差异基因,从而快速判断核心调控网络,找出关键候选基因以及明确相关转录因子功能,阐明植物逆境胁迫、生长发育、色泽品质变化以及活性物质调控的生物学机理。不仅为无参考基因组非模式植物研究提供一种新的研究思路,而且提高了植物利用价值,为作物育种、环境改善以及疾病治疗药物开发提供了便利。
近年来,高通量技术迅速发展使得转录组和代谢组数据获取更为快速、经济,加深了我们对不同植物分子调控机制和代谢物调控网络的理解[108-109]。通过转录组测序和代谢物检测可以获得大量数据,但如何充分有效从中选取和利用与研究目标相关的信息以及后续所筛核心数据的验证有待进一步探索。目前,转录组、蛋白组、代谢组联合分析方式[66,110]已被用于探索钙如何增强细胞机械强度[111]、植物自交不亲和机制[112]等一系列重要问题的研究中,从基因、蛋白质、代谢物水平分析问题,有助于更为全面理解生物信息,更多组学技术的联合分析将成为今后组学技术的发展趋势,为解决更加复杂的生物学问题提供支撑。
