腮腺分泌性癌1例
2022-09-29相龙全马廷廷王慧张孝常林凡忠张光海
相龙全 马廷廷 王慧 张孝常 林凡忠 张光海
1济宁市第一人民医院病理科,济宁 272000;2济宁市第一人民医院放射科,济宁 272000;3济宁市第一人民医院消化内科,济宁 272000
类似乳腺分泌性癌(mammary analogue secretory carcinoma,MASC)现已被确认为一种独特的原发性唾液腺肿瘤,以t(12;15)(p13;q25)易位导致ETV6-NTRK3基因融合为特征,其组织学、免疫表型和分子特征与乳腺分泌性癌(secretory breast cancer,SBC)相同[1]。自2017年该肿瘤被第4版世界卫生组织(WHO)头颈部肿瘤分类收录后,采用分泌性癌(secretory carcinoma,SC)命名。SBC临床上生长缓慢,主要发生于年轻女性[2],而SC多见于中年人。Boon等[3]回顾了279例病例,男女比例约为1.5∶1。SC通常被认为是低级别肿瘤,常因腮腺缓慢生长的无痛性肿块而就诊[1,4]。自从2010年Skálová等[1]首次将SC描述为唾液腺中的一个独特实体以来,人们对该肿瘤一直有着浓厚的兴趣,包括一系列描述形态学、免疫组织化学甚至超微结构的病例报道和文献综述[4-5]。尽管如此,其诊断仍具有挑战性,SC常被误诊为涎腺腺泡细胞癌(acinar cell carcinoma,AciCC)[3],需要我们通过形态学、免疫组织化学甚至分子生物学的联合诊断。据报道,涎腺肿瘤的发病率为3例/10万人[6],而SC占所有涎腺肿瘤的比例不足0.3%[7],由于已发表文章的数量有限,尚不能形成规范化的治疗方案。因此,我们通过对1例28岁青年男性患者腮腺SC进行报道,旨在提高对该病的认识,为制定规范化治疗方案提供绵薄之力。
病例资料
患者,男性,28岁,2016年5月16日因“右耳前无痛性肿物1年”入济宁市第一人民医院。患者1年前发现右耳前腮腺区一“红枣”大小肿物,按压时无疼痛,否认感冒发热时肿胀感,否认消长史及生长加速史,表面皮肤无破溃、麻木,1年来肿物生长缓慢,无明显变化,B超检查,提示:右腮腺占位,淋巴结可考虑,混合瘤不能排除。为进一步确诊,遂来院就诊。查体:一般情况尚可,神志清,心肺听诊无异常,肝脾肋下未及,颌面部左右基本对称,无明显畸形,右耳前可触及一大小3.0 cm×3.0 cm×3.0 cm肿物,局部无触压痛,表面皮肤色泽无异常,皮温不高,表面光滑,质硬边界清,活动度差。入院腮腺MR平扫:右侧腮腺浅叶见一类圆形异常信号影,大小1.8 cm×1.8 cm×1.6 cm,T1加权像(T1WI)呈等级高信号、T2加权像(T2WI)呈混杂高信号影,信号不匀,局部边界欠清晰,磁共振弥散加权成像(DWI)呈高低混杂信号改变(图1),双侧颌颈部见多发小淋巴结影。影像学提示右腮腺占位性病变。在完善相关检查,排除手术禁忌后,于全身麻醉下行右腮腺全叶及肿物切除术+面神经解剖术+邻位瓣转移修复术,术中完整切除肿物及腮腺全叶,注意保护面神经。术后将组织送检病理科。大体:灰白灰黄色组织1块,大小5.0 cm×3.0 cm×1.0 cm,切开,切面见一肿物,大小2.2 cm×1.8 cm×1.0 cm,切面灰红,质软,其余切面灰黄色,质中。镜下观察:组织学形态以微囊状,乳头状生长为主,微囊结构中含有嗜酸性分泌物,肿瘤细胞相对均匀,呈圆形或者卵圆形,具有低级别的泡状核、细颗粒染色质和明显的中央核仁。细胞核被浅嗜酸性颗粒或空泡状细胞质包围。有丝分裂和坏死罕见(图2)。免疫组化:肿瘤细胞波形蛋白、mammaglobin、细胞角蛋白7和S-100蛋白阳性(图3),DOG-1和p63阴性。
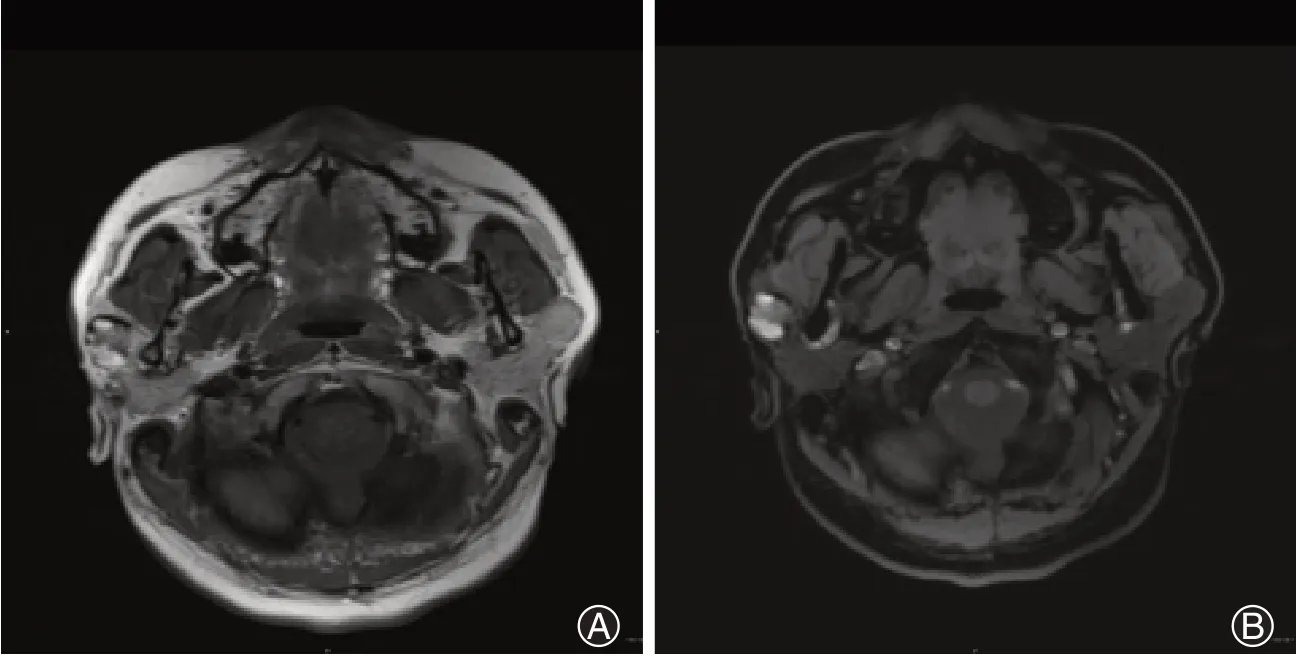
图1 腮腺分泌性癌患者腮腺MR平扫。A为T1加权像(T1WI)右侧腮腺病灶内见等级高信号,B为T2加权像(T2WI)右侧腮腺病灶呈混杂高信号
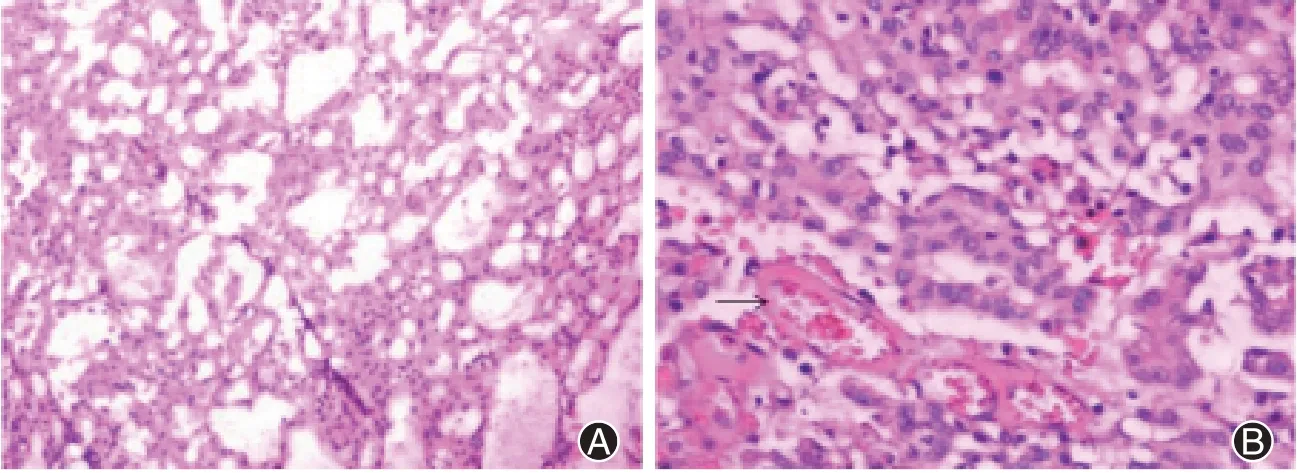
图2 腮腺分泌性癌患者病理特征(HE染色)。A为40倍镜下示癌细胞呈乳头-囊性排列;B为400倍镜下示癌细胞圆形/卵圆形,轻度异型性,胞质丰富,细胞核被浅嗜酸性颗粒或空泡状细胞质包围,“→”为微囊结构中嗜酸性分泌物
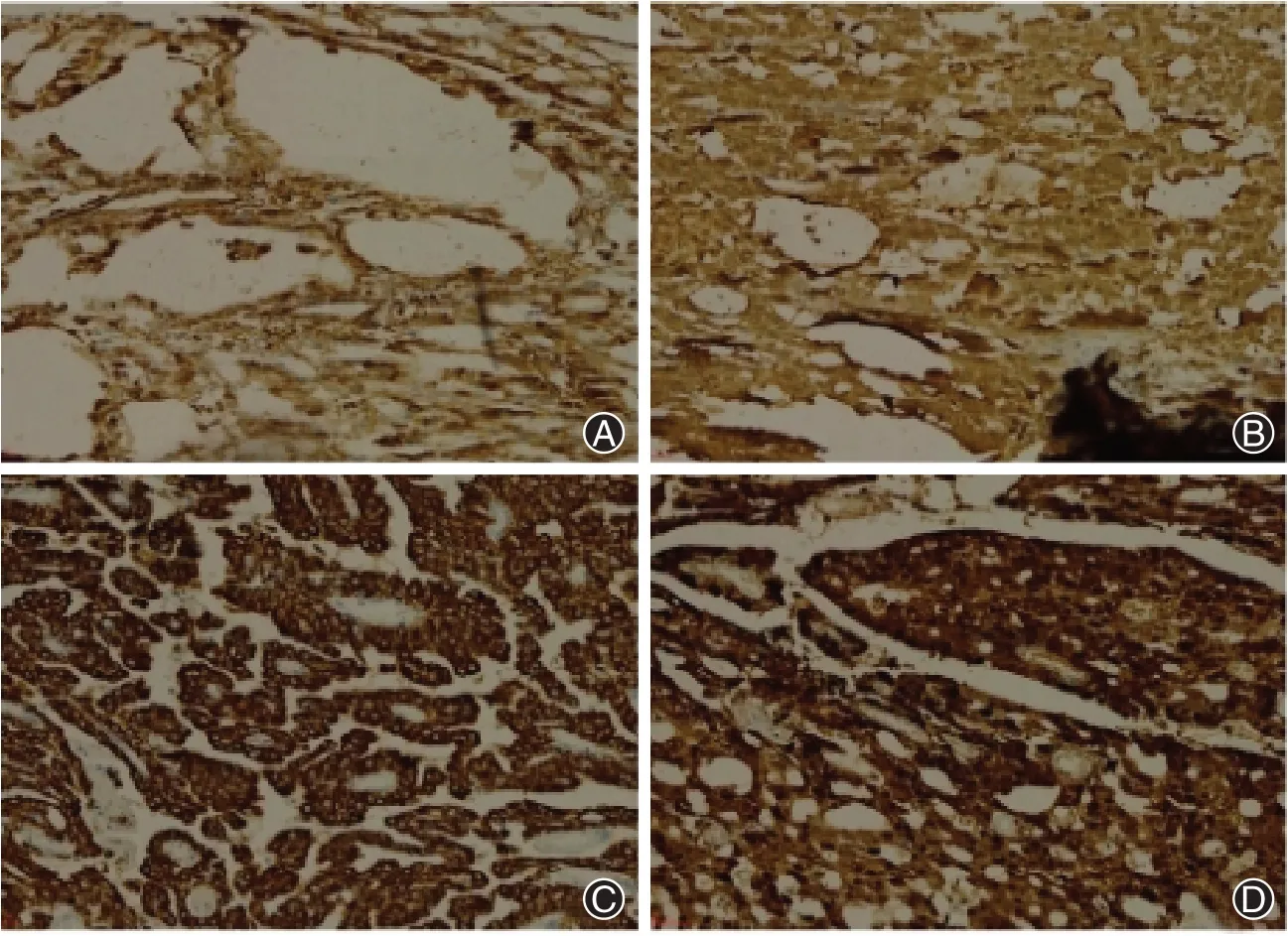
图3 腮腺分泌性癌患者癌细胞免疫组化结果。A为胞质Vimentin阳性;B为胞质mamag lobin阳性;C为胞质CK7阳性;D为胞质、胞核S100阳性
讨 论
Skálová等[1]在2010年首次记录了SC的临床和病理特征,认为它是一种独特的低级别涎腺SC,与SBC相似,以染色体t(12;15)(p13;q25)平衡易位导致12号染色体上的ETV6基因和15号染色体上的NTRK3基因融合为特征。乳腺和唾液腺组织来源于同一个外胚层,且具有相同的导管腺泡结构[8]。SC占 所有 涎 腺 肿 瘤 的 比 例<0.3%[7],根 据Jung等[9]1990年 至2012年的回顾性研究,SC的平均诊断年龄为46岁,一般范围为14~77岁,儿童和青少年病例少见。在首篇文章对其描述后,许多SC已经在腮腺、下颌下腺、鼻窦、唇和颊黏膜的小涎腺、皮肤、甲状腺、肺[10],甚至外阴[11]中报道。其中,约70%位于腮腺,不到1/4病例来自口腔内的小唾液腺,其他部位不太常见。腮腺SC临床上生长缓慢,最常见的症状是持续数月至数年缓慢生长的无痛肿块[1-6],尽管高达25%的病例可能有局部淋巴结转移,但很少发生远处转移或高级别转化[12]。而罕见的高级别转化具有临床侵袭性,会增加肿瘤的播散率及患者病死率[13]。在Skálová等[1]报道的3例接受腮腺切除术的高级转化型SC患者中,其中2例接受了术后放疗,另1例因病情严重,无法完成放疗。3例患者在确诊后2~6年内均死于转移性疾病。
SC是一个独特的实体,大多数情况下,组织病理学结合适当的免疫组化检查即可诊断[1]。SC呈胶状,切面呈白色至灰色。显微镜下,肿瘤呈分叶状,由纤维间隔分隔为局限性结节性肿块,大量细胞外分泌物质染色呈周期性PAS淀粉酶阳性。肿瘤细胞排列成多种形式,包括微囊性、大囊性、乳头状、实体型和管状结构[4]。本病例主要表现为微囊性和乳头状生长模式。肿瘤细胞相对均匀,具有低级别的泡状核、细颗粒染色质和明显的中央核仁,细胞核被浅嗜酸性颗粒或空泡状细胞质包围,有丝分裂和坏死罕见[1,14]。常可见肿瘤侵犯周围涎腺组织,少数病例侵犯神经,不常见侵犯血管[1]。其中,以嗜酸性和空泡状细胞质及小细胞核的中小型细胞增殖为其主要特征[12]。最近,又报道一项新的诊断特征,在SC病例中,除肿瘤的实性/囊性成分外,还可见核膜不规则[15]。免疫组织化学检测中,SC不同程度表达S-100、mammaglobin、细胞角蛋白、上皮膜抗原、波形蛋白;不表达肌上皮或基底细胞标记物,如P63、DOG-1、Calponin、CK5/6、CK14和平滑肌肌动蛋白[16]。在这些抗原中,mammaglobin和S-100对SC的细胞学诊断灵敏度高达95%。我们通过检测波形蛋白、mammaglobin、细胞角蛋白7和S-100蛋白阳性,DOG-1和p63阴性,以及联合其组织学特征,将其诊断为SC。对于诊断不清,尤其是细胞形态学特征支持但缺乏确切免疫组化染色的病例,可通过应用分子检测技术进行鉴别,包括FISH检测ETV6基因重排,RT-PCR检 测ETV6 NTRK3融 合 转 录 物[17]。WHO在2017年头颈部肿瘤的分类认识到,将分子医学进展纳入临床实践将不可避免。
少数情况下,由于涎腺肿瘤的起源、组织形态学特征、免疫组化表达、甚至基因改变等方面的相似性,使得涎腺肿瘤的病理诊断具有挑战性。回顾性研究发现,SC常被诊断为AciCC、导管内癌(intraductal carcinoma,IDC)、黏液表皮样癌(mucoepidermoid carcinoma,MEC),以及多形性低级别腺 癌(pleomorphic low-grade adenocarcinoma,PLGA)[16,18]。(1)AciCC:SC最常被误诊为AciCC[3],AciCC主要发生在腮腺,是一种低度恶性肿瘤,5年生存率为83.3%。AciCC具有细胞学和结构多样性的特点,由浆液性腺泡、夹层导管样、钩状、空泡状、透明和非特异性腺细胞组成,排列成固体/小叶、微囊、乳头状囊性和滤泡状生长模式,与SC相似[19]。大多数SC患者以前被诊断为“酶原缺乏”的AciCC[6]。经典的AciCC表现为嗜碱性细胞质,含有酶原颗粒,比SC具有更多的细胞多样性[4]。免疫组化显示DOG1强阳性,而不对S100、mammaglobin染色,这与SC染色正好相反[20]。Pinto等[21]也证明DOG1阴性,S-100、mammaglobin阳性是SC的有效筛选工具。鉴别AciCC和SC的最大挑战是酵母菌颗粒缺乏的AciCC,它有丰富的嗜酸性空泡状细胞质而不是颗粒状嗜碱性细胞质,也可以是S100阳性[5]。这种情况下,分子生物学发挥重要作用,AciCC缺乏ETV6基因重排的存在。根据这一认识和标准,先前诊断为AciCC的多个病例被重新归类为SC[4]。(2)IDC,以前称为低级别涎腺导管癌或筛状囊腺癌,现在被认为是一种与传统的涎腺导管癌无关的独特实体。与SC一样,它通常出现在腮腺,在口腔、颌下腺和小涎腺中也有报道[22]。IDC与SC在结构上有着惊人的相似性,有囊性、筛状、乳头状和实性结构以及嗜酸性分泌物。在细胞学特征上,两者均为低级立方细胞,偶有微绒毛状嗜酸性细胞质,伴有圆形或卵圆形细胞核,核仁不明显[5]。免 疫 组 化 中,两 种 肿 瘤S100和mammaglobin阳性[22-23]。主要区别是大多数IDC显示出完整的肌上皮层,与导管内生长一致[23],可通过肌上皮细胞标记物(如P63、calponin或SMA)与SC进行鉴别。(3)MEC:SC与MEC都能产生亲碱性分泌物[8],有必要将两者区别开来。一般情况下,MEC由黏液细胞、中间型细胞和表皮样细胞组成,而SC中没有鳞状细胞和黏液细胞,易于鉴别。然而,囊性结构在低级别MEC病变中也很常见,导致形态学上与SC相似[5],此时需要免疫组化鉴别。MEC免疫组化中S100和mammaglobin阴性,p63阳性,SC与之相反[14]。(4)PLGA,通常发生在小涎腺部位。它同时表达S-100和mammyglobin,缺乏泡状粉红色的细胞质。在PLGA中,结构的广泛变化为其特征,包括小叶、小梁、单层小管、筛孔、乳头和实体型,细胞成条索状或旋涡状排列。与SC需要ETV6来确认诊断[20]。
另外,在不同的病例报道中使用了不同的成像方式,包括超声、CT和MRI。SC在超声上呈低回声,在MRI的T1期呈高信号,同我们的影像学表现相一致。内出血最近被认为是一种能区分SC和AciCC的发现,这也许可以解释为什么我们的病例显示病变T1信号增强。超声引导下的细针穿刺抽吸活检(fine needle aspiration biopsy,FNAB)是一种合适的检查手段,大多数报道的病例包括FNAB[7],超声引导下的FNAB显示丰富、形态一致的涎腺上皮细胞,并伴有轻微的细胞异型性,以及可能存在的轻度核膜不规则和小到突出的核仁。FNAB表现为具有乳头状特征的上皮性低度涎腺肿瘤[4,7,12]。但并非所有的FNAB检查结果都能提供准确的诊断[24]。由于SC与其他涎腺肿瘤相似,有时很难用FNAB鉴别。即便如此,细胞学特征仍有助于我们考虑这一实体。
SC通常进展缓慢,其治疗常遵循低级别恶性涎腺肿瘤的治疗方法,包括对局部侵袭性较小的疾病进行全外科切除[25]。大多数患者在手术切除后预后良好,随访期间无远处转移。而对于存在高度转化的SC,常在颈清扫的基础上进行根治性手术,然后进行辅助放疗[24]。但是目前还没有关于颈清扫的标准临床指征文献[13]。随着分子技术的发展,基因靶向治疗显示出巨大的治疗潜力。恩曲替尼是种很有前途的口服制剂,为酪氨酸激酶抑制剂,Drilon等[26]报道了1例女性SC患者,她接受了恩曲替尼治疗。在最初影像资料中,可以观察到患者肿物缩小。遗憾的是,她对该药产生了耐药性。尽管如此,本研究仍为后续靶向药物干预的研究提供了依据[26]。
SC是一种低度恶性涎腺肿瘤,近几十年来,由于SC的罕见性以及与涎腺类肿瘤组织学的相似性,尚未有明确的诊断标准。现今根据其典型的形态学、免疫组织化学,以及独特的分子学特征,降低了其诊断难度。但由于目前的病例较少,其确切特征、治疗结果及预后尚有争议。本报道旨在提高对这一诊断的认识,为头颈部肿瘤的进一步完善以及制定标准化的治疗方案提供绵薄之力。
