五大连池新期火山熔岩台地4种乔木植物化学计量及其内稳性特征
2022-09-26黄庆阳徐明怡谢立红曹宏杰
沙 刚,黄庆阳,徐明怡,2,谢立红,杨 帆,曹宏杰,2
(1.黑龙江省科学院 自然与生态研究所,黑龙江 哈尔滨 150040;2.湿地与生态保育国家地方联合工程实验室,黑龙江 哈尔滨 150040)
生态化学计量学是探讨生物养分需求、盈亏状况、利用效率、内稳态特征以及养分限制等的重要手段[1],在探讨生态系统交互过程中多种化学元素以及能量平衡过程中用以解释环境特征与生物适应性的耦合关系[2-3]。生物体的C、N、P化学计量特征与其自身的稳定性、生物地球化学循环密切相关[4]。内稳性理论是构成生态化学计量学的核心概念之一[5],内稳性特征反映生物对环境变化的生理和生化适应[1,6],并且与物种生态适应性策略有关[7]。植物叶片N、P养分再吸收以及根系对养分的释放与吸收是植物体营养元素内稳性的重要调节手段[8]。由于生态化学计量内稳性是一个可以定量计算的参数,内稳性指数(H)可直接表征维管束植物的内稳性特征[9-11]。研究表明,内稳性不同的植物对外界环境的适应策略存在差异,在养分贫瘠的环境中内稳性较强的植物通过缓慢生长维持机体健康,内稳性较低的植物则通过调节机体养分含量来适应多变的环境[5]。同时,由于影响植物内稳性特征的因素具有多重性和不确定性,不同的生态系统类型、不同植物群落类型之间存在巨大差异,导致已有研究中植物内稳性的环境响应特征存在显著差异[12]。目前,高等植物N、P含量内稳性方面的研究相对较少[9,12],尤其是在一些特殊的生态系统和植物群落,如火山熔岩台地原生演替过程中的变化特征等亟待研究。
五大连池火山自然保护区位于黑龙江省黑河市西南部,地处小兴安岭西南山麓与松嫩平原的过渡地带,由不同喷发时期的14座火山组成,是我国保存最为完好的内陆单成因火山群[13]。老黑山熔岩台地喷发形成时间距今只有300余年(1719—2021年),灼热的喷发物破坏、覆盖原有土壤层,由于熔岩风化速度缓慢,还未形成明显的土壤层次,地表以大面积块状火山熔岩、火山砾、火山渣和火山灰为主。熔岩台地微地形复杂,保水能力不足,营养物质缺乏,尤其是氮缺乏,不能为植物生长提供充足的养分,造成植被演替缓慢[14],植被更新演替及生物地球化学循环都发生了改变[15]。近年来,国内一些学者对该区域植被演替、物种组成、植物多样性、植物功能性状及环境适应[16-19]等方面做了大量研究,而对植物化学计量特征以及内稳性等方面的研究尚未涉及,优势物种的养分限制规律、养分再吸收特征以及植被原生演替过程中植物的适应策略如何还缺乏足够的认识。
白桦Betula platyphylla、香杨Populus koreana、山杨Populus davidiana和落叶松Larix gmelinii是五大连池火山熔岩台地植被生态系统中重要的先锋种和建群种,在营养物质贫瘠的新期火山熔岩台地植被原生演替过程、环境塑造和植被生态系统发育中具有重要作用。开展营养物质贫瘠区植被原生演替过程中植物营养元素化学计量及其内稳性特征研究,探讨原生演替过程中植物的适应策略,为新期火山熔岩台地植物与环境因子的协同进化关系研究及养分贫瘠环境植被恢复提供参考。
1 研究地概况与研究方法
1.1 研究地概况
研究地点设在黑龙江黑河国家森林生态系统定位观测研究站(图1),位于黑龙江省黑河市西南部五大连池火山自然保护区内,地处小兴安岭西南山麓与松嫩平原的过渡地带(126°00′~126°45′E,48°30′~48°50′N)。该地属于温带大陆性季风气候区,冬季严寒漫长,夏季凉爽短促。年平均气温-0.5℃,无霜期为121 d,年平均降水量476.33 mm,多年平均相对湿度69.2%。五大连池老黑山熔岩台地面积约65 km2,喷发于300年前,以大面积块状火山熔岩、火山砾、火山渣和火山灰为主,熔岩风化速度缓慢,尚未形成明显的土壤层,水分不足,营养物质匮乏,植被演替缓慢,受周边环境影响,镶嵌分布有处于不同演替阶段的植物群落:地衣-苔藓群落、草本植物群落、灌木群落、矮曲林群落及针阔混交林群落等,其中乔木物种以白桦、香杨、山杨和兴安落叶松为主。
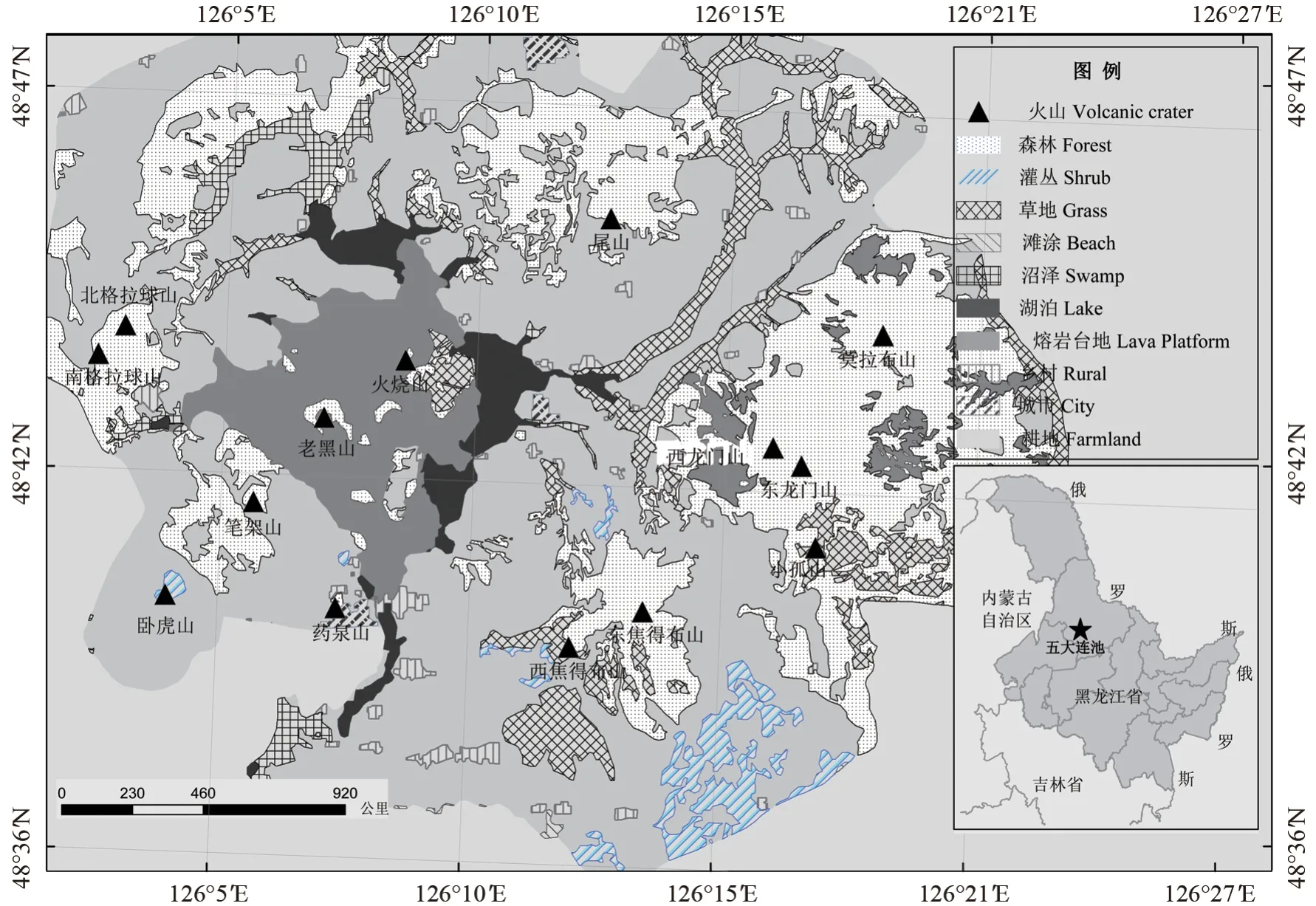
图1 研究区位置及其概况Fig.1 Location and basic information of the test sites
1.2 研究方法
1.2.1 样品采集和分析方法
2020年8月12—15日在老黑山(图1)熔岩台地上进行样地选择和样品采集,依据凯勒尔生活型分类标准选取落叶松(针叶木本型)和白桦、香杨、山杨(阔叶木本型)2个生活型4种乔木植物。选择单个物种集中分布的群落为研究样地,每个样地面积约400 m2。在每个样地内选择健康、生长状态相对一致的植株进行样品采集并进行标记,每种植物各选择10株,在每株植物的东、南、西和北4个方向采集植物粗根(直径大于3 cm)、细根(直径小于0.5 cm)、粗枝(直径大于3 cm)、细枝(直径小于0.5 cm)和叶。植物根系用铁锹去除表层土壤后,沿根系走向不断向外延伸3 m左右,利用枝剪截取3段粗根,每根10 cm左右,采集粗根同时采集连接在粗根上的细根,至少保证在2个方向上都能采集到根系样品;粗枝、细枝和叶片采集时在4个方向上首先用枝剪剪取粗细在3 cm左右的枝条后,分别收集粗枝、细枝和叶片;植物样品采集质量为每个部位200 g左右,每株植物5个器官样品,4种植物合计200个。采集根系样品时同步采集土壤样品。非根际土壤为距离粗根50 cm左右的土壤,采用多点混合的方式,采样深度为0~20 cm,样品过2 mm孔径的尼龙筛后收集到采样袋内,土壤样品500 g;根际土壤为细根表层附着的土壤,采集过程中,首先将细根从土壤中抽取出来后,用力抖动并摘取固定在根系表层的火山砾,再将根系置于一块1 m2的塑料布上,用毛刷将根系表层的土壤刷落,去除肉眼可见的根系等有机物后收集在采样袋内,土壤样品200 g;合计采集根际和非根际土壤样品80个。9月25日在标记过的植株附近采集新掉落的植物叶片,采集质量为100 g,每种植物采集10个样品,合计40个。植物样品清洗后105℃烘箱内杀青2 h,之后80℃烘干至恒质量。植物样品研磨后过60目筛,用于碳、氮和磷的测定。土壤样品自然风干后,进行土壤养分等指标的测定。
植物和土壤样品碳和氮采用元素分析仪(欧唯特/EA3000,意大利)测定;植物样品磷含量,采用H2SO4-H2O2消煮,钒钼黄显色-分光光度法测定;土壤样品磷含量,采用NaOH熔融,钼锑抗显色-分光光度法测定(赛默飞世尔/Evolution 300,美国);铵态氮(Ammonium nitrogen,NH4+-N)、硝态氮(Nitrate nitrogen,NO3--N)采用流动分析仪测定(SKALAR SAN++,荷兰);有效磷(Available phosphorus,AP)采用钼锑抗比色法测定(赛默飞世尔/Evolution 300,美国)。
1.2.2 数据处理
利用Excel 2017软件对试验测定获取的土壤理化指标数据和植物根、茎、叶以及凋落物样品的C、N和P含量数据进行初步处理并计算植物叶片的养分再吸收率,利用SPSS 25.0软件,采用Pearson相关分析方法,分析根际土壤氮、磷含量与植物不同器官对应的氮、磷含量的相关性;采用单因素方差分析(One-Way ANOVA)方法对根际、非根际土壤、不同植物以及各器官之间N、P化学计量等进行差异显著性检验。利用曲线拟合功能计算内稳性指数(H),文中图形输出和内稳性指数计算均利用Origin 2019b软件完成。用公式(1)[20]计算植物叶片的养分(N、P)再吸收率。

式(1)中:RE为养分再吸收率(100%);i分别为氮和磷;F分别为叶的氮含量(g·kg-1)和磷含量(g·kg-1);L分别为凋落叶的氮含量(g·kg-1)和磷含量(g·kg-1)。
内稳性指数(H)采用以下模型进行计算:

式(2)中:Y分别为单株植物器官细根(<0.5 cm)、粗根(>3.0 cm)、细枝(<0.5 cm)、粗枝(>3.0 cm)和叶的氮含量(mg·kg-1)和磷含量(mg·kg-1)以及对应的N∶P;x分别为单株植物下根际土壤的有效氮含量(mg·kg-1)和有效磷含量(mg·kg-1)以及对应的N∶P;c为常数;H为内稳性指数。H的类型依据Persson等确定的数值界定[5]。
2 结果与分析
2.1 植物和土壤中C、N、P含量及其化学计量特征
不同植物不同器官部位碳、氮、磷含量及其化学计量比存在差异。各器官碳含量均值表现为白桦>落叶松>香杨>山杨,细枝和粗枝>叶>细根和粗根(图2A);落叶松氮含量显著高于其他3种植物(P<0.05),4种植物各器官氮含量均值均表现为叶>细枝和粗枝>细根和粗根(图2B);各器官磷含量均值为香杨>白桦>山杨>落叶松,除山杨的细根外,4种植物的叶片磷含量均高于其他部位的磷含量(图2C)。
植物总体C∶N表现为山杨>香杨>白桦>落叶松,山杨、香杨和白桦各器官C∶N表现为粗根>粗枝>细根>细枝>叶,落叶松各器官C∶N最小,除与白桦叶、山杨叶和细根外均存在显著差异(P<0.05)(图2D);落叶松各器官C∶P和N∶P显著高于其他3种植物(P<0.05),植株总体C∶P表现为细枝和粗枝>细根和粗根>叶(图2E),N∶P表现为叶>细枝和粗枝>细根和粗根(图2F)。
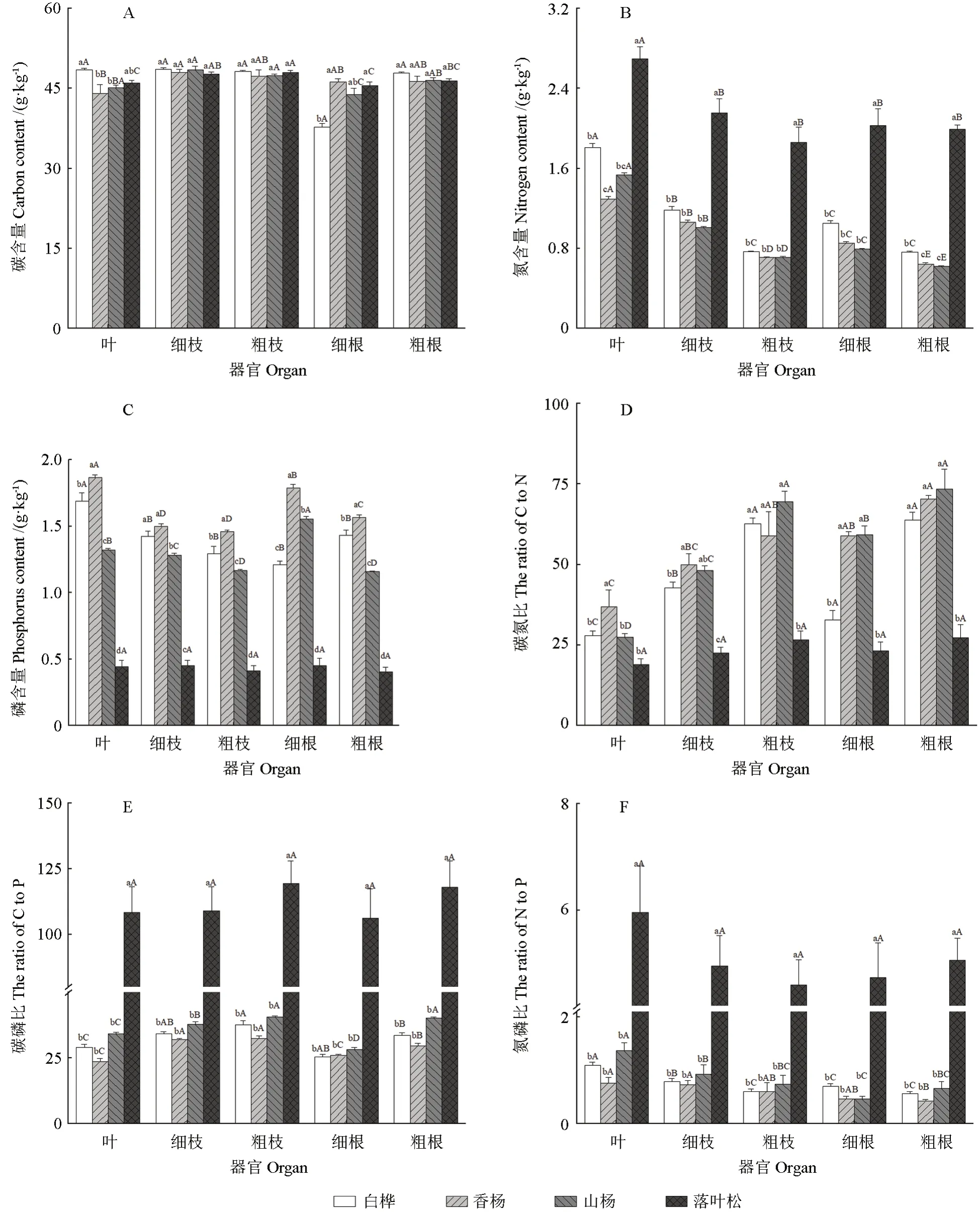
图2 4种树种不同器官碳、氮、磷含量及其化学计量比值(平均值±标准误差)Fig.2 The carbon, nitrogen and phosphorus contents and their ratios of the four plants (mean ± SE)
由表1可知,根际和非根际土壤全碳含量均表现为山杨>落叶松>白桦>香杨,除山杨全氮外,均表现为根际>非根际,白桦土壤碳含量根际和非根际差异显著(P<0.05);土壤全磷含量除落叶松外,均表现为非根际>根际;除山杨全量氮磷比外,均表现为根际>非根际,根际和非根际差异不显著。土壤速效氮含量均表现为非根际>根际,除落叶松外差异均达显著水平(P<0.05);香杨土壤速效磷为非根际>根际,且差异显著(P<0.05);土壤速效氮磷比均表现为非根际>根际,除香杨外差异显著(P<0.05)。
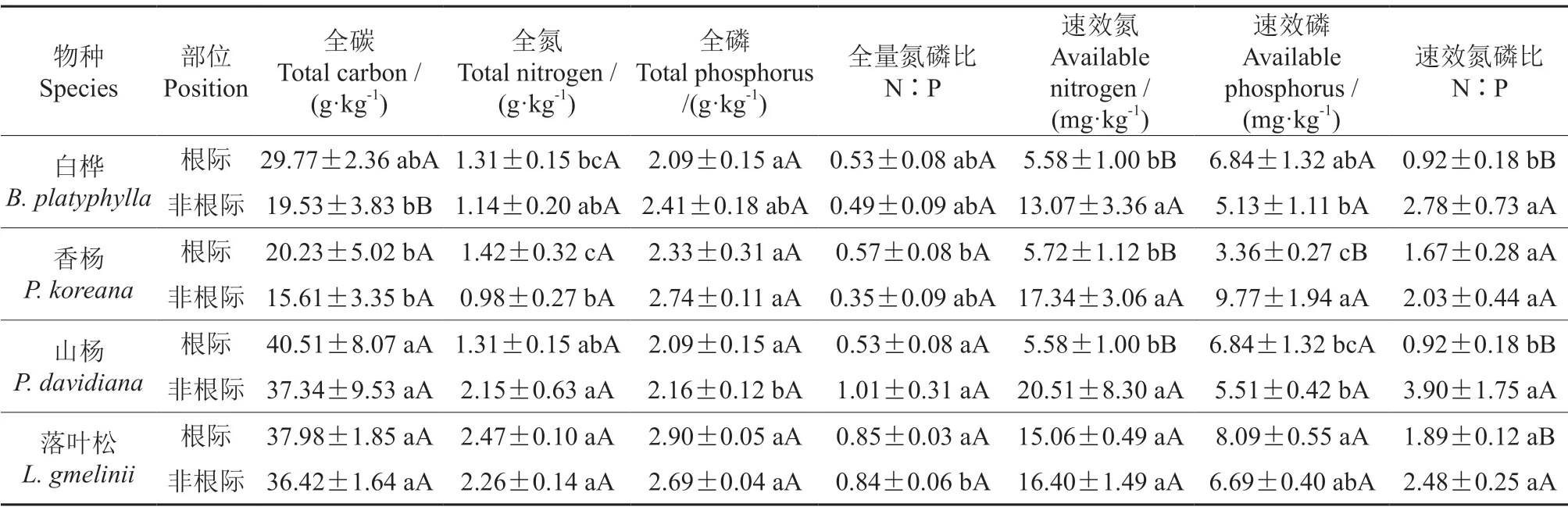
表1 不同植物下土壤碳、氮和磷含量及氮磷比值†Table 1 The content of carbon, nitrogen and phosphorus and the ratio of nitrogen and phosphorus in soil under different plants
由表2可知,白桦和山杨粗枝氮含量与根际土壤氮含量显著正相关(P<0.05),落叶松细根和粗根氮含量与根际土壤氮含量显著负相关(P<0.05);山杨叶和细根氮含量与根际土壤氮含量极显著正相关(P<0.01)。白桦叶片磷含量与根际土壤磷含量显著正相关(P<0.05);白桦细根和香杨细枝、粗根磷含量与根际土壤磷含量极显著正相关(P<0.01),山杨粗根磷含量与根际土壤磷含量极显著负相关(P<0.01)。

表2 4种植物器官部位氮、磷含量与根际土壤氮、磷含量的相关系数†Table 2 The correlation coefficients of the nitrogen (N) and phosphorus (P) concentration between rhizosphere soil and plant organs of four kinds of plants
2.2 植物凋落叶氮和磷含量及再吸收率
4种植物凋落叶的氮含量变化范围为0.85%~1.41%,均值为1.06%,N含量表现为落
叶松>白桦>山杨>香杨,针叶植物与阔叶植物凋落叶N含量差异显著(P<0.05),白桦与香杨凋落叶N含量也存在显著差异(P<0.05);4种植物凋落叶的P含量变化范围为0.31%~0.39%,均值为0.36%,P含量表现为山杨>白桦>香杨>落叶松,阔叶植物与针叶植物凋落叶P含量差异显著(P<0.05,图3A)。
4种植物的N再吸收率变化范围为34.46%~47.35%,均值为40.87%,N再吸收率表现为落叶松>白桦>山杨>香杨;4种植物的P再吸收率变化范围为33.08%~80.19%,均值为66.49%,P再吸收率表现为香杨>白桦>山杨>落叶松,阔叶植物与针叶植物P再吸收率差异显著(P<0.05,图3B)。白桦、香杨和山杨P再吸收率大于N的再吸收率,差异显著(P<0.05);落叶松N再吸收率大于P的再吸收率,差异显著(P<0.05,图3B)。

图3 4种植物凋落叶氮和磷含量及再吸收率Fig.3 The nitrogen and phosphorus contents and resorption rates in litter of the four plant species
2.3 植物叶片的N、P化学计量内稳性
火山熔岩台地不同元素、不同器官部位和不同植物的内稳性指数不同,根据内稳性大小的判定标准,均为稳态型(图4)。N、P和N∶P值的内稳性指数(HN、HP和HN:P)平均值分别为13.82、13.70和15.59,差异不显著(图4A);火山熔岩台地乔木植物叶、细枝、粗枝、细根和粗根的内稳性指数平均值分别为8.75、14.56、22.82、9.20和15.62;粗枝与叶和细根的内稳性指数差异显著(P<0.05,图4B);香杨和山杨的内稳性指数与白桦和落叶松的内稳性指数存在显著差异(P<0.05,图4C)。

图4 不同元素、器官以及植物类型的内稳性指数Fig.4 The homeostatic index (H) of different element, organ and plant types
不同植物的不同器官内稳性存在差异,落叶松不同器官的HN为弱稳态型及弱敏感型,其他3种植物不同器官的内稳性均为稳态型(图5)。4种植物不同器官的HN大小表现为香杨>山杨>白桦>落叶松,香杨和山杨除叶外其他器官的HN均显著高于白桦和落叶松的HN(P<0.05,图5A);4种植物HP的大小表现与HN相同,山杨叶和粗根的HP显著高于其他3种植物,香杨、山杨细枝和粗枝的HP显著高于白桦和落叶松的HP(图5B);香杨、山杨细枝和粗枝的HN∶P显著高于白桦和落叶松的HN∶P(P<0.05),山杨叶、细根和粗根的HN∶P显著高于其他3种植物的HN∶P(P<0.05,图5C)。
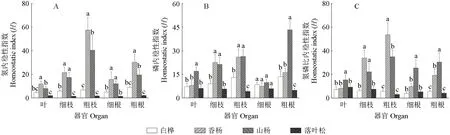
图5 4种植物器官的N、P和N∶P值的内稳性指数(H)Fig.5 The homeostatic index (H) of N, P and N∶P in the four plant organs
火山熔岩台地4种植物叶、细枝、粗枝、细根和粗根的HN分别为6.59、11.54、26.62、8.54和15.20,粗枝HN显著高于叶HN(P<0.05);粗枝HP最大,与叶、细枝和粗根HP差异不显著,但显著高于细根HP(P<0.05);粗枝HN∶P大于其他器官部位的HN∶P,且与叶HN∶P差异显著(P<0.05,图6A)。香杨HN、HP和HN∶P显著高于白桦和落叶松的HN、HP和HN∶P(P<0.05),与山杨HN、HP和HN∶P的差异不显著(图6B)。
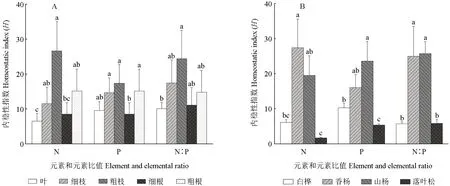
图6 不同器官和植物类型N、P和N∶P值的内稳性指数(H)Fig.6 The homeostatic index (H) of N, P and N∶P in different organs and plants
3 讨 论
3.1 植物器官N、P含量和N∶P以及植物生长养分限制性分析
目前,植物生态化学计量学研究已从关注叶和凋落物向关注植物不同器官的化学计量特征发展[21-22]。树种差异影响叶片等器官的化学计量特征[23-24]。本研究中,2种生活型(针叶型和阔叶型)的4种乔木的不同器官中叶片N、P含量最高,与蔡国俊等[21]和Zhang等[22]的研究结果一致。通常认为,叶片光合产物对维持植物在养分缺乏环境生长具有重要作用,Zhao等[25]和Zhang等[26]的研究表明,在受养分限制的环境条件中代谢功能活跃的器官倾向于获取更多的养分以维持较高的功能活性。因此,植物器官的功能性可能是决定不同植物器官养分分配策略的重要因素。本研究中,落叶松各器官N含量均显著高于其他3种植物,P含量则相反,说明在养分缺乏的火山熔岩台地针叶植物比阔叶植物需要更多的N,阔叶植物比针叶植物需要更多的P来维持其自身的正常生长。植物叶片的养分再吸收率也证明了这一推测。已有研究表明,植物生活型不仅影响不同器官的N、P含量及化学计量特征,在养分限制的情况下对N、P等养分利用效率和分配策略也产生影响[27-28]。
本研究中,叶片N含量低于热带雨林(2.15%)、亚热带常绿阔叶林(1.98%)和内蒙古阿拉善荒漠区主要优势植物(2.49%)的N含量,高于长白山针阔混交林(1.76%)的N含量[2,29-31],与植物叶片N含量随纬度的增加而增加[2,29]的研究结果存在一定差异。可能与所选择的植物物种不同有关,也可能与该区域植物对环境的生态适应策略与上述研究区域不同有关。叶片P含量与Elser等[2]的测定结果接近,但明显大于任书杰等[29]、Han等[30]和Reich等[31]的研究结果。本研究样地土壤磷含量平均值为2.35 g‧kg-1,显著高于我国平均土壤磷含量(0.56 g·kg-1)[32]。研究表明,植物叶片P含量与土壤磷含量之间具有正相关关系[33];同时,植物叶片P含量随纬度升高而升高[8,34],这些可能是火山熔岩台地植物叶片磷含量较高的原因。
植物叶片C∶N和C∶P在一定程度上反映植物对N和P养分的利用效率[35]。本研究中,落叶松C∶N低于香杨、山杨和白桦,C∶P则相反。表明本区域针叶型植物N利用效率低于阔叶型植物,P利用效率则高于阔叶型植物。4种植物C∶N和C∶P平均值分别为27.82±3.66和39.97±19.99。C∶N低于全球温带阔叶林(30.1)[36],高于中国南北样带(23.53)[37]和喀斯特地区植物(23.64、25.21和26.72)[21,38-39];C∶P显著低于全球温带阔叶林(374.7)[36]、中国南北样带(447)[37]和喀斯特地区植物(249.49、516.3和640.19)[21,38-39]。说明本研究区植物对N的利用和分配策略与其他区域无显著差异,而P的利用和分配策略可能与其他区域存在显著差异,土壤中P含量较高可能是导致这一差异的重要原因。植物叶片N∶P作为描述植物生长过程中N和P相对限制的一个指标[40],通常将植物叶片N∶P>16判定为P限制,14~16为N、P共同限制,而<14判定为植物生长受氮限制。本研究中,植物叶片N∶P为0.76~5.96,低于我国区域研究结果,与世界区域的研究结果相近[2,29-31]。本研究区土壤P含量(2.09~2.90 g‧kg-1)高于松嫩平原和黄土丘陵[24,41],且显著高于全国平均水平(0.56 g‧kg-1)[32]。而土壤N含量较低(0.98~2.47 g‧kg-1),属于N缺乏性区域[14],N∶P仅为0.53~1.01,远低于全球平均水平(5.9)和我国平均水平(3.9)[42],鉴于植物叶片N、P含量与土壤N、P含量有一定的相关性[30,41],在利用植物叶片N∶P进行植物养分限制状况评判时应考虑将土壤养分状况同时作为判别因子,因此,综合判断本研究区植物生长可能主要受N限制。
3.2 凋落物养分特征和养分再吸收
本研究中,4种乔木凋落物N再吸收率范围为34.46%~47.35%,P再吸收率为33.08%~80.19%。N再吸收率均明显低于Han等[43]对全球199种木本植物研究以及Tang等[44]对华东172种木本植物研究所得的N再吸收率(分别为57.4%、49.1%),落叶松林P的再吸收率低于二者的研究结果(分别为60.7%、51.0%),而香杨、山杨和白桦的P再吸收率则相反,表明植物生活型影响养分再吸收率。本研究区乔木凋落物养分的N∶P值比长白山次生针阔混交林9种植物凋落物高而C∶P值、C∶N值低[45],C∶N值、C∶P值较喀斯特峰丛洼地顶级植物群落凋落物高而N∶P值相同[46],纬度升高导致区域温度降低的影响可能是造成这种差异的主要原因[31]。
植物叶片的养分再吸收效率可以反映植物对养分循环策略以及对养分匮缺生境的适应能力[47],其强弱与物种的生态策略和适应性有关[48]。凋落物中的养分含量以及C∶N∶P比值与植物再吸收能力存在显著相关性,当土壤N、P养分匮乏情况下,植物会加速N、P等元素循环,通过改变养分利用策略以解决养分供应不足的问题。本研究中,4种乔木植物各器官N、P含量与根际土壤N、P含量的相关性除个别指标外并不明显,因此,养分的再吸收与直接从土壤中吸收养分的作用对维持本研究区植物养分需求可能同样重要[49]。
3.3 植物的内稳性特征
本研究中,4种植物和不同器官N、P含量及其比值的内稳性指数存在一定差异,落叶松不同器官的内稳性指数均显著低于其他3种阔叶植物。研究表明,不同物种的内稳性由于其生长策略不同而存在差异[8],植物种类对养分的选择性吸收特征的不同以及植物各器官的结构和功能差异会导致植物体各器官N和P等营养元素含量特征存在差异[50-51]。4种植物叶片和细根的HN、HP和HN∶P均低于细枝、粗根和粗枝,粗枝和粗根的内稳性高说明植物将更多的养分储存在其中。研究表明,在养分受限的情况下,植物通过控制养分的供给调节叶片的内稳性,通过不同器官的养分分配的权衡以适应营养元素匮缺的生境条件[51]。研究表明,内稳性较强的植物养分利用方式较为保守,对稳定性环境具有较强的适应能力,在贫瘠的环境中也能维持机体的缓慢生长[5]。因此,HN和HP较高的香杨和山杨能够成为火山熔岩台地重要的先锋物种。然而,内稳性指数较低的植物适应性却更强,随着熔岩台地土壤环境条件的逐渐改善,植被恢复改善土壤肥力[52],尤其是氮素的积累[53],环境异质性加大,并且随着种源数量的增加对多变环境适应能力更强的落叶松的分布区域将得到加强,将逐渐替代香杨和山杨而成为优势物种,并将促使该区域植被逐渐向以落叶松为优势物种的该区域顶级植被群落演替。
本研究主要针对4种乔木建群植物在较小的区域内1次采样的分析,植物种类单一,采样频次和范围有限,研究结果具有一定的局限性。为进一步探讨火山熔岩台地这种养分贫瘠环境植被原生演替过程中植物的生态适应过程、养分分配和利用策略以及群落的演替过程,需要扩大植物物种种类和研究范围,并与养分充足环境中相同物种进行比较,同时开展长期的定位监测,明确植物生长周期的生态化学计量特征和区域种群动态以及植物N、P等营养元素的化学计量特征和养分分配、利用策略,为区域植被恢复提供数据支持。
4 结 论
4种树种叶片磷含量均高于其他器官的磷含量;落叶松各器官C∶P和N∶P显著高于其他3种植物(P<0.05),而C∶N低于其他3种植物;不同植物器官部位N、P分配存在不均衡性;凋落物N含量和再吸收率表现为落叶松>白桦>山杨>香杨;凋落物P含量和再吸收率表现为山杨>白桦>香杨>落叶松;植物以提高养分的再吸收率来适应养分贫瘠环境以维持自身生长。
4种植物N、P和N∶P的内稳性指数(HN、HP和HN∶P)平均值分别为13.82、13.70和15.59,落叶松不同器官的HN为弱稳态型及弱敏感型,其他3种植物不同器官部位的内稳性均为稳态型,粗枝与叶的HN、HP和HN∶P存在显著差异。内稳性指数较低的落叶松将逐渐替代内稳性较强的香杨和山杨而成为优势物种。
