基于茉莉酸甲酯与油酸诱导的防御酶变化与粗毛纤孔菌三萜合成
2022-09-26刘东超李德海王占斌
刘东超,扈 博,周 姣,李德海,2,王占斌
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林食品资源利用重点实验室,黑龙江 哈尔滨 150040)
粗毛纤孔菌Inonotus hispidus是一种生长在水曲柳、桑树等落叶树上的寄生真菌,主要分布于我国北温带地区[1]。因该菌含有多糖、黄酮、三萜等生物活性成分,具有降血脂、抗氧化、抑菌等功效,备受人们关注[2]。但野生粗毛纤孔菌资源日益匮乏、人工栽培难度大、生长周期长等问题制约了对粗毛纤孔菌的进一步开发和利用。本实验室前期研究了菌丝体液体发酵培养技术,优化了培养基配方、发酵工艺、诱导剂种类等影响菌丝体生长及三萜含量的因素,建立了稳定的粗毛纤孔菌菌丝悬浮培养体系,可以在不受季节和环境等条件的制约下短时间内获得大量菌丝体及三萜类物质,大幅度降低了粗毛纤孔菌的开发成本[3]。但对于外源诱导子促进粗毛纤孔菌三萜合成的作用机理尚不明确,因此,进一步深入研究提高三萜类化合物合成量的调控机理具有重要的理论和实际意义。
诱导剂是提高次级代谢产物的重要手段,通过刺激生物细胞活化、离子跨膜运输、防御信号合成、茉莉酸(JA)和水杨酸(SA)合成积累等信号转导途径诱导生物体内次生代谢产物的合成[4]。在防御信号转导途径中,活性氧(ROS)分子通过在信号传导机制中充当次级信使来促使超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等生物防御相关酶的基因被激活和表达,从而提高次级代谢产物的合成量[5]。在高温胁迫后加入MeJA可促进白桦细胞三萜类物质的合成与积累,其原因可能是在高温诱导的基础上MeJA激活了防御反应,增强了细胞的耐热性,促进了鲨烯环氧酶(SE)、鲨烯合酶(SS)等三萜合成关键酶基因的表达水平上升[6];添加真菌诱导子可以使青钱柳Cyclocarya paliurus细胞发生氧化应激,激活细胞内源防御信号,促进甲戊二羟酸途径(MVA)上三萜合成相关酶的基因表达上调,提高细胞中三萜类物质的积累量[7];SA既可以通过提高还原型辅酶Ⅱ氧化酶(NADPH氧化酶)的活性来促进胞内ROS的积累,又可以在一定程度上抑制SOD、POD等ROS清除酶的活性来缓解ROS被清除,进而提高次级代谢产物产量[8];油酸可以降低黄曲霉毒素B1对肝细胞损伤的可能原因是通过促进抗氧化酶蛋白HO-1的表达来降低氧化应激水平,从而降低细胞凋亡[9]。然而,对于ROS是如何介导外界胁迫诱导生物体内次级代谢物积累的作用机制目前尚不清楚。
因此,本试验以粗毛纤孔菌为原料,研究在MeJA、油酸及其复配的诱导作用下菌丝体中防御酶变化与三萜类化合物合成量的相关性,为揭示诱导子促进生物体内次生代谢物合成奠定理论基础。
1 材料与方法
1.1 材料与试剂
粗毛纤孔菌菌丝体菌种由东北林业大学食品微生物实验室分离保存。
改良查氏培养基配方:经过研究确定为果糖40.00 g/L,牛肉膏6.20 g/L,磷酸二氢钾1.00 g/L,硫酸镁0.50 g/L。
茉莉酸甲酯(MeJA,采用0.20%的吐温-80助溶),上海源叶生物技术有限公司;油酸,阿拉丁试剂有限公司;果糖,北京奥博星生物技术公司;牛肉膏,北京奥博星生物技术公司;磷酸二氢钾,天津市致远化学试剂有限公司;硫酸镁,天津市化学试剂有限公司;SOD试剂盒、POD试剂盒、CAT试剂盒、H2O2试剂盒、MDA试剂盒,南京建成生物技术有限公司。
1.2 设 备
Erlab M321F超净实验室工作台,法国依拉勃公司;MGC-1500HP人工气候培养箱,玛瑞特MARIT公司;220R微量离心机,德国Hettich MIKRO公司;DDS-307电导率仪,上海精密仪器有限公司;PHS-3E pH计,雷磁上海仪电科学仪器股份有限公司;SJ510C立式压力蒸汽灭菌器,雅马拓公司;PD300-TE进口高剪切匀浆机,英国PRIMA公司;Multitron-Bacteria进口振荡培养箱,瑞士infors公司;UV-1750紫外可见分光光度计,日本岛津公司。
1.3 试验方法
1.3.1 MeJA与油酸诱导粗毛纤孔菌三萜的合成
参照文献[3]并稍作修改,将4℃下斜面保存的粗毛纤孔菌菌种接种于马铃薯葡萄糖培养基(PDA)平板上,28℃培养活化10 d,用接种针截取3片直径为12 mm的菌丝片接种于PDA液体培养基中。将活化后的菌种在无菌环境下使用匀浆机打碎,再以8%(培养基体积分数)的接种量接种于300 mL PDA培养液中,在26℃、125 r/min的条件下震荡培养,一般10 d传代1次,待菌丝体生长稳定后即可使用。
将活化后的菌种以8%(培养基体积分数)的接种量接种于300 mL改良查氏培养基的500 mL锥形瓶中,分别于当天加入3%(培养液体积分数,下同)的油酸(油酸组)、第6天加入50 μmol/L MeJA(MeJA组)和当天加入2%油酸与第6天加入100 μmol/L MeJA(复配组)诱导剂进行诱导培养,以不加诱导剂为对照组。然后分别在培养的第0、2、4、6、8、10天取样进行指标测定,每组试验重复3次。
1.3.2 粗毛纤孔菌总三萜的提取与测定
参照文献[10],准确称取一定量的粗毛纤孔菌菌丝体粉末,置于500 mL圆底烧瓶中,按料液比1∶70的比例加入72%的乙醇,210 W超声提取30 min,4 000 r/min离心10 min得上清液即待测液。
采用香草醛-高氯酸法[11]测定粗毛纤孔菌三萜含量。准确吸取200 μL的待测液置于5 mL容量瓶中,在100℃的水浴锅中蒸干。然后加入200 μL 5%香草醛-冰乙酸(现配现用)和800 μL高氯酸溶液(质量分数为70%~72%,避光)于70℃水浴锅中反应15 min,再经室温放置冷却后,加入乙酸乙酯定容至5 mL,上下摇晃混匀。以不加样品的溶液为空白对照,于波长551 nm处测定吸光值。以齐墩果酸作为标准品,得到标准曲线Y=0.005 2X+0.002 7(R2=0.999 7)。式中:Y为吸光度;X为标准品质量(μg)。计算三萜含量(mg/g),公式如(1)所示。
式中:IHT为粗毛纤孔菌总三萜含量(mg/g);Y为吸光度值;N为提取液的稀释倍数(350倍);m为干样样品的质量(g)。
1.3.3 菌丝体干质量的测定
将液体培养基中菌丝体经3层纱布过滤,用蒸馏水重复洗涤菌丝体数次后在42℃烘箱中烘干,精确称量菌丝体干质量。
1.3.4 pH值、电导率的测定
采用纱布过滤,收集各试验组的粗毛纤孔菌菌丝培养液于10 mL离心管中,经6 000 r/min离心10 min后,取其上清液即待测液。分别使用pH计和电导率仪测定其pH值和电导率值。
1.3.5 过氧化氢含量的测定
H2O2含量是按照南京建成生物有限公司的试剂盒A064-1-1说明书进行测定。准确称取1.00 g粗毛纤孔菌菌丝体鲜样于研钵中,加入9倍体积的生理盐水,在冰水浴条件下充分研磨,使用离心机以10 000 r/min的速度离心10 min,取上清液即待测液。在空白管、标准管、测定管中均加入1 mL 37℃温预后的试剂一,然后分别加入0.1 mL的双蒸水、0.1 mL H2O2标准品应用液、0.1 mL的待测样本,最后均加入1 mL的试剂二,混匀。使用紫外分光光度计测定在405 nm下各试管吸光度值(双蒸水调零)。根据公式(2)计算H2O2含量。
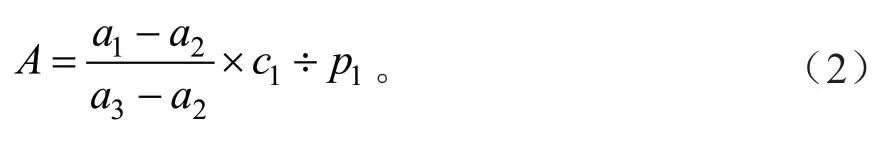
式中:A为H2O2含量(mmol/gprot);a1为测定OD值;a2为对照OD值;a3为标准OD值;c1为标准品浓度(163 mmol/L);p1为待测样本蛋白浓度(gprot/L)。
1.3.6 防御酶活性的测定及分析
1.3.6.1 粗酶的提取
准确称取1.00 g粗毛纤孔菌菌丝体鲜样,加入9倍体积的生理盐水,在冰水浴条件下充分研磨成10%的组织匀浆,2 500 r/min离心10 min,取上清液即酶粗提液,用于酶的活性的测定。
1.3.6.2 SOD活性的测定
SOD含量是按照南京建成生物有限公司的试剂盒A001-1-2说明书进行测定。测定管加入1 mL试剂一应用液、0.05 mL样品、0.1 mL试剂二、0.1 mL试剂三、0.1 mL试剂四应用液,混匀后37℃恒温水浴40 min,然后加入2 mL显色剂,混匀后室温放置10 min。对照组为不加入样品(加入0.05 mL蒸馏水)。使用紫外分光光度计测定在550 nm下各试管吸光度值(蒸馏水调零)。根据公式(3)计算SOD含量。
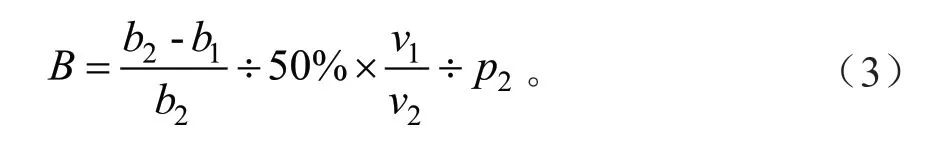
式中:B为SOD活力(U/mgprot);b1为测定OD值;b2为对照OD值;v1为反应液总体积(mL);v2为取样量(mL);p2为待测样本蛋白浓度(gprot/L)。
1.3.6.3 CAT活性的测定
CAT含量是按照南京建成生物有限公司的试剂盒A007-1-1说明书进行测定。用生理盐水将粗酶液稀释到匀浆浓度为0.5%后进行试验。试验组先加入0.05 mL组织匀浆、37℃温热的1 mL试剂一和0.1 mL试剂二,混匀后在37℃下反应60 s,再加入1 mL试剂三和0.1 mL试剂四,混匀。对照组为最后加入0.05 mL组织匀浆。使用紫外分光光度计测定在405 nm下各试管吸光度值(蒸馏水调零)。根据公式(4)计算CAT含量。
柱面坐标系中的三个坐标面分别为:以z轴为中心轴的圆柱面(r为常数),过 z轴的半平面(θ为常数),与 xOy面平行的平面(z为常数).
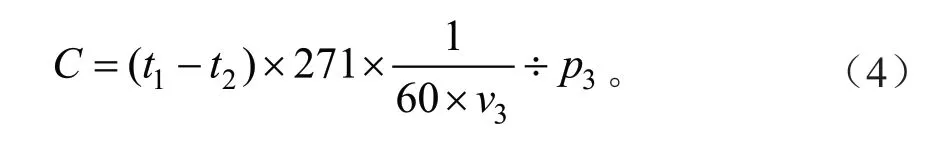
式中:C为CAT活力(U/mgprot);t1为测定OD值;t2为对照OD值;v3为取样量(mL);p3为待测样本蛋白浓度(gprot/L)。
1.3.6.4 POD活性的测定
POD含量是按照南京建成生物有限公司的试剂盒A084-3-1说明书进行测定。试验组加入2.4 mL试剂一、0.3 mL试剂二应用液、0.2 mL试剂三应用液、0.1 mL样品(对照组在加入0.1 mL样品前加入0.2 mL双蒸水),37℃水浴准确反应30 min,加入1 mL试剂四,混匀后3 500 r/min离心10 min,取上清液即待测液。使用紫外分光光度计测定在550 nm下各试管吸光度值(蒸馏水调零)。根据公式(5)计算POD含量。
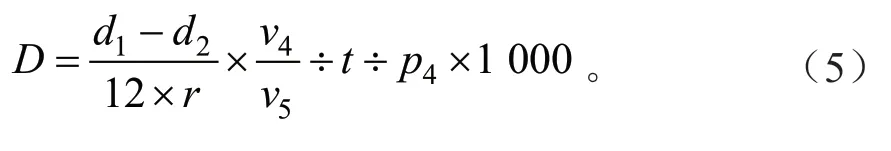
式中:D为POD活力(U/mgprot);d1为测定OD值;d2为对照OD值;r为比色光径(1 cm);v4为反应液总体积(mL);v5为取样量(mL);t为反应时间(30 min);p4为待测样本蛋白浓度(gprot/L)。
1.3.7 丙二醛含量的测定
MDA含量是按照南京建成生物有限公司的试剂盒A003-3-1说明书进行测定。标准管、标准空白管、测定管分别加入0.1 mL标准品、0.1 mL无水乙醇、0.1 mL测试样品,然后均加入0.1 mL试剂一,混匀后均加入3 mL试剂二和1 mL试剂三,再次混匀。试管口用保鲜膜扎紧,然后每个试管扎一个小孔,95℃水浴40 min,然后使用流水冲凉,在4 000 r/min离心10 min。使用紫外分光光度计测定在532 nm下各试管吸光度值(蒸馏水调零)。根据公式(6)计算MDA含量。
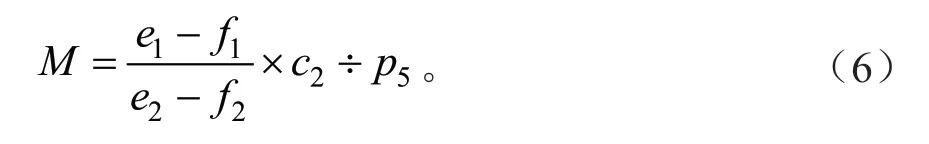
式中:M为MDA含量(nmol/mgprot);e1为测定管OD值;e2为标准管OD值;f1为测定空白管OD值;f2为标准空白管OD值;c2为标准品浓度(10 nmol/mL);p5为待测样本蛋白浓度(gprot/L)。
试验均独立重复3次,试验基础数据统计利用Excel 2019软件进行分析,使用Origin 9.0软件对图表进行处理,显著性分析采用SPSS 20.0软件,以平均值±标准差表示,P<0.05具有显著性差异。
2 结果与分析
2.1 MeJA、油酸处理对粗毛纤孔菌菌丝体质量及三萜含量的影响
诱导子是一类能够促进生物产生一系列防御反应、提高植物防御性次级代谢产物合成的因子。它通过触发活性氧迸发,破坏生物细胞的完整性,提高相关防御酶活性,从而促进次生代谢产物相关合成酶的基因表达,最终提高次生代谢产物产量。MeJA、油酸处理对粗毛纤孔菌菌丝体质量及三萜含量的影响如图1所示。
由图1a可知,各组粗毛纤孔菌菌丝体质量均随着培养时间的增加而增加,且各诱导组菌丝体质量均高于空白组(P<0.05)。在空白组中,培养前4 d菌丝体质量急剧增加,达到7.81 g/L,然后缓慢增加。MeJA组和复配组在第6天再次急剧上升然后缓慢增加,其中复配组在第8天菌丝体质量增幅最大,比同期对照组增加了35.10%。由图1b可知,各组粗毛纤孔菌菌丝体三萜含量均随着培养时间的增加而增加,且各诱导组三萜含量均高于空白组(P<0.05),MeJA组和复配组在第6天再次急剧上升然后缓慢下降,其中复配组在第8天菌丝体三萜含量达到最高值,含量为148.93 mg/g,比同期对照组增加了129.41%。研究发现,当植物受到病原体侵害时,萜类物质的积累可以提高植物对病原体的防御能力[12]。在诱导子提高次级代谢产物合成积累的大量文献中也显示,低浓度的SA、MeJA、一氧化碳(CO)等均能促进三萜、黄酮、多酚等次级代谢产物合成积累,但对动物细胞或其他处理原料的生长起到了抑制作用[13-14]。在本研究中发现,MeJA和油酸不但具有增加次级代谢产物产量的功效,还可以提高菌丝体的生物积累量。为了明确其原因,本试验进一步分析了MeJA与油酸处理对粗毛纤孔菌菌丝体防御生理作用的影响。
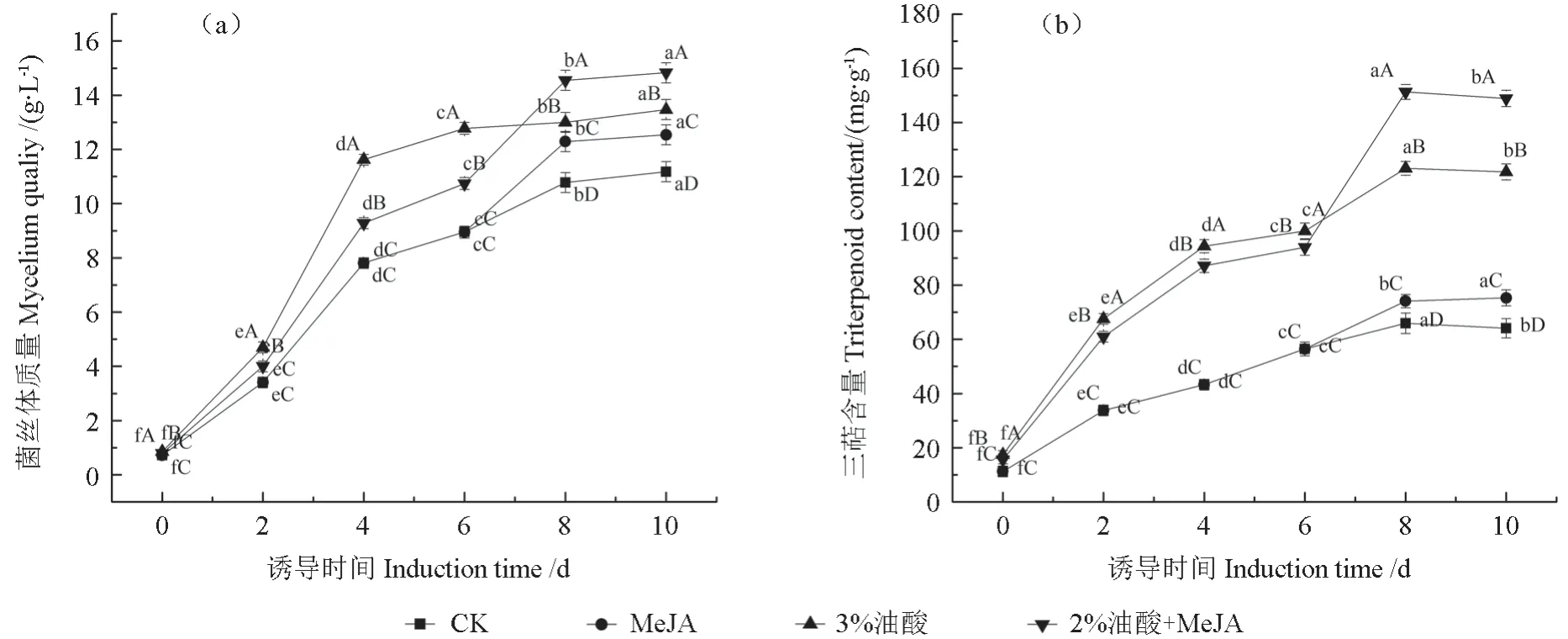
图1 MeJA、油酸处理对粗毛纤孔菌菌丝体质量和三萜含量的影响Fig.1 The effect of MeJA, oleic acid treatment on the quality and triterpene content of I.hispidus mycelia
2.2 MeJA、油酸处理对粗毛纤孔菌菌丝体pH值和电导率的影响
pH值和电导率是生物受逆境胁迫损害程度的重要指标,可以用于鉴定细胞的损坏程度。诱导剂的添加可增加培养液的pH值和电导率值,进而促进活性氧的迸发和提高次生代谢产物的合成。MeJA、油酸作用下粗毛纤孔菌悬浮培养液中pH值和电导率值的变化如图2所示。

图2 MeJA、油酸处理对粗毛纤孔菌菌丝pH值和电导率的影响Fig.2 The effect of MeJA, oleic acid treatment on the pH and conductivity of I.hispidus mycelia
从图2a中可以看出,各组培养液的pH值从整体上均呈现出先升高后下降的趋势,各试验组培养液的pH值均显著高于空白对照组(P<0.05),说明培养液被各诱导子处理后发生了明显的碱化。各组培养液的pH值均在培养前期呈现上升趋势,处理2 d后开始下降,MeJA组和复配组在第6天再次上升然后下降,其中复配组在第8天pH值达到最高值,是对照组的1.15倍。从图2b中可以看出,各处理组培养液的电导率值均显著高于空白对照组(P<0.05),其中空白组呈现一直下降的趋势,油酸组和复配组呈现先升高后下降的趋势,MeJA组在加入MeJA后呈现先上升后下降的趋势,说明培养液被各诱导子处理后粗毛纤孔菌菌丝体细胞膜的通透性变大,且各诱导组培养液的电导率值随着诱导时间的延长与空白对照组的比值逐渐增大。其中复配组在第8天电导率值达到最高,是对照组的1.58倍,而复配组三萜含量也在第8天急剧增加,这可能是因为添加诱导子激活了生物细胞膜的离子泵,使K+/H+发生交换,并伴随着Ca2+的内流和Cl-的外流,促使培养基碱化和细胞质酸化,进而提高次生代谢产物[15]。培养液电导率的升高是病原菌引起生物细胞产生防御反应的一个生理表象,其原因可能是由于细胞坏死导致电解质的释放。因此,本研究发现MeJA和油酸诱导处理粗毛纤孔菌菌丝体增加了细胞膜的通透性。
2.3 MeJA、油酸处理对粗毛纤孔菌菌丝体中过氧化氢含量的影响
H2O2作为一种最稳定的活性氧,可以通过跨膜运输的方式在细胞间进行扩散和代谢,但过高含量的H2O2会破坏生物细胞内的大分子物质,对细胞造成毒害作用,进而抑制生物体及次级代谢产物的合成。MeJA、油酸处理对粗毛纤孔菌菌丝体过氧化氢含量的影响如图3所示。
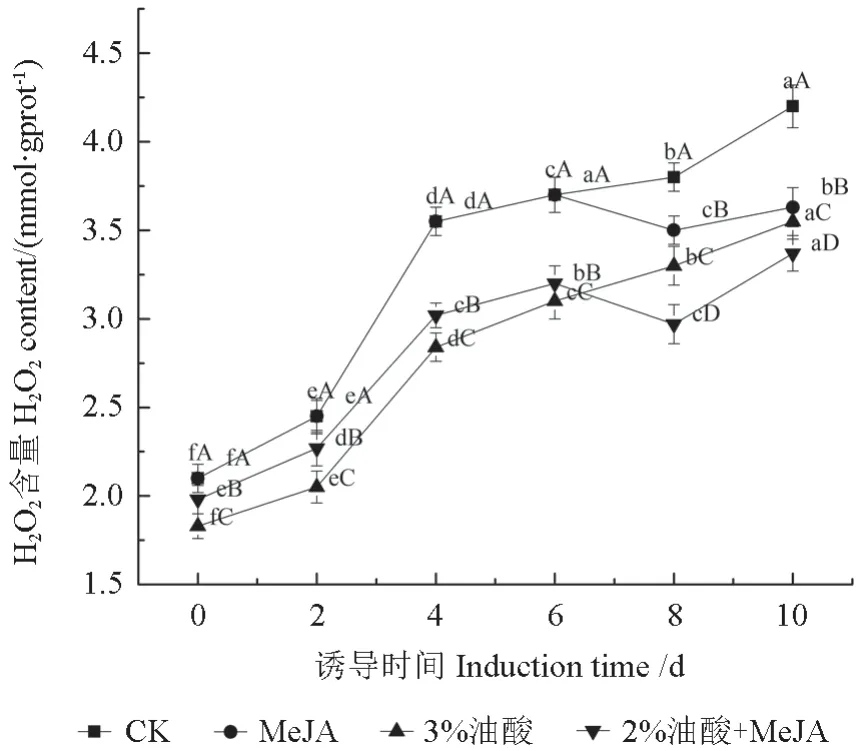
图3 MeJA、油酸处理对粗毛纤孔菌菌丝体过氧化氢含量的影响Fig.3 The effect of MeJA, oleic acid treatment on the content of hydrogen peroxide in I.hispidus mycelia
由图3可知,从总体上看各组中H2O2含量变化均呈现上升趋势,但各试验组H2O2含量均显著低于对照组(P<0.05)。在空白组中,菌丝培养2 d后H2O2含量急剧增加,第4天达到3.55 mmol/gprot,然后趋于平缓。MeJA组和复配组在第6天开始下降然后上升,其中复配组在第8天H2O2含量达到最低值,为2.97 mmol/gprot,比同期对照组低了21.83%。而复配组在第8天三萜增长率最高,这可能是MeJA和油酸协同抑制H2O2产生,从而促进三萜类物质合成。H2O2的迸发是生物细胞在遭受逆境胁迫损害下普遍出现的特征性反应之一,本试验结果表明MeJA、油酸及其复配具有降低H2O2含量的能力。
2.4 MeJA、油酸处理对粗毛纤孔菌菌丝SOD、CAT和POD活性的影响
2.4.1 MeJA、油酸处理对粗毛纤孔菌菌丝体中SOD活性的影响
超氧化物歧化酶(SOD)是一类抗氧化金属酶,普遍存在于植物、动物以及微生物体内几乎所有的细胞中,是生物体内酶类抗氧化保护系统清除活性氧的核心酶。作为植物防御系统中的第一道防御反应,SOD可以将ROS代谢所产生的超氧自由基分解为水和氧气。MeJA、油酸及复配处理后粗毛纤孔菌菌丝体中SOD酶活性的变化如图4所示。
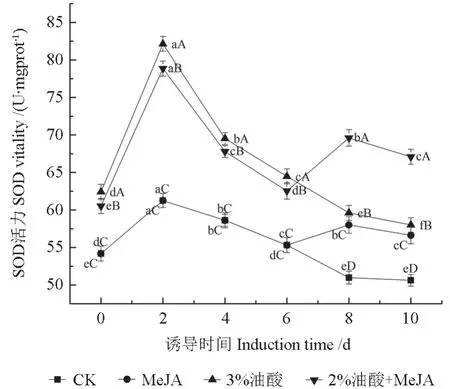
图4 MeJA、油酸处理对粗毛纤孔菌菌丝体中SOD活性的影响Fig.4 The effect of MeJA, oleic acid treatment on the activity of SOD enzyme in I.hispidus mycelia
由图4可知,在经各诱导子处理后,菌丝体中的SOD酶活性显著高于对照组(P<0.05),且各组均在前期呈现上升趋势,处理2 d后开始下降,MeJA组和复配组在第6天再次上升然后下降,其中复配组在第8天SOD酶活性达到最高值,为69.61 U/mgprot,比同期对照组高了36.84%。由此可知,油酸、MeJA及复配具有提高SOD酶活性的能力,这可能是SOD酶对菌丝体内ROS含量升高的一种生理应答,它的活力会随着菌丝体内ROS含量的突增而发生突增。而从第2天开始,各组中SOD酶活力开始下降,这可能是菌丝体为了防止胞内积累过多由SOD催化ROS产生的H2O2的一种调控方式,是菌丝体防止氧化损伤的自我保护性反应之一[16]。由此可知,油酸、MeJA及其复配具有提高SOD酶活性的能力。
2.4.2 MeJA、油酸处理对粗毛纤孔菌菌丝体中CAT活性的影响
过氧化氢酶(CAT)是一种普遍存在于动物、植物和微生物体内末端的氧化还原酶,CAT通过催化H2O2分解为H2O和O2,进而清除生物体内过量的活性氧,可以防止生物组织受到毒害。MeJA、油酸及复配处理后粗毛纤孔菌菌丝体中CAT酶活性的变化如图5所示。

图5 MeJA、油酸处理对粗毛纤孔菌菌丝体CAT活性的影响Fig.5 The effect of MeJA, oleic acid treatment on the activity of CAT enzyme in I.hispidus mycelia
从图5可以看出,在经各诱导子处理后,菌丝体中的CAT酶活性显著高于对照组(P<0.05),且各组均在前期呈现上升趋势,处理4 d后开始下降,MeJA组和复配组在第6天再次上升然后下降,其中复配组在第8天CAT酶活性达到最高值,为37.21 U/mgprot,比同期对照组高了57.29%。CAT酶活力的升高一方面可能是保护细胞免受高浓度H2O2的损害,另一方面可能是通过信号网络促进三萜类化合物的合成[17]。由此可知,油酸、MeJA及其复配具有提高CAT酶活性的能力。
2.4.3 MeJA、油酸处理对粗毛纤孔菌菌丝体中POD活性的影响
POD是生物细胞抵抗各种生物及非生物胁迫的保护酶。它通过调控超氧阴离子和过氧化氢的浓度来参与调控防御反应,进而介导脂质过氧化反应,提高次级代谢产物的产量。MeJA、油酸及复配处理后粗毛纤孔菌菌丝体中POD酶活性的变化如图6所示。
从图6可以看出,在经各诱导子处理后,菌丝体中的POD酶活性显著高于对照组(P<0.05),且各组均在前期呈现上升趋势,处理4 d后开始下降,MeJA组和复配组在第6天再次上升然后下降,其中复配组在第8天POD酶活性达到最高值,为1.66 U/mgprot,比同期对照组高了45.58%。POD和CAT是植物体内两种重要的清除H2O2的氧化还原酶,可以催化H2O2分解,促进次级代谢产物合成[18]。POD的活性变化也可能是对MeJA、油酸所致的氧化应激的一种保护反应。由此可知,油酸、MeJA及复配具有提高POD酶活性的能力。
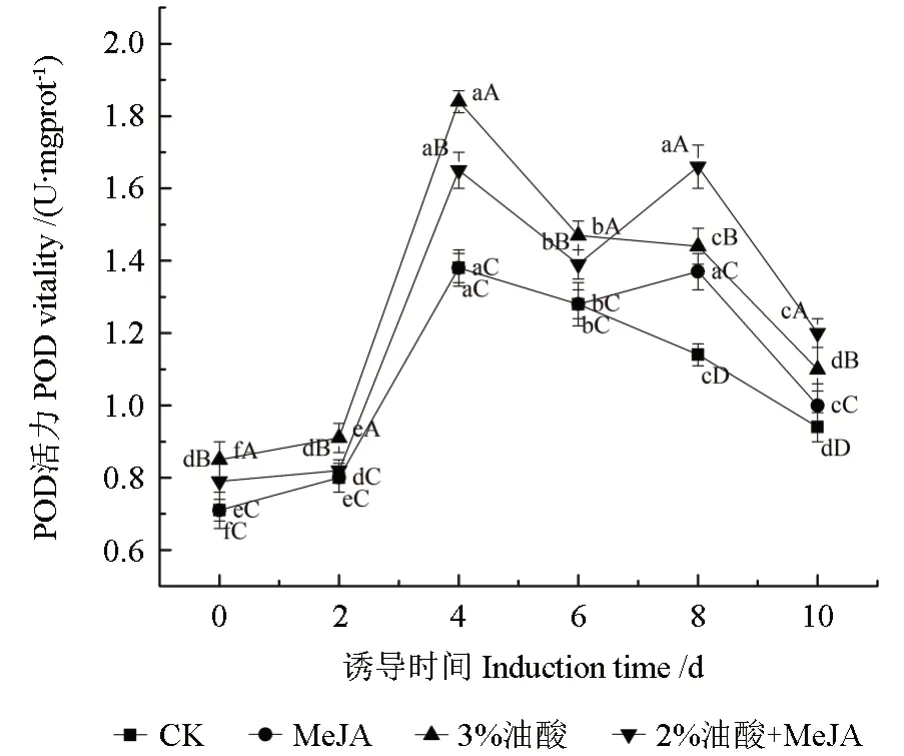
图6 MeJA、油酸处理对粗毛纤孔菌菌丝体POD酶活性的影响Fig.6 The effect of MeJA,oleic acid treatment on the activity of POD enzyme in I.hispidus mycelia
2.5 MeJA、油酸处理对粗毛纤孔菌菌丝体中丙二醛含量的影响
MDA是判定脂质过氧化程度的重要指标,它的含量变化可以反映细胞膜损伤程度和植物对逆境条件反应的强弱。当生物受到逆境胁迫损害时,脂质过氧化会导致氧化性细胞损伤和膜功能障碍,从而抑制生物生长和次级代谢产物合成。MeJA、油酸处理对粗毛纤孔菌菌丝体MDA含量的影响如图7所示。
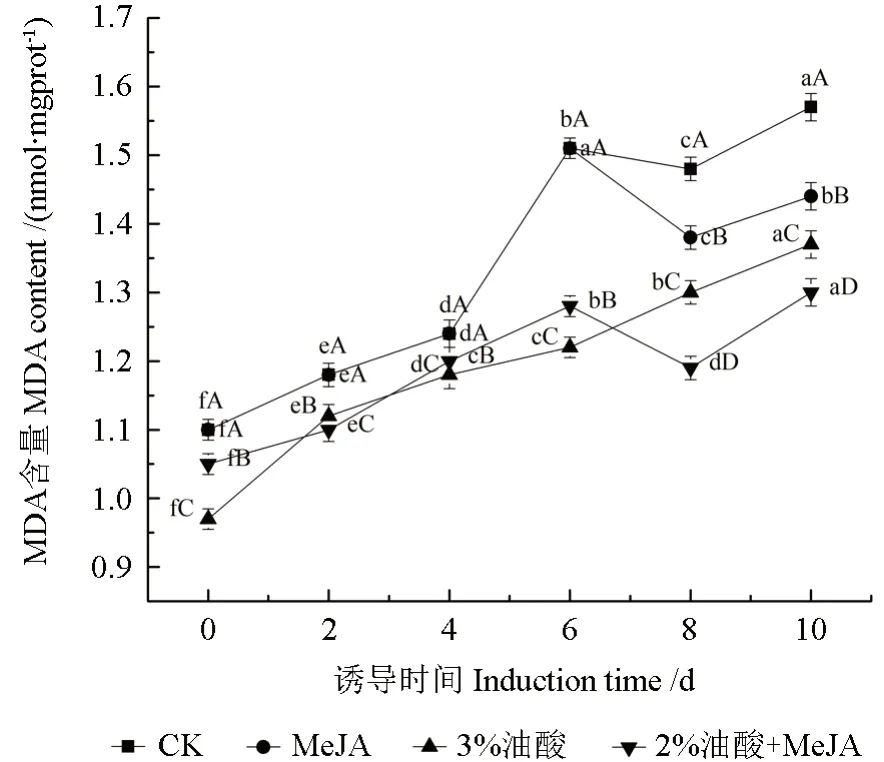
图7 MeJA、油酸处理对粗毛纤孔菌菌丝体MDA含量的影响Fig.7 The effect of MeJA,oleic acid treatment on the MDA content in I.hispidus mycelia
由图7可知,在所有组中,MDA含量随着培养时间的增加而增加,但各诱导组MDA含量均低于空白组(P<0.05)。在空白组中,培养4 d后MDA含量急剧增加,第6天达到1.51 nmol/mgprot,然后缓慢上升。MeJA组和复配组在第6天开始下降然后上升,其中复配组在第8天MDA含量达到最低值,为1.19 nmol/mgprot,比同期对照组低了19.60 %。而复配组在第8天三萜增长率最高,表明经MeJA和油酸处理后粗毛纤孔菌后对MDA的积累有一定抑制作用,从而可以减轻膜质过氧化作用对细胞的伤害,提高菌丝体对病害的抗逆能力,这一结果也与其他诱抗剂作用生物中MDA含量变化相一致[19]。MDA含量的降低与生物对胁迫耐受力的响应增强有关[20]。因此,油酸、MeJA及复配具有降低MDA含量的能力,降低了菌丝体细胞膜脂过氧化水平。
3 讨论与结论
生物在遭受逆境胁迫时,细胞内产生与清除ROS之间的平衡就会遭到破坏,从而造成ROS的过量积累。ROS一方面可以直接杀灭侵染生物的病原体,另一方面还可以作为信号分子直接或间接地激活某些防御基因的表达,从而增加生物细胞内防御性次级代谢产物的积累[21]。有文献报道,H2O2可作为真菌诱导子诱发植物细胞防御反应的主要胞内信使,可以有效地提高白桦细胞中白桦酯醇的合成量[22]。内生真菌能够通过刺激H2O2和一氧化氮(NO)的信号转导通路,从而刺激白术中倍半萜类化合物的合成[23]。但过量的ROS会对机体造成伤害,所以生物体内有一套完整的调节氧化与抗氧化平衡的系统,即当ROS大量积累时,各种抗氧化酶活性也会随之升高[24]。
pH值、电导率、H2O2、丙二醛等是生物遭受生物及非生物损害的重要指标,常被用于鉴定细胞的损坏程度,而SOD、POD及CAT是细胞内清除ROS的3种重要的抗氧化酶[25]。
在本试验中发现,经MeJA和油酸单一及复配处理后的菌丝体的pH值和电导率值显著高于对照组,而H2O2和丙二醛含量显著低于对照组,防御酶活性和三萜含量显著高于对照组。由此可见,诱导剂促使粗毛纤孔菌菌丝体的细胞膜通透性发生了改变,但未对菌丝造成胁迫伤害,其生物积累量未受到抑制。MeJA和油酸处理增加了细胞膜的通透性,但电导率的升高速率滞后于pH值的升高速率,这可能是因为MeJA和油酸诱导先引发了培养液的碱化,然后培养液的碱化引发了氧迸发和脂质过氧化,从而导致离子渗透压升高,表现为电导率的升高[26]。此外,在诱导初期POD活性滞后于SOD、CAT活性升高,SOD活性的升高可能是对ROS中超氧阴离子自由基(O2-·)浓度升高的一种调控措施,是菌丝体防止氧化损伤的自我保护性反应之一。在SOD酶的作用下可以将超氧阴离子歧化生成H2O2,然后POD与CAT将H2O2分解为H2O和O2。研究发现,使用真菌诱导子可以提高红豆杉悬浮培养细胞中紫杉醇(萜类物质)的含量,且POD、CAT和SOD等防御酶的活力也发生了时序性变化[27]。向丹东玄参的培养液中加入MeJA后,细胞内通过产生类黄酮物质增加悬浮细胞对自由基的清除力,从而增强细胞的抗氧化能力[28]。因此,本试验中SOD、POD与CAT酶活的升高可能是机体为了防止ROS引起的细胞损伤和维持细胞内ROS的平衡。MDA是脂质过氧化的最终产物,它反映了机体受氧化损伤的程度。各实验组中MDA含量均低于空白对照组,表明MeJA和油酸通过调节菌丝体内抗氧化酶活性来降低脂质过氧化程度。因此,MeJA和油酸诱导粗毛纤孔菌三萜合成的机理在于其激活了抗氧化防御系统,减少了自由基的积累,降低了膜脂过氧化水平。
外源添加诱导剂是提高次级代谢产物的重要途径之一。研究发现,10 μmol/LCO处理桑黄菌丝4 d时三萜含量的增幅最大,比同期对照增加了29.63%;向培养到第6天的桦褐孔菌中加入50 μmol/L MeJA,其三萜总含量可达到1 082.19 mg/L,比不加诱导剂的空白对照组高了119.96%;对白桦悬浮细胞单独施加外源SA后,总三萜含量在处理后2 h最高,比同期对照增加了17.22%[29-31]。本试验结果发现MeJA和油酸复配组菌丝体含量、三萜含量及防御酶活性等均高于MeJA和油酸组,其中复配组在第8天菌丝体三萜含量达到最高值,为148.93 mg/g,比同期对照组增加了129.41%。其原因可能是油酸在粗毛纤孔菌菌丝体发酵前期作为一种促进菌丝体生长的辅助碳源,而在后期作为诱导子促进三萜合成途径中关键酶的基因表达[32]。MeJA在菌丝体发酵后期不仅作为次级代谢合成中的第二信使,还可以提高菌丝体中活性氧的浓度,刺激相关防御酶的启动,促进三萜合成途径关键酶的表达[33]。不同诱导子诱导的信号通路也存在相互联系,如MeJA和酵母提取物(YE)均可以提高花菱草悬浮细胞中苯并菲啶生物碱含量,但它们所介导苯并菲啶生物碱生物合成途径的阶段不同,MeJA促进了早起代谢物二氢血红素的积累,而YE促进了后续代谢物血红素的转化,且与单一诱导子相比复配组以MeJA、SA、YE顺序处理细胞时细胞内的苯并呋喃吡啶生物碱积累量更多[34]。
本试验初步确定了MeJA和油酸是能够促进粗毛纤孔菌悬浮培养菌丝体中三萜类物质积累的诱导因子,在它们的诱导作用下,粗毛纤孔菌菌丝体发生了氧化应激反应,继而促进菌丝体中三萜类物质的积累。但在本试验中,防御酶干预的MeJA与油酸诱导粗毛纤孔菌三萜合成的作用机制还需深入研究。
