聚多巴胺磁性分子印迹聚合物的制备及其在测定食品中玉米赤酶烯酮上的应用
2022-09-22胡美华刘秀娟万全玉胡贵祥段文丽王歌云
胡美华 ,刘秀娟 ,万全玉 ,胡贵祥 ,段文丽 ,王歌云
(1.南昌师范学院 化学与食品科学学院,南昌 330032;2.传染病预防控制国家重点实验室研究基地,江西省动物源与媒介生物性传染病重点实验室,南昌市疾病预防控制中心,南昌 330038)
玉米赤酶烯酮(ZEN)是由镰刀菌产生的一种真菌毒素,又称F-2毒素,其化学名称为6-(10-羟基-6-氧基碳烯基)-B-二羟基苯甲酸-H-内酯,广泛存在于小麦、玉米、大米等谷物及其制品中[1]。当食用被ZEN 污染的食物后,ZEN 通过食物链在人体内蓄积,易引起生殖发育毒性和免疫毒性,严重威胁人类健康[2]。因此,许多国家和组织将ZEN 在食品中的含量作了限制,如欧盟规定各类谷物及其制品中ZEN 的质量分数为20~400μg·kg-1[3];我国规定谷物及其制品中ZEN 的限量为60μg·kg-1[4]。
近年来,国内外已开发多种测定ZEN 的方法[5-6]。其中,高效液相色谱(HPLC)-荧光检测法因成本低、准确度高、灵敏度高等特点被广泛使用[7]。众所周知,仪器检测前,样品的前处理是非常关键的,不仅能有效去除杂质干扰,还能富集目标物,提高分析结果的灵敏度和准确度。常见的前处理技术包括液-液萃取法[8]、固相萃取法[9]、免疫亲和柱法[10]等。这些方法尽管在某种程度上提高了ZEN 检测的灵敏度和选择性,但液-液萃取和固相萃取在样品的纯化效率和选择性方面不够理想,免疫亲和柱的使用成本较高[11]。因此,有必要开发一种环境友好、选择性高、成本低廉的ZEN 前处理技术,以适合现代绿色化学的要求。
磁性分子印迹聚合物是一种具有特异识别能力的高分子仿生纳米材料[12]。基于以下原因,磁性分子印迹聚合物在样品前处理领域引起了研究者的广泛关注[13]。一是具有超顺磁性,在外加磁场作用下,达到快速分离,提高了分离效率[14];二是具有分子印迹独特性质(选择性高、稳定性好、专一性高)[15]。然而,传统分子印迹聚合物在制备过程中存在一些不足,例如制备步骤繁琐,反应条件苛刻[16],且以目标物作为模板时,易引起模板泄漏造成假阳性现象,增加成本并给操作者带来健康危害等[17-18]。为了有效避免上述缺点,开发一种简单、绿色、快速的分子印迹聚合物的制备方法是有必要的。
槲皮素是一种植物提取物,其结构与ZEN 结构类似(见图1),而毒性和成本相较ZEN 均要低。以槲皮素为模拟模板分子制备的分子印迹聚合物,已成功应用于复杂基质中ZEN 的萃取和富集[19]。多巴胺(DA)是一种天然的生物分子,其结构中含有-OH和-NH2,能够在弱碱性环境下自聚合,形成一种亲水性和生物相容性良好的聚多巴胺膜,可作用于任何材料的表面[20]。利用DA 的这一特性,用于分子印迹聚合物的制备,显著缩减了传统分子印迹聚合物的制备过程。基于二者的特点,本工作以四氧化三铁纳米粒子(Fe3O4NPs)为磁源,槲皮素为模拟模板分子,DA 为功能单体和交联剂,在三羟甲基氨基甲烷(Tris)-HCl缓冲溶液(pH 8.5)中,一步法制备 Fe3O4磁性分子印迹聚合物(Fe3O4@PDA MIPs),并对所得到的Fe3O4@PDA MIPs进行结构表征和吸附性能评价。以ZEN 为研究对象,以Fe3O4@PDA MIPs为固相吸附剂,优化了萃取和富集条件,并结合HPLC,最终实现食品样品中ZEN 含量的测定。
1 试验部分
1.1 仪器与试剂
UltiMate 3000 型高效液相色谱仪;JEM-2100型透射电子显微镜(TEM);WQF-510A 型傅里叶变换红外光谱(FTIR)仪;DP63C 型真空干燥箱;KQ-500DB型超声波清洗器;2-16 KL型离心机;所有玻璃仪器均经体积比为3∶1 的盐酸-硝酸混合液浸泡、水冲洗,并烘干备用。
ZEN 标准储备溶液:1 g·L-1,准确称取1 mg ZEN,用乙腈溶解并定容于1 mL 容量瓶中,混匀,配制成质量浓度为1 g·L-1的ZEN 标准储备溶液,于-20 ℃的冰箱中储存,使用前自然恢复至室温。
ZEN 标准溶液:5 mg·L-1,移取适量的ZEN标准储备溶液置于10 mL容量瓶中,用乙腈稀释至刻度,混匀,配制成质量浓度为5 mg·L-1的ZEN标准溶液,于-20 ℃的冰箱中储存,使用前自然恢复至室温。
ZEN 的纯度为99.5%;黄曲霉毒素B1(AFB1)的纯度大于99%;伏马毒素B1(FB1)溶液,质量浓度为50.5 mg·L-1;赭曲霉毒素A(OTA)的纯度为98.14%;脱氧雪腐镰刀菌烯醇(DON)溶液,质量浓度为100.5 mg·L-1;Tris的纯度大于99.8%;甲醇、乙腈、乙酸均为色谱纯;六水合三氯化铁、无水乙酸钠、乙二醇、多巴胺盐酸盐、槲皮素、盐酸均为分析纯;试验用水为超纯水。
食品样品(大米、玉米、小麦、葡萄酒和食用油)均随机购自某超市。
1.2 色谱条件
色谱条件参照GB/T 5009.209-2016《食品安全国家标准 食品中玉米赤酶烯酮的测定》,并进行了部分改进。具体如下:Eclipse Plus C18色谱柱(150 mm×4.6 mm,3μm);柱温35 ℃;进样体积20μL;荧光检测器,激发波长274 nm,发射波长440 nm;流动相A 为乙腈,B 为水,C 为甲醇;流量1.0 mL·min-1。梯度洗脱程序:0~4 min时,A 由40%升至55%,B 由52%降至37%,保持2 min;6~7 min时,A 由55%降至40%,B 由37%升至52%。
1.3 试验方法
1.3.1 Fe3O4@PDA MIPs的制备
Fe3O4@PDA MIPs的制备参照本课题组前期研究[17],并略作改变。具体步骤如下:称取Fe3O4NPs(本课题组前期已制备)0.2 g于三颈瓶中,加入10 mmol·L-1Tris-HCl缓冲溶液(pH 8.5)80 mL,室温机械搅拌1 h,直至磁性材料均匀分散。随后,滴加含0.8 g·L-1槲皮素(模拟模板分子)的乙腈溶液5 mL,继续搅拌2 h,使槲皮素分子充分与Fe3O4NPs表面接触。接着,加入多巴胺盐酸盐100 mg,再次搅拌6 h后,用磁铁将所得产物与溶液分离。用3%(体积分数,下同)乙酸-20%(体积分数,下同)乙腈混合液洗涤固体产物,直至模拟模板分子不被HPLC 检出(紫外检测波长为374 nm),再用水洗涤5次。最后,得到的Fe3O4@PDA MIPs于45 ℃真空干燥24 h。Fe3O4磁性非分子印迹聚合物(Fe3O4@PDA NIPs)采用相同的条件制备,仅制备过程中不添加模拟模板分子。
1.3.2 吸附性能试验
称取3 mg Fe3O4@PDA MIPs置于10 mL 含不同初始质量浓度(1.0~80.0 mg·L-1)的ZEN 标准溶液中,室温下进行吸附试验。超声萃取5 min后磁分离,上清液用HPLC检测,并根据公式(1)计算Fe3O4@PDA MIPs 对ZEN 的吸附情况。以Langmuir[21]和Freumdlich[22]等温吸附模型评价吸附剂的吸附性能[见公式(2)和(3)],通过数据拟合可分别得到公式(4)和(5)。
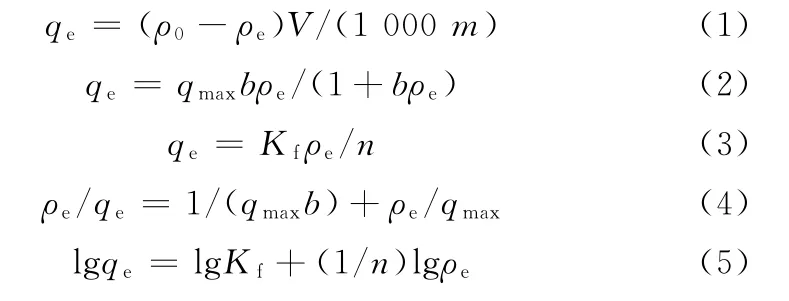
式中:qe为平衡吸附容量,mg·g-1;qmax为最大吸附容量,mg·g-1;ρ0 和ρe 分别表示初始质量浓度和平衡质量浓度,mg·L-1;V为溶液体积,m L;m为吸附剂的质量,g;b、Kf和n表示Langmuir和Freumdlich的常数。
1.3.3 样品分析
1)提取 依据国家标准GB/T 5009.209-2016中方法对样品进行提取,略作改进,具体如下:固体样品称量前需粉碎,液体样品需混匀。称取40.0 g样品于烧杯中,加入体积比为9∶1的乙腈-水的混合液100 mL,超声提取30 min,过滤,备用。
2)萃取和净化 准确移取上述提取液20 mL于顶空瓶中,氮气吹至近干,再分别加入30 mg Fe3O4@PDA MIPs和10 mL 水,室温超声萃取5 min后,在外加磁铁作用下,将磁性分子印迹聚合物从溶液中分离,弃去上清液。在顶空瓶中加入2 mL乙腈解吸2次(每次1 mL),磁铁分离。吸取0.5 mL解吸液于1.5 mL 进样瓶中,加入0.5 mL水,其目的是保证进样溶液与初始流动相接近,混匀,供HPLC测定。
2 结果与讨论
2.1 Fe3 O4@PDA MIPs的制备和表征
试验以槲皮素为模拟模板分子制备磁性分子印迹聚合物,制备过程如图1所示。基于DA 在弱碱性环境下自聚合作用,Fe3O4NPs表面形成一层聚多巴胺薄膜;聚多巴胺结构中-NH2和-OH 官能团和槲皮素结构中-OH 和=O 官能团之间通过非共价键作用,有效地将槲皮素固定在其中;洗脱后,该材料表面形成了与槲皮素在空间构型上相匹配的孔穴和结合位点。利用槲皮素在结构上与ZEN 相似的特点,Fe3O4@PDA MIPs能有效吸附ZEN,达到分离富集的目的。
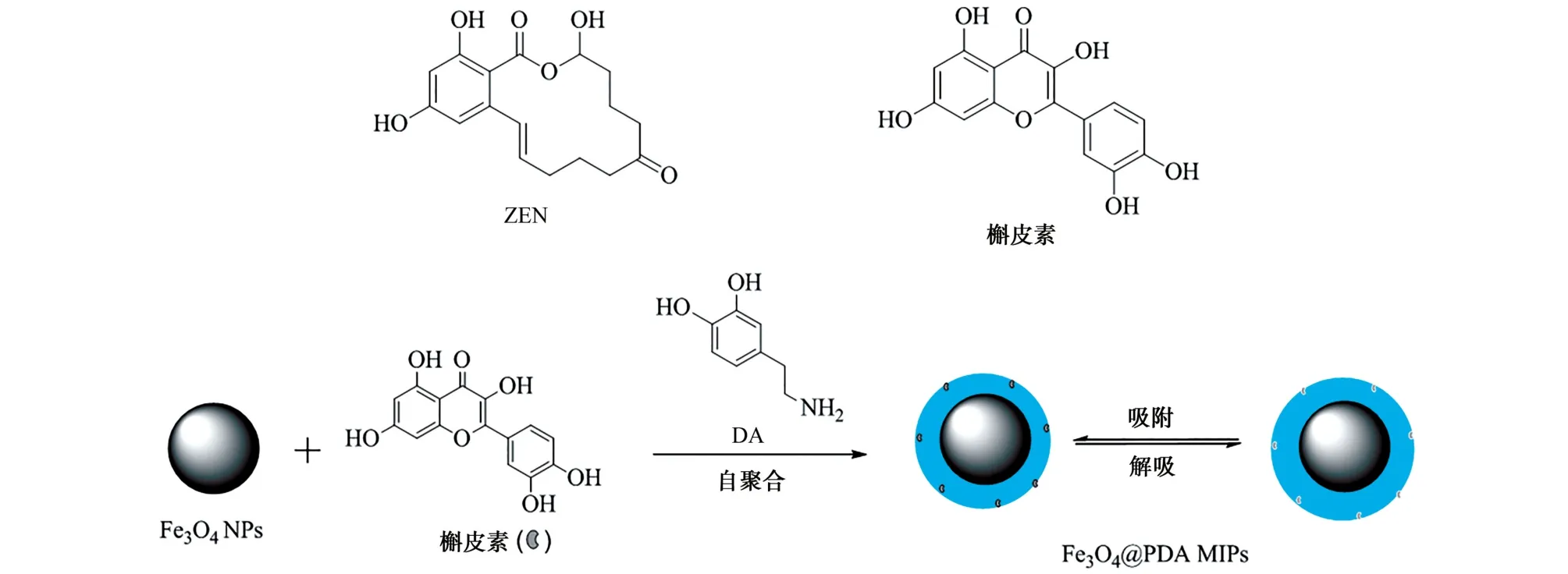
图1 ZEN 和槲皮素的结构以及Fe3 O4@PDA MIPs的制备过程Fig.1 Structures of ZEN and quercetin,and the preparation process of Fe3 O4@PDA MIPs
采用TEM 对Fe3O4NPs 和Fe3O4@PDA MIPs的形貌进行表征,见图2。
由图2可知:Fe3O4NPs的分散性好,形貌为中空结构;在Fe3O4NPs表面明显被一层灰色聚多巴胺包裹[见图2(b)箭头所示],厚度约为13 nm,该数据表明,分子印迹薄层已成功包裹在Fe3O4NPs表面。

图2 Fe3 O4 NPs和Fe3 O4@PDA MIPs的TEM 图Fig.2 TEM images of Fe3 O4 NPs and Fe3 O4@PDA MIPs
通过KBr 压片获得了DA、Fe3O4NPs 和Fe3O4@PDA MIPs的FTIR 图,见图3。
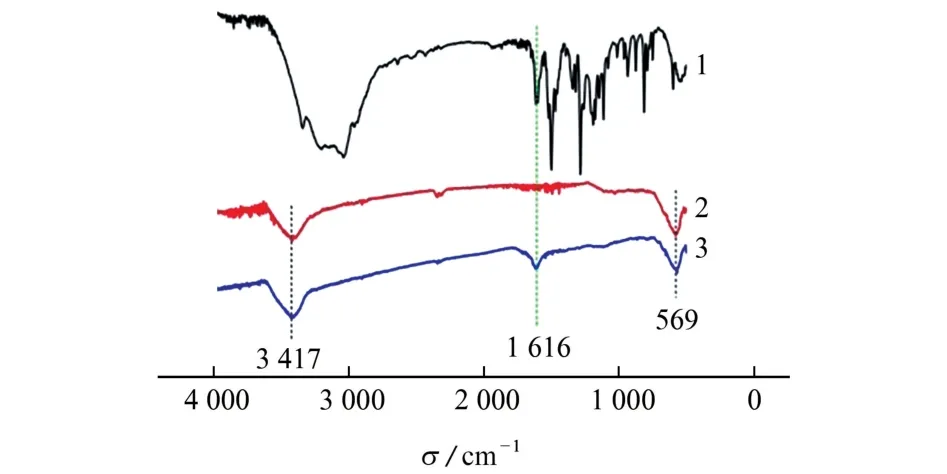
图3 DA、Fe3 O4 NPs和Fe3 O4@PDA MIPs的FTIR 图Fig.3 FTIR spectra of DA,Fe3 O4 NPs and Fe3 O4@PDA MIPs
由图3可知:在聚多巴胺包裹之前,Fe3O4NPs位于3 417 cm-1与569 cm-1处的吸收峰归因于官能团-OH 和Fe-O 的伸缩振动(曲线2);从Fe3O4@PDA MIPs 的红外光谱图来看,在1 616 cm-1处出现的吸收峰归因于DA 芳香环中C=C官能团的伸缩振动(曲线3),这表明在Fe3O4NPs表面包裹着一层聚多巴胺。
2.2 萃取条件的优化
整个优化过程以ZEN 回收率来评价萃取效率,考察了Fe3O4@PDA MIPs用量、溶液酸度、超声萃取时间、解吸溶剂种类和解吸方式等因素对萃取效率的影响。
2.2.1 Fe3O4@PDA MIPs用量
试验考察了Fe3O4@PDA MIPs用量分别为2,5,10,20,30,50 mg时对ZEN 萃取效率的影响。结果表明:当Fe3O4@PDA MIPs的用量从2 mg增大到30 mg时,Fe3O4@PDA MIPs对ZEN 的萃取效率逐渐增大,ZEN 回收率由20.2%增加到82.8%;继续增加Fe3O4@PDA MIPs的用量,ZEN 的回收率无明显变化。因此,试验选择30 mg 作为Fe3O4@PDA MIPs的用量。
2.2.2 溶液酸度
据文献[23]报道,当溶液p H<2时,磁性纳米材料易被分解。因此,试验重点考察了溶液pH 分别为2,3,4,5,6,7,8,9 时Fe3O4@PDA MIPs对ZEN 萃取效率的影响。结果表明:当溶液pH 为2~6时,Fe3O4@PDA MIPs对ZEN 的萃取效率基本保持不变,回收率为82.7%;随着溶液pH 继续增大,Fe3O4@PDA MIPs对ZEN 的萃取效率逐渐下降,甚至降至6.6%(pH 9)。这可能由于溶液p H<6时(ZEN 的pKa为7.6[24]),ZEN 被质子化,使其表面带有正电荷,与PDA 的负电荷通过静电吸引力拉近了与Fe3O4@PDA MIPs材料之间的距离,进而促进了ZEN 在分子印迹孔穴中的吸附。考虑到该分子印迹聚合物在水溶液中原始pH 为5.7,为保证试验操作的方便性,本试验不调节溶液的酸度,即溶液pH 为5.7。
2.2.3 超声萃取时间
超声萃取能有效地将Fe3O4@PDA MIPs快速分散于溶液中,缩短了其与ZEN 分子接触时间,提高了工作效率。为此,试验考察了超声萃取时间在1~20 min内,Fe3O4@PDA MIPs对ZEN 萃取效率的影响。结果表明:当超声萃取时间为1~5 min时,该分子印迹聚合物对ZEN 萃取效率呈现明显增大趋势;当超声萃取时间大于5 min时,萃取效率达到最大值且保持不变(回收率为83.4%)。因此,试验选择5 min作为超声萃取时间。
2.2.4 解吸溶剂种类和解吸方式
试验对比了在甲醇、乙腈、含0.5%(体积分数,下同)乙酸的甲醇溶液和含0.5%乙酸的乙腈溶液等4种溶剂解吸下ZEN 的洗脱效果,结果见图4。
由图4可知,甲醇和含0.5%乙酸的甲醇溶液对ZEN 的解吸效率明显低于乙腈和含0.5%乙酸的乙腈溶液,且酸的加入对解吸效率无明显影响。因此,试验选择乙腈作为解吸溶剂。
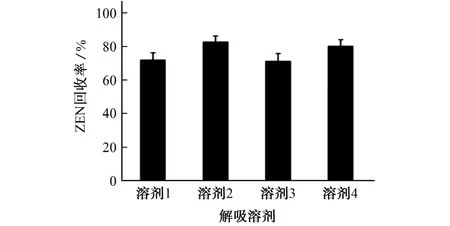
图4 解吸溶剂对ZEN 洗脱效果的影响Fig.4 Effect of desorption solvent on elution effect of ZEN
试验进一步考察了1 mL 乙腈解吸1次、2 mL乙腈解吸1次、2 mL乙腈解吸2次(每次1 mL)等3种解吸方式对ZEN 解吸效率的影响。结果表明,ZEN 的回收率依次为82.8%,83.5%,87.1%,当采用2 mL乙腈解吸2次(每次1 mL)的方式解吸时,能满足对ZEN 解吸效率的要求。因此,试验选择2 mL乙腈解吸2次(每次1 mL)的方式进行解吸。
2.3 Fe3 O4@PDA MIPs的特异性
在吸附材料为30 mg、溶液pH 为5.7、超声萃取时间为5 min、2 mL 乙腈解吸2次(每次1 mL)的解吸方式等优化的试验条件下,试验还考察了Fe3O4@ PDA MIPs、Fe3O4@ PDA NIPs 和Fe3O4NPs对ZEN 的吸附和富集情况。结果表明,Fe3O4@PDA MIPs、Fe3O4@PDA NIPs和Fe3O4NPs对ZEN 的萃取回收率分别为87.1%,53.7%和8.7%,后两种材料的富集能力明显低于Fe3O4@PDA MIPs,可能归因于这两种材料表面未有与ZEN 在空间构型上相匹配的孔穴,仅依靠π-π键和物理作用将ZEN 吸附。不同吸附材料对10μg·L-1ZEN 标准溶液吸附富集后的色谱图见图5。
由图5 可知:相较于直接进样的色谱图,采用Fe3O4@PDA MIPs吸附后的ZEN 的保留时间和峰面积几乎一致;然而,经Fe3O4@PDA NIPs富集后,ZEN 峰面积明显较小;而采用Fe3O4NPs吸附时,没有检出ZEN。这进一 步证明 了Fe3O4@PDA MIPs印迹空腔的形成,展示了对ZEN 的特异性富集。
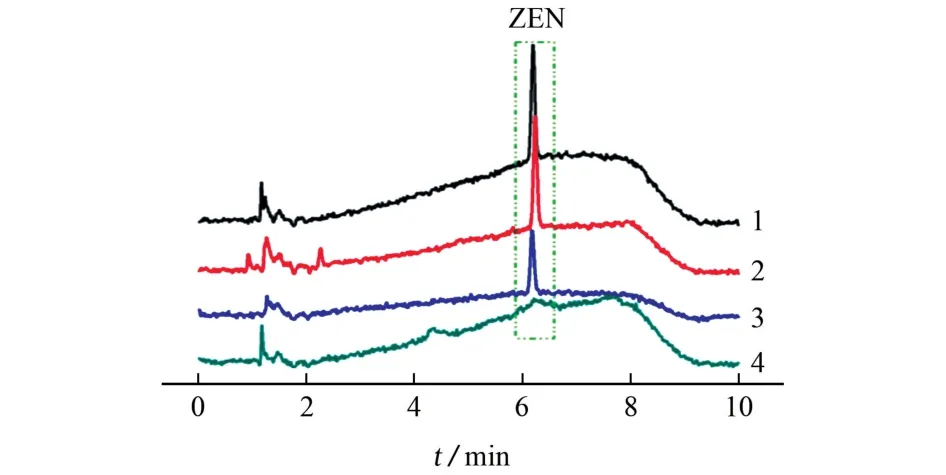
图5 不同吸附材料处理下ZEN 的色谱图Fig.5 Chromatograms of ZEN acquired under the treatment of different adsorbent materials
2.4 Fe3 O4@PDA MIPs的稳定性
为了进一步评价Fe3O4@PDA MIPs的稳定性,将Fe3O4@PDA MIPs连续进行吸附-洗脱-吸附循环试验。每进行下一次吸附前均采取10 mL 解吸溶剂(乙腈)活化2次,每次5 mL。结果显示,该材料在经过7次循环使用后,对ZEN 的吸附能力没有明显下降,回收率稳定在85.1%左右,相对标准偏差(RSD)为1.5%。这说明Fe3O4@PDA MIPs具有良好的稳定性,至少可重复使用7次,节约了试验成本。
2.5 吸附性能
对公式(1)计算的结果作图(图6)可知,随着ZEN 初始质量浓度的增加,Fe3O4@PDA MIPs对ZEN 的平衡吸附容量逐渐增大,且ZEN 初始质量浓度为20 mg·L-1时,该分子印记聚合物对ZEN的吸附达到饱和,得到平衡吸附容量,为1.28 mg·g-1。由公式(4)和(5)分别计 算,25 ℃时,Fe3O4@PDA MIPs对ZEN 的Langmuir等温吸附模型参数为:qmax为1.49mg·g-1,b为0.22 L·mg-1,相关系数R2为0.993 0。Fe3O4@PDA MIPs对ZEN 的Freundlich等温吸附模型参数为:Kf为0.061,n为1.20,相关系数R2仅为0.925 0。这阐明了Fe3O4@PDA MIPs对ZEN 吸附方式符合Langmuir模型,即Fe3O4@PDA MIPs通过单分子层的形态将ZEN 吸附在其表面,且最大吸附容量为1.49 mg·g-1,与试验测定值接近。
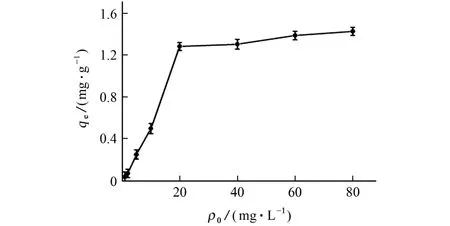
图6 等温吸附曲线Fig.6 Isothermal adsorption curve
2.6 共存物的影响
为了评价试验制备的Fe3O4@PDA MIPs的选择性,选取食品中常见真菌毒素(AFB1、FB1、OTA和DON)为模型,考察了在各共存物存在下,该分子印记聚合物对ZEN 吸附能力的影响。试验规定,测定误差的绝对值小于5%,且萃取回收率大于80%,表示共存物不干扰目标物的检测。试验向5μg·L-1ZEN 标准溶液中分别加入不同质量浓度的上述单一真菌毒素,采用最优试验条件萃取,以HPLC测定。结果显示,150倍(750μg·L-1)的AFB1和DON,200倍(1 000μg·L-1)的FB1和OTA 均不干扰Fe3O4@PDA MIPs对ZEN 的萃取和检测。因此,Fe3O4@PDA MIPs展示出对ZEN 的较高选择性。
2.7 标准曲线和检出限
向顶空瓶中分别加入30 mg Fe3O4@PDA MIPs和10 mL质量浓度分别为1,2,5,10,20μg·L-1的ZEN 标准溶液系列,在优化的试验条件下测定。以ZEN 的质量浓度为横坐标,对应的峰面积为纵坐标,绘制标准曲线,得到线性回归方程为y=4.229×103x-9.464×102,线性范围为1~20μg·L-1,相关系数r为0.999 8。
以3倍信噪比(S/N)计算ZEN 的检出限(3S/N),得到结果为0.68μg·L-1,明显低于国家标准GB/T 5009.209-2016中的检出限(10μg·L-1)。
2.8 精密度和回收试验
按照试验方法分析5种不同基质样品(玉米、大米、小麦、食用油和葡萄酒),结果均未检出ZEN。向上述5种阴性基质样品中添加质量浓度为2,10,16μg·L-1的ZEN 标准溶液,进行加标试验,每个加标水平平行测定5 次,计算回收率和测定值的RSD,结果见表1。
由表1可知,在实际样品中ZEN 的加标回收率为80.1%~101%,RSD 为5.0%~8.6%。这表明以该分子印迹聚合物为固相萃取剂,结合HPLC 对ZEN 的检测结果展现出较为满意的精密度和准确度。
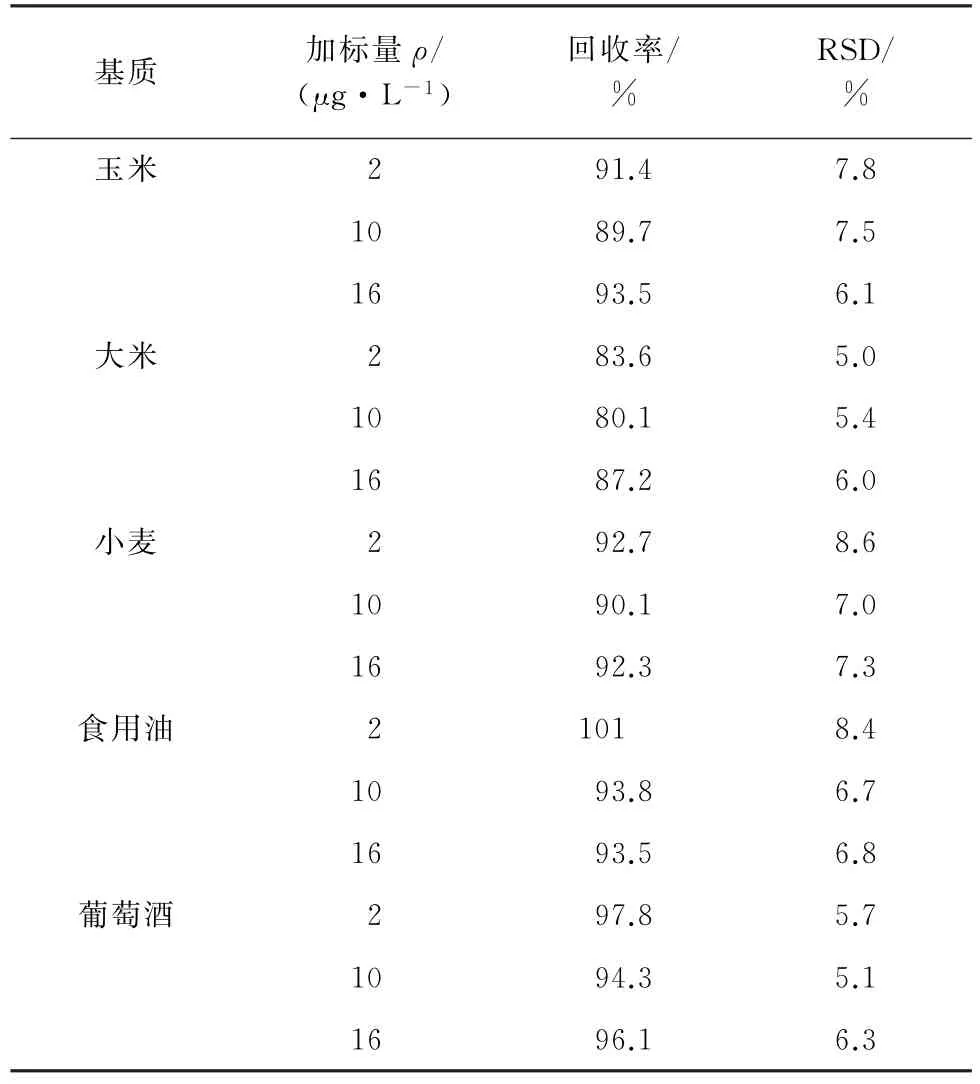
表1 精密度和回收试验结果(n=5)Tab.1 Results of tests for precision and recovery(n=5)
本工作以表面印迹技术为基础,以Fe3O4NPs为磁核,槲皮素为模拟模板分子,DA 为功能单体和交联剂,在室温条件下,一步法制备了磁性分子印迹聚合物。该聚合物表现出以下特征:①超顺磁性,无需离心或过滤操作,就能快速从溶液中分离,节约时间和成本;②高选择性,利用与模拟模板分子在空间构型上相类似的孔穴,准确识别ZEN;③克服了因模板泄露而引起的误差。与传统分离材料相比,基于Fe3O4@PDA MIPs建立的前处理方法具有材料使用量小、富集能力强、选择性高、可重复使用的优点,与HPLC-荧光检测法结合,构建了ZEN的定量分析方法。该方法准确度、精密度和灵敏度均能满足复杂食品样品中ZEN 的检测需求,具有较好的应用前景。
