脊髓背角环磷酸腺苷直接激活的交换蛋白在大鼠炎性痛中的作用
2022-09-22陈彬彬张一肖万海方
陈彬彬 张一肖 王 振 万海方
炎性痛是临床上常见的症状之一,急性炎性痛(1 个月以内的疼痛)往往是保护性疼痛,而慢性炎性痛(持续超过3 个月的疼痛)作为一种病理性疼痛,不仅降低了患者生活质量,也会引起镇痛药物的滥用,甚至引发社会心理问题[1]。因此,有效镇痛尤为重要。环磷酸腺苷(cyclic adenosine monophosphate,cAMP)直接激活的交换蛋白(exchange protein directly activated by cAMP,Epac)在疼痛调节过程中发挥了重要作用[2],可将与Rap 蛋白结合的二磷酸鸟苷(guanosine diphosphate,GDP)置换为三磷酸鸟苷(guanosine triphosphate,GTP),激活Rap 蛋白[3],包括Epac1 和Epac2 两种亚型。其中Epac1 在中枢或外周神经系统、血管内皮细胞等组织中广泛表达[4]。下丘脑室旁核(paraventricular nucleus,PVN)Epac1 蛋白参与了弗氏完全佐剂(Freund's complete adjuvant,CFA)诱导的慢性炎性痛[5],而Epac 蛋白在脊髓水平参与调节炎性痛过程的相关研究较少。脊髓背角是外周伤害性信息传入通路的第一级中转站,也是疼痛信号传递与整合的初级中枢[6]。因此,本研究采用CFA 诱导的大鼠炎性痛模型,探讨脊髓背角Epac 蛋白在炎性痛中的作用。
1 材料与方法
1.1 实验动物 清洁级健康成年雄性SD 大鼠84只,3 月龄,体质量230~250 g,实验动物许可证号:SCXK(鲁)20140007。所有大鼠置于22~24 ℃,昼12 h夜12 h 节律光照中,自由饮水摄食,实验前静养1周。实验过程中对动物的处置符合相关动物伦理学处理标准条例。
1.2 实验试剂及仪器 Epac1 抗体(货号ab21236)和抗Epac2 抗体(货号ab21238)均购自美国Abcam公司;抗GAPDH 抗体(货号AC001)购自美国ABclonal 公司;抗c-Fos 抗体(货号#2250)购自美国Cell Signaling Technology 公司;CFA(货号F5881)购自美国Sigma 公司;8p-CPT-2'-O-Met-cAMP(8p-CPT)(货号4853)购自英国Tocris 公司;热痛敏刺激仪(ⅡTC series 8-309)购自中国医学科学院生物工程研究所;激光共聚焦显微镜(FV1000)购自Olympus。
1.3 实验模型及分组 取20 只大鼠做非模型鼠,余64 只大鼠参照文献[7]的方法建立炎性痛模型。分别在大鼠双侧后爪趾底皮下注射CFA 100 μL(以下称为建模),大鼠双侧后爪出现红、肿等炎症表现,表明模型制备成功。本实验研究中炎性痛大鼠模型均制备成功。将大鼠按随机数字表法分为三组:对照组(C组)、生理盐水组(NS 组)和Epac 激动剂8p-CPT 组(8p-CPT 组),每组12 只。其中C 组为非模型鼠,不做任何处理,NS 组和8p-CPT 组为模型鼠,分别于建模后6 d,鞘内给予NS、Epac 激动剂8p-CPT 10 μL(以下称为给药)。
1.4 Western blot 法 于建模前及建模后1、3、6、9、14 d 检测大鼠Epac1、Epac2 蛋白含量,每个时间点检测4 只,共24 只。将大鼠予10%水合氯醛麻醉后,取大鼠腰膨大L4-6脊髓,放入预冷的裂解液中,于冰上充分匀浆,每个样本匀浆3 次,每次10 s,间隔5 s冷却,离心15 min 后吸取上层清液,采用二喹啉甲酸(bicinchoninic acid,BCA)法行样本蛋白浓度测定,配平后加入上样缓冲液,放入沸水中促使蛋白变性。10% SDS-PAGE 电泳分离目标蛋白(Epac1、Epac2和GAPDH),湿转至PVDF 膜,5%脱脂牛奶封闭2 h后分别加入1∶1000 稀释后的一抗,4 ℃孵育过夜,复温后分别加入碱性磷酸酶标记的1∶1000 稀释后的二抗,避光孵育2 h,洗涤后显色,采用Image J 软件分析图像。
1.5 免疫荧光法 于建模前及建模后1、3、6、9、14 d检测大鼠脊髓背角Epac1 阳性细胞数,每个时间点检测4 只,共24 只;于给药后1 h 检测三组大鼠(C组、NS 组和8p-CPT 组)脊髓背角c-Fos 阳性细胞数,每组检测4 只,共12 只。予10%水合氯醛麻醉大鼠后,给予4%多聚甲醛充分灌注,取腰膨大L4-6脊髓,固定4~6 h 后放入30%蔗糖溶液中脱水,待样本组织块沉底后进行冰冻冠状连续切片。磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤样本切片后加入抗Epac1 抗体(1∶200)或抗c-Fos 抗体(1∶200),4 ℃孵育过夜,Tris 缓冲盐溶液(Tris buffered saline,TBS)洗涤后加入相应二抗,避光常温孵育2 h,再次洗涤后贴片、甘油封片,激光共聚焦显微镜下观察拍片。采用mage-Pro Plus 软件分析计算脊髓背角Epac1 或c-Fos 阳性细胞数。
1.6 热刺激缩足潜伏期(thermal withdrawal latency,TWL)检测法 于建模前1 h、给药前1 h 及给药后30 min、1 h、2 h、3 h 检测三组大鼠TWL,每组检测8 只,共24 只。参照Hargreaves 法,将大鼠放置在厚3 mm、长15 cm、宽15 cm 的有机玻璃箱中,并在同一时段、室温、湿度下检测TWL。采用热痛敏刺激仪通过恒定的光源刺激强度照射大鼠左后肢足底后外侧部。记录从照射开始到大鼠出现抬腿回避动作之间的时间,每只大鼠连续测定5 次,测量间隔3 min,取其中较平稳3 次的平均值作为大鼠TWL。为防止组织损伤,设置自动切断时间为25 s。
1.7 统计学方法 应用SPSS 16.0 统计软件进行数据分析。正态分布的计量资料以均数±标准差()表示,多组均数比较采用单因素方差分析,两两比较采用SNK 检验,组间均数比较采用双因素重复测量方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 不同时间点Epac1、Epac2 相对含量和Epac1 阳性细胞数比较 建模后3、6 d 腰膨大脊髓Epacl 蛋白含量均明显低于建模前和建模后1 d(P<0.05)。不同时间点Epac2 蛋白含量差异均无统计学意义(P>0.05)。建模后3、6、9、14 d 脊髓背角Epac1 阳性细胞数明显低于建模前(P<0.05),建模后3、6、9 d 脊髓背角Epac1 阳性细胞数明显低于建模后1 d(P<0.05)。见表1。
表1 不同时间点Epac1、Epac2 相对含量和Epac1 阳性细胞数比较()
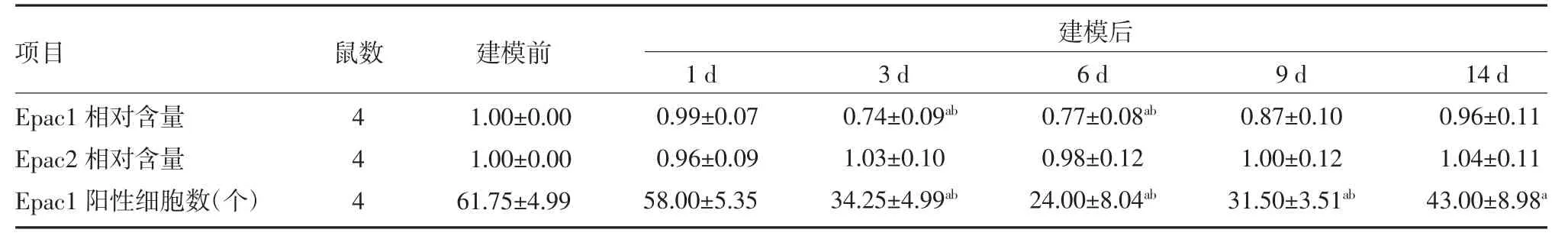
表1 不同时间点Epac1、Epac2 相对含量和Epac1 阳性细胞数比较()
注:Epac 为环磷酸腺苷直接激活的交换蛋白;与建模前比较,aP<0.05;与建模后1 d 比较,bP<0.05
2.2 三组大鼠不同时间点TWL 比较 给药前1 h及给药后30 min、1 h、2 h、3 h NS 组和8p-CPT 组TWL 均明显低于C 组(P 均<0.05),给药后30 min、1 h 和2 h 8p-CPT 组TWL 均明显高于NS 组(P 均<0.05)。见表2。
表2 三组大鼠不同时间点TWL 比较(s,)

表2 三组大鼠不同时间点TWL 比较(s,)
注:C 组不做任何处理;NS 组于建模后鞘内给予生理盐水;8p-CPT 组于建模后鞘内给予8p-CPT-2'-O-Met-cAMP;TWL 为热刺激缩足潜伏期;与C 组同期比较,aP<0.05;与NS 组同期比较,bP<0.05
2.3 三组大鼠脊髓背角c-Fos 阳性细胞数比较 给药后1 h NS 组和8p-CPT 组脊髓背角c-Fos 阳性细胞数明显高于C 组(P<0.05),8p-CPT 组脊髓背角c-Fos 阳性细胞数明显低于NS 组(P<0.05)。见表3。
表3 三组大鼠脊髓背角c-Fos 阳性细胞数比较(个,)

表3 三组大鼠脊髓背角c-Fos 阳性细胞数比较(个,)
注:C 组不做任何处理;NS 组于建模后鞘内给予生理盐水;8p-CPT 组于建模后鞘内给予8p-CPT-2'-O-Met-cAMP;与C 组比较,aP<0.05;与NS 组比较,bP<0.05
3 讨论
Epac 蛋白和蛋白激酶A(protein kinase A,PKA)均为cAMP 下游信号分子,介导多种cAMP 效应,在神经元兴奋性[8]、神经递质释放[9]、突触传递[10]等方面发挥了重要作用。在外周初级感觉神经元水平,PKA蛋白在炎性痛急性期发挥调节作用,而PKA 和Epac蛋白共同参与介导了慢性疼痛过程,通过对胞内活化的Epac 蛋白有效抑制,可以缓解慢性炎性痛反应[11]。
本研究结果显示,建模后1 d(炎性痛急性期),L4-6脊髓Epac 蛋白含量和脊髓背角Epac1 阳性细胞数均无明显变化;建模后3 d(炎性痛亚急性期)腰膨大脊髓Epac1 蛋白含量和脊髓背角Epac1 阳性细胞数均明显降低,并于建模后6 d(炎性痛慢性期)达到最低值,因此,考虑在此时进行药物干预治疗效果最佳。建模后6 d,脊髓Epac2 蛋白表达无明显变化,提示参与促进CFA 引起的慢性炎性痛过程的蛋白为Epac1 蛋白而非Epac2 蛋白。本实验研究选择于建模后6 d 进一步通过鞘内注射给予Epac 激动剂8p-CPT 进行药理学干预,结果显示,8p-CPT 可以明显减轻CFA 诱发的慢性炎性热痛敏反应,与鞘内注射NS 前1 h 比较,给药后30 min、1 h、2 h 和3 h 炎性热痛敏反应均无明显变化,表明鞘内注射NS 对实验结果无明显影响。给药后1 h 药效最强,此时进行脊髓背角神经元活化标记物c-Fos 阳性细胞数检测,提示8p-CPT 的镇痛作用可能与其引起的脊髓背角神经元兴奋性降低、抑制痛信号传导有关,这也与前期研究下丘脑室旁核内Epac1 通路下调引起慢性炎性痛过程的结果相一致[5],但与Singhmar 等[11]研究表明的外周感觉神经元中Epac1 蛋白上调引起慢性炎性痛过程的结果相反,这可能与外周和中枢在慢性炎性痛调节过程中发挥的不同作用有关。
在外周炎症反应持续刺激下,伤害性感受器敏感性增加,痛觉神经兴奋阈值降低,产生的异常动作电位可以通过伤害性有髓Aδ 纤维和无髓C 纤维向中枢传递,伤害性传入纤维首先终止于脊髓背角[12],同时脊髓背角神经元也接收高级中枢5-羟色胺和去甲肾上腺素等单胺能神经元下行传入的调节[13],通过与脊髓背角兴奋型或者抑制型中间神经元形成突触或容积传递,整合疼痛信号,经过第一级中转后继续发出神经纤维上升1~2 个节段,在白质前联合处交叉至对侧并组成脊髓丘脑束,进一步向高级中枢传递痛、温觉。随着外周疼痛信号的不断传入,脊髓背角疼痛相关的神经递质或调质,如谷氨酸、γ-氨基丁酸(GABA)、P 物质、乙酰胆碱、甘氨酸等分泌调节功能受损[14],打破局部兴奋性和抑制性神经递质相互作用间的平衡,且局部信号受体或膜蛋白,如GABA 受体、M 胆碱能受体、钾氯联合转运蛋白2 等功能也发生改变[15],造成肢体对伤害性刺激反应性增强,这可能引起炎性痛从急性向慢性发生转变,产生慢性痛觉过敏。
综上所述,CFA 诱导的慢性炎性痛与脊髓背角Epac1 蛋白含量降低、引起局部神经元异常激活、增强外周伤害性刺激应激反应有关,这将为临床慢性炎性痛的治疗提供一定的理论基础和治疗靶点。
