人类辅助生殖技术用液体类医疗器械细菌回复突变试验的优化研究
2022-09-21孙国伟王丽洁朱飞冀胡彩珍孙金陆苏静娜方菁嶷
孙国伟 王丽洁 朱飞冀 胡彩珍 孙金陆 苏静娜 方菁嶷
1 苏州苏大卫生与环境技术研究所有限公司 (江苏 苏州 215000)
2 苏州大学苏州医学院 (江苏 苏州 215000)
内容提要:目的:对人类辅助生殖技术用液体类医疗器械的细菌回复突变试验进行优化研究。方法:以该类医疗器械的典型代表—囊胚培养液为研究对象,根据其特点对其细菌回复突变试验的剂量水平选择、结果判定方式等进行优化,分析经优化后的细菌回复突变试验结果。结果:在经优化的试验条件下,细菌回复突变试验系统有效,试验结果为阴性且具有可重复性。结论:通过对细菌回复突变试验剂量水平选择、结果判定方式的优化,可获得更准确、可靠的测试结果。
细菌回复突变试验是由Bruce N.Ames于1975年建立并不断发展完善的一种用于测试致突变性的短期生物学试验。细菌回复突变试验的主要原理为:利用是否能引起组氨酸营养缺陷型(His-)菌株(S.typhimurium或E.coli)的回复突变来判断受试物是否具有潜在的致突变性[4,5]。由于该方法具有快速、灵敏、操作简便等优点,是目前在化学品、药品、医疗器械等诸多领域中被广泛应用的一种遗传毒性初筛测试方法。由于ART液体器械具有组分复杂、营养丰富等特点,使该类器械在进行细菌回复突变试验时极易对试验系统产生干扰作用,从而影响试验有效性及最终测试结果的判读。本文以ART液体器械的典型代表—囊胚培养液为例,对该类器械的细菌回复突变试验进行了优化研究,以期为其遗传毒性等安全性评价提供技术参考[6]。
1.材料与方法
1.1 一般材料
试剂:生理盐水(广西裕源);NaNH4HPO4·4H2O、K2HPO4·3H2O、MgSO4·7H2O、NaCl、KCl、MgCl2·6H2O、葡萄糖、L-组氨酸、D-生物素(国药);柠檬酸、叠氮钠(Alfa Aesar);PBS缓冲液(HyClone);琼脂粉(Beyotime);葡萄糖-6-磷酸盐、9-氨基吖啶、2-硝基芴、2-氨基蒽(Sigma-Aldrich);NADP(Biohonren);苯并(a)芘(Aladdin);丝裂霉素C(GLPBIO);大鼠肝微粒体酶S9(Moltox)。
菌种:鼠伤寒沙门氏菌(Salmonellatyphimurium)TA97a、TA98、TA100、TA102、TA1535(Moltox)。
仪器设备:高压灭菌器(上海博迅);超净工作台(江苏苏净);生物安全柜(Haier Biomedical);生化培养箱、恒温培养摇床(上海一恒);分光光度计(Thermo Fisher)。
1.2 方法
1.2.1 试剂配制
参照YY/T 0870.1分别配制S9-Mix、40%(W/V)葡萄糖溶液、Vogel-Bonner(VB)液、底层琼脂培养基、顶层琼脂培养基及阳性诱变剂。
1.2.2 菌悬液制备
将各试验菌株接种至NB培养基中,37˚C静置过夜,随后37˚C振荡培养至获得109cfu/mL的菌悬液。
病害防治。在茄子的生长中,其病害主要有茄苗猝倒病、立枯病、绵疫病和病毒病,针对这些病害要采取具体的措施进行防治,一般采用用50%多菌灵可湿性粉剂每平方米苗床 8-10 g,与细土混匀,播种时下铺上盖,出苗后用75%百菌清可湿性粉剂六百倍液喷雾可防治猝倒病与立枯病菌;也可以用64%杀毒矾600倍液喷雾防治绵疫病;用维生素A120倍液喷雾,苗期2次,移栽后1次,可防治病毒病。
1.2.3 样品制备
无菌操作,将囊胚培养液用生理盐水分别稀释为50%、25%、12.5%、5%四个浓度,共平行制备三份样品,稀释完成后立即用于试验(本研究共选取100%、50%、25%、12.5%、5%五个剂量水平)。
1.2.4 平板掺入流程
将顶层琼脂培养基融化并保温在45˚C条件下,根据表1将各溶液加入顶层琼脂培养基中,混匀后注入底层琼脂平板上,转动平板使其分布均匀(每组三个平行)。待顶层琼脂培养基凝固后,于37˚C倒置培养72h。培养后,观察背景菌苔生长情况,记录每皿回复突变菌落数,以每皿回复突变菌落数平均值±标准差(Mean±SD)表示。
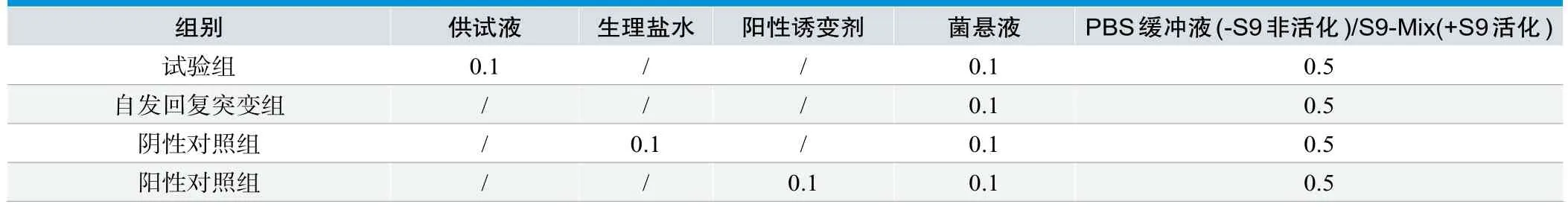
表1.组别设置(mL)
1.2.5 结果评估
使用SPSS Statistics 25对各组间的回复突变菌落数进行差异性分析(t检验),P<0.01(阳性对照与阴性对照比较)、P<0.05(试验组与阴性对照比较)即认为存在显著性差异。
试验菌悬液浓度应≥109cfu/mL,背景菌苔应生长良好;自发回复突变组回复突变菌落数应在实验室历史数据范围内;阳性对照较阴性对照应有显著性增加且在实验室历史数据范围内;满足上述条件,试验系统方为有效。
不论在活化或非活化的试验系统下,试验组回复突变菌落数较对应阴性对照具有与剂量相关的增加,或至少在一个剂量水平,至少有一种试验菌株呈现出可重复的并具有统计学意义的增加,且上述试验组回复突变菌落数超出了阴性对照的实验室历史数据范围,即可判定为阳性结果;反之则判定为阴性结果[7,8]。
2.结果与分析
2.1 背景菌苔生长情况及回复突变菌落生长抑制性分析
背景菌苔生长情况[9]:与阴性对照相比,12.5%样品的TA97a(+S9)和12.5%样品的TA98(+S9)和100%样品的TA1535(-S9)和100%、50%、25%样品的TA1535(+S9)的背景菌苔显著变薄,且背景菌落明显增大,致使有肉眼可见的孤立菌落出现;100%、50%、25%样品的TA97a(+S9)和TA98(+S9)有超过平皿面积90%的区域无背景菌苔产生;5%样品的各菌种背景菌苔生长良好。
回复突变菌落生长抑制性:与阴性对照相比,100%样品的TA102(-S9)回复突变菌落数的降低率超过50%,100%、50%、25%样品的TA102(+S9)回复突变菌落数的降低率超过50%;12.5%、5%样品各菌种每皿回复突变菌落数未出现上述情况。
通过对上述结果的综合分析(见表2),排除对本试验系统具有细胞毒性或生长抑制性的剂量水平后,用于后续细菌回复突变试验结果评估的剂量分别为:100%样品的TA97a(-S9)、TA98(-S9)、TA100(+S9和-S9),50%样品的TA102(-S9)、TA1535(-S9),12.5%样品的TA102(+S9)、TA1535(+S9)及5%样品的TA97a(+S9)、TA98(+S9)。
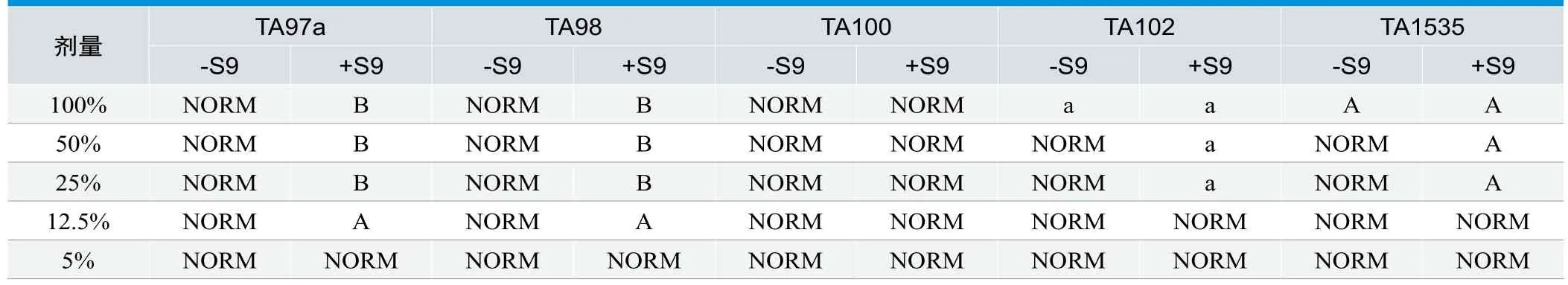
表2.背景菌苔生长情况及回复突变菌落生长抑制性分析
2.2 细菌回复突变试验结果分析
试验菌悬液浓度为1.7×109cfu/mL,自发回复突变组回复突变菌落数均在实验室历史数据范围内。阳性对照回复突变菌落数较阴性对照具有显著性增加(P<0.01)且在实验室历史数据范围内,差异性分析见表3。因此,本研究中的细菌回复突变试验系统有效。
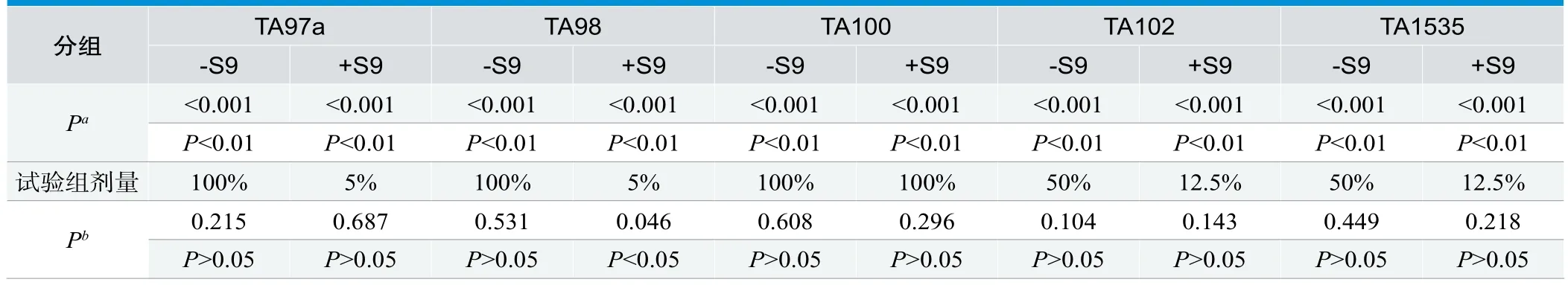
表3.回复突变菌落数的差异性分析(t检验)
与阴性对照相比,100%样品的TA97a(-S9)、TA98(-S9)、TA100(+S9和-S9),50%样品的TA102(-S9)、TA1535(-S9),12.5%样品的TA102(+S9)、TA1535(+S9),5%样品的TA97a(+S9)的回复突变菌落数均不存在统计学上的显著性差异(P>0.05);5%样品的TA98(+S9)虽然存在显著性差异(P<0.05),但其并未超出阴性对照的实验室历史数据范围;故上述各组别的试验数据均不符合“1.2.5结果评估”中关于阳性结果的评判要求,差异性分析见表3。
综上所述:在本研究条件下,细菌回复突变试验系统有效,试验结果为阴性(无致突变作用),且试验结果具有可重复性(三份平行样品的试验结果显示出极高相似性,重复性数据未呈现),说明本研究对该试验的优化是行之有效的。
3.讨论
3.1 ART液体器械细菌回复突变试验剂量水平选择的优化
ISO/TR 10993-33中规定:对于无细胞毒性的可溶受试样品,在≥5µL/皿的剂量范围内选择单一剂量水平进行细菌回复突变试验即可[7]。但由于多数ART液体器械均含有丰富的供配子和胚胎生长发育所必需的能量物质(如氨基酸、葡萄糖、丙酮酸盐等),受试样品中大量的氨基酸和糖类等物质会干扰细菌回复突变试验的部分细菌体系,造成部分试验菌种的自发回复突变数量异常增多、背景菌苔生长异常等现象(过半数的组别在原液等其他高浓度时出现异常),从而导致整个细菌回复突变试验的失败或测试结果误判等[10]。因此,对于ART液体器械的细菌回复突变试验来说,在不确定其氨基酸或糖类等物质种类及含量的情况下,建议在≥5µL/皿的剂量范围内进行多剂量水平试验(如本研究中的100%、50%、25%、12.5%、5%五剂量水平),以规避高浓度的氨基酸和糖类等物质对试验系统可能存在的干扰作用。
3.2 ART液体器械细菌回复突变试验结果判定方式的优化
对于多剂量水平的细菌回复突变试验来说,其结果判定的方式通常为:通过背景菌苔生长情况及回复突变菌落生长抑制性的分析,筛选出对所有试验菌株在各试验系统(+S9与-S9)下均无异常的剂量组别,随后使用该剂量水平的测试数据对结果进行最终判定;但经过对多种ART液体器械的细菌回复突变试验结果的分析,发现上述常用的结果判定方式存在着较大缺陷,极易造成阳性结果漏判等情况。因此,建议对ART液体器械细菌回复突变试验的结果采用分类、多重判定的方式来进行(如2.1所述),这种分类判定的方式使得每种试验菌株的各试验系统均采用了对该组别试验无干扰作用的最大剂量水平进行最终的结果判定,可以很好地避免阳性结果漏判情况,使结果更准确、可靠。
