光照对香菇菌丝后熟转色过程中活性氧代谢及自噬的影响
2022-09-21鲍大鹏黄天宇黄卫华李福后唐利华
管 婉 储 婷 鲍大鹏 黄天宇, 张 建, 黄卫华 李福后 唐利华,,3,*
(1 上海市农业科学院食用菌研究所,上海 201403;2 江苏海洋大学食品科学与工程学院,江苏 连云港 222005;3 上海海洋大学食品学院,上海 201306;4 浙江省庆元县食用菌科研中心,浙江 庆元 323800)
香菇(Lentinulaedodes)起源于我国,别名香信、冬菇、菊花菇、香纹,是世界上久负盛名的食用菌。随着近年来我国农业优惠政策相继实施,我国香菇产量持续增长并稳居世界前列。然而,现阶段我国的香菇生产模式和生产工艺较发达国家仍相对落后,优化栽培模式与生产参数迫在眉睫。
光照是食用菌生长发育过程中的重要影响因素[1-2],不同品种食用菌对光照条件的要求各异[3-4]。已有研究报道,黑暗处理有利于白僵菌加拿大1号菌株菌丝生长[5],而蓝光诱导能够促进蛹虫草子实体生长发育,同时提高蛹虫草虫草素含量[6],一定量的蓝光照射对杏鲍菇子实体的形态发育有明显促进作用[7]。香菇菌丝后熟转色作为香菇菌丝发菌完成后的重要生理成熟过程,其转色的好坏直接影响到香菇原基的发生和发育,在香菇出菇管理中至关重要。已有试验表明,光能够诱导香菇菌丝后熟转色[8],但缺乏具体的作用机制研究。
活性氧(reactive oxygen species, ROS)作为生物体内的信号分子,其作用早已被广泛关注。烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate, NADPH)氧化酶作为活性氧的主要来源,对细胞内信号调控同样具有重要作用[9-10]。现今关于光照与活性氧在植物生长发育中的作用机制研究已经十分深入,如弱光下苹果叶片的过氧化氢含量、超氧阴离子产生速率以及丙二醛(malondialdehyde, MDA)含量均大幅升高时,过氧化物酶(peroxidase, POD)与超氧化物歧酶(superoxide dismutase, SOD)活性则显著降低[11]。而在不适宜的光环境下,会诱使生物体内抗氧化系统发挥作用以维持体内氧化平衡,如提高抗氧化酶[过氧化氢酶(catalase, CAT)、POD、SOD]活性来适应强光环境[12]。但目前关于光照对食用菌生长发育的影响研究仍鲜有报道。
本研究以自然光照条件与黑暗条件下香菇菌丝后熟转色(10、30、50 d)的菌皮为材料,检测其活性氧代谢变化情况,并通过透射电镜分析及实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)对自噬基因Atg8的表达水平进行分析,旨在进一步明确香菇菌丝后熟转色过程的光照条件,为后续香菇栽培及其菌丝转色的研究提供参考。
1 材料与方法
1.1 试验菌株
香菇(Lentinulaedodes)菌株W1,由上海市农业科学院食用菌研究所提供。
1.2 试验试剂

1.3 主要仪器
ECAN Infinite 200 Pro多功能酶标仪,瑞士TECAN公司;DW-86L626超低温冰箱,海尔集团青岛海尔冰箱有限公司;5418R冷冻离心机,德国Eppendorf公司;HC110-PRO恒温金属浴,北京大龙兴创实验仪器股份公司;KMC-1300V漩涡混合器,韩国Biocex公司;UV-1800分光光度计,上海岛津企业管理有限公司;HP-2132精密色差仪,苏州美方机电有限公司;FTC3000荧光定量PCR仪,上海旦鼎国际贸易有限公司。
1.4 试验设计
本试验所用香菇菌包湿重300 g,含水量65%,木屑质量占79%,麸皮质量占20%,石膏质量占1%,置于上海国森生物科技有限公司的香菇菇房(光照强度200~300 Lx,湿度75%~85%,每天光照12 h)培养。设置光照组(Light)与黑暗组(Dark),从香菇菌包接种后开始观察记录,分3个时间点取样,每次间隔20 d,分别为转色10、30、50 d,每个时间点光照组和黑暗组随机各取3包,使用色差仪在每个菌包的表层四周随机取10个均匀散布的点测量色差值(L*值),计算每个菌包的平均色差值(L*值),再计算每组的平均色差值(L*值),最后将菌包破袋后用手术刀刮取表层菌皮,迅速液氮速冻待测。
1.5 透射电镜的自噬分析
用 2.5% GA将转色50 d的香菇光照组与黑暗组样品迅速固定后,送往武汉纽泰斯生物科技有限公司利用透射电镜(transmission electron microscope, TEM)分析细胞内结构变化。
1.6 qRT-PCR检测自噬相关基因Atg8的表达情况
转色时间最久的50 d光照组和黑暗组表征对比最明显(图1),最具进一步研究价值。为进一步分析光照对香菇菌丝后熟转色影响的自噬情况,取香菇菌丝转色50 d的光照组与黑暗组样品,每个样本设3个重复,先将RNA反转录成cDNA,然后设计特异性的引物(表1)和sybr green I荧光染料进行qRT-PCR检测。qRT-PCR反应体系50 μL:2×PCR buffer 25 μL,正反引物(25 mol·μL-1)各1 μL,cDNA 2 μL,DEPC水21 μL。qRT-PCR扩增程序:95℃预变性5 min;95℃变性20 s,59℃退火20 s,72℃延伸25 s,35个循环;94℃ 90 s,60℃ 3 min,72℃检测信号。采用2-ΔΔCt法分析香菇菌丝后熟转色不同时期自噬相关基因Atg8的相对表达量。
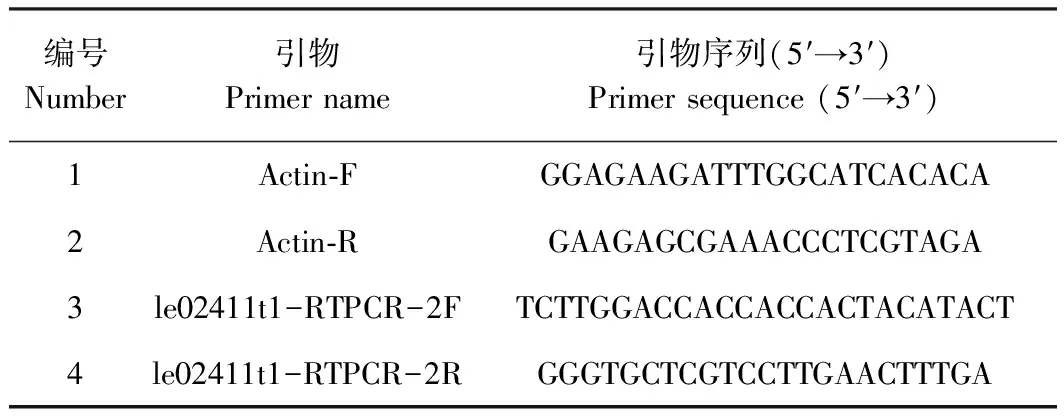
表1 本研究中使用的引物Table 1 The primers used in this study
1.7 数据分析
使用Graphed prism 8对试验数据进行统计分析及绘图,每个试验3个重复,图中数值均为平均数±标准差。
2 结果与分析
2.1 光照对香菇菌丝后熟转色的影响
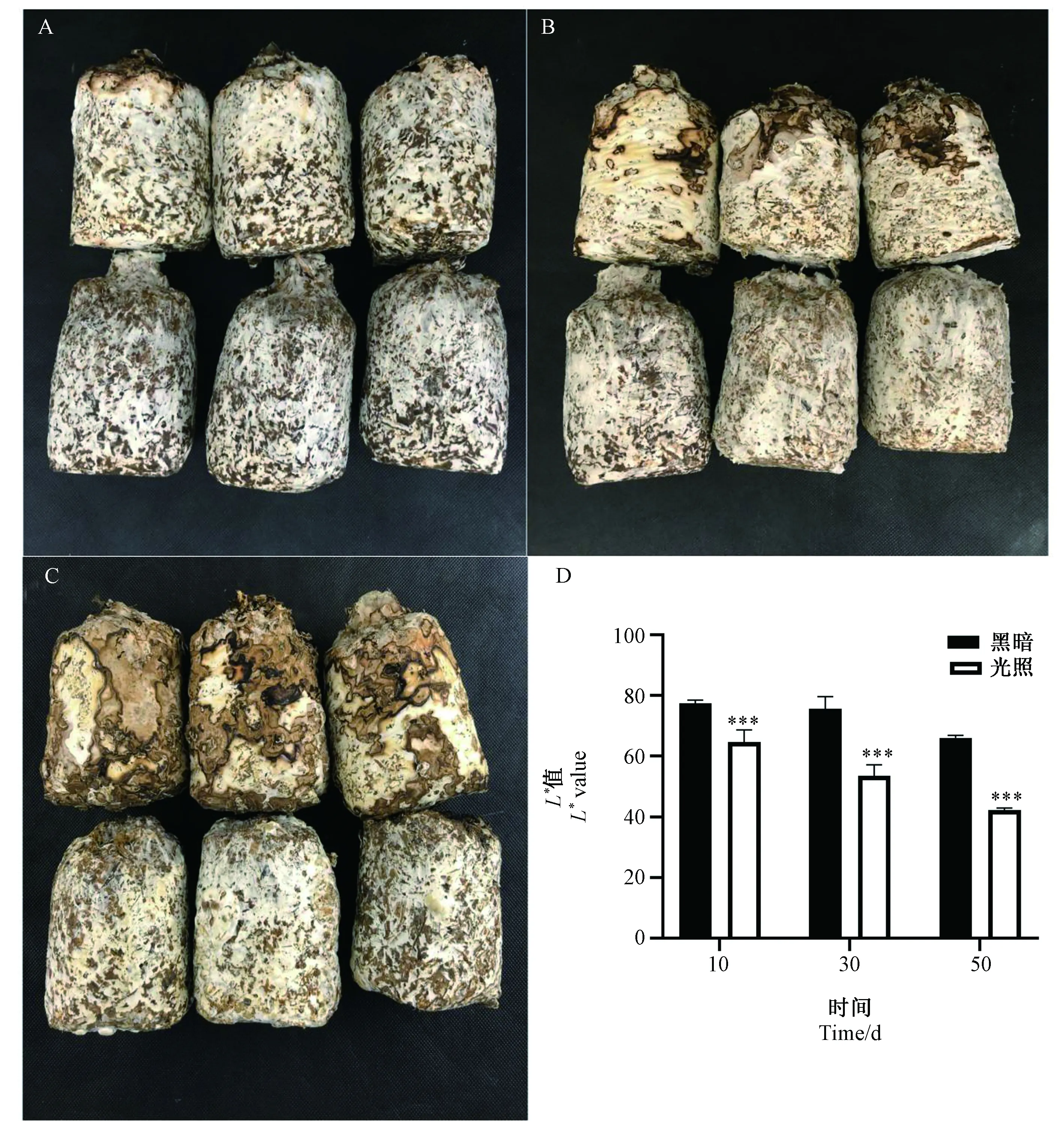
注:***表示同一时间点差异显著(P<0.001)。Note: *** indicate significant difference at 0.001 level at the same time point.图1 光照(上)与黑暗(下)处理后香菇菌丝后熟转色10 d(A)、30 d(B)、50 d(C)情况及色差L*值变化(D)Fig.1 Brown film formation of Lentinula edodes after light (top) and dark (bottom) treatments for 10 d (A), 30 d (B), and 50 d (C) and changes in color difference L* values (D)
试验选用光照组与黑暗组两组处理,在香菇菌丝后熟转色10 d(图1-A)、30 d(图1-B)、50 d(图1-C)分别拍照记录及分析取样,L*值代表明暗度(黑白),L*值越大,说明颜色越白。香菇菌丝后熟转色10 d的黑暗组色差值(77.46)大于光照组(66.67)(图1-D),在转色10 d(图1-A)可直观观察到光照处理下的香菇菌包菌丝浓密,菌皮颜色加深且伴有棕褐色菌皮,呈现明显转色特征,而黑暗处理下的香菇菌包表层皆为白色菌丝,与菌丝刚长满时基本一致,表层无棕褐色菌皮生成,无转色特征。香菇菌丝后熟转色30 d的黑暗组色差值(75.65)大于光照组(53.5)(图1-D),在转色30 d(图1-B)可直观观察到光照处理下的香菇菌包已有大面积棕褐色菌皮,而黑暗处理下的香菇菌包表层仍为白色菌丝,无转色特征。香菇菌丝后熟转色50 d的黑暗组色差值(66.08)远大于光照组(42.34)(图1-D),在转色50 d(图1-C)可直观观察到光照处理下的香菇菌包转色即将完成,而黑暗处理下的香菇菌包表层仍为白色菌丝,无转色特征。由光照组与黑暗组的L*值(图1-D)表明,随着发育时间的延长,光照组和黑暗组的L*值都变小,黑暗组在转色10和30 d的L值变化较小,但在转色50 d时的L*值降低,可能是由于香菇菌丝在生长发育过程中不断吸收营养,菌丝老化引起菌皮表层颜色加深,因此L*值降低。相较于黑暗组,光照组L*值显著降低,表明光照诱导香菇菌丝后熟转色。综上可知,黑暗条件下的香菇菌丝不转色,香菇菌丝后熟转色过程需要光照条件。
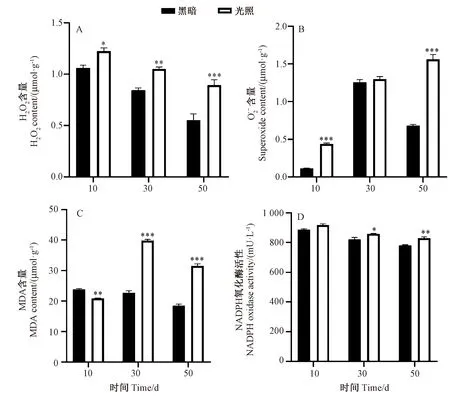
注:*、**和***分别表示同一时间点在0.05、0.01和0.001水平上差异显著。下同。Note: *, ** and *** indicate significant difference at 0.05, 0.01 and 0.001 level at the same time point, respectively. The same as following.图2 光照与黑暗处理后香菇菌丝后熟转色期间H2O2含量(A)、O2·-含量(B)、MDA含量(C)、NADPH氧化酶活性(D)变化Fig.2 Changes of H2O2 content (A), superoxide anion content (B), MDA content (C) and NADPH oxidase activity (D) during postripeness color change of Lentinula edodes mycelia after light and dark treatment
2.2 光照对香菇菌丝后熟转色期间活性氧含量的影响
在香菇菌丝后熟转色10、30、50 d 3个时间点,光照组的H2O2含量(图2-A)、O2·-含量 (图2-B)、NADPH氧化酶活性(图2-D)均高于黑暗组。其中H2O2含量与NADPH氧化酶活性变化趋势较一致,在转色50 d光照组O2·-含量与H2O2含量分别比黑暗组高128.6%、61.3%。可见,光照时间越长,光照对香菇菌丝后熟转色的影响越大,活性氧含量越高。

图3 光照与黑暗处理后香菇菌丝后熟转色期间SOD活性(A)、CAT活性(B)、POD活性(C)变化Fig.3 Changes of SOD (A)、CAT activity (B)、POD (C) during postripeness color change of Lentinula edodes mycelia under light and dark treatment
MDA含量可以反映细胞膜脂过氧化程度。光照组的MDA含量(图2-C)在转色10 d显著低于黑暗组,随着后熟转色时间增加,光照组的MDA含量又极显著高于黑暗组,在转色50 d时,光照组MDA含量较黑暗组高70.39%。而在光诱导香菇菌丝后熟转色30 d,MDA含量最高,说明不能仅依据H2O2含量判断香菇过氧化程度,推测这与H2O2还能作为细胞内信号分子参与基因分子调控有关。
2.3 光照对香菇菌丝后熟转色期间抗氧化酶活性的影响
2.4 自噬特征的透射电镜分析
香菇菌丝后熟转色50 d是试验时间最久,光照组与黑暗组表征差异最大的时间点。由透射电镜分析两组自噬特征变化,光照组(图4-A)中可直观观察到正在形成的新月状吞噬泡和已经完成包裹的双层膜多层膜自噬体,呈自噬特征。黑暗组(图4-B)未观察到自噬体,未出现自噬特征。

图4 香菇菌丝后熟转色50 d光照(A)与黑暗(B)处理的自噬比较Fig.4 Comparison of autophagy of Lentinula edodes mycelium after 50 days of postripeness color change under light (A) and dark (B)
2.5 自噬相关基因Atg8的表达情况
由图5可知,香菇菌丝后熟转色50 d光照组与黑暗组两组自噬基因Atg8的表达量差异较大。与黑暗组相比,光照组Atg8基因相对表达量显著升高。

图5 香菇菌丝后熟转色后期(50 d)光照组与黑暗组自噬相关基因Atg8表达量Fig.5 Expression of autophagy related gene Atg8 in light group and dark group at the late stage during postripeness color change of Lentinula edodes mycelia (50 d)
3 讨论
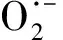
在本研究中,自然光照条件下香菇菌丝正常后熟转色,而黑暗条件下香菇菌丝一直不转色,与洪沛等[18]报道的不同光源条件下香菇菌丝生长情况存在显著差异的结果吻合。前人研究表明,活性氧在信号传导中发挥重要作用[19-22]。根据环境的不同,调节活性氧平衡可以启动不同的细胞反应,包括触发涉及细胞保护的信号通路、启动线粒体分裂和自噬激活[23-26]。厉晓东等[27]研究表明自噬在丝状真菌细胞凋亡中有显著影响,Atg8调控自噬体形成过程中自噬泡的延伸[28],且自噬对于氧化应激过程中活性氧积累所产生的细胞受损或有毒物质的降解是必需的[29]。本研究发现,相较于不转色的黑暗组,香菇菌丝转色50 d的光照组Atg8基因相对表达量显著升高,这与房丽丽等[30]报道的香菇菌丝转色后的Atg8表达量比转色前高的结果一致,进一步说明自噬参与香菇转色过程。
现今,随着香菇生产设施、设备条件的不断改善和环境控制技术水平的不断提高,对设施化和工厂化生产技术水平提出了更高的要求[31-33]。本研究探讨不同光照环境对香菇菌丝后熟转色的影响,分析活性氧与自噬在其中所起的作用,为香菇菌丝后熟转色过程对光环境的需求提供了一定的理论依据,也为深入研究光综合诱导特殊有效成分大量积累的特殊调控机制提供了有效参考。
4 结论
本研究结果表明,香菇菌丝后熟转色需要光照条件,黑暗条件下香菇菌丝不转色。相比黑暗条件,自然光照条件下香菇菌丝活性氧含量整体呈升高趋势,且细胞自噬特征明显。本研究为进一步探索香菇菌丝后熟转色机制提供了参考,但关于光环境因素(光强、光源、光周期)对香菇菌丝后熟转色的影响还有待进一步深入研究。
