NO处理对采后映霜红桃果实冷害及呼吸作用的影响
2022-09-21宋丛丛赵垚垚段玉权
宋丛丛 赵垚垚 李 昂 林 琼 段玉权
(中国农业科学院农产品加工研究所,北京 100193)
桃(PrunuspersicaL. Batsch)属蔷薇科(Rosaceae)李属(Prunus)植物,在我国已有多年的栽培历史,栽培区域广泛,品种繁多,各国的栽培种先后由我国引入,目前在世界各地均有种植[1]。映霜红是近几年新培育的晚熟品种,果肉脆甜可口,清香宜人,果实硬度大,耐贮耐运,但冷藏期间极易受到冷胁迫,并表现出果肉褐变、木质化或絮败,无法正常软化等冷害症状,从而降低其商业价值,造成经济损失[1-2]。
植物呼吸途径主要包括糖酵解(glycolysis/embden-meyerh of pathway, EMP)、三羧酸(tricarboxylic acid, TCA)循环、磷酸戊糖(pentose phosphate pathway, PPP)途径和电子传递途径[3]。呼吸作用的强弱一般用呼吸强度来衡量,呼吸强度是影响保鲜、评价果实货架期的重要因素和指标,是园艺产品最重要的品质特性。在呼吸跃变型果实中,呼吸途径和呼吸强度在采后贮藏期间不断发生变化。同时,果蔬采后的成熟衰老及耐藏性与呼吸速率和不同呼吸途径的比例也密切相关[4]。朱玲玲等[5]发现褪黑素处理可以减缓青花菜的总呼吸速率,延缓青花菜的黄化衰老,这与改变青花菜EMP、TCA循环和PPP途径的运行密切相关。Lin等[6]发现H2O2通过抑制龙眼果实PPP途径,增强EMP和TCA循环途径来提高果实呼吸速率,加速果肉分解并缩短果实货架期。高等植物的线粒体具有两条电子传递途径,一是电子通过细胞色素氧化酶途径从泛醌转移到氧气,该途径产生腺嘌呤核苷三磷酸(adenosine triphosphate, ATP),另一条是通过替代氧化酶(alternative oxidase, AOX)途径,不产生ATP[7]。研究表明在正常生长条件下,AOX途径AOX蛋白水平极低,但大多数非生物胁迫(包括干旱、高盐、低温等)会明显诱导AOX蛋白水平上调[8-9]。近年来,多项研究表明AOX有助于植物的抗冷胁迫[10-11]。因此,合理调控呼吸作用对果实采后贮藏保鲜具有重要意义。
一氧化氮(nitric oxide, NO)作为信号分子,参与呼吸作用、成熟衰老、细胞壁木质化、种子发芽等多种植物生理生化过程[12-13]。目前,NO用于果蔬保鲜已成为果蔬贮藏保鲜领域的热门课题之一,许多园艺作物中,如香蕉[14]、芒果[15]、柑橘[16]、草莓[17]、伽师瓜[18]等,用一定浓度的外源NO或NO供体处理可以抑制果蔬贮藏期的呼吸速率,减轻冷害,延缓成熟衰老,延长货架期,并改善果蔬采后贮藏品质。已有研究发现,NO可以通过提高果实抗氧化能力[15,19],能量代谢[20],保护细胞膜[21],激活CBF(C-repeat binding transcription)抗冷途径[22]来提高果实抗冷性。但NO通过对不同呼吸途径之间的调控来提高果实抗冷性的研究鲜有报道。本研究以映霜红桃为试验材料,探究不同浓度NO理对不同呼吸途径关键酶的活性及呼吸速率的调控作用,以期从NO对不同呼吸途径影响的角度探讨NO提高桃果实采后贮藏品质及延缓冷害的作用机理,为NO在桃采后贮藏保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
映霜红桃,于2020年10月购自北京新发地水果批发市场,使用常温货车2 h内运回实验室。挑选大小一致、无病虫害、无机械损伤的桃果实作为试验样品。
NO气体(纯度99.9%),N2气体(纯度99.9%),三氯乙酸、间苯二酚、乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)、2,6-二氯酚靛酚钠(2,6-dichlorophenolindophenolsodium salt, DCIP)、吩嗪硫酸甲酯(phenazine methosulfate, PMS)、D-葡萄糖-6-磷酸二钠盐、6-磷酸果糖(6-phosphate-fructose, 6-P-F)、琥珀酸,购自上海源叶生物科技有限公司;三羟甲基氨基甲烷(Tris)、牛血清蛋白(bovine serum albumin, BSA)、蔗糖,购自国药集团化学试剂有限公司;丙二醛(malondialdehyde content, MDA)含量检测试剂盒,购自北京索莱宝科技有限公司;植物细胞色素氧化酶(cytochrome oxidase,COX)酶联免疫分析试剂盒、植物交替氧化酶(alternative oxidase,AOX)酶联免疫分析试剂盒,购自上海酶联生物科技有限公司;一氧化氮测定试剂盒,购自南京建成生物工程研究所。
1.2 仪器与设备
Neofuge 15R台式高速冷冻离心机,上海力申科学仪器有限公司;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;BIORAD680型全自动酶标仪,美国Biorad公司;F-950型便携式乙烯/O2/CO2分析仪,北京阳光亿事达科技有限公司;多功能高速球磨仪,五洲鼎盛北京科技有限公司;GY-4水果手持式硬度计,北京阳光亿事达有限公司。
1.3 试验方法
1.3.1 材料处理 将挑选出的果实随机分成4组,每组40个果,设3个生物学重复,共480个果实。处理方法:1)试验组:通入N21~2 min排出熏蒸桶中空气,分别加入5、10、15 μL·L-1NO熏蒸3 h;2)对照(CK)组:N2熏蒸3 h。熏蒸箱内放入10 mL的1% (w/v) KOH溶液吸收CO2。处理后放入温度4±1℃、相对湿度90%~95%的冷库贮藏,每隔7 d取一次样并测定相关指标。
1.3.2 内源NO含量测定 准确称取1 g桃组织,加入4 mL 磷酸缓冲液(pH值7.4),冰浴匀浆。取20%匀浆液,于4℃、4 000×g条件下离心15 min,取上清液于冰上待测。内源NO含量测定参照一氧化氮(NO)测定试剂盒说明书。
1.3.3 冷害指数测定 根据Wang等[23]的评价方法。每隔7 d随机从冷库中取出果实,观察果肉褐变面积,统计冷害指数(cold index, CI)。依据发病面积,分为4个等级:0级=正常(未发生褐变);1级=极轻(褐变面积1%~25%);2级=较轻(褐变面积26%~50%);3级=严重(褐变面积51%~75%);4级=极严重(褐变面积76%~100%)。冷害指数=∑[(级数×对应级别的果数)/(4×果实总数)]×100%。
1.3.4 硬度测定 根据千春录等[24]的方法,采用GY-4水果手持式硬度计11.1 mm探针进行测定。在每个桃果实对称两侧赤道位置取2个点,各削去厚度1 mm左右的果皮,进行测定,每个处理3次重复,取平均值。
1.3.5 呼吸速率测定 根据张小康等[20]的方法,每个处理取6个果,2个一组放入1.5 L保鲜盒中,密封2 h,用F-950型便携式乙烯/O2/CO2分析仪检测CO2浓度。呼吸速率用 mL·kg-1·h-1CO2表示。
1.3.6 葡萄糖磷酸异构酶(glucose-6-phosphate isomerase,GPI)活性测定 参照Zhang等[25]的方法并稍作修改。称取0.1 g桃冻样加入1 mL 0.05 mmol·L-1Tris-HCl,冰浴研磨。在4℃、12 000×g条件下离心30 min,取上清液于4℃保存待用。测定时取0.25 mL上清液,加入0.5 mL 10 mmol·L-16-磷酸葡萄糖。30℃水浴5 min,加入1 mL 10%三氯乙酸,4℃、 12 000×g离心15 min,取0.1 mL上清液加入2.5 mL 38% HCL和1 mL 0.1%间苯二酚,80℃水浴10 min。在520 nm波长下以6-P-F为标准物测定果实6-P-F含量以表示GPI活性。
1.3.7 琥珀酸脱氢酶(succinic dehydrogenase,SDH)活性、葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G-6-PDH)和6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,6-PGDH)联合活性测定 参照Zhang等[25]的方法并稍作修改。SDH活性测定:取7 μL磷酸钾缓冲液,7 μL琥珀酸钠,7 μL DCIP及175 μL蒸馏水组成反应液,置于30℃水浴中保温10 min。测定酶活性前加入7 μL提取酶液,混匀。测定时加7 μL PMS,在600 nm波长下测定吸光度的变化。G-6-PDH和6-PGDH联合活性测定:取180 μL测定介质(5 mmol·L-16-磷酸葡萄糖溶液,5 mmol·L-1MgCl2,5 mmol·L-1烟酰胺核苷酸,0.1 mol·L-1Tris-HCI),加入20 μL样品,以20 μL Tris-HCl的缓冲液作为对照,立即于340 nm波长下测定吸光度的增量。
1.3.8 COX和AOX活性测定 准确称取0.1 g桃果实组织,加入1 mL 磷酸钠缓冲液(pH值7.4),冰浴匀浆。于4℃、8 000×g条件下离心30 min,取上清液于冰上待测。COX和AOX活性测定使用植物细胞色素氧化酶(COX)和植物交替氧化酶(AOX)酶联免疫分析试剂盒,严格按照说明书操作。
1.4 数据分析
采用SPSS 24软件对数据进行统计分析,显著性分析采用最小显著性差异法(least-significant difference, LSD),试验结果均表示为平均值±标准误差,所得数据使用Origin 8.6软件进行作图。
2 结果与分析
2.1 不同浓度NO处理对映霜红桃内源NO含量的影响

图1 不同浓度NO处理对映霜红桃内源NO含量的影响Fig.1 Effect of NO treatment on the endogenous NO content of Yingshuanghong peach
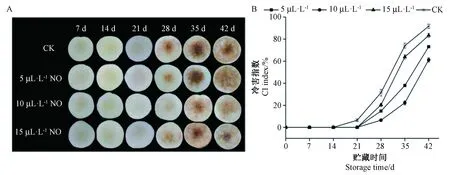
图2 不同浓度NO处理对映霜红桃冷害症状(A)和冷害指数(B)的影响Fig.2 Effect of NO treatment on chilling injury symptoms (A) and index (B) of Yingshuanghong peach
由图1可知,桃果实内源NO含量在整个贮藏过程中呈现先上升后下降的趋势,贮藏21 d前,NO处理的桃果实内源NO含量显著高于对照(P<0.05)。贮藏14 d时,10 μL·L-1NO和15 μL·L-1NO处理的桃果实内源NO含量是对照的1.7和1.62倍。贮藏35 d时,15 μL·L-1NO处理组内源NO含量显著下降(P<0.05),与10 μL·L-1NO处理组相比降低了43.17%。表明外源NO处理对内源NO的诱导存在浓度效应 ,即外源NO浓度低于10 μL·L-1时提高内源NO浓度,高于10 μL·L-1时抑制NO积累,其中10 μL·L-1NO 处理组效果最有效。
2.2 不同浓度NO处理对映霜红桃冷害的影响
由图2可知,不同浓度NO处理的桃果实冷害症状与冷害指数出现显著差异(P<0.05),且均呈现上升的趋势。贮藏至21 d时,对照组的果肉开始出现冷害症状,果心呈现褐色,而NO处理延缓了冷害的发生。贮藏至35 d时,所有处理组果肉均出现明显褐变,对照组的冷害指数达到74.07%,显著高于NO处理组(P<0.05),其中10 μL·L-1NO处理组的桃果实冷害症状最轻。由此可见,NO处理可以减轻桃果实采后冷藏期间的冷害症状,延缓冷害的发生,其中10 μL·L-1NO处理组效果最好。
2.3 不同浓度NO处理对映霜红桃硬度的影响
由图3可知,NO处理可以保持桃果实硬度,维持果实采后贮藏品质。对照和15 μL·L-1NO处理组的硬度在贮藏 21 d 显著下降(P<0.05),而后提高,这可能是由于冷害使果实无法正常后熟。5 μL·L-1和10 μL·L-1NO处理组桃果实硬度在贮藏期间持续下降,贮藏21 d时,10 μL·L-1NO处理组的硬度比对照组高26.9%,比15 μL·L-1NO处理组高38.2%。表明适当浓度的NO处理可以维持桃果实贮藏期间的硬度,而高浓度的NO处理则影响果实采后正常软化。
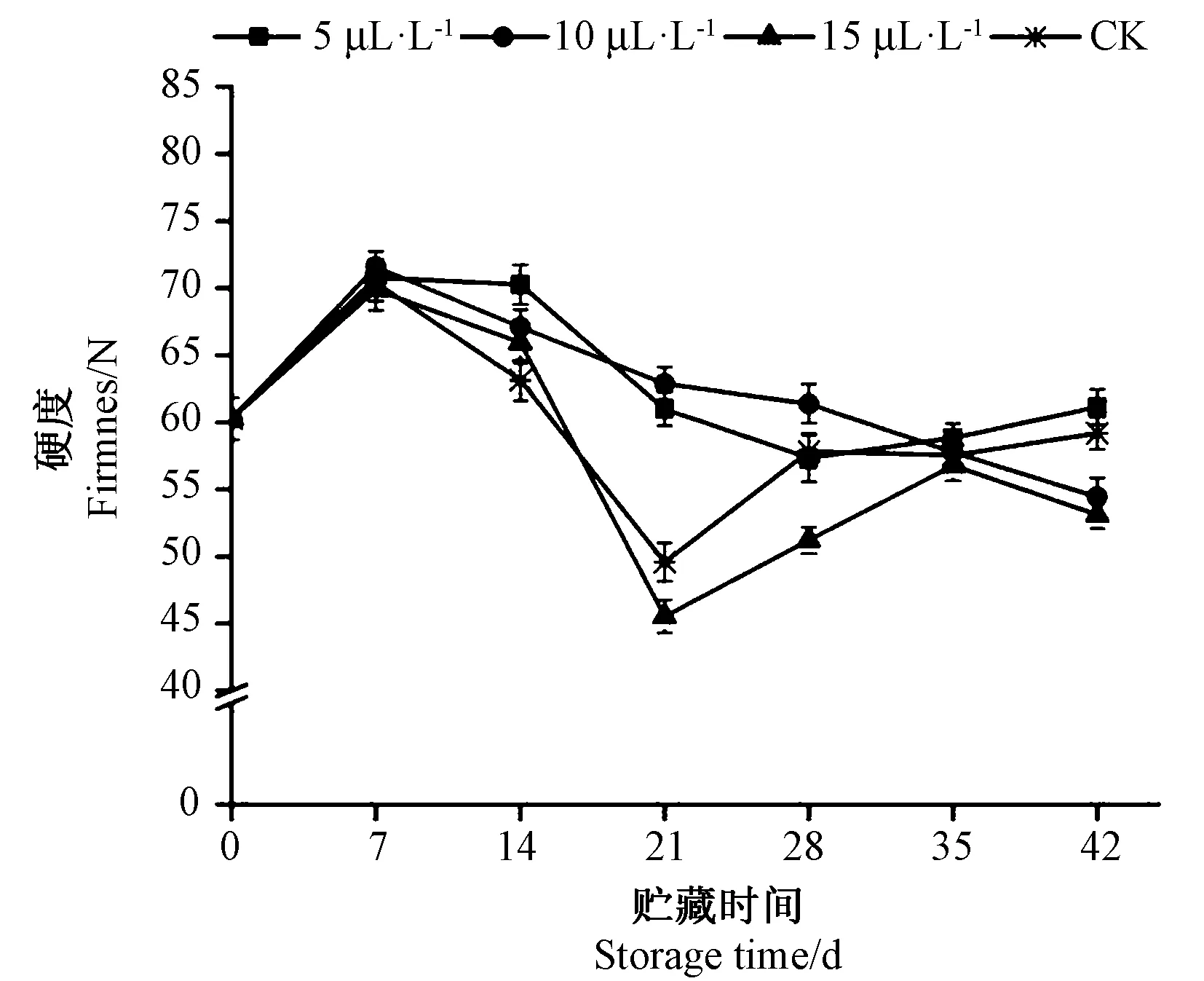
图3 不同浓度NO处理对映霜红桃硬度的影响Fig.3 Effect of NO treatment on firmness of Yingshuanghong peach
2.4 不同浓度NO处理对映霜红桃呼吸速率的影响
由图4可知,随着贮藏时间的延长,桃果实的呼吸速率呈现先上升后下降的趋势。在贮藏21 d时达到呼吸高峰,且10 μL·L-1NO处理组的呼吸速率显著低于其他处理(P<0.05),峰值为7.46 mL·kg-1·h-1。而15 μL·L-1NO处理促进了果实采后的呼吸作用,峰值为9.55 mL·kg-1·h-1。由此可见,不同浓度的NO对桃果实的呼吸速率影响不同,10 μL·L-1NO处理可以显著抑制桃果实的呼吸速率(P<0.05),延缓果实成熟衰老。

图4 不同浓度NO处理对映霜红桃呼吸速率的影响Fig.4 Effect of NO treatment on respiration rate of Yingshuanghong peach
2.5 不同浓度NO处理对映霜红桃呼吸途径关键酶的影响
葡萄糖磷酸异构酶(GPI)是糖酵解途径的关键酶,其活性由6-P-F含量来表示。由图5-A可知,NO处理可以抑制桃果实6-P-F含量的升高,贮藏前14 d均呈现下降的趋势。贮藏7 d时,对照组6-P-F含量为12.53 g·kg-1,而10 μL·L-1NO处理组含量为10.05 g·kg-1,显著低于对照组(P<0.05)。琥珀酸脱氢酶(SDH)是TCA循环途径的关键酶。由图5-B可知,随着贮藏时间的延长,各处理SDH活性均呈现先上升后下降趋势,对照和10 μL·L-1NO处理组在21 d达到最高,分别为317.28和251.59 U·g-1。5 μL·L-1和15 μL·L-1NO处理组桃果实SDH活性在28 d达到最大值,显著高于10 μL·L-1NO处理(P<0.05)。葡萄糖-6-磷酸脱氢酶(G-6-PDH)和 6-磷酸葡萄糖酸脱氢酶(6-PGDH)是磷酸戊糖途径的关键酶。由图5-C可知,贮藏21 d前,NO处理显著提高了G-6-PDH和6-PGDH联合活性(P<0.05)。贮藏7和14 d时,10 μL·L-1NO处理比对照高49.43%和23.16%。贮藏28 d后,10 μL·L-1NO和15 μL·L-1NO处理的桃果实G-6-PDH和6-PGDH联合活性呈下降趋势,显著低于其他组(P<0.05)。以上研究结果表明,10 μL·L-1NO处理可以抑制桃果实冷藏期间GPI活性和SDH活性,提高G-6-PDH和6-PGDH联合活性,进而影响桃果实的呼吸速率。
2.6 不同浓度NO处理对映霜红桃电子传递途径关键酶的影响

图5 不同浓度NO处理对映霜红桃6-磷酸果糖含量(A)、SDH活性(B)、G-6-PDH和6-PGDH联合活性(C)的影响Fig.5 Effect of NO treatment on 6-P-F content(A), SDH (B), G-6-PDH and 6-PGDH (C) activity of Yingshuanghong peach

图6 不同浓度NO处理对映霜红桃COX活性(A)和AOX活性(B)的影响Fig.6 Effect of NO treatment on COX (A) and AOX (B) activity of Yingshuanghong peach
由图6-A可知,对照组桃果实COX活性在贮藏28 d内持续处于较高水平,在贮藏35 d时缓慢下降。5 μL·L-1NO处理显著抑制了桃果实贮藏前期的COX活性(P<0.05),在7和14 d分别比对照低17.03%和19.16%。而15 μL·L-1NO处理组COX活性在贮藏14~21 d下降,21 d时,COX活性为0.83 U·L-1,分别比对照和10 μL·L-1NO处理组低19.65%和16.73%。由图6-B可知,10 μL·L-1NO处理显著提高了桃果实的AOX活性(P<0.05),在贮藏21和28 d分别比对照高20.25%和27.70%。与对照相比,15 μL·L-1NO处理也提高了映霜红桃的AOX活性,但差异不显著(P>0.05)。由此可见,NO处理可以抑制桃果实冷藏期间的COX活性,提高AOX活性,其中,10 μL·L-1NO处理组效果最好。
3 讨论
桃果实冷害的主要症状是果实内部褐变,伴随着乙烯生成的抑制和无法正常软化,导致果肉出现粉状质地[26-27]。而缓解冷害是一氧化氮在果蔬保鲜中最成熟的作用之一。王鲁阳等[28]研究表明,60 μL·L-1NO处理可以减轻哈密瓜果实冷害发病率与冷害指数。Jiao等[29]使用NO供体硝普钠(sodium nitroprusside, SNP)处理提高了桃果实耐冷性,减轻了果实冷害。同时,在番茄果实中也发现,通过褪黑素处理提高果实内源NO含量,可以抑制ROS、MDA积累,从而提高果实耐冷性[30]。本研究表明,在贮藏21 d前,10 μL·L-1NO处理的映霜红桃果实内源NO含量与对照组相比显著提高(P<0.05),且硬度下降速度缓慢,其冷害症状与冷害指数明显低于对照组,这与使用NO供体硝普钠浸泡桃果实得到的结果一致[29]。但是NO的处理效果具有浓度效应,不同植物和组织对外源NO处理的浓度要求也不同。研究发现低浓度NO处理可以缓解镉胁迫对草地早熟禾造成的伤害,而高浓度NO处理抑制了早熟禾种子萌发及幼苗正常生长[31]。同样,常雪花等[32]研究发现,高浓度(200 μL·L-1)NO处理不仅不能保持果实的贮藏品质,反而会加速贮藏期间冬枣果实的品质劣变,导致果实出现较为严重的腐烂。在本试验中,随着贮藏期间桃果实果肉褐变的出现,对照和15 μL·L-1NO处理组的果实在贮藏21 d后硬度显著升高(P<0.05),使果实无法正常软化,且果肉褐变严重,影响果实品质。因此,外源NO处理通过提高桃果实内源NO含量,维持果实正常软化后熟,减轻桃果实冷害;过高浓度的NO处理会加速果实衰老,而对于映霜红桃果实,10 μL·L-1NO处理效果最优。
呼吸作用被认为是影响采后果实成熟衰老及贮藏品质的重要因素。有研究表明,采后果实的品质变化与呼吸速率密切相关,NO处理可以降低果实的呼吸速率,抑制生理代谢,延缓果实冷害,保持果实较高的品质[4,33]。范蓓等[34]研究发现,NO处理可以延缓芒果果实呼吸高峰的出现,抑制冷害的发生。裴哗哗等[35]发现不同浓度乙烯处理会提高果实呼吸速率,加速果实冷害的发生。在本试验中,桃果实呼吸速率高峰出现在贮藏21 d,10 μL·L-1NO处理组显著低于其他处理,且冷害症状和冷害指数最低,而15 μL·L-1NO处理未抑制果实呼吸速率的升高,反而促进了果实的品质劣变,这与不同浓度NO处理伽师瓜[18]的结果一致。
植物呼吸代谢包括多条代谢途径,而GPI、SDH、G-6-PDH和6-PGDH分别为糖酵解、TCA循环和磷酸戊糖途径的关键酶。本研究结果表明,不同浓度NO处理桃果实不同程度地降低了GPI和SDH活性,提高了G-6-PDH和6-PGDH联合活性,其中10 μL·L-1NO处理的效果最好。桃果实呼吸速率变化趋势与GPI和SDH活性变化趋势一致,表明NO可以通过调控呼吸途径关键酶的活性来调节各呼吸途径呼吸速率强弱,从而影响总呼吸速率,这与NO处理在伽师瓜[18]、番茄[4]中的研究结果相似。COX作为细胞色素途径的关键酶,对果实能量代谢具有调控作用,本试验不同浓度NO处理的果实COX活性在贮藏期间无显著变化(P>0.05)。AOX是抗氰呼吸途径的关键酶,其与果实的采后处理方式、贮藏条件、品质变化等密切相关。研究发现,NO处理可以提高AOX活性和基因表达水平,从而增强果实耐寒性[29]。Wang等[36]研究发现,NO处理可以通过提高G-6-PDH和6-PGDH活性来增强香蕉果实耐冷性。在本研究中,10 μL·L-1NO处理维持了较高的AOX活性、G-6-PDH和6-PGDH活性,以及较低的果实冷害症状与冷害指数,这与通过外源黄体酮处理提高果实AOX活性和基因表达来延缓香蕉冷害发生的结果一致[14]。王雅楠[37]研究发现诱导李果实抗氰呼吸,提高AOX的活性,可以延缓李果实冷害,提高抗冷能力。综上所述,一氧化氮处理通过提高映霜红桃果实内源NO含量,增强了抗氰呼吸和磷酸戊糖途径的呼吸速率,降低了糖酵解、TCA循环、细胞色素氧化酶途径的呼吸速率,从而降低了总呼吸速率,减少了果实的硬度损失,提高了果实抗冷性。
4 结论
本研究结果表明,10 μL·L-1NO处理可以延缓桃果实冷藏期间冷害的发生,降低冷害指数,这与NO处理参与调控桃果实呼吸作用密切相关。NO处理可通过降低糖酵解途径、TCA循环途径、细胞色素氧化酶途径关键酶的活性,降低果实的呼吸速率,抑制桃果实的采后生理活动。同时,NO处理通过提高G-6-PDH和6-PGDH联合活性及AOX活性增强磷酸戊糖途径和抗氰呼吸途径,提高果实冷藏期间的耐冷性,减轻果实冷害,维持贮藏品质。因此,外源NO处理在延长桃果实采后贮藏期及维持果实品质方面具有较好的应用前景。
