褐斑病侵染下2,3-丁二醇-凹凸棒石复合制剂对草地早熟禾细胞壁组成物质及细胞壁降解酶活性的影响
2022-09-21张露露刘兴菊马晖玲
张露露 刘兴菊 马 源 马晖玲,*
(1 甘肃农业大学草业学院/草业生态系统教育部重点实验室,甘肃 兰州 730070; 2 青海大学畜牧兽医科学院,青海 西宁 810016)
草地早熟禾(PoapraterrsisL.)作为全世界草坪建植的主要冷季性草种[1],其种质资源丰富,分布区域广泛。草地早熟禾具有适应性强且绿期较长等特点,但其在湿热适宜条件下极易感染褐斑病,叶片出现黄化、萎蔫现象,特别是修剪过的叶片顶端更容易受到病原菌侵入[2]。草坪草褐斑病是一种土传真菌病害,主要由立枯丝核菌(Rhizoctoniasolani)侵染引起[3],该病原菌常以菌丝形式侵入植物体内,通过分泌毒素或细胞壁降解酶(cell-wall degrading enzymes, CWDE)来破坏植物细胞壁及中胶层结构,损伤细胞膜、细胞器等,从而引起机体内部功能紊乱,导致病害发生[4]。有研究表明褐斑病在冷季型草坪上普遍发生,在湿热的夏季时期,草坪发病率高达80%以上[5]。
使用传统的化学药剂防治,既污染当地的生态环境,又会增加植物的耐药性,不符合现代生态可持续发展理念。植物根际益生菌(plant growth promoting rhizobacteria, PGPR)作为现代生态农业的研究热点,其作用主要是定殖于植物根系,优先占领根际,促进生长素(indole acetic acid, IAA)、抗生素、铁载体等的产生,促使植物健康生长[6]。PGPR的主导机制为诱导体系抗性(induced systemic resistance, ISR),主要体现在应对病原菌入侵时,改变植物细胞壁结构,调整生理生化反应,合成防御病原菌的次生代谢物质[7],以抵御或减轻病原菌分泌产生的毒素和细胞壁降解酶对植物细胞壁、细胞膜的破坏程度。有研究表明挥发性化合物2,3-丁二醇(2,3-butanediol, 2,3-BD)及其同分异构体在PGPR诱导植物抗病性能提高方面发挥重要作用[8]。有研究发现2,3-BD诱导处理的匍匐剪股颖对褐斑病的防治效果优于苯并噻二唑(benzothiadiazole, BTH)[9]。当2,3-BD浓度为250 μmol·L-1时,对试验苗的诱抗作用最佳,而2,3-BD浓度为550 μmol·L-1时,对田间成熟草坪的防治效果最好,可显著降低褐斑病的发生率[10]。因此,2,3-BD在提高植物抗病的广谱性和实用性方面具有重要科学研究价值。
凹凸棒石(palygorsk, PAL)是一种富含镁铝硅酸盐的粘土矿物,具有2∶1型的层状结构,其内部丰富的纳米微型孔道使得PAL的内比表面积达到600 m2·g-1,为吸附和容纳物质提供了充足空间[11]。研究表明,PAL不仅可以吸附重金属离子和水分子,还能有效吸附醇、醛、烷烃类等大分子有机物质,其中PAL对醇类物质的吸附能力较强[12]。目前,在农业生产方面PAL主要被用作农药载体、肥料添加剂、包衣缓释剂等[11,13],但是化肥和农药对环境的污染极大,已不符合生态农业可持续发展理念。
目前国内外通用的植物免疫诱导剂普遍存在持效期短、诱导效果不佳、需要多次诱导等问题[14-15],使得诱导剂在农业产生中的使用效率明显降低。结合PLA性质推测,利用PAL的吸附性和黏结性将植物诱导剂与其作用形成复合型缓释制剂,能够提高对植物的诱导效果,从而弥补诱导剂的实用缺陷,但此类研究鲜有报道。鉴于此,本试验通过2,3-BD诱导、2,3-BD-PAL复合诱导的方式,探究草地早熟禾叶片中细胞壁组成物质及细胞壁降解酶活性在病原菌胁迫条件下的变化,旨在明确2,3-BD诱导、2,3-BD-PAL复合诱导对植物抗病能力的提升效果,以及PAL对2,3-BD的诱导效果影响,为2,3-BD与PAL复合诱导草坪草抗褐斑病的研究提供理论基础,同时为其他诱导剂与PAL复合应用的有效开发利用提供新的研究方向。
1 材料与方法
1.1 试验材料
草地早熟禾品种:纳苏(Nassau),购自北京克劳沃草业技术开发中心。
褐斑病病原菌:立枯丝核菌,购自中国科学院菌种保存中心。
植物诱抗剂:2,3-BD,购自西亚试剂(临沂)。
凹凸棒石,购自兰州沃迪受损土地修复与环境工程研究院,产地甘肃省临泽县,细度1 000目。
1.2 试验方法
1.2.1 病原菌菌种制备 立枯丝核菌-马铃薯葡萄糖琼脂(potato dextrose agar, PDA)培养基:1 000 mL自来水+200 g马铃薯,煮沸20 min,过滤,加自来水定容至1 000 mL,再加入20 g葡萄糖+15 g琼脂粉,搅拌均匀,待完全溶解后,将液体分装在500 mL锥形瓶中,在121℃灭菌锅中灭菌26 min。灭菌完成后,在超净工作台中将培养基分倒在培养皿中。冷却后,在培养基上接入立枯丝核菌,用石蜡封口膜封口。将其倒置培养于光照14 h·d-1、25℃,黑暗10 h·d-1、20℃的恒温培养箱中,培养7 d。
病原菌菌种制备:参考Cortes-Barco等[16]的接菌物制备方法并改进。用无菌水完全浸泡500 g麦粒,隔夜,晾干水分后放置于240 mL组培瓶中,约占瓶体积1/2,加盖封口膜,连续灭菌3次,冷却后用打孔器打取立枯丝核菌-PDA生长物,接入麦粒组培瓶中,混匀后于恒温培养箱中培养14 d。每天摇晃使麦粒充分被病原菌侵染,待麦粒充分长满菌丝后,颜色呈现深褐色时,将其置于托盘中在通风处阴干,完全干燥后粉碎制成菌粉,放置在4℃冰箱备用。
1.2.2 育苗种植及试验处理 种子清洗:将供试种子弃去杂质和有虫蚀及成熟度较低的种子,用无菌水侵泡5 h,乙醇(70%)浸泡1 min,次氯酸钠(20%)浸泡15~20 min,用蒸馏水冲洗6~7次,至刺鼻酸味消失为止,将其放置于室内,自然阴干。
育苗种植:将土壤、细沙、蛭石混合(1∶1∶1)在180℃烘箱中灭菌3 h,以充分杀菌,冷却后装入直径为9 cm,高度为12 cm的豆浆杯中,约占1/2体积。将草地早熟禾种子均匀播散在豆浆杯中,每个杯中大约0.2 g种子,附沙浸水,盖上保温罩,置于恒温培养室,培养条件为光照16 h 23℃黑暗8 h 20℃。
试验处理:设置4组处理,分别为对照组(CK):未诱导未接菌。处理组:(1)未诱导接菌。(2)2,3-BD诱导接菌:待幼苗生长30 d后,在每个重复中依次加入浓度为0.3 mmol·L-1的2,3-BD诱导剂30 mL,诱导培养7 d。(3)2,3-BD-PAL复合诱导接菌:在育苗种植时对每个重复施加2.63 g·kg-1PAL,将其均匀撒入混合土中搅拌,充分浸水,待幼苗生长30 d后,进行2,3-BD诱导处理。之后对3组处理的每个重复中都接入立枯丝核菌菌粉0.3 g,接菌时先喷湿叶片再将菌粉均匀撒播,保温罩遮盖,置于恒温培养室。
1.2.3 生理指标测定 对接菌后不同处理的草地早熟禾叶片(对照正常生长),按照0、3、7、15 d的时间点分别采样。每个样0.2 g,每个指标3个重复。用锡箔纸装袋,封口,经液氮冷冻后放置在-80℃下冷藏备用。用于测定纤维素、果胶、木质素含量[17]。
1.2.4 细胞壁降解酶制备 参照李宝聚等[18]的研究方法,取草样0.2 g于研钵中,加入2 mL 1 mol·L-1NaCl提取液(0.02 mol·L-1Tris-Hcl缓冲液,pH值7.4),冰浴下研磨,匀浆在4℃、12 000 r·min-1条件下离心15 min,上清液即为酶液,于-20℃冰箱中保存备用。
1.2.5 酶活性测定 羧甲基纤维素酶(carboxymethyl cellulase, Cx)、β-葡萄糖苷酶(β-glucosidase, β-Glu)、滤纸酶(filter paper enzyme, FPA)、多聚半乳糖醛酸酶(polygalacturonase, PG)和果胶甲基半乳糖醛酸酶(pectin methyl-galacturonase, PMG)活性采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid, DNS)比色法测定[19-20]。果胶甲基反式消除酶(pectin methyl transeliminase, PMTE)和多聚半乳糖醛酸反式消除酶(polygalacturonic acid transeliminase, PGTE)活性测定参考李宝聚等[18]的方法。
酶蛋白浓度按照Bradford[21]的方法,以牛血清白蛋白为标准蛋白质,用考马斯亮兰G-250显色,在595 nm下比色测定,以牛血清白蛋白浓度为横坐标,吸光度为纵坐标制作标准曲线,将测定样品吸光度值带入标准曲线计算酶液蛋白浓度。
1.3 数据处理
采用SPSS 19.0系统软件分析数据,采用单因素ANOVA对多组样本进行分析处理,Duncan’s新复极差法进行显著性方差分析;采用Microsoft Excel 2010绘制图表。
2 结果与分析
2.1 病原菌胁迫7 d时各处理组草地早熟禾叶片形态
如图1所示,当接入病原菌7 d时,对两组2,3-BD诱导处理的草地早熟禾叶片和未诱导处理进行比较观察,能够明显看出未诱导处理的植株茎基部和叶基部存在大量白色的病原菌丝。而使用2,3-BD诱导和2,3-BD-PAL复合诱导处理的植株叶片上附着的菌丝数量相对较少,与未诱导处理相比植株发病率明显降低。其中2,3-BD-PAL复合诱导处理的草株叶片,仅在茎基部存在少量枯叶,地上部叶片色泽保持嫩绿并生长旺盛,其诱导效果优于2,3-BD单独诱导处理。
2.2 病原菌胁迫下草地早熟禾叶片中细胞壁组成物质变化
2.2.1 病原菌胁迫下草地早熟禾叶片中纤维素含量变化 如图2所示,随病原菌胁迫时间的延长,各处理组叶片中纤维素含量均先下降后上升。在胁迫3 d时,未诱导处理叶片中纤维素含量快速下降,相比CK低29.49%,之后随胁迫时间的延长,其纤维素含量与CK之间保持显著差异(P<0.05)。而两组诱导处理的纤维素含量在整个病原菌胁迫期间均低于CK,但差异不显著(P>0.05)。同时,在胁迫期间未诱导处理叶片纤维素含量低于两组诱导处理,且与2,3-BD-PAL复合诱导处理之间存在较大差异。
2.2.2 病原菌胁迫下草地早熟禾叶片中果胶含量变化 如图3所示,在无病原胁迫时,CK和各处理组叶片果胶含量之间无显著差异(P>0.05)。当受到菌丝胁迫3 d时,两组诱导处理的果胶含量快速上升,与CK相比分别显著高19.68%和32.57%,之后保持稳定。而未诱导处理的果胶含量随胁迫时间的延长呈先上升后下降趋势,但与CK相比无显著差异(P>0.05)。在病原菌胁迫期间,两组诱导处理叶片中果胶含量均高于未诱导处理,其中2,3-BD-PAL复合诱导处理与未诱导处理之间差异显著(P<0.05)。

注:不同大写字母表示同一处理不同接菌天数间差异显著(P<0.05);不同小写字母表示同一接菌天数不同处理之间差异显著(P<0.05)。下同。Note:Different capital letters indicate that the same treatment has significant differences in different time periods at 0.05 level. Different lowercase letters indicate significant differences between different treatments in the same time period at 0.05 level. The same as following.图2 病原菌胁迫下草地早熟禾叶片中纤维素含量变化Fig.2 Changes of cellulose content in the leaves of Poa pratensis under pathogenic stress

图3 病原菌胁迫下草地早熟禾叶片中果胶含量变化Fig.3 Changes of pectin content in the leaves of Poa pratensis under pathogenic stress

图4 病原菌胁迫下草地早熟禾叶片中木质素含量变化Fig.4 Changes of lignin content in the leaves of Poa pratensis under pathogenic stress
2.2.3 病原菌胁迫下草地早熟禾叶片中木质素含量变化 如图4所示,在病原菌胁迫初期,各处理组的草地早熟禾叶片中木质素含量保持稳定,无显著差异(P>0.05)。胁迫7 d时,两组诱导处理的木质素含量上升较为明显,其中2,3-BD-PAL复合诱导处理的木质素含量积累最快,与CK相比显著高17.08%,之后保持稳定。而未诱导处理的木质素含量与CK之间无显著差异(P>0.05)。在胁迫15 d时,未诱导处理的木质素含量低于CK,并与2,3-BD-PAL复合诱导处理、2,3-BD诱导处理之间存在显著差异(P<0.05)。
2.3 病原菌胁迫下草地早熟禾叶片中纤维素酶活性变化
2.3.1 病原菌胁迫下草地早熟禾叶片中Cx活性变化 如图5所示,在没有病原菌入侵时,CK和各处理组的草地早熟禾叶片中Cx活性保持在一致水平。在接入病原菌后,各处理组叶片Cx活性均快速上升,并远高于0 d,具有显著差异(P<0.05)。在胁迫3 d时,各处理组Cx活性与CK相比依次高76.7%、65.5%和52.6%,差异显著(P<0.05)。在胁迫7和15 d时,未诱导处理的Cx活性虽有降低,但均显著高于两组诱导处理。在胁迫后期,2,3-BD-PAL复合诱导处理的叶片中Cx活性与未诱导处理和2,3-BD诱导处理之间均存在显著差异(P<0.05)。

图5 病原菌胁迫下草地早熟禾叶片中Cx活性变化Fig.5 Changes of Cx activity in the leaves of Poa pratensis under pathogenic stress
2.3.2 病原菌胁迫下草地早熟禾叶片中β-Glu活性变化 如图6所示,随胁迫天数的延长,各处理组的草地早熟禾叶片中β-Glu活性均显著高于CK(P<0.05)。在胁迫3 d时,各处理组的β-Glu活性与CK相比依次高83.1%、73.1%和64.3%,差异显著(P<0.05)。在胁迫7 d时,未诱导处理的β-Glu活性下降,与2,3-BD诱导处理接近一致,在胁迫后期又升高,与两组诱导处理之间差异显著(P<0.05)。在胁迫7和15 d时,2,3-BD-PAL复合诱导处理的β-Glu活性显著低于2,3-BD诱导处理(P<0.05)。

图6 病原菌胁迫下草地早熟禾叶片中β-Glu活性变化Fig.6 Changes of β-Glu activity in the leaves of Poa pratensis under pathogenic stress

图7 病原菌胁迫下草地早熟禾叶片中FPA活性变化Fig.7 Changes of FPA activity in the leaves of Poa pratensis under pathogenic stress
2.3.3 病原菌胁迫下草地早熟禾叶片中FPA活性变化 如图7所示,在病原菌胁迫下,各处理组的草地早熟禾叶片中的FPA活性变化趋势与Cx和β-Glu活性变化趋势相似。在胁迫3 d时,各处理组的FPA活性与CK相比均差异显著(P<0.05),分别高64.7%、42.9%和36.3%。其中未诱导处理的FPA增加速度最快、含量最高,并显著高于两组2,3-BD诱导处理。在胁迫7 d时,2,3-BD诱导处理的FPA活性上升,并显著高于未诱导处理(P<0.05)。在胁迫15 d时,未诱导处理的FPA活性与2,3-BD-PAL复合诱导处理相比具有显著差异(P<0.05)。
2.4 病原菌胁迫下草地早熟禾叶片中果胶酶活性变化
2.4.1 病原菌胁迫下草地早熟禾叶片中PMG活性变化 如图8所示,在病原菌胁迫3 d时,各处理组的草地早熟禾叶片中PMG活性均有显著上升,与CK相比依次高39.23%、27.06%和20.13%。其中,未诱导处理的PMG活性增加量大。之后随病原菌胁迫天数的延长,两组诱导处理的PMG活性恢复降低,与CK一致,无显著差异(P>0.05)。而未诱导处理的PMG活性在胁迫后期有小幅上升,与两组诱导处理相比差异显著(P<0.05)。

图8 病原菌胁迫下草地早熟禾叶片中PMG活性变化Fig.8 Changes of PMG activity in the leaves of Poa pratensis under pathogenic stress
2.4.2 病原菌胁迫下草地早熟禾叶片中PG活性变化 如图9所示,草地早熟禾叶片在没有受到外界胁迫时,其体内的PG活性维持在低水平条件下。在病原菌入侵3 d时,处理组的叶片中PG活性突增,与CK相比依次高89.1%、84.0%和75.5%,差异显著(P<0.05)。在胁迫7和15 d时,未诱导处理的PG活性先降低再升高,与CK差异显著(P<0.05)。同时2,3-BD-PAL复合诱导处理的PG活性显著低于2,3-BD诱导处理。在胁迫15 d时,两组诱导处理的PG活性与未诱导处理相比存在显著差异(P<0.05)。

图9 病原菌胁迫下草地早熟禾叶片中PG活性变化Fig.9 Changes of PG activity in the leaves of Poa pratensis under pathogenic stress

图10 病原菌胁迫下草地早熟禾叶片中PGTE和PMTE活性变化Fig.10 Changes of PGTE and PMTE activities in the leaves of Poa pratensis under pathogenic stress
2.4.3 病原菌胁迫下草地早熟禾叶片中PGTE和PMTE活性变化 如图10所示,在没有病原胁迫时,CK和各处理组的草地早熟禾叶片中PGTE与PMTE的活性水平基本一致,均处于极低活性条件下。当接入病原菌后,各处理组的叶片中PGTE和PMTE活性变化与CK相比均无显著差异(P>0.05)。在胁迫3 d时,处理组PGTE活性均低于CK,而PMTE活性与CK一致。在胁迫7和15 d时,未诱导处理的PGTE和PMTE活性均有所上升,并高于CK和两组诱导处理,但差异不显著(P>0.05)。在病原胁迫期间,两组2,3-BD诱导处理的叶片中PGTE活性均低于CK,而PMTE活性与CK保持一致。
2.5 病原菌胁迫下草地早熟禾叶片中细胞壁降解酶活性比较
在病原菌胁迫期间,通过对草地早熟禾叶片中细胞壁降解酶活性的平均差值进行比较(图11),发现各处理组的草地早熟禾叶片在受到病原菌胁迫时,其体内的Cx、β-Glu、PG、PMG和FPA活性均有升高,而PGTE和PMTE活性极低,变化不明显。其中Cx活性增加量最大,β-Glu和PG活性相近,这3种酶活变化量均高于其他4种酶。因此,7种细胞壁降解酶的活性大小依次为Cx>β-Glu>PG>PMG>FPA>PGTE=PMTE。同时未诱导处理的叶片中Cx、β-Glu、PG、PMG和FPA活性均高于两组诱导处理,并与2,3-BD-PAL复合诱导处理的酶活之间保持较大差异。在病害胁迫期间,2,3-BD-PAL复合诱导处理的叶片中酶活性整体低于2,3-BD诱导处理。
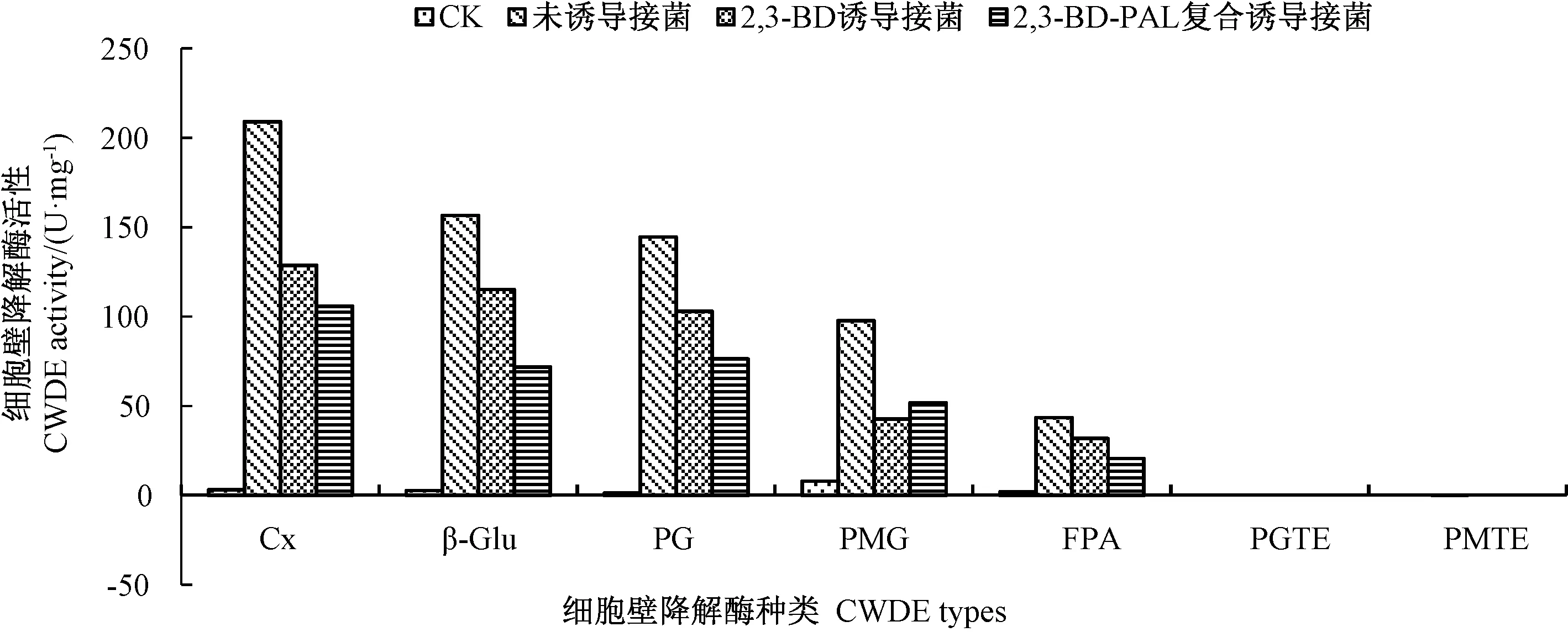
图11 病原菌胁迫下草地早熟禾叶片中细胞壁降解酶活性比较Fig.11 Comparison of CWDE activity in the leaves of Poa pratensis under pathogenic stress
3 讨论
3.1 病原菌胁迫下草地早熟禾叶片中细胞壁降解酶活性变化
病原菌在入侵寄主过程中,会分泌纤维素酶、果胶酶和蛋白酶等降解酶类以消解植物细胞壁结构,使其更好地定植于寄主细胞内,进行侵染和扩展[4]。其中,Cx和β-Glu是纤维素酶的构成组分,其主要作用是将细胞壁中天然纤维素连续水解成小分子葡萄糖。果胶酶是一种多组分复合酶,其含量上升可使植物体果胶含量降解,组织解离并腐软,促使植物衰老或死亡[22]。本研究中,随病原菌胁迫时间的延长,各处理组的草地早熟禾叶片中3种纤维素酶活性变化趋势基本相似,其中在病原胁迫3 d时,未诱导处理叶片的Cx、β-Glu和FPA活性快速上升到最大值,显著高于两组诱导处理,且2,3-BD-PAL复合诱导处理的酶活抑制效果优于2,3-BD单独诱导处理。各处理组的3种酶活变化幅度为Cx>β-Glu>FPA,说明Cx起主要降解作用。董国强等[23]报道立枯丝核菌产生的纤维素酶是一种典型的复合酶,能够快速分解天然纤维素,且Cx活力最高,这与本研究结果相符。同时,本研究各处理组的4种果胶酶活性变化中,PG活性上升明显,与3种纤维素酶活性变化趋势相一致;PMG活性在病原胁迫3 d时增加显著,之后有所恢复;PMET和PGET活性极低,对细胞壁降解作用不明显。陈夕军等[24]对水稻纹枯病研究中果胶酶活性变化的研究结果表明,立枯丝核菌分泌的果胶酶中PG活性最高,其次是PMG,而PGTE和PMTE活性很低,这与本研究结果一致。各处理组草株叶片中7种细胞壁降解酶的活性比较结果为Cx>β-Glu>PG>PMG>FPA>PGTE=PMTE。这表明菌丝在入侵草地早熟禾叶片期间会分泌出大量的Cx、β-Glu和PG,用于分解植物纤维素和果胶,使其快速侵入寄生细胞内。
本试验中,草株经2,3-BD诱导处理后,其叶片中Cx、β-Glu和PG等酶的活性被有效抑制,延缓了组织病变过程。李灿婴等[25]、刘晨霞等[264]分别使用茉莉酸甲酯(methyl jasmonate, MeJA)、酸性硫酸钙(acidic calcium sulfate, ACS)预处理桃果后,发现青霉(Penicilliumexpansum)、匍枝根霉(Rhizopusstolonifer)菌丝生长被明显抑制,β-Glu、Cx、PG、PMG、PGTE和PMTE等酶活性有效降低,病原菌致病力大大减弱,从而阻止了病斑的形成。这与本研究中2,3-BD的诱导效果相似,但其作用方式有所差异,2,3-BD并未通过直接抑制菌丝生长发挥作用,而是通过提高植物自身抗性来抵御病原菌的入侵[10]。但不同之处是,2,3-BD对立枯丝核菌生长无直接抑制作用,而是通过诱导提高植物自身抗性来抑制病原菌入侵[10]。与2,3-BD诱导相比,2,3-BD-PAL复合诱导进一步抑制了细胞壁降解酶活性升高,而2,3-BD诱导具有增强植株自身免疫力、构建细胞壁垒的作用[27]。由此推测,PAL能够利用强劲吸附力将2,3-BD固定于根系土壤周围,从而不断构建坚固的细胞防御屏障。当外界病原物侵入机体时,其产生的抗性水平强于2,3-BD单独诱导,从而更大幅度降低Cx、β-Glu和PG等酶对细胞壁的破坏程度。此外,本研究结果表明,纤维素酶Cx、β-Glu和果胶酶PG的活性变化趋势一致,均在病害初期时快速上升,其中纤维素酶Cx活性变化幅度最大,在病原侵入和最初扩展过程中,起到主要的降解破坏作用。也有研究指出,立枯丝核菌产生的众多细胞壁降解酶中,果胶酶最先产生,并大量分泌以助菌丝入侵寄主,纤维素酶后产生,参与病害扩展[28-29],与本研究结果不一致,这可能与立枯丝核菌的不同融合群对寄主的侵染方式、寄主类型及菌丝侵染时期、侵染过程有关。
3.2 病原菌胁迫下草地早熟禾叶片中细胞壁组成物质变化
纤维素作为植物细胞壁的骨架构成,通常由白色结晶态微纤丝聚集而成,其含量可达40%~70%[30-31]。果胶是细胞壁多糖组分,在控制细胞壁的多孔性、细胞间的黏连、细胞膨胀和病菌抗御等方面发挥重要作用[32]。本研究中,在病原菌入侵初期,未诱导处理叶片的Cx和β-Glu活性升高使得叶片中纤维素被快速降解,并在胁迫期间与CK保持显著差异,而两组诱导处理的纤维素含量下降范围小,与CK间差异不显著,其中2,3-BD-PAL复合诱导处理叶片的纤维素含量显著高于未诱导处理。陈梦茵[33]研究发现三磷酸腺苷(adenosine triphosphate, ATP)处理能有效降低果胶甲基酯酶(pectin methylesterase, PE)、PG和Cx、β-半乳糖苷酶活性,抑制纤维素和半纤维素等细胞壁组分的降解,从而保护细胞壁结构。本试验中,植株经诱导后,有效降低了叶片中Cx和β-Glu活性,抑制纤维素的降解,这与前人研究结果一致。同时,两组诱导处理的草地早熟禾叶片在受到病原菌刺激后,其体内果胶含量快速升高,并与CK相比差异显著,之后保持稳定;而未诱导处理的叶片果胶含量变化范围小,均低于两组诱导处理,与2,3-BD-PAL复合诱导处理之间存在显著差异。刘佩佩等[34]研究指出,果胶降解后会形成寡聚半乳糖醛酸(oligogalacturonides, OGs),OGs能被受体快速识别,进而激活植物应激反应,促使果胶多糖合成以增强细胞壁的硬度和刚度。由此推测,本研究中叶片果胶含量升高的原因是,菌丝分泌的果胶降解酶使部分果胶降解为OGs,激发了机体应答反应,从而开启代偿过程,合成更多果胶,巩固细胞结构。总之,草株经2,3-BD-PAL复合诱导处理后,根系周围中2,3-BD保持在高水平,当菌丝侵染时,2,3-BD诱导机体强烈反应,迅速激活防御体系,阻止纤维素降解,促进果胶生成,以加固细胞壁屏障,有效抵御菌丝入侵。同样,刘兴菊[17]研究发现,2,3-BD能使匍匐翦股颖叶片纤维素和果胶含量显著增加,并能通过其相互作用增强细胞壁结构,降低病害发生率。这进一步证实了2,3-BD诱导能够有效提高草坪草细胞壁的防御机能,阻止病原菌入侵。
木质素是一种复杂的酚类聚合物,是植物次生细胞壁的构成物质,赋予植物强度、硬度,是植物抵抗逆境和自我保护的重要结构屏障[35]。植物组织木质化不仅构成纤维素降解酶的物理屏障,而且可以通过疏水、静电和氢键作用与其形成无效吸附[36],降低病原酶解效应。本研究中,在菌丝入侵前期,由于缺乏木质素降解酶,使得各处理的草地早熟禾叶片中木质素含量保持不变。在胁迫中后期,两组诱导处理的木质素含量上升明显,而未诱导处理的木质素含量与CK之间无明显差异,并在胁迫后期显著低于两组诱导处理。邹丽[37]研究表明,病原菌侵入后,植物体内抗病信号分子SA、JA含量增加,并通过调控木质素合成,增加机体对病原菌的抗性。本研究中,2,3-BD诱导后,植株木质素含量明显积累,增加了细胞壁木质化程度,结合上述前人研究表明,外源诱导能够更快增加抗病信号分子的表达量,合成木质素以提高植物抗性。同时,PAL将2,3-BD在土壤中储蓄固定,对植物体进行最大限度地诱导供给,高效积累木质素,抵御菌丝入侵。此外,本研究中2,3-BD产生的ISR不同于水杨酸(salicylic acid, SA)介导的系统获得抗性(systemic acquired resistance, SAR),ISR诱抗过程中不产生病程相关蛋白(pathogenesisrelated genes, PR),通过依赖于NPR1上调次生代谢产物合成相关酶基因表达,使机体免疫反应处于防御启动状态[38]。当2,3-BD-PAL复合诱导的植物,在面对病虫害攻击时能够更快更精准地激活防御反应链,产生更强的抗性水平,对抗逆境伤害。同时2,3-BD诱导、2,3-BD-PAL复合诱导与病原菌刺激可能对植物产生双重诱抗机制,既产生SAR又产生ISR,使机体中SA途径和JA/ET途径之间可能存在协同表达,共同增强植物抗病性[23]。
综上,本研究结果表明在整个病害胁迫期间,未诱导处理的叶片中纤维素结构被病原分泌的Cx和β-Glu快速降解,果胶含量虽有增加,但木质化程度低下,其叶片抵抗力明显不及两组诱导处理。而植物经2,3-BD-PAL复合诱导处理后,可能利用PAL本身强大吸附性和黏结性,将2,3-BD进行吸附释放,使之能够持续性诱导植物抗性水平的不断提升,更大程度上抑制菌丝的入侵,降低叶片中降解酶的活性,减轻病害发生率。尚千涵[39]通过对油菜经济性状的研究发现,质量分数15%的PAL包衣的磷酸二铵的缓释效果好于单施磷酸二铵的处理,抗衰老及抗逆性能力显著提升。王桂苓等[40]指出PAL能有效吸附肥料中部分N、P、K等,以延长并提高肥料利用率,促进植物营养生长,增强抗逆性。这些研究都表明PAL能够利用其多孔性的晶体结构特点,将吸附的农药和肥料以S型曲线缓释,既降低了农药化肥的用量和次数,又延缓了病害的发生。PAL与农药化肥配施与本试验中PAL和2,3-BD复合诱导可能存在相似机理,均为缓释增强作用,进一步验证了PAL广泛的应用价值。
4 结论
本研究中,草地早熟禾经2,3-BD诱导处理后,其叶片中Cx、β-Glu和PG等酶的活性被有效抑制,延缓了组织病变过程。而2,3-BD-PAL复合诱导的植株在受到菌丝入侵时,能快速高效地促进果胶和木质素积累,并减弱Cx和β-Glu酶对叶纤维素的降解作用,从而保障细胞壁结构的完整性,极大程度地提高植物对病害的防御能力。本研究仅在实验室条件下验证了2,3-BD与PAL对草地早熟禾的复合诱导效果,缺乏田间的理论研究。后期可在大田基础上开展2,3-BD-PAL复合制剂对草坪草抗病性的诱导作用研究,为促进生态环境可持续发展提供理论依据。
