1 株鸡源奇异变形杆菌的分离鉴定及药敏试验
2022-09-20熊菊萍肖滢宇韩青松高小龙李增魁仝丽娜
熊菊萍,肖滢宇,张 诚,韩青松,高小龙,李增魁,文 英,仝丽娜
(1.青海大学农牧学院,青海 西宁 810016;2.温州科技职业学院,浙江 温州 325006)
奇异变形杆菌(Proteus mirabilis)是肠杆菌科变形杆菌属的一种兼性厌氧革兰阴性杆菌。 该菌广泛存在于土壤、污水、污泥和动物及人体体表、黏膜、消化道、粪便中,是一种常见的条件致病菌[1]。在一定条件下, 如人体免疫力下降时, 可引起腹泻、尿道炎、腹膜炎、脑膜炎、菌血症和败血症等疾病,其中以泌尿系统感染最常见[2-4]。 同时,奇异变形杆菌也是引发细菌性食物中毒的第四大病原菌[5]。 奇异变形杆菌不仅可以感染人,还可以感染牛、羊、猪、犬、兔、狐狸、竹鼠、食蟹猴、大熊猫等多种动物[6-10]。 近年来,因奇异变形杆菌感染引发的幼畜和家禽发病或死亡的情况在我国多省份均有报道,且该菌临床分离率呈上升趋势,威胁着人类健康和畜禽养殖业健康发展[10-13]。 并且,为了促进动物生长和减少细菌病发生, 部分养殖场对抗生素类药物的不合理、不规范使用,甚至滥用,加剧了耐药菌株的出现。 李欣楠等[14]从辽宁肉鸡养殖场分离的67 株奇异杆菌, 对11 种抗生素耐药性普遍较高,其中对黏杆菌素E、氟苯尼考和磺胺异噁唑等9 种药物耐药率可达80%。 徐睿等[15]从西昌地区鸡场分离到2 株奇异变形杆菌, 该2 株菌对14 种抗生素耐药率分别为78.6%和71.4%。 庞洪泽等[16]从秦皇岛地区的鸡场中分离到1 株多重耐药奇异变形杆菌。 多重耐药性的不断出现增加了该病防治的难度。因此,调查了解奇异变形杆菌耐药性状况, 对指导青海省养鸡场合理用药具有重要意义。
2019 年11 月, 青海省大通县某肉鸡场的部分鸡发病,初期病鸡精神沉郁、羽毛蓬乱,并排出黄绿色和水样稀粪,后期有鸡只死亡。为确定病鸡死亡原因,该研究从发病鸡场采集病料,分离到一株疑似菌,经革兰染色镜检、生化鉴定、16S rDNA和tuf 特异性基因PCR 扩增与测序后, 鉴定为奇异变形杆菌, 并对分离菌进行了致病性试验和药敏试验, 旨在为禽类奇异变形杆菌病的防治提供参考。
1 材料与方法
1.1 病料来源
青海省大通县某肉鸡场的部分鸡发病, 临床症状为羽毛蓬乱、精神沉郁并排出黄绿色稀粪。从上述病鸡无菌采集肝脏、 脾脏和泄殖腔拭子等作为病料。
1.2 主要试剂
营养琼脂培养基购自北京奥博星生物技术有限责任公司;MH 琼脂培养基、营养肉汤培养基购自杭州微生物试剂有限公司;SS 琼脂、 细菌微量生化鉴定管、 药敏纸片均购自青岛高科技工业园海博生物技术有限公司; 麦氏比浊管购自温州市康泰生物科技有限公司; 革兰染色剂购自北京索莱宝科技有限公司;DL 2 000 DNA Marker 购自天根生化科技有限公司;2×EasyTaq PCR SuperMix购自北京全式金生物技术有限公司; 胶回收试剂盒购自生工生物工程(上海)股份有限公司。
1.3 试验动物
10 只2 周龄SPF 白来航雏鸡购自济南赛斯家禽科技有限公司。
1.4 分离培养与染色镜检
将采集的病料划线接种普通营养琼脂和SS琼脂,置于37 ℃恒温培养箱18~36 h,并观察菌落形态,挑取可疑菌落在营养琼脂和SS 琼脂平板上分区划线,进行纯化。纯化后的可疑菌落进行革兰染色镜检。 接种纯化后的疑似菌落至营养肉汤,37 ℃振荡培养18~24 h。
1.5 生化鉴定
将“1.4”项下营养肉汤中培养的细菌用无菌生理盐水稀释到0.5 麦氏浓度(约1×108CFU/mL)后, 按照生化鉴定管说明书接种于细菌微量生化鉴定管中,37 ℃培养24~48 h,参照《伯杰细菌鉴定手册》(第八版)进行结果判定。
1.6 细菌16S rDNA 和奇异变形杆菌tuf 基因扩增
使用水煮法提取细菌基因组DNA。 在SS 琼脂平板上挑取单个菌落接种于2 mL 营养肉汤培养基中,37 ℃、180 r/min 振荡培养12 h,用微量移液器吸取400 μL 菌液于1.5 mL 离心管中,12 000 r/min 离心2 min,弃去上清液,用无菌水重悬,放入沸水中煮8 min 后,12 000 r/min 离心2 min,取上清液即为DNA 模板,于-20 ℃保存。
设计16S rDNA 和奇异变形杆菌tuf 基因特异性引物,引物序列为16S rDNA-F:CAGGCCTAACACATGCAAGTC,16S rDNA -R:GGGCGGWGTGTACAAGGC, 产 物 大 小 为 1 400 bp;tuf -F:AAATTGTTGAATTAGCAGAAGCA,tuf -R:GCGATTGGGTGGATCAGTTC,产物大小为540 bp。以制备的细菌基因组DNA 为模板进行PCR 扩增,16S rDNA 和tuf 基因扩增反应体系均为:2×Taq Mix 25 μL、上下游引物各1 μL、模板2 μL,无酶灭菌水21 μL;阴性对照反应体系除模板改为无酶灭菌水外,其余组分同上。 16S rDNA 扩增反应条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,35 个循环;72 ℃延伸10 min。tuf 基因扩增反应条件为:57 ℃退火30 s,72 ℃延伸30 s, 其余反应条件同16S rDNA 扩增反应条件。 PCR 产物经1%琼脂糖凝胶电泳检测,切下目的片段,进行胶回收,将产物送生工生物工程(上海)股份有限公司测序,测序结果与GenBank 上公布的序列进行BLAST 比对。 用DNAStar 软件进行序列同源性分析,用MEGA 软件构建系统发育树。
1.7 雏鸡致病性试验
将10 只2 周龄SPF 雏鸡随机分为试验组和对照组。 试验组腹腔注射1 mL 的菌液(1 个麦氏比浊度,约3×108CFU/mL),对照组腹腔注射无菌肉汤1 mL。接种后每隔12 h 观察并记录雏鸡精神状况和死亡情况,并对死亡雏鸡进行解剖,无菌采集心脏、肝脏和脾脏,进行细菌分离鉴定。
1.8 药敏试验
采用K-B 纸片扩散法进行药敏试验。 挑取平板纯化的菌落, 接种至5 mL 营养肉汤培养基中,37 ℃、180 r/min 振荡培养12 h。 用生理盐水将菌液稀释至0.5 麦氏浓度(约1×108CFU/mL)。 用无菌棉签蘸取稀释好的菌液均匀涂抹在MH 琼脂平板上,并贴上药敏纸片,放入37 ℃恒温培养箱培养24 h 后测量抑菌圈直径并记录。 根据美国临床和实验室标准协会 (Clinical and Laboratory Standards Institute,CLSI) 推荐的纸片扩散法标准进行结果判定。
2 结果与分析
2.1 细菌的形态特征和镜检结果
分离菌在SS 琼脂培养基上为半透明、中央黑色或整个菌落都呈黑色的圆形扁平菌落 (见图1A)。 革兰染色镜检可发现长短不一、两端钝圆的革兰阴性杆菌,单个或成簇分布(见图1B)。
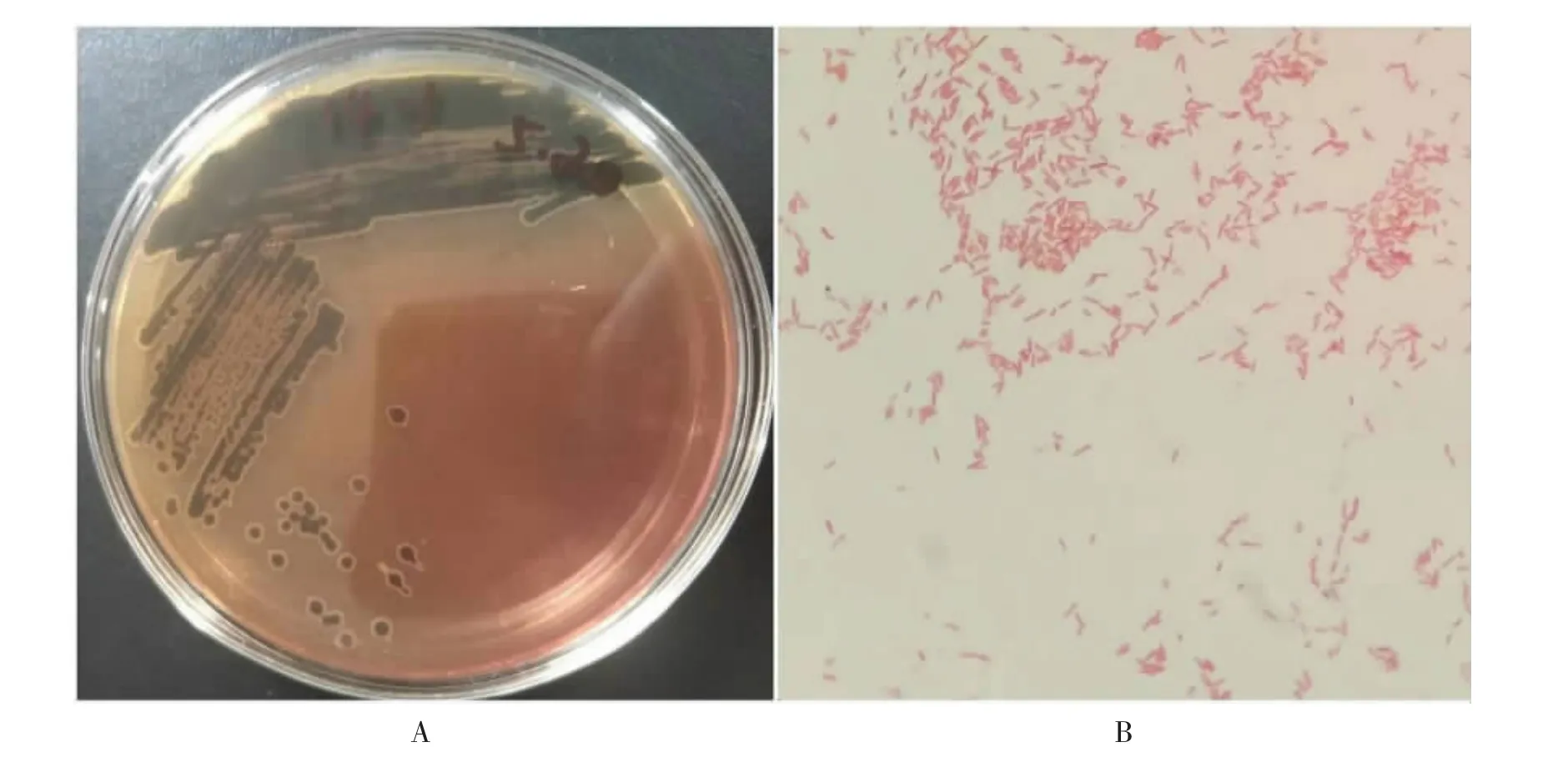
图1 分离菌株菌落形态和革兰染色镜检结果
2.2 生化试验
分离菌生化鉴定结果如表1 所示, 苯丙氨酸酶、明胶、鸟氨酸脱羧酶、尿素酶、木糖、脂酶和水杨苷试验呈阳性;西蒙枸橼酸盐、色氨酸肉汤、麦芽糖、 甘露醇和七叶苷水解试验反应呈阴性,与《伯杰细菌鉴定手册》中奇异变形杆菌的生化特征相对应。

表1 生化鉴定结果
2.3 细菌16S rDNA 和tuf 基因扩增
以水煮法制备的DNA 为模板, 用16S rDNA引物通过PCR 成功扩增出1 400 bp 左右的目的条带,琼脂糖凝胶电泳结果见图2。 切胶回收该目的条带,回收产物送生工生物工程(上海)股份有限公司测序。 测序结果与GenBank 上公布的序列进行BLAST 比对,显示与奇异变形杆菌同源性高达99.9%。 同时,用奇异变形杆菌特异性tuf 基因特异性引物通过PCR 成功扩增出540 bp 左右的目的条带,琼脂糖凝胶电泳结果见图3。 将分离株命名为DT1。
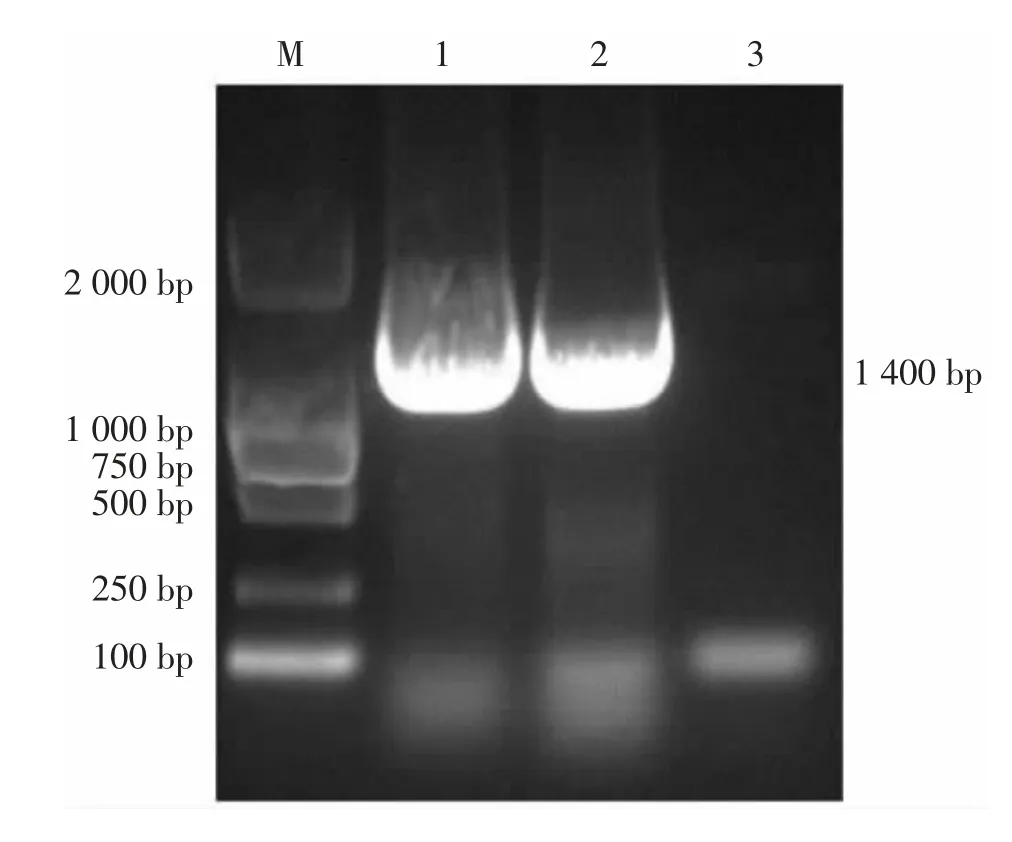
图2 16S rDNA PCR 扩增结果
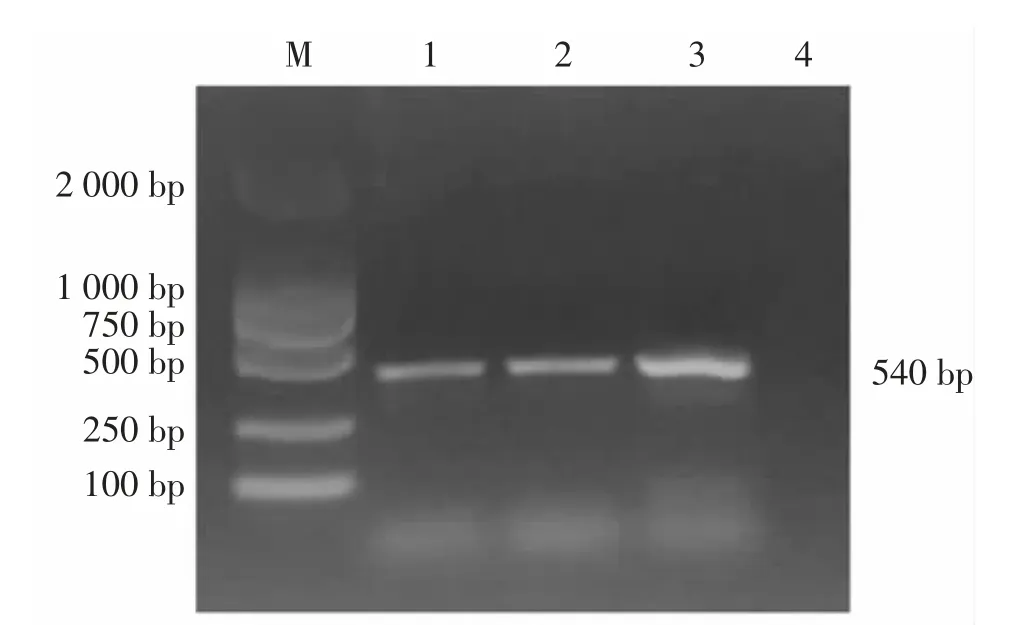
图3 tuf 基因PCR 扩增结果
2.4 16S rDNA 基因系统进化分析
由图4 可知,青海大通分离株DT1 与23 个参考株16S rDNA 序列进行比对, 同源性为96.7%~99.9%。 DT1 与孟加拉国水体分离株(GenBank 登录号:MH010137)、 尼日利亚鸡分离株(GenBank登录号:LC385636)、印度鱼分离株(GenBank 登录号:KU378106)、 中国河南狐狸分离株(GenBank登录号:EU3643833) 和中国山东人分离株(Gen-Bank 登录号:GQ259884)同源性最高,达99.9%;与中国河南鸡分离株 (GenBank 登录号:KJ156620)同源性最低,为96.7%。
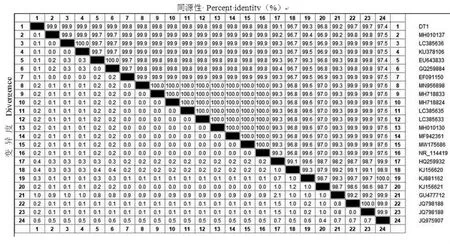
图4 16S rDNA 序列同源性比对
对DT1 株与GenBank 中收录的23 株奇异变形杆菌16S rDNA 序列绘制系统进化树。由图5 可知,24 株奇异变形杆菌在进化上分为两大支,奇异变形杆菌来源广泛,宿主多,DT1 株与中国河南狐狸分离株(GenBank 登录号:EU3643833)和中国山东人分离株(GenBank 登录号:GQ259884)属于同一分支,遗传关系最为密切。
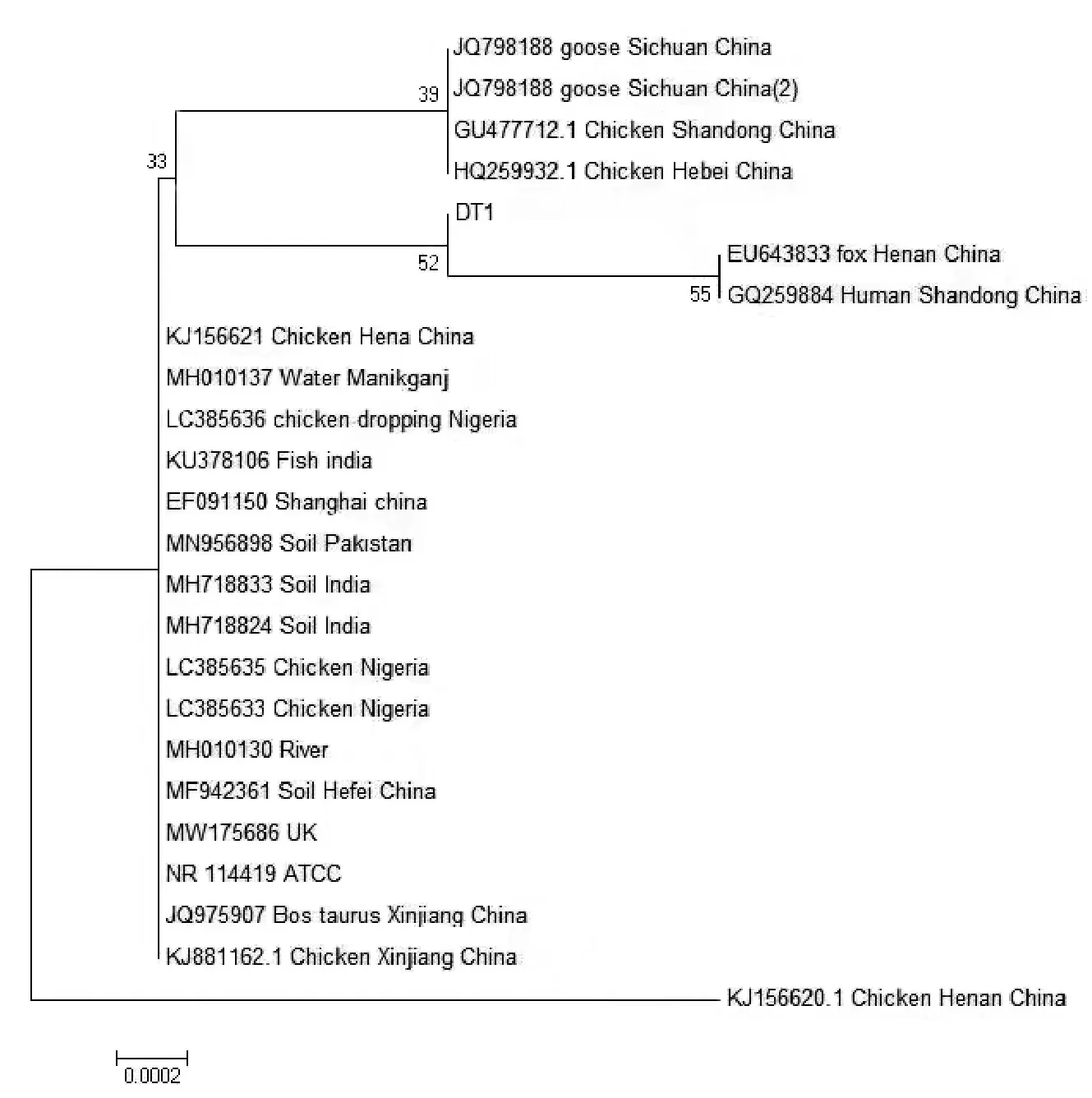
图5 16S rDNA 系统进化树
2.5 雏鸡致病性试验
试验组接种菌液8 h 后雏鸡开始发病, 主要表现为精神沉郁、排黄色稀粪;12 h 后,雏鸡相继死亡,至48 h 全部死亡。 并且从死亡雏鸡的心脏、肝脏和脾脏中再次分离到该病原菌, 而对照组雏鸡全部存活,表明该株奇异变形杆菌具有致病性。
2.6 药敏试验
根据CLSI 药敏试验判定标准, 如表2 所示,分离菌对哌拉西林、头孢吡肟、头孢噻肟、头孢西丁、氨曲南、阿米卡星、卡那霉素、氧氟沙星、美罗培南等药物高度敏感,对环丙沙星、奥格门汀中度敏感,对氨苄西林、阿莫西林、头孢唑啉、万古霉素、庆大霉素、链霉素、阿奇霉素、四环素、多西环素、萘啶酸、氯霉素、克林霉素、呋喃妥因、利福平、多黏菌素B、氟苯尼考产生了耐药性。
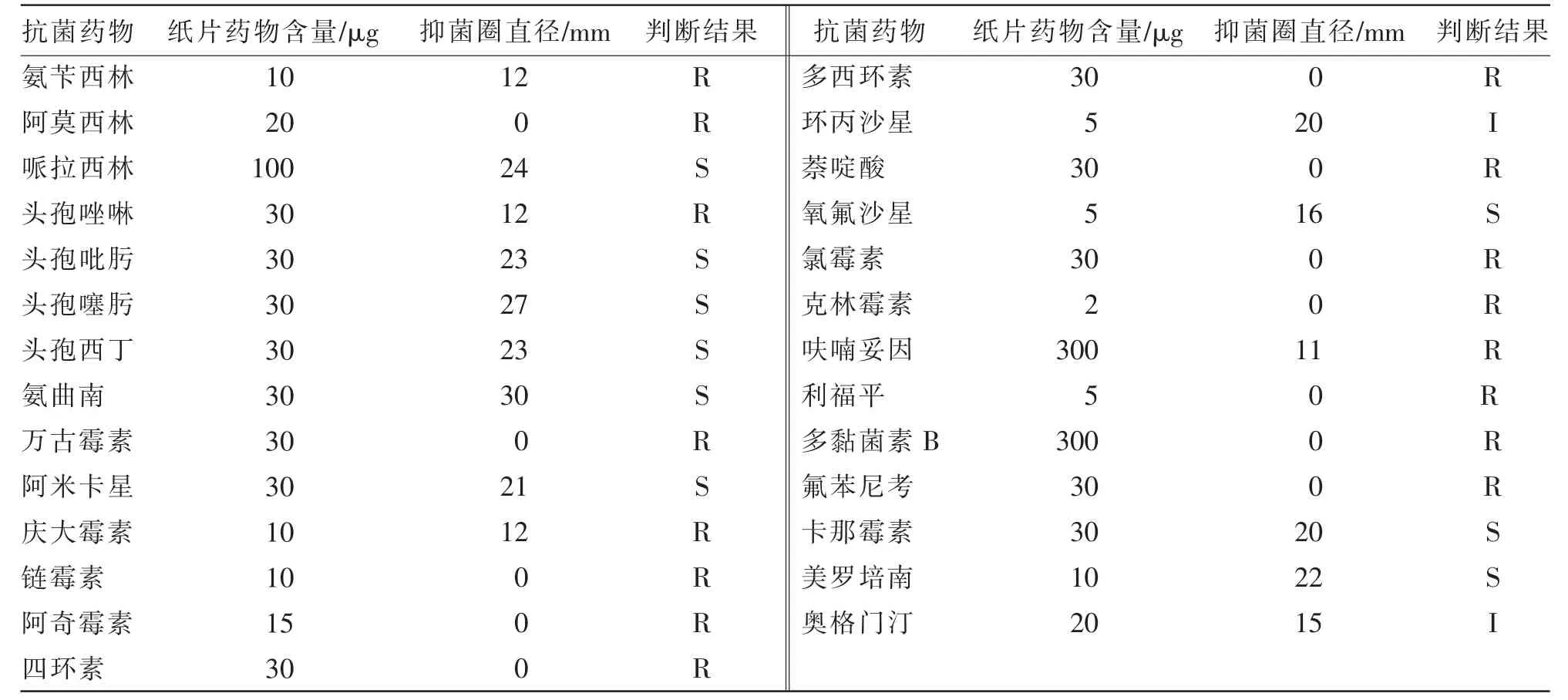
表2 药敏试验结果
3 讨论
近年来,奇异变形杆菌感染家禽的情况时有报道,并且种鸡感染后可垂直传播给后代,造成雏鸡发病死亡,对养禽业有较大危害[16]。为查明青海省大通县某鸡场肉鸡发病死亡原因,该研究无菌采集病死鸡病料,进行细菌的分离培养鉴定。 目前,细菌分类鉴定方法主要有两种: 一种是基于形态学和生化反应的鉴定法,另一种是核酸分类法[17-18]。基于形态学和生理生化的鉴定法需要对细菌进行纯培养,然后进行形态学观察,再将纯培养物接种生化反应管来加以鉴定,鉴定过程往往费时费力。16S rDNA 大小适中(1.5 kb),其内部既含有同类菌之间高度保守的序列, 又含有不同种类菌高度变异的差异序列, 是目前核酸法鉴定细菌种属的理想靶标,已广泛应用于细菌分类鉴定上,且操作相对简便快速[19]。该研究为快速、准确鉴定分离菌类别,在细菌纯培养后,挑取平板上的可疑菌落进行了16S rDNA 扩增和测序, 通过与GenBank 中公布的序列比对后, 发现与奇异变形杆菌同源性最高,为99.9%。 随后,又对分离的疑似菌同步进行了革兰染色镜检和生化试验, 进一步确认分离的疑似菌为奇异变形杆菌, 为疾病快速诊断奠定了基础。
为鉴定该分离菌是否具有致病性, 选择2 周龄SPF 雏鸡进行了攻毒试验, 结果表明该奇异变形杆菌具有致病性,雏鸡致死率可达100%,并且从病死鸡脏器中分离到该菌, 表明发病鸡场病原为该株奇异变形杆菌。细菌病由于血清型多、致病机制复杂、毒力因子众多,往往缺乏有效的疫苗,抗生素仍是目前防治细菌病的最有效手段。然而,由于抗生素不规范、不合理使用,使包括奇异变形杆菌在内越来越多的细菌产生了多重耐药性,给细菌病防治带来一定的困难[19]。 为评价该研究分离的该株奇异变形杆菌耐药性,选取9 大类27 种药物进行药敏试验,结果显示分离菌对青霉素类、β-内酰胺类、糖肽类、氨基糖苷类、大环内酯类、四环素类的少部分药物产生了耐药性, 而对喹诺酮类中的绝大多部分药物产生了耐药性,对头孢类、单酰胺菌素类中的一些药物高度敏感, 表现为多重耐药,与先前报道的结果基本一致[20]。 因此,发生细菌性疾病时,迅速分离致病菌,进行药物敏感试验,选择敏感药物对控制疫病至关重要。
4 结论
从发病鸡场分离到一株奇异变形杆菌, 该菌对鸡具有较强的致病性,且表现为多重耐药。
