PTD-FNK 蛋白对雄性小鼠生理功能的影响
2022-09-20刘嘉欣刘浩宇余波龙胡传活
刘嘉欣,刘浩宇,余波龙,陈 婷,胡传活,李 珣
(广西大学动物科学技术学院,广西 南宁 530004)
PTD-FNK 蛋白由超级抗凋亡蛋白FNK 与蛋白转导域PTD 融合而成[1],可以保护细胞免受多种病理条件诱导的死亡[2]。 目前PTD-FNK 蛋白在医学领域研究较多,如治疗化疗引起的秃头症[3]、提高骨髓单个核细胞移植效率[1]、保护细胞免受冻融诱导的死亡损伤[4]。 PTD-FNK 蛋白的抗细胞凋亡优势具有广阔的发展前景。 有研究发现,PTD-FNK 蛋白能迅速透过血脑屏障进入脑细胞[5]。 而在大鼠心脏缺血/灌注模型中,PTD-FNK蛋白只在局部缺血早期才能进入心肌细胞[6]。 这些结果提示,PTD-FNK 蛋白对动物机体并非具有完全的保护作用。该试验以雄性小鼠为研究对象,探讨PTD-FNK 蛋白对小鼠饮食、生长、生殖及其他生理功能的影响,以期为进一步阐明PTD-FNK蛋白对机体的保护作用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 实验动物
16 只6 周龄健康雄性C57BL/6J 小鼠, 体重(25±2)g,购自广西医科大学实验动物中心。
1.1.2 试验试剂
PTD-FNK 蛋白由广西大学动物科学技术学院解剖实验室提供。Trizol、RNA 酶抑制剂、反转录试剂盒、qPCR Master Mix 均购于南京诺唯赞生物科技有限公司。
1.1.3 试验仪器
BSM-2200.2 型电子分析天平,上海卓精电子科技有限公司产品;Light Cycler 96 型实时荧光定量PCR 仪,Roche 公司产品;DT-810 型红外线体温检测仪,南北仪器有限公司产品。
1.2 试验方法
1.2.1 实验动物分组及饲养管理
小鼠在温度为(24±2)℃、湿度为(50±10)%、光照为12L∶12D 的环境下单笼饲养, 自由采食饮水。 适应性饲养2 周后,将小鼠随机分为2 组,即对照组 (腹腔注射生理盐水0.1 mL/只) 和PTDFNK 蛋白组[腹腔注射300 μg/(kg·BW)PTD-FNK蛋白],每组8 只,每天腹腔注射给药1 次(19:00),连续给药7 d。
1.2.2 小鼠健康指标及采食饮水量测定
试验期间,每天记录小鼠体重、体温、血糖以及白天和夜间的采食量和饮水量, 并统计当天的总采食量和总饮水量。
1.2.3 小鼠生长性能测定
于试验第1 天和最后1 天测量鼻肛距, 分别计算试验开始时和试验结束时体长。 计算试验期间的体增重、试验前后的Lee′s 指数。体增重=试验结束体重-试验开始体重。 Lee′s 指数=体重(g)1/3×103/体长(cm)。
1.2.4 脏器指数的测定
将小鼠以颈椎脱臼法处死,取出心脏、肝脏、睾丸、脾脏、肾脏,称重并计算脏器指数。 脏器指数=脏器湿重/小鼠体重[7]。
1.2.5 精子活力及质膜完整率检测
分离小鼠附睾,制备精子悬液[8],精子活力检测 参 考Pourentezari 等[9]和Sm 等[10]报 道 的 方 法。取10 μL 精液制片,高倍镜(400 ×)下镜检,统计活动的精子数,计算精子活力。 精子活力=活动精子数/总精子数。
精子质膜完整率检测参考Ommati 等[11]和Dolati 等[12]报道的方法。 将精液与果糖-柠檬酸钠低渗溶液混合,37 ℃水浴10 min, 取20 μL 混合液,高倍镜(400×)下镜检,统计尾部弯曲的精子数,计算精子质膜完整率。 精子质膜完整率=尾部弯曲精子数/总精子数。
1.2.6 睾丸组织HE 染色
将固定好的睾丸组织流水过夜冲洗, 不同浓度酒精梯度脱水,正丁醇透明后浸蜡包埋,完全凝固后进行切片,37 ℃烘干,4 ℃保存。 制备好的切片用二甲苯和无水乙醇梯度脱蜡、脱水,苏木精、伊红染色,酒精梯度脱水后封片,显微镜下观察并拍照[13]。
1.2.7 睾丸细胞凋亡、氧化应激、内分泌相关基因mRNA 相对表达量检测
收集并研磨睾丸样品, 采用Trizol 法提取睾丸总RNA,并按照反转录试剂盒说明书的步骤将RNA 产物逆转录为cDNA[14],随后利用qPCR 法检测睾丸组织中细胞凋亡相关基因Bax 和Caspase-3、氧化应激相关基因SOD 和GPX1、内分泌相关基因STAR 和17β-HSD 的mRNA 相对表达量, 内参基因为GAPDH。 反应体系为20 μL:qPCR Master Mix 10 μL, 上、 下游引物各1 μL,ddH2O 7 μL,cDNA 模版1 μL。 反应条件为:95 ℃预变性3 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸60 s,循环35 次;72 ℃延伸5 min。 所有反应重复3 次[15]。 所用引物如表1 所示。 相关基因mRNA 相对表达量用2-△△Ct法计算。

表1 qPCR 所用引物信息
1.3 统计分析
试验数据采用SPSS 18.0 统计学软件进行独立t 检验, 各组数据以“平均值±标准误”(Mean±SEM)的形式表示,并进行显著性检验;用Graph-Pad Prism 9 软件分析结果并作图。
2 结果与分析
2.1 PTD-FNK 蛋白对小鼠健康指标及采食饮水的影响
如图1 所示, 与对照组相比,PTD-FNK 蛋白组小鼠7 d 内总采食量和7 d 内夜间12 h 的总采食量均极显著(P<0.001)降低,7 d 内白天12 h 的总采食量无显著(P>0.05)变化;此外,PTD-FNK蛋白组小鼠7 d 内总饮水量显著(P<0.05)降低,7 d 内夜间12 h 的总饮水量极显著 (P<0.001)降低,7 d 内白天12 h 的总饮水量无显著(P>0.05)变化;PTD-FNK 蛋白组的体温和血糖均无显著 (P>0.05)变化。
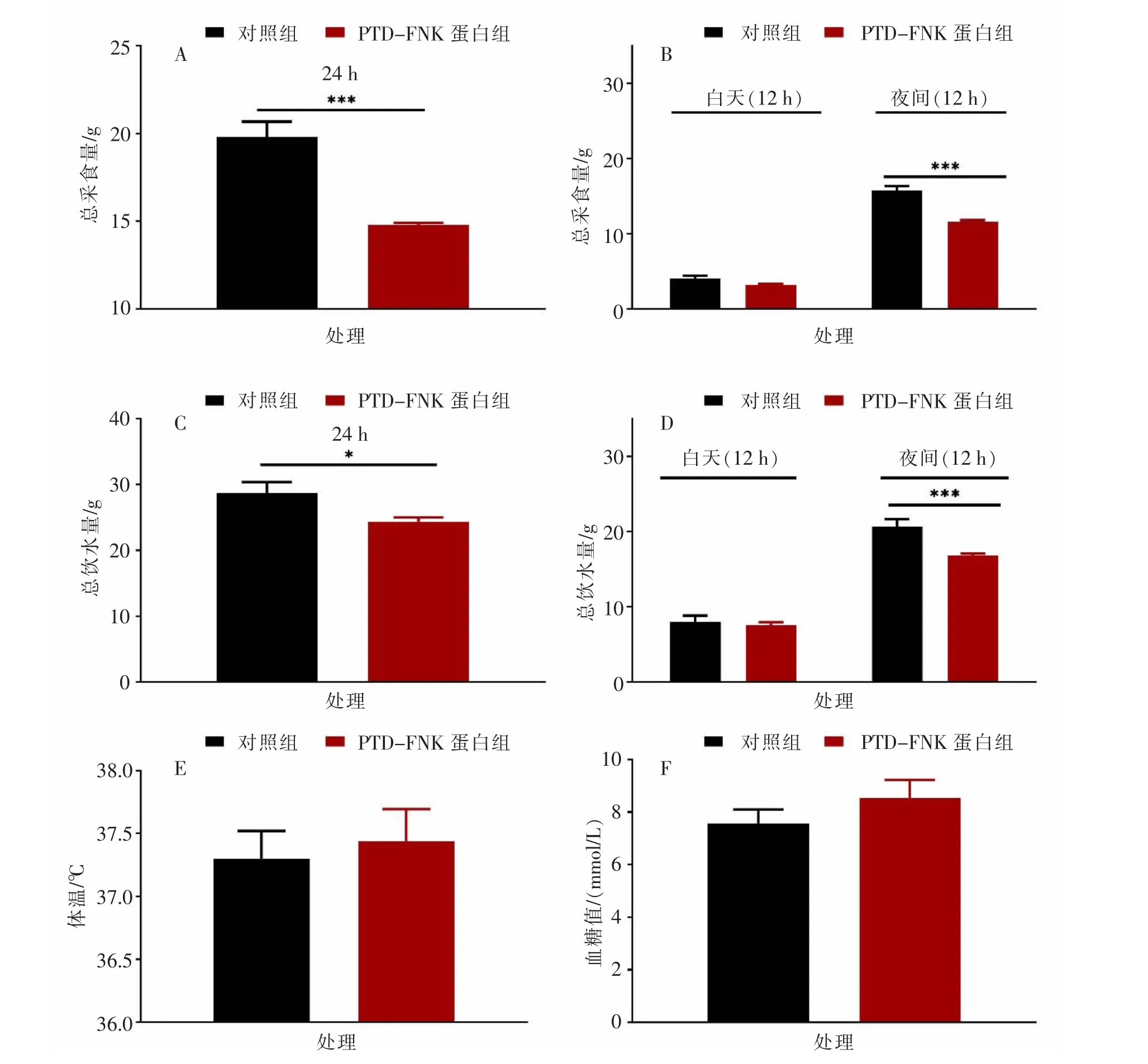
图1 小鼠健康指标及采食饮水情况
2.2 PTD-FNK 蛋白对小鼠生长性能的影响
如图2 所示, 与对照组相比,PTD-FNK 蛋白组小鼠的体增重、 试验前后Lee′s 指数均无显著(P>0.05)变化。

图2 小鼠生长性能
2.3 PTD-FNK 蛋白对小鼠脏器指数的影响
如图3 所示,与对照组相比,PTD-FNK 蛋白组小鼠肝脏指数显著(P<0.05)降低,小鼠的心脏、肾脏、脾脏、睾丸等脏器指数均无显著(P>0.05)变化。

图3 小鼠脏器指数
2.4 PTD-FNK 蛋白对小鼠精子质量的影响
如图4 所示, 与对照组相比,PTD-FNK 蛋白组小鼠精子活力极显著(P<0.01)提高,小鼠精子质膜完整率无显著(P>0.05)变化。

图4 小鼠精子质量
2.5 小鼠睾丸组织的病理学观察
如图5 所示,对照组小鼠睾丸组织结构完整,生精上皮厚度正常,各级生精细胞排列整齐、发育良好, 有大量支持细胞和间质细胞。 与对照组相比,PTD-FNK 蛋白组生精小管中可见有大量的成熟精子,但部分生精小管间隙增大。
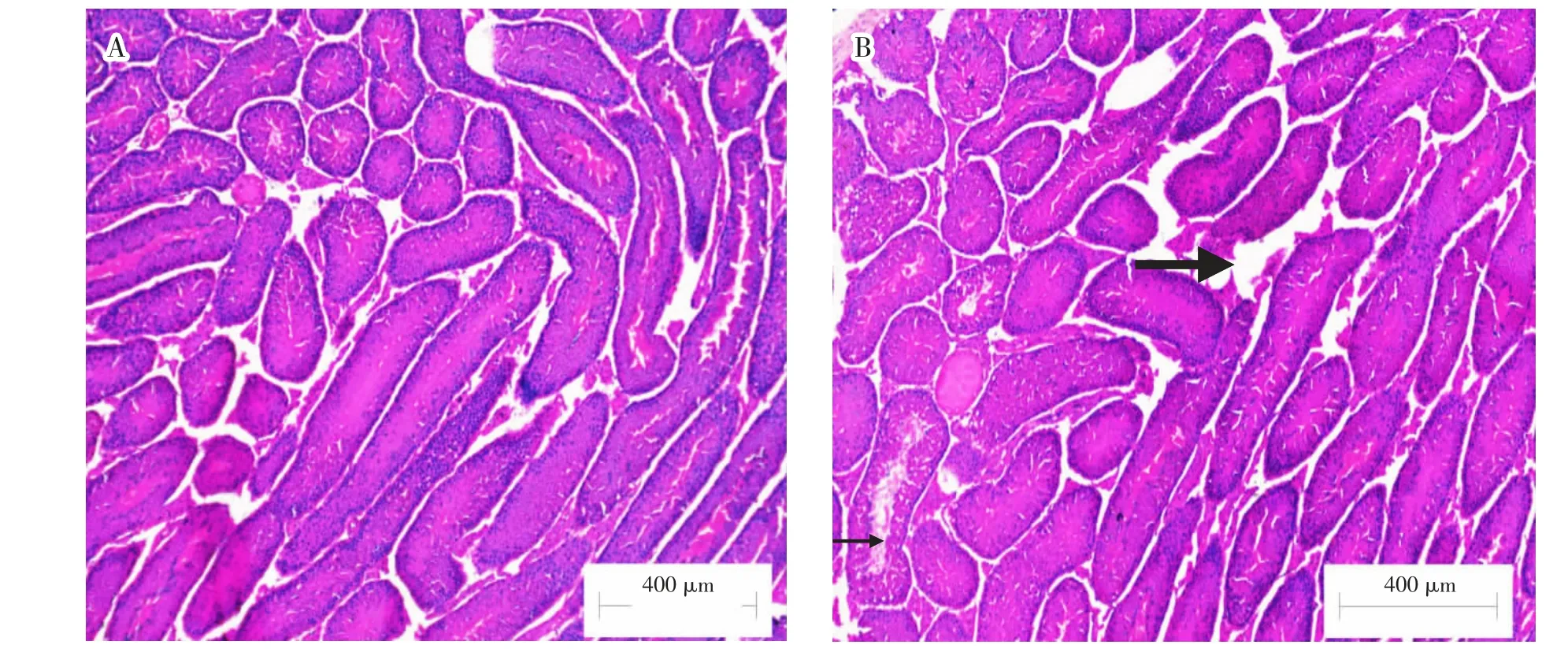
图5 小鼠睾丸组织切片(HE,100×)
2.6 PTD-FNK 蛋白对小鼠睾丸细胞凋亡的影响
如图6 所示, 与对照组相比,PTD-FNK 蛋白组小鼠睾丸中Bax 基因的mRNA 相对表达量极显著(P<0.01)升高,睾丸中Caspase-3 基因的mRNA相对表达量无显著(P>0.05)变化。

图6 小鼠睾丸Bax 和Caspase-3 基因的mRNA 相对表达量
2.7 PTD-FNK 蛋白对小鼠睾丸氧化应激的影响
如图7 所示, 与对照组相比,PTD-FNK 蛋白组小鼠睾丸中SOD 基因的mRNA 相对表达量极显著 (P<0.01) 提高, 小鼠睾丸中GPX1 基因的mRNA 相对表达量无显著(P>0.05)变化。

图7 小鼠SOD 和GPX1 基因的mRNA 相对表达量
2.8 PTD-FNK 蛋白对小鼠睾丸分泌功能的影响
如图8 所示, 与对照组相比,PTD-FNK 蛋白组小鼠睾丸中STAR 和17β-HSD 基因的mRNA相对表达量均无显著(P>0.05)变化。

图8 小鼠STAR 和17β-HSD 基因mRNA 相对表达量
3 讨论
自人工合成PTD-FNK 蛋白出现以来,开展的研究以该蛋白对各组织、器官损伤的保护为主。目前 已 知PTD-FNK 蛋 白 对 冻 存 精 子[16]、缺 血/再 灌注引起的心肌梗死[6]、急性肺损伤[17]、短暂的全身缺血引起的海马体神经元死亡有保护作用[18],鲜有针对整个动物机体的研究,PTD-FNK 蛋白调控动物机体生理功能的机制尚不清楚。 该试验在已有研究的基础上对健康小鼠进行腹腔注射PTDFNK 蛋白试验, 探索PTD-FNK 蛋白对动物机体生理功能的影响, 以期为提高畜禽的生长性能和繁殖优良个体提供新思路。
PTD-FNK 蛋白是Bcl-xl 蛋白的一个功能型增强体[19],Bcl-xl 蛋白为Bcl-2 家族抗凋亡分子中的一员[20],由于与PTD-FNK 蛋白、FNK 蛋白相关的文献报道鲜见, 该文多处引用与Bcl-xl 蛋白和Bcl-2 蛋白相关的文献。 试验中PTD-FNK 蛋白组小鼠采食量和饮水量显著下降,可能与PTD-FNK蛋白的剂量及试验时间有关。 与对照组相比,PTD-FNK 蛋白组心脏、脾脏、肾脏、睾丸指数以及Lee′s 指数、体重、血糖、体温均变化不明显,但肝脏指数显著下降。 据报道,正常情况下空腹时,血糖的维持依赖于促胰岛素的分泌以及肝脏在胰岛素的刺激下控制肝糖原生成和输出[21],该试验中PTD-FNK 蛋白组小鼠可能因采食量显著减少,糖原摄入不足, 导致肝脏增加分解代谢将肝糖原转化为葡萄糖以维持血糖稳定, 同时该组小鼠体重略有升高,这些可能是导致肝脏指数降低的原因。Ke 等[22]研 究 发 现 敲 除 小 鼠Bcl-2 基 因 后 小 鼠 的体重下降,瘦肉量显著减少,结合该试验结果,说明PTD-FNK 蛋白可能通过增加饲料转化率以提高小鼠生长性能。
繁殖性能影响畜牧业的生产水平。 该研究试验组小鼠睾丸生精细胞和成熟精子数增加, 原因可能是Bcl-xl 蛋白可使细胞免于死亡[23],PTDFNK 蛋白作为Bcl-xl 蛋白的功能型增强体,可提高精细胞存活能力。PTD-FNK 蛋白组小鼠精子活力显著上升,质膜完整率无明显变化,与李丹丹等[16]关于不同浓度PTD-FNK 蛋白对猪精子冷冻后质膜完整率及精子活力的影响的研究结果一致, 说明PTD-FNK 蛋白可以提高小鼠的精子质量。 同时PTD-FNK 蛋白组小鼠的SOD 基因和GPX1 基因mRNA 的表达明显升高, 表明机体抗氧化的能力升高,Cuttle 等[24]利用氧化应激模型比较远端和近端肾小管上皮细胞的存活力, 发现Bcl-xl 蛋白在体外肾小管上皮细胞易位可保护远端细胞免受氧化损伤,该试验结果与之类似,由此可以推测PTD-FNK 蛋白有助于提高机体的抗氧化能力。与对照组相比,PTD-FNK 蛋白组小鼠Bax基因的mRNA 表达显著升高,Caspase-3 基因的mRNA 表达无明显变化,表明该试验中PTD-FNK蛋白没有引起凋亡发生, 但引起了上游促凋亡基因表达的升高。Shimokawa 等[25]研究发现精子冷冻过程中加入300 nmol/L PTD-FNK 蛋白能抑制Caspase-3 和Caspase-9 的表达,刘蛟等[26]研究发现注射1 nmol/L PTD-FNK 蛋白可显著降低冷冻水牛精子Caspase-3 基因mRNA 的表达, 而注射0.1、10、100 nmol/L PTD-FNK 蛋白则无明显变化,说明Caspase-3 基因mRNA 的表达与注射PTDFNK 蛋白的剂量有关。 Cui 等[27]的研究发现亚慢性2,5-hexanedi-one 暴露导致抗凋亡蛋白Bcl-2和促凋亡蛋白Bax 在大脑皮层和小脑中的表达显著 增 加;Wennersten 等[28]的 研 究 发 现 实 验 性 脑 损伤导致Bcl-2 基因和Bax 基因均表达上调,该试验与以上结果类似。 此外,Oltvai 等[29]的研究发现Bax 蛋白本身并不会导致细胞死亡, 并且细胞凋亡与Bax 蛋白和Bcl-2 抗凋亡蛋白的比例有关,当Bcl-2 蛋白过量时, 细胞受到保护, 因此注射PTD-FNK 蛋白并不会导致细胞凋亡,但可能导致Bax 基因表达的升高,从而达到动态平衡,其具体的影响机制尚待进一步探究。 与对照组相比,PTD-FNK 蛋白组小鼠STAR 基因和17β-HSD 基因mRNA 表达无明显变化,表明睾丸的分泌正常,尚未发现PTD-FNK 蛋白影响小鼠睾丸正常分泌的报道,STAR 基因和17β-HSD 基因mRNA 表达无明显变化,可能是由于机体稳态相对平衡,对睾丸的分泌无影响。 线粒体既是产生活性氧(ROS)的主要场所,也是被攻击的首要目标[30],ROS 的暴露具有触发线粒体磷酸转运体(mitochondrial phosphate transporter,MPT)诱 导RIRR(ROS-induced ROS release)[31]的潜能,使促凋亡蛋白和细胞色素C 释放, 是细胞凋亡信号之一。 SOD 和GPX1 能高效清除机体内ROS[32],避免细 胞膜的氧化损伤和高氧条件下DNA 的破坏,Bcl-xl 蛋白可增加SOD 基因和GPX1 基因的表达及抑制Caspase-3 蛋白的活性, 维持线粒体膜电位和ATP 含量的稳定,减缓细胞凋亡。 据报道,给心肌细胞转染Bcl-xl 基因能显著提高大鼠抗缺氧、抗损伤、抗氧化能力[6]。 PTD-FNK 蛋白可能通过增加抗氧化酶的表达来提高小鼠的抗氧化能力,防止线粒体遭受ROS 破坏, 以降低DNA 受到攻击的概率,进而阻碍内源性的细胞异常凋亡,提高其抗凋亡能力。
综上所述,短期注射PTD-FNK 蛋白会降低小鼠食欲,增强饲料转化效率,提升精液品质和机体的抗氧化能力。鲜有学者研究PTD-FNK 蛋白对动物食欲的影响,因此对影响小鼠食欲的PTD-FNK蛋白剂量把握不准, 该试验小鼠的体增重有所增长,这可能是PTD-FNK 蛋白作用的结果,其机制尚待进一步探究; 而PTD-FNK 蛋白能通过增加SOD、GPX1 等抗氧化酶的表达来清除小鼠睾丸组织内的ROS,进而阻碍内源性的细胞异常凋亡,提高机体细胞的抗氧化和抗凋亡能力, 从而提升生精细胞的活力。 由此可见, 在畜牧生产中,PTDFNK 蛋白有助于提高饲料的转化率, 降低生产成本,同时有助于提高精液品质和数量,获得优秀的畜禽个体。
4 结论
PTD-FNK 蛋白可以抑制雄性小鼠的采食、饮水及肝脏的生长发育,提高小鼠的精子质量。
