菊苣酸调控p38 MAPK/NF-κB/NLRP3信号通路对缺血性脑卒中大鼠神经元凋亡及炎症反应的影响
2022-09-20张富慧郝静峰张自艳王志海
张富慧, 郝静峰, 张自艳, 王志海, 律 静
缺血性脑卒中可导致患者肢体残疾或认知功能障碍,脑缺血会引起神经细胞凋亡,炎症反应、氧化应激等是缺血性脑卒中的病理损伤机制,减少神经细胞凋亡、抑制炎症反应对缺血性脑卒中具有保护作用[1,2]。核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)与神经炎性损伤发生发展密切相关,核因子-κB(NF-κB)是激活NLRP3炎症小体的重要因子,p38丝裂原活化蛋白激酶(p38 MAPK)可通过NF-κB通路调节炎症因子表达,介导炎性损伤,p38 MAPK/NF-κB/NLRP3信号通路对炎症性疾病发挥重要的调控作用[3]。
菊苣酸(chicoric acid,CA)是从菊苣叶中提取的酚类物质,具有抗氧化、抗炎、抗病毒、心肌保护的作用[4]。研究显示CA可通过抑制p38 MAPK和NF-κB信号通路,改善炎症诱导的小鼠认知功能障碍,通过调节抗炎抗氧化作用保护神经损伤[5]。CA对缺血性脑卒中的影响及其机制尚不清楚,本研究探索CA对缺血性脑卒中大鼠神经元凋亡、炎症反应及p38 MAPK/NF-κB/NLRP3信号通路的影响,初步探讨其作用机制。
1 材料与方法
1.1 材 料
1.1.1 动物 SPF级健康雄性SD大鼠,6~8周龄,体质量(230±20)g,购自中山大学实验动物中心,动物生产许可证号:SCXK(粤)2020-0006,大鼠饲养环境为:(23±2)℃,湿度(60±5)%, 12 h明/暗循环,自由饮水进食。本研究经医院伦理委员会批准。
1.1.2 主要药物和试剂 CA(原料药,纯度99.95%,批号C7243)购自武汉东康源科技有限公司;p38 MAPK激活剂(Anisomycin)(批号SC0132)购自美国MCE公司;2,3,5-氯化三苯基四氮唑(TTC)染色液(批号T8877)、尼氏(Nissl)染色液(批号SF3627)、TUNEL细胞凋亡检测试剂盒(批号C1917)、大鼠肿瘤坏死因子-α(TNF-α)(批号KS40173)、白细胞介素(IL)-1β(批号KS41256)、IL-6(批号KS50197)酶联免疫吸附检测试剂盒、蛋白裂解液(批号KL10647)均购自上海碧云天生物技术有限公司;兔抗鼠磷酸化p38 MAPK(p-p38 MAPK)(批号9215)、p38 MAPK(批号9212)、磷酸化NF-κB p65(p-NF-κB p65)(批号3039)、NF-κB p65(批号8242)、NLRP3(批号15101)、β-肌动蛋白(β-actin)(批号01247)单克隆抗体、羊抗兔二抗(批号06211)均购自美国CST公司。
1.1.3 主要仪器 组织切片机(型号YD-315)、荧光显微镜(型号JS-750T)、凝胶成像系统(型号JS-M6PH)均购自上海玉研科学仪器有限公司;酶标仪(型号SY96A)购自山东方科仪器有限公司。
1.2 方 法
1.2.1 缺血性脑卒中模型制备、分组及给药 采用改良线栓法[6]制备缺血性脑卒中大鼠模型,操作如下:异氟烷麻醉大鼠,将大鼠固定,沿颈部切开皮肤,分离颈内动脉、颈外动脉和右侧颈总动脉;将颈外动脉和颈总动脉结扎,夹闭颈内动脉,将线栓插入颈外动脉直至到达颈内动脉,向内插入约18 mm,固定2 h后抽出线栓,缝合伤口。术后24 h对造模大鼠进行Zea Longa评分,Zea Longa评分1~3分表示造模成功[7]。将造模成功的大鼠随机分为:模型组、CA组、CA+Anisomycin组,每组12只。另取12只大鼠作为假手术组,假手术组操作同模型组,但不进行线栓操作。CA组大鼠使用10 mg/kg CA腹腔注射给药[8];CA+Anisomycin组大鼠使用10 mg/kg CA和2 mg/kg Anisomycin[9]腹腔注射给药;假手术组与模型组腹腔注射等量的生理盐水;每天1次,连续给药2 w。
1.2.2 Zea Longa评分与脑梗死体积百分比检测 Zea Longa评分:给药周期结束后,各组均未出现大鼠死亡,采用Zea Longa评分法[7]对各组大鼠进行神经功能缺损评分,评分区间为0~4分,得分越高表示神经功能缺损越严重。脑梗死体积百分比检测:断头处死大鼠,迅速取出整脑,选择其中6只大鼠,-20 ℃冰箱冷冻,沿冠状面切成6片厚度为2 mm的切片,使用2% TTC溶液37 ℃避光染色30 min,正常脑组织显色红色,梗死组织为白色,Image Pro Plus 6.0软件分析并计算脑梗死体积百分比(脑梗死体积百分比=脑梗死体积/整脑体积×100%)。另外6只大鼠的海马组织于-80℃保存。
1.2.3 Nissl染色检测大鼠海马组织神经元损伤 取出冻存的海马组织,石蜡切片经脱蜡至水,加入Nissl染色液37℃染色10 min,蒸馏水洗涤,95%酒精脱水,二甲苯透明,中性树胶封片,在显微镜下观察尼氏体。
1.2.4 TUNEL法检测大鼠海马组织神经元凋亡 取海马组织冰冻切片,0.5%聚乙二醇辛基苯基醚通透30 min后,加入TUNEL染色液,避光孵育1 h,DAPI避光孵育5~10 min复染细胞核,荧光显微镜观察海马组织神经元凋亡,计算神经元细胞凋亡率(神经元细胞凋亡率=凋亡神经元细胞数/总神经元细胞数×100%)。
1.2.5 酶联免疫吸附法检测大鼠海马组织TNF-α、IL-1β和IL-6水平 将海马组织(组织:生理盐水=1∶9)在冰浴条件下研磨匀浆,15000 r/min离心10 min,分离上清,酶联免疫吸附法检测海马组织TNF-α、IL-1β、IL-6水平。
1.2.6 蛋白免疫印迹法检测大鼠海马组织p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、NLRP3蛋白表达 蛋白裂解液提取各组大鼠海马组织中总蛋白,蛋白经定量后,取30 μg样品经电泳、转膜与封闭,加入兔抗鼠p-p38 MAPK(1∶300)、p38 MAPK(1∶300)、p-NF-κB p65(1∶500)、NF-κB p65(1∶500)、NLRP3(1∶1000)、β-actin(1∶1000)一抗稀释液,4 ℃孵育过夜,羊抗兔二抗(1∶3000)室温孵育2 h,放大显色后,以β-actin为内参,分析各蛋白相对表达。
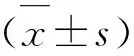
2 结 果
2.1 各组大鼠Zea Longa评分和脑梗死体积百分比比较 与假手术组比较,模型组大鼠Zea Longa评分和脑梗死体积百分比显著升高(P<0.05);与模型组比较,CA组大鼠Zea Longa评分和脑梗死体积百分比显著降低(P<0.05);与CA组比较,CA+Anisomycin组大鼠Zea Longa评分和脑梗死体积百分比显著升高(P<0.05)(见表1、图1)。
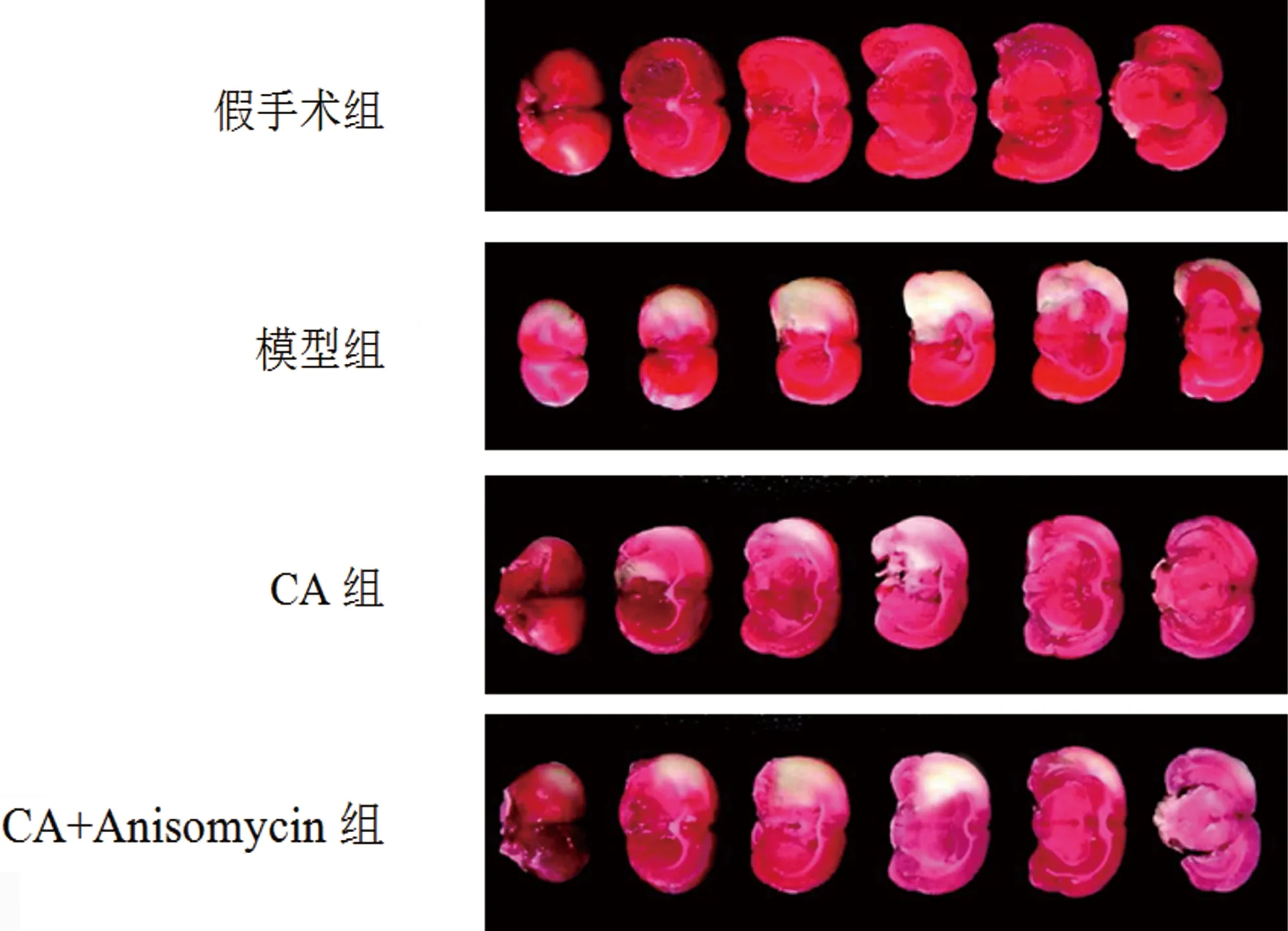
图1 各组大鼠脑梗死体积观察(TTC染色)
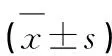
表1 各组大鼠Zea Longa评分和脑梗死体积百分比比较
2.2 各组大鼠海马组织神经元损伤比较 假手术组大鼠神经元形态规则,结构完整,细胞染色加深,尼氏体数目丰富;模型组大鼠神经元形态不规则、染色较浅,尼氏体数目明显减少;CA组大鼠神经元形态较模型组明显改善,形态较饱满,染色均匀,尼氏体密集;CA+Anisomycin组较CA组神经元损伤严重,细胞皱缩,尼氏体数目减少(见图2)。

图2 各组大鼠海马组织神经元损伤观察(Nissl染色,×400)
2.3 各组大鼠海马组织神经元凋亡比较 神经元凋亡显示为绿色,所有细胞核显示为蓝色,假手术组大鼠几乎无神经元凋亡。假手术组、模型组、CA组、CA+Anisomycin组大鼠神经元细胞凋亡率分别为(1.83±0.45)%、(34.21±6.33)%、(18.56±3.58)%、(23.59±4.42)%。与假手术组比较,模型组大鼠神经元细胞凋亡率显著升高(P<0.05);与模型组比较,CA组大鼠神经元细胞凋亡率显著降低(P<0.05);与CA组比较,CA+Anisomycin组大鼠神经元细胞凋亡率显著升高(P<0.05)(见图3)。
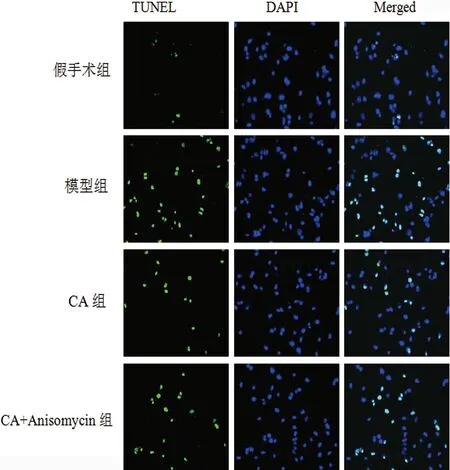
图3 各组大鼠海马组织神经元凋亡情况(TUNEL染色,×200)
2.4 各组大鼠海马组织TNF-α、IL-1β和IL-6水平比较 与假手术组比较,模型组大鼠海马组织TNF-α、IL-1β和IL-6水平显著升高(P<0.05);与模型组比较,CA组大鼠海马组织TNF-α、IL-1β和IL-6水平显著降低(P<0.05);与CA组比较,CA+Anisomycin组大鼠海马组织TNF-α、IL-1β和IL-6水平显著升高(P<0.05)(见表2)。
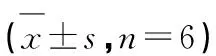
表2 各组大鼠海马组织TNF-α、IL-1β和IL-6水平比较
2.5 各组大鼠海马组织p38 MAPK/NF-κB/NLRP3通路相关蛋白表达水平比较 与假手术组比较,模型组大鼠海马组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平显著升高(P<0.05);与模型组比较,CA组大鼠海马组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平显著降低(P<0.05);与CA组比较,CA+Anisomycin组大鼠海马组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平显著升高(P<0.05)(见表3、图4)。
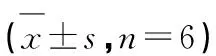
表3 各组大鼠海马组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平比较

注:A:假手术组;B:模型组;C:CA组;D:CA+Anisomycin组图4 各组大鼠海马组织p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、NLRP3蛋白印迹图
3 讨 论
缺血性脑卒中会导致脑组织缺血坏死,引起患者偏瘫、失语、记忆力下降等,严重影响患者生活质量,缺血缺氧可引起脑组织受损、细胞坏死、神经功能受损、炎症反应加剧[10]。本研究结果显示,给予缺血性脑卒中模型大鼠CA治疗后,神经功能损伤明显减轻,脑梗死体积减小,神经元形态较饱满,染色均匀,尼氏体密集,神经元细胞凋亡率降低,表明CA可减轻缺血性脑卒中大鼠神经功能损伤。
CA是从菊苣和紫锥菊等植物中提取的活性物质,具有抗病毒、抗炎、抗氧化、抑肿瘤、抗衰老、调节糖脂平衡等多种药理作用[11,12]。高红艺等[13]研究显示,CA可上调沉默信息调节因子1(SIRT1)蛋白表达,抑制NF-κB的转录活性、海马氧化应激损伤及炎症反应,改善脓毒症相关性脑病小鼠认知功能。另有研究显示[14],CA可显著抑制一氧化氮和前列腺素E2的水平及炎症因子的释放,减少脑缺血再灌注损伤大鼠的神经功能缺损和梗死体积。以上研究表明[13,14]CA具有神经保护的作用。脑卒中可引起TNF-α、IL-1β和IL-6等多种促炎因子水平升高,lL-1β与脑组织损伤的程度有关,抑制lL-1β的释放,可显著减少脑梗死体积[15]。本研究使用CA治疗缺血性脑卒中模型大鼠后,大鼠海马组织TNF-α、IL-1β和IL-6水平显著降低,与既往报道结果类似[13,14],表明CA通过抑制炎症反应缓解脑损伤。
NLRP3是炎症反应的活性核心,缺血性脑卒中发生后,NLRP3转录激活,催化IL-1β分泌,加重组织损伤,NF-κB是激活NLRP3炎症小体的重要因子,CA可抑制NF-κB和NLRP3信号通路的激活[16]。Ding等[17]研究显示,在脂多糖诱导的小鼠急性肺损伤模型中,CA可显著抑制MAPK和NLRP3活化,减轻炎症反应。本研究结果显示,CA可降低缺血性脑卒中大鼠海马组织NLRP3的表达水平,与Wang等[16]报道结果一致。p38是MAPK信号通路重要的成员,参与神经元的凋亡,脑部缺血缺氧可引起MAPK信号通路的激活,促进神经元凋亡[18]。NF-κB是p38 MAPK的下游分子,p-p38 MAPK可激活NF-κB,通过调节细胞核凋亡相关基因表达,诱导神经元凋亡;而抑制p38 MAPK通路,可抑制NF-κB的激活,从而减弱TNF-α、IL-1β和IL-6等细胞因子的释放,减轻脑组织损伤[19]。李依玲等[20]研究表明,CA可抑制NF-κB信号通路的激活,减轻脂多糖诱导的H9C2细胞损伤。本研究在使用CA治疗缺血性脑卒中模型大鼠后,大鼠海马组织p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、NLRP3蛋白表达水平显著降低,提示CA可抑制p38 MAPK/NF-κB/NLRP3通路的激活。本研究结果还显示,CA改善缺血性脑卒中大鼠脑损伤的作用可被Anisomycin逆转,推测CA可通过抑制p38 MAPK/NF-κB/NLRP3信号通路来抑制炎症反应,缓解缺血性脑卒中大鼠脑组织损伤,降低神经元凋亡。
综上所述,CA可通过抑制p38 MAPK/NF-κB/NLRP3信号通路,抑制炎症反应,降低神经元凋亡,保护缺血性脑卒中引起的大鼠脑损伤。
