线粒体自噬参与NLRP3介导的炎症反应在脑卒中康复中的作用
2022-09-20李振东张诚诚张月娟
王 维, 李振东, 张诚诚, 张月娟
神经炎症是整个脑卒中康复过程中一个关键而复杂的病理生理过程,涉及早期损伤到缺血后组织修复[1]。研究表面,Nod样受体蛋白-3(Nod-like receptor pyrin domain3,NLRP3)炎症小体可能对介导炎症反应和诱导卒中后细胞损伤和死亡至关重要[2,3]。NLRP3炎症小体由NLRP3、凋亡相关斑点样蛋白(包含caspase激活的招募域和前体caspase-1)组成,通过caspase-1激活触发IL-1β和IL-18的释放,在缺血性脑卒中发挥重要作用[4]。随后,IL-1β和IL-18都参与炎症反应的启动和放大[4]。然而,NLRP3炎性体在缺血性卒中中的具体细胞位置和信号通路仍不清楚。据报道,线粒体功能障碍在一些炎症性疾病中激活NLRP3炎症体,如代谢综合征、动脉粥样硬化、神经退行性变和肾病[5,6]。然而,目前还没有明确的证据表明线粒体自噬与NLRP3炎症体在脑卒中中的关系。本研究旨在阐明这些问题,以揭示神经炎症在介导缺血性卒中损伤中的更多细节。
1 材料与方法
1.1 动物模型建立和分组 健康的雄性280~320 g Sprague-Dawley大鼠从广东省医学实验动物中心[许可证号:SCXK(粤)2018-0029]获得。将大鼠饲养在温度(25±2)℃和湿度可控制的房间中。使动物保持在12 h:12 h的光/暗循环下,自由进食和饮水。大鼠随机分为6组,每组8只:假手术组(Sham)、Sham+雷帕霉素(Rapamycin,RAPA)组、再灌注后6 h组(I/R 6 h)、I/R 6 h+RAPA组、再灌注后24 h(I/R 24 h)和I/R 24 h+RAPA组。参照文献方法建立短暂性大脑中动脉闭塞(Transient middle cerebral artery occlusion,tMCAO)模型,以刺激大鼠的缺血/再灌注(ischemia/reperfusion,I/R)损伤[7]。大鼠通过腹腔注射戊巴比妥(100 mg/kg)诱导麻醉,在颈部做中线切口以暴露右颈外动脉。然后,将一条单丝(北京西浓科技有限公司)插入颈内动脉中,经过颈外动脉,直至感觉到轻度阻力,表明该细丝已正确地放置在近端大脑前动脉的一部分,并阻塞了流向大脑中动脉的血液。将单丝放置在原位120 min,然后抽出以诱导再灌注。当大鼠恢复意识时,出现左前肢麻痹或打圈运动,并且当单丝移开大脑时没有观察到脑出血的梗死组织,表明模型成功建立。假手术作为对照,除没有插入单丝和随后的再灌注,其余操作同tMCAO方法。药物组在再灌注后立即以4 mg/kg的剂量腹腔注射RAPA(一种典型的自噬诱导剂,在使用前先溶解在无菌的DMSO溶液中,剂量参照文献报道[8])。其余组动物接受等体积的DMSO溶液。
1.2 免疫荧光分析 再灌注6 h和24 h后取脑,4 ℃下用4%多聚甲醛固定过夜。蔗糖梯度脱水后进行冰冻切片。然后,将10 μm厚的冠状切片在室温下用含0.5%Triton X-100的10%山羊血清封闭30 min,然后用小鼠抗caspase-1(英国Abcam公司,1∶50)抗体和兔抗Iba1抗体(美国Wako公司,1∶250)或兔抗NeuN抗体(Abcam,1∶50)或兔抗GFAP抗体(Abcam,1∶250)在4 ℃过夜。切片用PBS洗涤3×10 min,然后用Alexa-Fluor 488共轭山羊抗鼠IgG(上海Beyotime公司,1∶500)和Alexa-Fluor 555共轭驴抗兔IgG(Beyotime,1∶500)的混合物在室温下孵育1 h,再用DAPI染色5 min。使用lx71荧光显微镜(日本OLYMPUS公司)采集缺血核心皮质区域的图像。不同类型神经细胞中caspase-1阳性细胞的百分率。
1.3 脑组织线粒体形态分析 取1 mm3缺血核心皮质区域脑组织,分别用4%戊二醛、四氧化锇固定。用PBS冲洗后,组织经梯度酒精脱水。将包埋剂和100%丙酮按1∶1比例孵育1 h,将组织块进行超薄切片,枸橼酸铅染色。采用H-7700透射电镜(日本Hitachi公司)对切片进行超微结构检查。
1.4 BV2小胶质细胞培养和处理 BV2细胞购自美国典型培养物保藏中心。将BV2细胞接种在含有10%热灭活胎牛血清(美国Gibco公司)和1%青霉素/链霉素(美国HyClone公司)的DMEM/F12培养基(Gibco)中培养。使用Lipo3000(美国Invitrogen公司)将si-NLRP3 siRNA(正向,5’-GUACUUAAAUCGUGAAACAdTdT-3’;反向,3’-dTdTCAUGAAUUUAGCACUUUGU-5’)或si-NC(核糖核酸)转染BV2细胞。转染24 h后,将BV2细胞进行氧-糖剥夺/复氧(Oxygen-glucose deprivation/reoxygenation,OGD/R)处理。具体操作:用无葡萄糖DMEM培养基(美国Gibco公司)代替培养基,然后将培养板放入含有95%N2和5%CO2的混合气体的MIC-101缺氧培养箱(美国Billups Rothenberginc公司),孵育4 h,然后恢复正常气体和培养基,诱导OGD/R模型。将siRNA转染和OGD/R处理组分为以下几组:对照组(NC)、OGD/R组(OGD/R)、OGD/R+si-NC组(si-NC转染)、OGD/R+si-NLRP3组(用si-NLRP3转染)、NC+RAPA组和OGD/R+RAPA组。需要药物治疗的细胞组在复氧后用含25 nmol/L RAPA的DMEM/F12培养基处理,其他组用PBS作为对照。
1.5 线粒体膜电位测量(Δψm) 用JC-10染色法测定神经细胞线粒体膜电位。JC-10是一种亲脂性阳离子菁染料,在线粒体基质中呈现红色荧光聚集体。当失去膜电位时,这些聚集体分解成绿色荧光单体。细胞与10 μg/ml JC-10在37 ℃黑暗条件下孵育45 min。然后用流式细胞仪(美国BD-FACSVerse公司)对细胞进行分析,激发发射波长为488 nm,发射波长为530 nm。测量聚集体(红色荧光)和单体(绿色荧光)的百分比。线粒体去极化以绿色荧光强度的百分比表示。
1.6 Western blot分析 用RIPA缓冲液(上海Beyotime公司)裂解缺血皮质或细胞提取总蛋白。通过BCA试剂盒评估蛋白质含量。采用10%SDS-PAGE电泳将蛋白质转移到PVDF膜上(美国Invitrogen公司)。将膜用5%脱脂牛奶封闭1 h,然后在4 ℃下用以下一抗封闭过夜:NLRP3(1∶1000)、caspase-1(1∶1000)、IL-1β(1∶1000)、LC3-Ⅰ/Ⅱ(1∶800)和GAPDH(1∶1000,均购自英国Abcam公司)。将PVDF膜与抗兔IgG(美国MultiSciences公司,1∶5000)在室温下孵育1 h。使用蛋白质印迹检测化学发光试剂盒(南京凯基生物科技发展有限公司)观察目标条带。
2 结 果
2.1 在I/R损伤过程中NLRP3炎性体激活的细胞位置变化情况 在缺血损伤区观察到,I/R损伤后6 h,切割的caspase-1主要在小胶质细胞中表达[(88.4±1.1)%],在其他细胞类型中很少表达。然后,切割的caspase-1在24 h时主要在神经元[(63.4±2.2)%]中表达,而在小胶质细胞[(12.2±1.1)%]中表达降低(见图1A、图1B)。
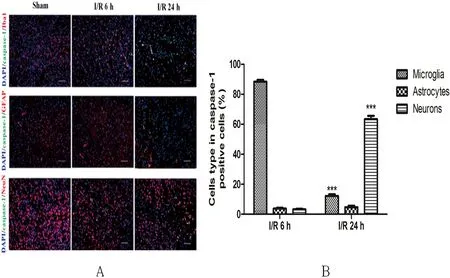
图1 在I/R损伤过程中NLRP3炎性体激活的细胞位置变化情况。A:切割的caspase-1在假手术和脑I/R后6 h和24 h小胶质细胞、星形胶质细胞和神经元中的表达(放大倍数:×200,比例尺=100 μm);B:脑I/R后6 h和24 h切割的caspase-1阳性细胞在不同类型细胞中的百分率。与I/R后6 h相比***P<0.001
2.2 NLRP3激活小胶质细胞的炎症小体途径 与NC相比,在OGD/R后,BV2细胞中NLRP3的蛋白水平随着时间的推移而增加,尤其是在24 h(均P<0.01)。当通过si-NLRP3转染使BV2细胞中NLRP3表达沉默时,观察到在OGD/R后,切割的caspase-1和切割的IL-1β表达水平显著下调(P<0.05),提示NLRP3介导小胶质细胞的炎症小体途径激活(见图2A、图2B)。
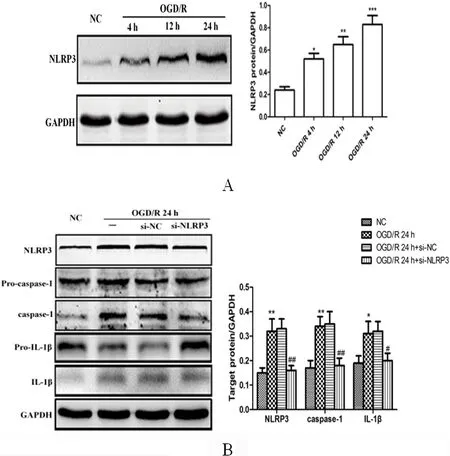
图2 Western blot检测NLRP3炎性体在BV2细胞中的表达。A:OGD/R后不同时间点NLRP3在BV2细胞中的表达;B:转染si-NLRP3对OGD/R处理的BV2细胞中NLRP3、pro-caspase-1、caspase-1、pro-IL-1β和IL-1β的表达。与NC相比*P<0.05,**P<0.01,***P<0.001;与OGD/R 24 h+NC相比#P<0.05,##P<0.01
2.3 I/R损伤和OGD/R过程中脑组织线粒体形态学变化和自噬情况 假手术组大鼠线粒体完整,嵴光滑透明,间质均匀。I/R损伤后6 h,线粒体肿胀,嵴断裂,基质密度降低,线粒体空泡化。I/R损伤后24 h,大量线粒体被破坏,自噬体少见。体外试验显示,在OGD/R后,BV2细胞中LC3-Ⅰ向LC3-Ⅱ转化随着时间的推移而减少,尤其是在24 h(均P<0.01)。表明OGD/R抑制了BV2细胞的自噬水平(见图3A、图3B)。
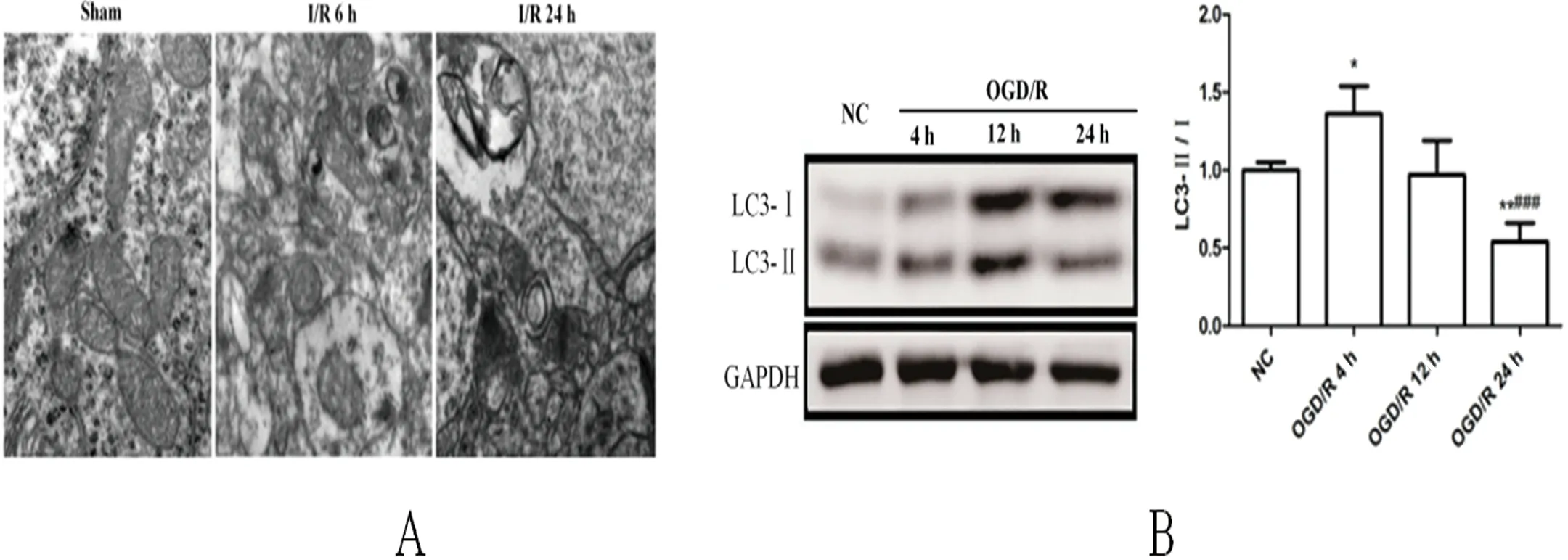
图3 在I/R损伤和OGD/R过程中脑组织线粒体形态学变化和自噬情况。A:透射电镜显示假手术和I/R后6 h和24 h大鼠脑组织线粒体损伤的典型图像(放大倍数:×16000);B:OGD/R对BV2细胞自噬标记物LC3蛋白表达的影响。与对照组相比*P<0.05,**P<0.01;与OGD/R 4 h组相比###P<0.001
2.4 自噬诱导剂可抑制OGD/R损伤时NLRP3炎性体的激活 用JC-10和流式细胞术检测各组线粒体膜电位(Δψm)提示,JC-10形成聚集体,在Q2象限显示红色荧光。暴露于OGD/R后24 h,BV2细胞中Q3象限细胞比例增加,聚集体分解为绿色荧光单体。细胞表现出低膜电位(绿色荧光)的百分比表明膜电位丢失。与OGD/R组相比,自噬诱导剂RAPA能够挽救线粒体的损伤(P<0.05)。接下来,研究分析了线粒体功能障碍与NLRP3炎症体之间的关系,结果显示,RAPA可抑制OGD/R诱导的BV2细胞中NLRP3、切割的caspase-1和切割的IL-1β表达水平上调(P<0.05)(见图4A~D)。
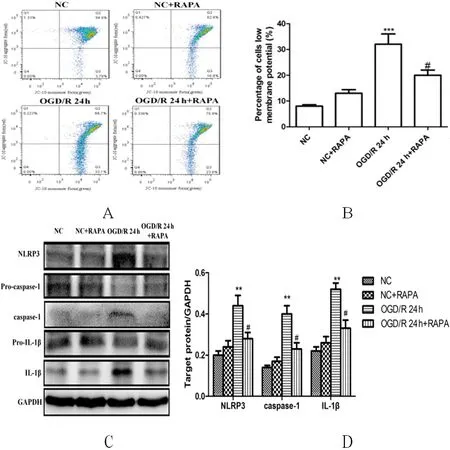
图4 OGD/R后BV2细胞线粒体自噬抑制可激活NLRP3炎性体。A、B:流式细胞术观察各组低细胞膜电位的百分比及定量分析;C、D:自噬诱导剂RAPA对OGD/R处理的BV2细胞中NLRP3、pro-caspase-1、caspase-1、pro-IL-1β和IL-1β的表达。与NC相比**P<0.01;与OGD/R 24 h相比#P<0.05
2.5 自噬诱导剂抑制脑I/R损伤时NLRP3炎性体的激活 I/R+RAPA组在脑I/R损伤后6 h或24 h时,小胶质细胞[(12.7±1.8)% vs (70.0±2.0)%]和神经元[(11.9±1.9)% vs (70.8±1.7)%]中切割的caspase-1的表达均显著低于I/R组(P<0.001) 。这些结果表明,自噬诱导剂在脑I/R损伤中能抑制NLRP3炎性体的激活,提示线粒体功能障碍在脑I/R损伤中起重要作用(见图5A~C)。
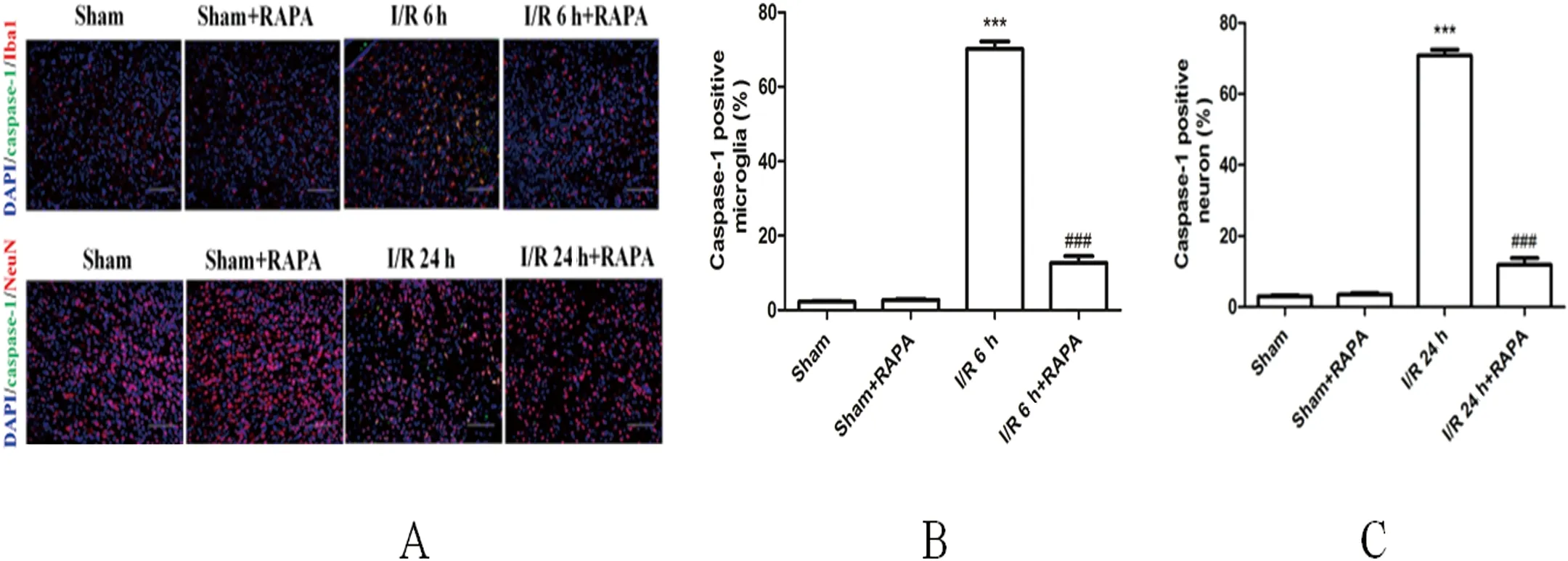
图5 自噬诱导剂可抑制脑I/R后NLRP3炎性体的活化。A:切割的caspase-1在脑I/R后6 h和24 h小胶质细胞和神经元中的表达;B:脑I/R后6 h切割的caspase-1阳性细胞在小胶质细胞的百分率;C:脑I/R后24 h切割的caspase-1阳性细胞在神经元中的百分率。与Sham相比***P<0.001;与I/R后6 h或24 h相比***P<0.001
3 讨 论
最近,在I/R损伤后的一些器官中发现了NLRP3炎症体,如大脑、心脏、肾脏和睾丸[9]。据报道,损伤相关分子模式是激活NLRP3的关键初始刺激[10]。NLRP3可激活前半胱氨酸蛋白酶-1裂解成活性片段,然后裂解的半胱氨酸蛋白酶-1诱导形成成熟的促炎细胞因子,即IL-1β和IL-18[4]。这些细胞因子随后启动或放大多种下游信号通路,以驱动促炎症过程,导致细胞损伤,并可能会释放损伤相关分子以诱导更多炎症[11]。在小鼠脑内,观察到LPS刺激后,小胶质细胞中出现NLRP3、ASC和caspase-1的表达,而星形胶质细胞中未检测到这种表达,表明小胶质细胞可能是参与功能性NLRP3炎症体形成的主要部位[12]。此外,Zhang等发现,在OGD/R条件下,原代皮质神经元中NLRP3炎症体蛋白和IL-1β和IL-18的水平上调[13]。相反,在MCAO小鼠模型中,Sun等证明NLRP3在小胶质细胞和血管内皮细胞中表达,但在神经元中不表达[2]。因此,NLRP3炎性体在脑I/R损伤中的特异性表达和分布尚未得出结论。
在本研究中,我们选择大鼠作为动物模型,因为大鼠的基因与人类的基因相对接近,并动态观察了I/R损伤后NLRP3炎性体途径的细胞定位。结果显示,在tMCAO大鼠中裂解的caspase-1主要在24 h内的缺血核心区域表达,并且活化的炎症小体在脑I/R损伤后首先在小胶质细胞中形成,但在星形胶质细胞中不形成,然后在24 h内主要在神经元中表达。而当BV2细胞中的NLRP3 siRNA转染使NLRP3表达沉默时,观察到在OGD/R后,切割的caspase-1和切割的IL-1β表达水平显著下调,提示NLRP3介导小胶质细胞的炎症小体途径激活。先前的一项研究表明,NLRP3炎性体诱导了caspase-1依赖性焦磷酸化,可能是氯胺酮诱导的海马神经毒性中与线粒体相关凋亡相关的重要途径[14]。这些先前的结果与本研究结果一致。因此,小胶质细胞是脑I/R损伤后早期激活的NLRP3炎性小体的主要来源,可能驱动促炎过程,导致细胞死亡和破坏,并在后期主要聚集在神经元中,诱发神经元死亡和血脑屏障完整性障碍[15]。
线粒体对I/R损伤极为敏感。NLRP3炎症体的升高引起线粒体通透性转换孔的开放和线粒体极化,导致线粒体膜电位和mPTP开放降低,从而导致线粒体自噬[16]。线粒体自噬不仅选择性地清除受损的线粒体,而且阻止受损线粒体产生ROS,并可改善炎症反应[17]。因此,中度自噬是正常代谢中不可或缺的一部分,可清除受损蛋白质,并在脑损伤中发挥神经保护作用。研究表明,氧化苦参碱通过促进SIRT1介导的自噬来减轻缺血性卒中引起的认知障碍[18]。此外,许多神经保护药物被认为可以通过激活自噬来减轻缺血诱导的继发性脑损伤[19]。同样,本研究观察到,I/R损伤后大量线粒体被破坏,自噬体减少,并且暴露于OGD/R的BV2细胞中LC3-Ⅰ向LC3-Ⅱ转化随着时间的推移而减少,表明OGD/R抑制了BV2细胞的自噬水平。此外,自噬诱导剂RAPA可以通过上调线粒体自噬水平来保护线粒体的功能,这与先前发现RAPA可阻止氧化应激缺血环境中mPTP开放和线粒体去极化的研究一致[20]。因此,我们使用RAPA来确定BV2细胞中线粒体自噬和NLRP3炎性体之间的关系。结果表明,线粒体自噬在OGD/R后BV2细胞NLRP3炎性体途径的激活中起重要作用,RAPA能有效减轻BV2细胞NLRP3炎性体反应,并且RAPA能抑制I/R损伤后NLRP3炎性体的激活,提示线粒体自噬在脑I/R损伤中起重要作用。
综上所述,本研究确定了脑I/R损伤后NLRP3炎性体途径细胞定位的动态变化,表明小胶质细胞是脑I/R损伤早期激活NLRP3炎性体的主要来源,随着时间的推移,NLRP3炎症小体在神经元中被激活。此外,线粒体自噬下调是激活小胶质细胞NLRP3炎性体的关键,自噬诱导剂可有效减轻OGD/R和脑I/R损伤后小胶质细胞和神经元的NLRP3炎性体反应。
