不同疾病伴发脑桥十字征的影像学特点及临床分析
2022-09-20付胜奇张淑玲范文斐周晓影任雅芳
宋 良, 付胜奇, 张淑玲, 范文斐, 周晓影, 任雅芳
脑桥“十字面包(hot cross bun,HCB)”征是指在 T2成像上发现脑桥十字形高信号。多在多系统萎缩(mutiple system atrophy,MSA)和脊髓小脑共济失调(spinocerebellar ataxia,SCA)中出现,通常被认为是由脑桥小脑纤维的神经胶质增生引起[1]。最新研究表明,HCB征并不是MSA、SCA的特异性标志,也可以出现在其他疾病中。目前国内还没有研究来系统评价不同疾病伴发HCB征的发病机制、临床异质性、影像学特征及疾病进展过程。本研究报道了1例伴有HCB征的MSA患者,并对已发表的伴有HCB征相关文献进行系统回顾分析,以揭示不同疾病之间伴发HCB征的可能关联。
1 资料与方法
1.1 研究对象 收集我院神经内科患者资料进行初步分析。通过检索PubMed、Web of Science、中国期刊全文数据库(CNKI)、万方数据库4个数据库。检索时间从开始至2022年3月。中文检索词为:“脑桥十字征”“脑梗死”“多系统萎缩”等。英文检索词为:”hot cross bun” “pontocerebellar” “cruciate” “cruciform” “MSA” 和“multiple system atrophy”等。本研究的检索范围仅限定关于人类的英文及中文文章共纳入14例病例,其中1例为本院病例。
纳入标准:(1)与HCB征相关的个案报道;(2)T2WI提示HCB征,且其影像学表现与临床症状相关;(3)病因诊断明确;(4)由神经内科两位副主任医师共同确认。排除标准:(1)同一篇文章重复发表或者同一组数据重复使用;(2)综述、计划书及横断面研究等;(3)相同病因诊断的个案分析可排除;(4)文献提供数据不完整。
1.2 研究方法 对14例患者的一般资料、发病时间、临床体征、实验室检查、影像学检查、临床诊断、治疗及临床转归等情况进行回顾性分析。
1.3 病例资料 患者男,45岁,农民,因“进行性头晕、行走不稳2 y,言语不清1 y,饮水呛咳4 m余”入院。2 y前(2020年2月)无明显诱因出现头晕、行走不稳,伴有双下肢发热感,就诊于当地行颈胸椎CT、肌电图未见异常,给予药物治疗症状无好转,并逐渐加重。1 y前(2021年2月)逐渐出现言语不清,上述症状进行性加重,未治疗。4 m前(2021年10月)出现饮水呛咳,遂于2022年2月14日入住我院神经内科。既往体健。查体:卧立位血压:卧位:127/97 mmHg,立位:1 min 83/62 mmHg,立位:3 min 84/62 mmHg,立位:5 min 87/63 mmHg。意识清楚,构音障碍,共济失调步态,四肢肌力Ⅴ级,四肢肌张力增高,双下肢为著,双下肢腱反射(),双侧掌颏反射阳性,双侧巴氏征阳性。双侧指鼻、跟膝胫试验欠稳准。Romberg征阳性,后拉试验阳性。辅助检查:血糖:6.11 mmol/L,余血生化、肿瘤标志物均正常。膀胱残余尿量477 ml。头部MRI:脑桥、小脑中脚、小脑显著萎缩,T2WI见脑桥HCB征(见图1)。该患者隐匿起病,进行性加重,出现体位性低血压、尿储留等自主神经症状、小脑性共济失调及帕金森症状,故定位于自主神经系统、小脑、锥体束、椎体外系,结合头部MRI可见小脑、脑桥萎缩、脑桥HCB征,故定性考虑MSA-C。治疗上给予辅酶Q10、B族维生素、米多君等治疗后,患者自觉症状较前改善出院随访中。
2 结 果
2.1 HCB 的疾病谱 我们共收集了14名患者(文献中13名患者和本院患者)的数据进行描述性分析,并对纳入的病例进行系统回顾。一般特征(见表1),潜在的疾病谱各不相同,包括营养代谢性[脑腱黄瘤病(CTX)[2]]、炎性脱髓鞘性[多发性硬化(MS)[3]]、神经系统变性病[皮质基底节变性(CBD)[4]、MSA]、继发于疑似血管炎的帕金森综合征[5]、肿瘤(乳腺癌软脑膜转移[6])、副肿瘤[睾丸肿瘤坏死引起副肿瘤综合征(PNS)[7]]、感染性疾病[脑炎[8]、副肿瘤菱形脑炎[9]、HIV相关进行性多灶性白质脑病(PML)[10]、变异型克雅病(CJD)[11]]、遗传相关性疾病[脊髓型小脑共济失调2型(SCA2)[12]]、脑卒中(脑梗死[13])和中毒(苯妥英钠引起的中毒性脑病[14])等。
2.2 临床特点 14例患者的起病形式:3例急性起病,4例亚急性起病、快速进展,6例慢性起病、进行性加重,有1例未提及起病形式。临床体征以小脑共济失调(8例,57.1%)最多见,其次是构音障碍(7例,50%)、四肢无力(4例,28.5%)、锥体束征(4例,28.5%),部分患者有步态不稳(3例,21.4%)、运动迟缓(3例,21.4%)、四肢肌张力增高(3例,21.4%)、排尿功能障碍 (2例,14.3%)、眼球震颤 (3例,21.4%)、肢体震颤 (2例,14.3%)、肢体共济失调(2例,14.3%)、认知障碍(2例,14.3%)。小脑共济失调是与脑桥核和脑桥小脑束损伤相关的最常见症状,通常见于神经退行性疾病、遗传性疾病和感染性疾病等。
2.3 影像学表现 14例患者在 T2WI中所有病例均发现HCB征(见图1)。其中,有10例(71.4%)伴随严重的脑桥、小脑萎缩,3例(21.4%)T2WI出现双侧小脑中脚(桥臂)高信号,1例(7.1%)出现单侧小脑中脚高信号。代谢性疾病和变性病可见到广泛的脑白质病变。

图1 1A:T2示双侧齿状核高信号,1B:T2示脑桥十字征;2A:FLAIR示双侧侧脑室旁多发脱髓鞘,2B:T2示脑桥十字征;3A:T2示额叶皮质萎缩、额叶白质高信号,3B:T2示小脑萎缩、脑桥十字征;4A、B:T2示小脑萎缩,脑桥十字征;5A:T2示9个月前脑桥肿胀,5B:T2示9个月后脑桥、小脑萎缩、脑桥十字征;6A:矢状位T1示脑桥小脑萎缩,6B:T2示脑桥十字征;7A:增强MRI-T1示小脑沟弥漫性线性增强,7B:T2示脑桥十字征,脑桥、小脑无萎缩;8A、B:T2示脑桥十字征;9A、B:T2示脑桥十字征,双侧小脑中脚高信号;10A、B:T2及FLAIR示左侧小脑中脚不对称高信号,延伸到左小脑半球;11A:DWI示对称丘脑萎缩和广泛皮质高信号,11B:FLAIR示脑桥十字征,小脑中脚萎缩高信号、颞叶高信号;12A:矢状位T1示严重脑桥小脑萎缩,12B:FLAIR示脑桥十字征;13A:DWI双侧桥臂、右侧小脑急性梗死,13B:1 y后随访T2示脑桥、小脑萎缩,脑桥十字征;14A:FLAIR示双侧基底节区对称性带状高信号,14B:T2示脑桥十字征
2.4 治疗与转归 1例临床诊断脑炎的患者给予免疫球蛋白、甲强龙、单唾液酸四己糖神经节苷脂及康复治疗后,已完全治愈出院,1 y后随访HCB征消失。有4例患者给予对症治疗后,临床症状均有明显改善。1例CBD随访3 y后死亡。1例乳腺癌软脑膜转移患者自动出院。有6例患者文献中未提及预后(见表1)。
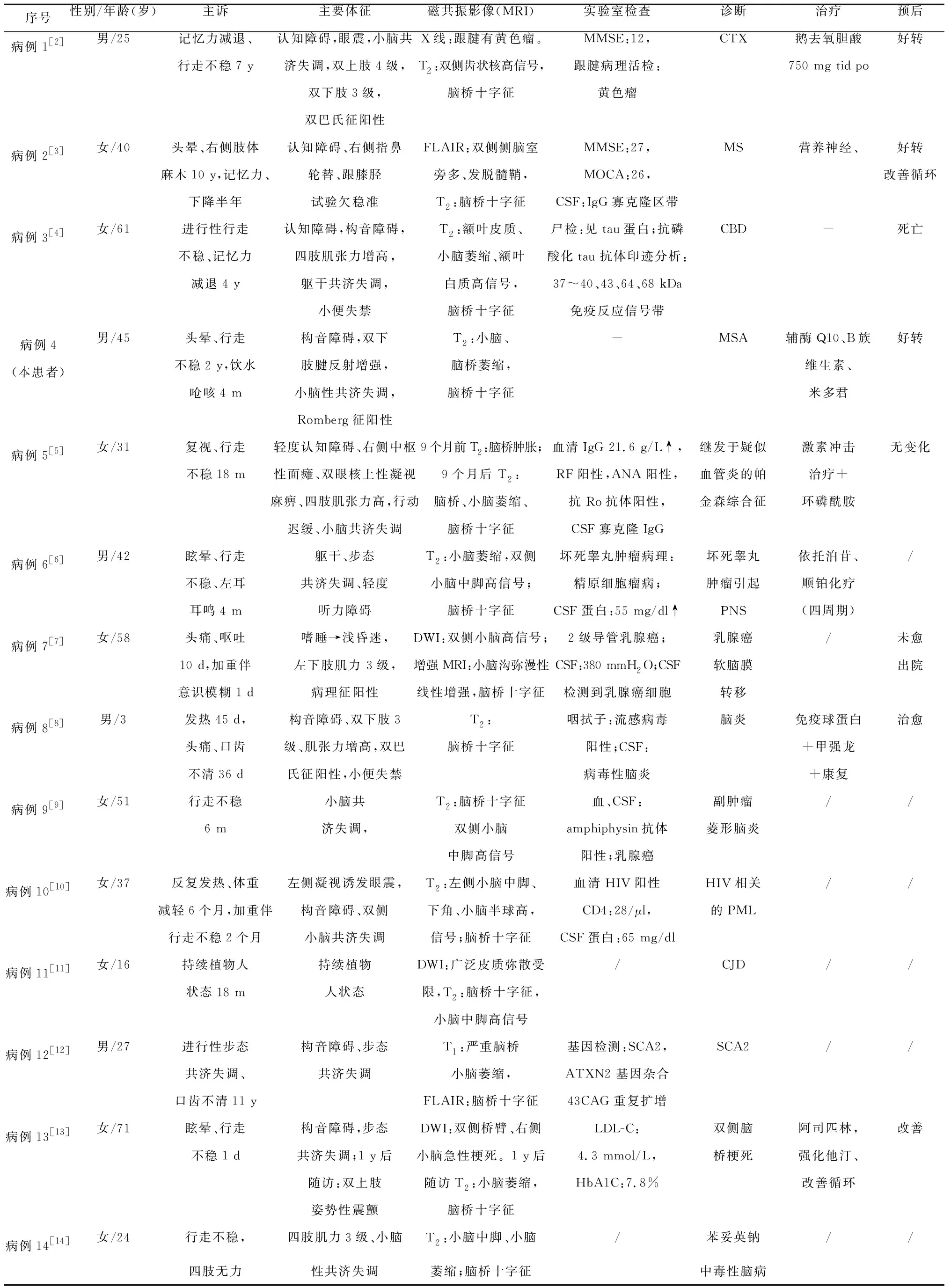
表1 一般特征表
3 讨 论
HCB征最早是在1990年由Savoiardo等[15]于橄榄脑桥小脑萎缩的病例中首次发现并报道,1998年由Schrag等将这种脑桥高信号影命名为“十字征”。Schrag等指出HCB征形成机制主要是:脑桥核及其发出的通过小脑中脚到达小脑纤维(桥横纤维)选择性变性,而小脑上脚纤维、锥体束、内侧丘系和脑桥背盖部却未受损,脑桥神经元、桥横纤维、小脑中脚因变性而严重减少,同时神经胶质增生使其水量增加,从而导致HCB征。HCB征多与脑桥、小脑萎缩有关,最常见于MSA,但其并不是特异性标志。目前有多项报道指出HCB征也可出现在其他疾病中,根据病因分型,总结如下。
CTX是一种先天性脂酸代谢障碍引起的脂质异常贮积病。它是由致病基因CYP27A1突变所致固醇-27羟化酶缺乏,使胆固醇合成胆汁酸受阻,导致胆固醇前体-胆甾烷醇沉积于脑、肝、肺和肌腱。跟腱常常出现跟腱黄瘤。由于胆甾烷醇具有神经毒性作用,导致中枢-周围神经系统广泛损害,中枢好发于小脑齿状核。在例1[2]患者的MRI中,T2可见双侧小脑齿状核非均匀高信号及小脑萎缩,脑桥出现典型HCB征,考虑与胆甾烷醇沉积于小脑损害桥横纤维所致。
MS是一种免疫介导的中枢神经系统慢性炎性脱髓鞘疾病。研究指出,MS各个阶段均可出现脑萎缩,原因可能是炎症诱导的轴索损伤导致传导束出现沃勒变性,或是髓鞘再生失败导致炎症后神经变性[16]。例2患者[3]出现HCB征,病因可能跟MS病程长,其炎症导致小脑中脚纤维束发生轴索损伤出现沃勒变性,从而导致脑桥-小脑萎缩,引起桥横纤维变性使其含水量增加,出现典型影像学改变。
CBD是皮质、基底节区及脑干神经元和胶质细胞中存在过度磷酸化tau蛋白沉积。例3患者[4]是第1例报道tau相关的神经退行性疾病与HCB征相关。结合病理活检,该患者出现HCB征的原因主要是脑桥核和中缝核神经元显著丢失、星形胶质细胞增生导致脑桥垂直线生成,桥横纤维显著退化,而皮质脊髓束和内侧丘系较少受累,导致横线形成,最终出现HCB征。
MSA典型影像学特点包括脑干、小脑萎缩、壳核“裂隙征”、脑桥HCB征和小脑中脚对称高信号等[17]。MSA的主要病理改变是脑桥基底核和小脑神经胶质细胞内出现嗜酸性包涵体,导致神经细胞死亡、萎缩、消失、神经细胞脱髓鞘及胶质增生,导致桥横纤维髓鞘受累而脑干被盖部和锥体束纤维相对保留所致,神经胶质增生使其含水量增加,从而出现HCB征。Horimoto等[18]把十字征演变过程分为6期:0期正常;Ⅰ期开始出现垂直高信号影;Ⅱ期出现清晰垂直高信号影;Ⅲ期继垂直线后开始出现水平高信号影;Ⅳ期为清晰的垂直线和水平线同时出现;Ⅴ期为水平线前方的脑桥腹侧出现高信号,或脑桥基底部萎缩引起的腹侧脑桥体积缩小,并发现水平线总是在垂直线后出现。本例患者临床诊断为可能的MSA,MRI提示患者处于HCB征的Ⅲ期,临床上需继续对患者进行随访。病例5[5]出现与小脑和脑干功能障碍相关的严重帕金森综合征,早期MRI示脑桥肿胀,可排除MSA。结合患者血清和脑脊液结果提示患者早期脑桥肿胀可能诊断是血管炎,该患者出现HCB征病因可能为继发于血管炎性梗死的选择性沃勒变性所致。
病例6[6]为睾丸肿瘤坏死引起的PNS,由于PNS新陈代谢率高,肿瘤的血液供应量过大引起免疫反应,导致患者脑脊液出现炎症反应,累积脑桥及双侧小脑中脚。由于小脑中脚炎性改变导致脑桥小脑束出现沃勒变性,出现HCB征。病例7[7]诊断乳腺癌软脑膜转移。该患者MRI未见显著小脑、脑桥萎缩,我们推测出现HCB征病因如下:(1)脑积水或脑脊液流动受阻导致颅内压升高;(2)肿瘤压迫或侵犯脑、脊髓引起的神经功能障碍;(3)破坏血-脑脊液屏障;(4)肿瘤压迫脑部血管侵入脑表面和血管周围间隙引起的脑缺血,可引起血管痉挛、脑病和供血减少;(5)由于神经元对脑葡萄糖利用的竞争性抑制导致代谢紊乱。因此,我们推测PNS出现HCB征可能是由于脑缺血、神经元营养缺乏、代谢异常和/或肿瘤直接侵袭导致。
HCB征在中枢神经系统感染性疾病中较少见。病例8[8]和9[9]指出HCB征可出现于脑炎、HIV患者中。病例9是第一个关于副肿瘤性菱形脑炎的报告。菱形脑炎病因谱包括感染性疾病、自身免疫性疾病和PNS中的免疫反应。本病例在血清及脑脊液中均检测到amphiphysin 抗体,提示PNS诊断明确。其出现HCB机制可能是由于仅限于神经元的肿瘤抗原或感染性抗原可诱导炎症形成,造成脑桥中缝、脑桥小脑纤维的神经元损伤导致自身免疫抗体生成[19],引起脑部炎症性疾病,最终导致机体对免疫抑制治疗出现反应,从而形成HCB征。病例10[10]为HIV相关的PML,其MRI提示存在不对称的坏死脱髓鞘过程,推测HCB征可能是由于HIV病毒感染导致脑桥小脑纤维损伤,随后出现神经胶质增生,导致左侧小脑白质病变,出现与PML一致的桥横纤维受损。病例12[12]为SCA2,其临床核心症状为小脑共济失调,可伴有椎体外系、椎体束征及周围神经病变等。病理表现为小脑、脑干和脊髓的变性、萎缩,早期可表现为橄榄桥脑小脑萎缩,导致脑干神经元和桥横纤维髓鞘受累而锥体束、内侧丘系、脑桥背盖部未受损,同时合并脑桥神经元胶质增生,出现HCB征。病例13[13]是1例伴有HCB征的双侧脑桥梗死,由于双侧椎动脉急性闭塞导致双侧桥臂、右侧小脑半球及脑桥旁正中出现急性脑梗死。桥臂是构成连接脑桥基底部与小脑的大量联系纤维束,通过桥横纤维构成脑桥小脑束。这些脑桥小脑束的沃勒变性容易导致小脑萎缩。该患者1 y后随访出现HCB征,考虑可能与脑桥梗死后桥横纤维发生继发于轴索损伤的沃勒变性有关。病例14[14]报道苯妥英钠所致的中毒性脑病患者在小脑齿状核出现对称带状异常信号(T1低信号、T2、FLAIR高信号),该患者的影像学示小脑显著萎缩,但脑桥体积基本正常,这与 MSA-C完全不同,其出现HCB征的原因可能是苯妥英钠可以选择性地破坏桥脑小脑纤维束,导致脑桥出现HCB征。
综上所述,本研究系统的回顾总结了引起HCB征的罕见病因,包括营养代谢性、炎性脱髓鞘性、神经系统变性病、肿瘤或副肿瘤、感染性、遗传、中毒和脑卒中等病因。根据临床表型、神经影像学特征和基础疾病的不同,HCBs 的发生可能涉及不同的神经发病机制。因此我们在临床上遇到HCB征患者,不能轻易诊断神经退行性疾病,需要同时考虑是否可能合并以上病因,进一步为临床提供诊疗思路。
