卡瑞利珠单抗治疗胃腺癌致周围神经病变及横纹肌溶解病变1例报告
2022-09-20董芹芹胡怀强郭洪伟曹秉振陈碧红路爱军
袁 军, 董芹芹, 胡怀强, 郭洪伟, 曹秉振, 陈碧红, 路爱军
随着现代医学的不断发展,在攻克恶性肿瘤技术方面,我们进入了普遍应用免疫检查点抑制剂(immune checkpoint inhibitor,ICIs)的时代,ICIs可明显延缓不同种类实体肿瘤患者病情进展,增加生存时间[1]。但近年来研究发现,由于ICIs能增强免疫细胞活性以杀伤肿瘤细胞,同时也会损害机体的免疫耐受能力,从而引起大量的免疫相关不良事件(immune-related adverse events,irAEs)。ICIs种类繁多,目前大致分为3类,包括靶向于PD-1、 PD-L1(配体)以及细胞毒性T淋巴细胞相关蛋白(CTLA-4)。卡瑞利珠单抗属PD-1抑制剂代表药物之一,在2019年才经我国国家药品监督管理局(NMPA)批准[2],因而关于此药的irAEs病例报道较少,缺乏临床应用经验。故本文报道1例胃贲门腺癌患者在联合应用卡瑞利珠单抗+奥沙利铂+替吉奥+阿帕替尼4 w后逐渐出现肌无力、多组颅神经损害、心肌损害等临床症状。经激素及免疫球蛋白等治疗后好转出院。本文旨在帮助临床医师早期识别irAEs、制定针对性治疗策略,有效改善患者预后。
1 临床资料
患者,男性,83岁。因“眼睑下垂、言语不清6 d,加重6 h”就诊。2021年9月22日因反酸就诊外院查癌胚抗原:9.02 μg/ml;糖类抗原CA199:3323 U/ml。胃镜检查示贲门-胃底占位,病理示贲门胃底腺癌,免疫组化示Her-2(2+),10月2日和10月16日分别给予静滴卡瑞利珠单抗200 mg及奥沙利铂、替吉奥、阿帕替尼化疗药物2个周期。2021年10月26日无明显诱因出现右眼睑下垂,视物模糊,随即数天内出现左侧眼睑下垂,视物模糊加重,伴言语不清、声音嘶哑、吞咽呛咳。无发热,无偏侧肢体无力。就诊于外院测眼压正常,完善头部CT及头颈部CTA示颅内动脉硬化及左侧大脑后动脉狭窄。查肌钙蛋白I 0.94(0~0.04 ng/ml);肌酸激酶(CK):1672 U/L(26~140 U/L);肌酸激酶同工酶26.5 ng/ml(0~5 ng/ml)。心电图提示广泛ST-T改变,予以甲泼尼龙激素冲击治疗(500 mg/d)症状无改善,2021年11月4日就诊我科。既往史:高血压病史14 y,口服尼群地平片。糖尿病病史14 y,口服二甲双胍、格列美脲等。血糖血压控制可,无其他自身免疫性疾病史。个人史:吸烟及饮酒30余年,每日约10支;饮酒300 ml。自诉对“阿莫西林”过敏。家族史:父亲因高血压去世,母亲因冠心病去世;2弟1妹体健;家族中无类似病史。入院查体:体温36.5 ℃,脉搏100 次/min,呼吸20次/min,血压:135/80 mmHg。氧饱和度94%。心肺腹查体:轻度喘憋貌,强迫半卧位。神经系统查体:神志清,精神差,双侧瞳孔对光反射灵敏、瞳孔直径约3 mm,双侧眼睑下垂,右侧为著,双侧眼球各项运动均受限;声音嘶哑、构音不清,双侧咽反射减弱、悬雍垂右偏,舌肌力弱。双下肢肌力Ⅳ级,四肢腱反射减退(+),肌张力正常。吞咽功能评定:阳性。ADL评分60分。入院辅助检查:肿瘤标记物:糖类抗原199(CA199)334.80 U/ml。降钙素原(PCT)0.55 ng/ml;丙氨酸氨基转移(ALT)110 U/L;天门冬氨酸氨基转移酶(AST)151 U/L;白蛋白(ALB)34.2 g/L;高密度脂蛋白胆固醇(HDL-C)0.95 mmol/L;葡萄糖(GLU)6.61 mmol/L;乳酸脱氢酶(LDH)647 U/L;心肌酶:肌酸激酶(CK)2567 U/L;肌酸激酶(CK-MB)33.50 μg/L;糖化血红蛋白(HbA1c)6.60%;C反应蛋白(CRP)9.72 mg/L;余血常规、电解质、凝血功能等指标大致正常。头部MRI:脑内多发腔隙性脑梗死、缺血、软化灶。心脏超声:主动脉硬化;左室顺应性减低;左室收缩功能正常。腰椎穿刺:脑脊液压力正常、脑脊液常规正常;脑脊液生化:葡萄糖4.56 mmol/L;氯117.0 mmol/L;脑脊液IgA9.29 mg/L。抗体检测:副肿瘤综合征自身抗体14项阴性,神经节苷脂抗体谱24项阴性。骨骼肌抗体IgG、抗心肌抗体IgG(+),抗AChR抗体IgG阳性。肌电图:双侧正中神经F波出现率低,双侧胫神经及腓总神经传导速度下降(34.8~38.5 m/s),提示周围神经病变。新斯的明试验、冰袋均阴性。心电图:广泛ST-T段改变。入院后予以对症治疗。心肌酶、BNP及肝功能较前好转,神经系统查体无明显变化。11月11日(入院第二周)予以0.9%氯化钠注射液 250 ml+甲泼尼龙琥珀酸钠500 mg 静滴 1/d及免疫球蛋白27.5 g静滴 1/d 共5 d。此后序贯减少激素用量,期间心肌损伤标记物、脑钠肽(BNP)、肝功能等指标明显下降(见图1)。至入院第5周改为口服醋酸泼尼松片20 mg 口服 1/d。第6周时患者好转出院。住院期间完善肌肉活检(腓肠肌):灶性变性坏死伴横纹肌溶解样改变,CD8免疫组化阳性(见图2)。出院时神经系统查体:双眼睑下垂较前明显缓解,略有声音嘶哑,右眼球可内收,余各项活动仍不能,左眼球外展略受限,上视、下视、内收受限;四肢肌力Ⅴ-级,四肢腱反射减弱(+)。
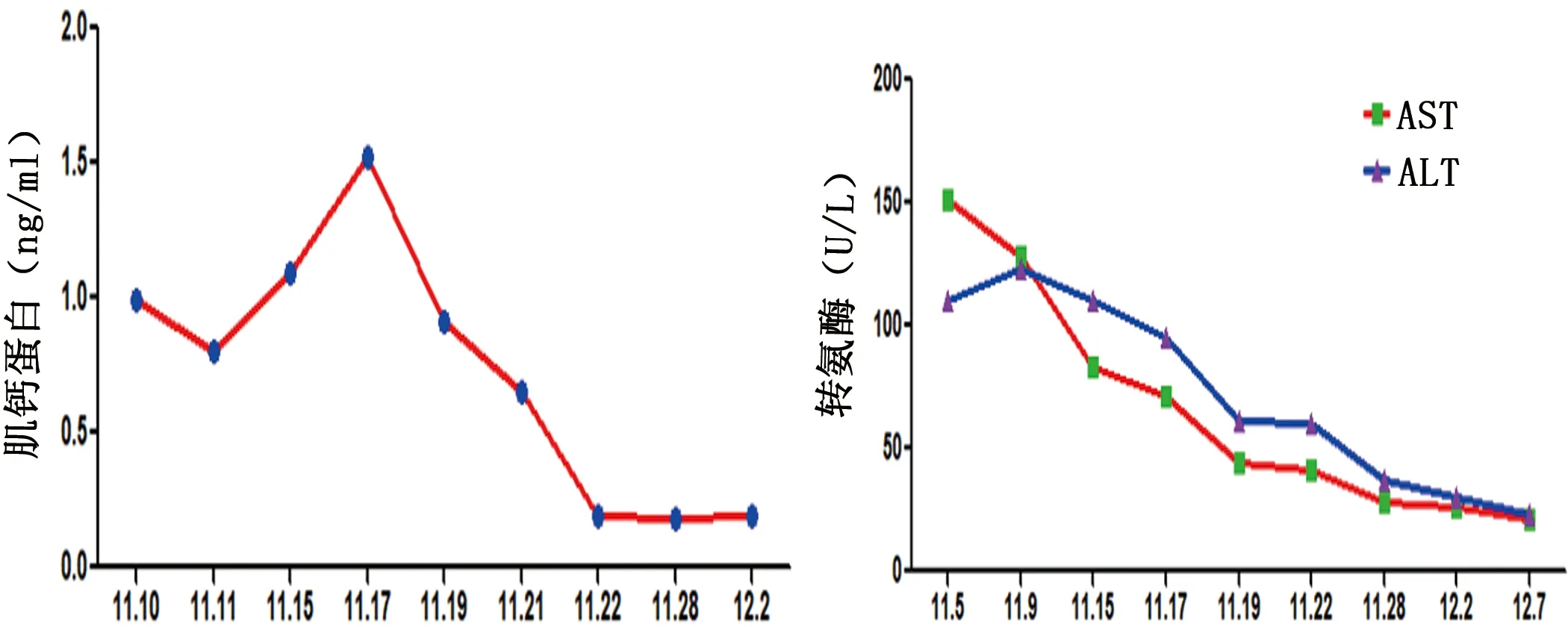
图1 入院后肌钙蛋白Ⅰ及丙氨酸氨基转移、天门冬氨酸氨基转移酶动态变化
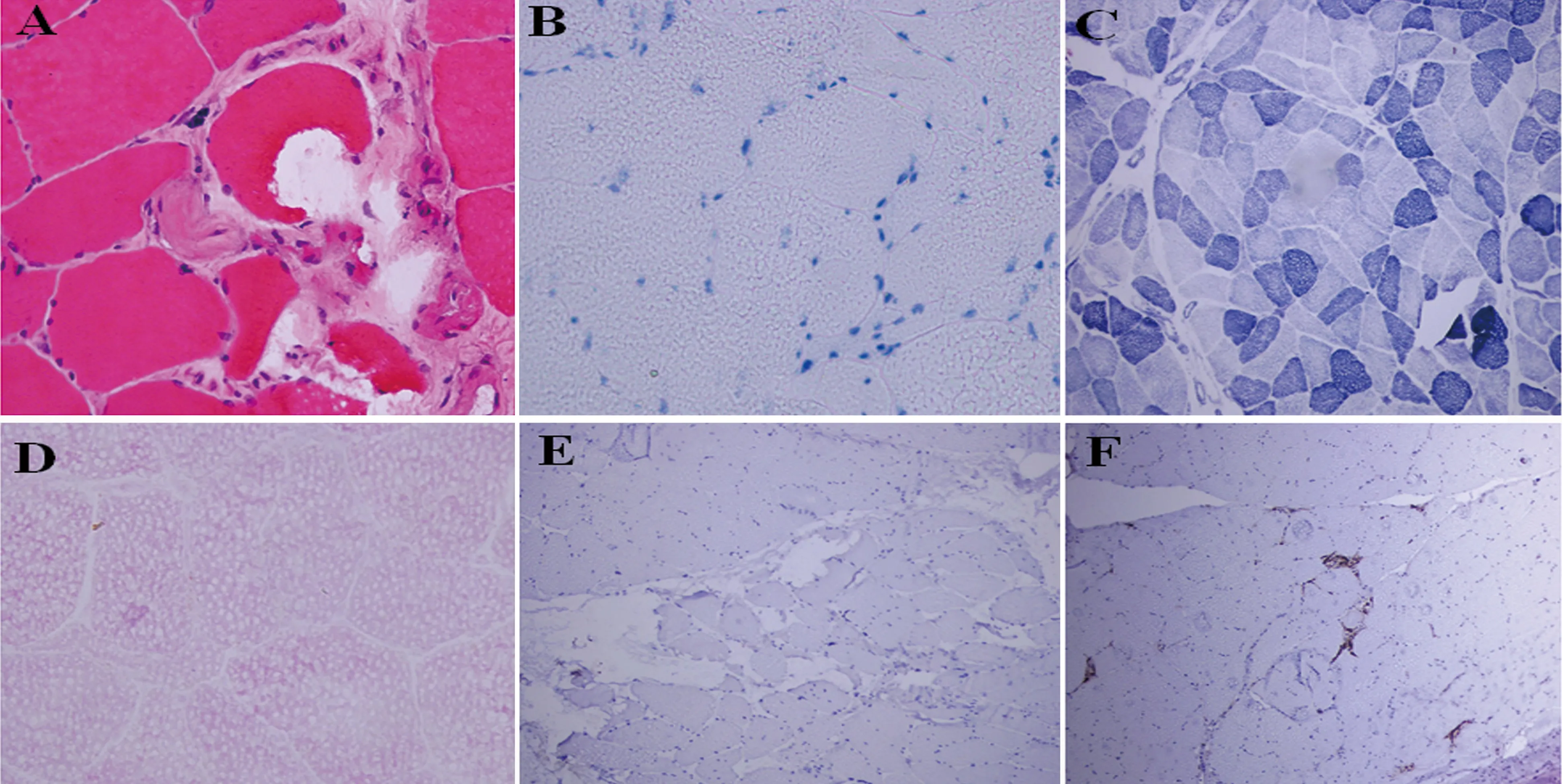
图2 肌肉活检A~F:A:苏木精-伊红(HE)染色:灶性变性坏死伴横纹肌溶解样改变;B:油红O(ORO):未见异常;C:Ⅰ-四氮唑蓝还原酶NADH-DR:两型肌纤维染色区分正常;D:过碘酸希夫(PAS):未见异常;E:CD4:未见异常;F:免疫组化CD8阳性
2 讨 论
卡瑞利珠单抗由我国自主研发,在2019年5月29日经NMPA批准上市,目前经广泛的临床试验研究,可用于治疗包括肝癌、晚期非小细胞肺癌、纵隔原发弥漫大B细胞淋巴瘤、胃食管癌等[3]。但与此同时,发现卡瑞利珠单抗也可引起诸多免疫相关不良事件,如免疫相关性间质性肺炎、结肠炎、白癜风、自身免疫性肝炎、以及内分泌功能障碍。ICIs治疗后出现神经系统相关不良事件(neuroiogic adverse events,NAEs)发生率为1%~5%。包括重症肌无力(myasthenia gravis,MG)、吉兰-巴雷综合征(Guillain-Barre syndrome,GBS)、肌炎和非感染性脑炎等[4]。在停止免疫治疗数月后,还可出现延迟免疫相关事件,包括急性脑病、神经结节病和GBS[5]。其临床症状相互交叉,往往会被忽视或掩盖。NAEs分为中枢神经系统和周围神经系统不良事件。较为严重的NAEs会急剧减少患者生存时间,这在国内外时有报道。在美国食品和药品监督管理局以及NMPA发布的ICIs药物中,已经证实纳武利尤单抗、帕博利珠单抗、伊匹木单抗3种药物可导致NAEs[6]。目前,卡瑞利珠单抗irAEs有关报道主要以皮肤及其附件,呼吸系统、骨骼肌、心脏、泌尿系统损害为主。尚无NAEs报道。因ICIs导致的irAEs大多出现在接受ICIs治疗的早期,主要与ICIs激发的肿瘤免疫应答及免疫调节失衡相关。某些肿瘤在神经、肌肉组织中存在相同的抗原决定簇,当ICIs改善肿瘤的免疫攻击的同时,会介导对神经肌肉系统产生继发免疫损伤,也可能导致原本隐匿的神经系统副肿瘤综合征的加重[7]。
ICIs相关性心肌炎发生率较低,约1.14%。但致死率较高,以PD-1单药相关的心肌炎病死率为36%;当合并抗CTLA-4治疗时,心肌损害症状会出现更早,其发生率及死亡率也显著提高[8]。ICIs相关性心肌损害发生机制目前尚未完全明确,但通常与免疫耐受的下调、共同抗原交叉反应、自身抗原所介导的免疫反应以及调节性T细胞稳态丧失相关[9]。PD-1相关心肌炎患者心肌解剖可见大量炎性细胞浸润,且来自心脏、骨骼肌和肿瘤的T细胞受体测序显示,这些组织中都有相似的T细胞克隆,因此抗心肌抗体可能出现阳性[10]。临床上可表现心脏特有症状,如胸痛、喘憋等心衰表现及不同类型的心率失常,甚至出现心源性休克或心脏骤停[11]。也可存在一些非特征性表现,如乏力、肌肉疼痛、发热等。实验室检查中心脏标志物升高是较为显著的指标,以肌钙蛋白升高为著,脑钠肽(BNP)或 N端前脑钠肽(NT-proBNP)、肌酸激酶等在ICIs相关心肌炎中也会明显升高。ICIs相关性心肌炎中约40%~89%的患者将呈现心电图异常变化,主要为短期内广泛的ST段抬高。此外,50%的患者超声心动图会出现LVEF下降(LVEF<50%),极易诱发左心室收缩功能障碍[12]。临床遇到上述症状时,排除急性冠状动脉综合征并结合相关病史,应高度怀疑ICIs相关心肌炎[13]。本文患者存在:(1)暴发性心肌炎,药物性心肌炎;(2)横纹肌溶解综合征;(3)胃恶性肿瘤;(4)心力衰竭表现。根据诺氏药物不良反应评估量表,该例卡瑞利珠单抗导致心肌炎的评分为6分,为很可能有关(probable),同时具有客观证据及定量检测结果支持。关于ICIs相关性心肌的治疗,依据美国国家癌症研究所(National Cancer Institute,NCI)制定的常见不良事件评价标准(common terminology criteria for adverse events,CTCAE)对irAEs由轻到重分为1~5级[14],达到3级患者应及时停用ICI并使用糖皮质激素,效果不佳时可试用免疫抑制剂。
ICIs常常出现心肌、骨骼肌损害合并,约25%的患者可出现ICIs相关性心肌炎,而普通 MG 合并心肌炎的患者仅为0.9%。本文患者其血清中抗骨骼肌抗体IgG抗心肌抗体IgG及抗AChR抗体IgG均阳性,但并未诊断为MG。因其约30%的ICI 相关 MG 可合并肌炎,出现肌无力、横纹肌溶解等表现,称为免疫相关性肌炎(immune related myositis,IRM),目前文献已报道除卡瑞利珠单抗外多数单抗药物可导致IRM[15],近年来经ICIs治疗后出现重症肌无力-肌病重叠综合征病例也逐渐被报道[16]。患者肌活检可见坏死肌纤维,呈现多灶性坏死纤维簇、肌巨噬细胞细胞聚集与肌纤维再生等表现。国内曾有应用PD-1抑制剂后出现周围神病变报道,但主要以脱髓鞘损害为主。本文患者在应用卡瑞利珠单抗时曾合并其他几种化疗药物,但肌电图特点较为不符。如铂类药物导致周围神经病变在肌电图上出现改变时,一般均在用药数月以上[17]。当PD-1 抑制剂治疗后体内免疫稳态平衡被打破,可导致周围神经及神经肌肉-接头的数种抗原产生自身抗体[18]。2014年GBS和MFS的新分类和诊断标准提出一种GBS分类方法,描述变异型-不完全性的Miller-Fisher(MFS)综合征。MFS中约2/3以上患者血清中出现抗GQ1b抗体阳性,当机体免疫系统发生错误识别,可诱导交叉反应性自身免疫产生GQ1b抗体,直接与动眼神经、滑车神经、展神经的结旁区、神经肌肉接头的神经节苷脂受体特异性结合,造成轴突及髓鞘脱失病理改变[19]。曾有文献报道抗GQ1b抗体阴性的MFS患者,其原因可能是未寻找到出现症状后合适的检测抗体时间[20]。部分患者可出现抗GM1、GD1a IgG抗体阳性。临床表现上更加复杂多样,包括不伴有共济失调的急性眼外肌麻痹以及眼内肌、面神经麻痹、味觉异常等颅神经受损。也包括头痛、头晕、肢体麻木无力等非特异性症状[21]。可不出现脑脊液蛋白细胞分离现象。本文患者亦不能排除ICIs相关MFS诊断。ICIs相关心肌损害或神经系统损害均可使用激素治疗,此患者停用ICI后经大剂量激素治疗以及静脉注射免疫球蛋白,临床症状明显改善,包括颅神经损害的恢复及心肌损伤相关指标均呈现下降趋势。但患者神经系统症状恢复仍较为缓慢,部分患者也可试用血浆置换疗法。对于此类患者的临床治疗方案及愈后观察,仍需进一步积累更多相关经验。
本文报道1例胃腺癌患者在应用PD-1 抑制剂卡瑞利珠单抗后出现神经系统、肌肉、心脏损害等。其中以周围神经及支配眼外肌神经、心肌、骨骼肌损害较为突出,同时合并多种抗体阳性。本文所报道内容可作为PD-1 抑制剂治疗出现NAEs增加相关临床诊疗支持,警惕其神经系统并发症,总结归纳治疗方案,以提高诊断率和治疗效果。但在更深层次的免疫机制方面,仍需更多基础研究工作者进一步研究阐明。
