肝硬化患者上消化道出血的危险因素分析
2022-09-20石小枫
王 茜,薛 莹,冯 雪,程 雪,石小枫△
(1.重庆医科大学附属第二医院感染科 400010;2.云南省第一人民医院感染科,昆明 650100;3.湖北省武汉市第一医院康复科 430030)
肝硬化是临床常见的慢性进行性肝病,是由一种或多种病因长期或反复作用形成的弥漫性肝损害,病理组织学检查是其诊断的标准[1]。肝硬化往往伴有多系统受累,晚期常出现上消化道出血、肝性脑病、继发性感染等并发症,而上消化道出血是最常见的致死并发症[2]。可通过检测肝静脉压力梯度(hepatic venous pressure gradient,HVPG)判断门静脉高压及上消化道出血风险,但该检查为有创检查,故临床常采用电子内镜这一无创检查来评价肝硬化患者食管静脉曲张程度[3],通过电子内镜可以直观地了解患者静脉曲张部位、程度及有无红色征[1],但电子内镜需在静脉麻醉下实施,而一般情况较差、有麻醉风险的患者存在绝对禁忌证。若能通过检测生化指标,初筛具有上消化道出血风险的肝硬化患者或排除出血风险极小的患者,再决定是否进行该项检查,将会有效减少肝硬化上消化道出血的发生率。本文通过分析不同阶段肝硬化患者生化指标来探讨肝硬化上消化道出血患者的临床特征,为减少上消化道出血的发生、提高患者生存率提供参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2010-2021年重庆医科大学附属第二医院明确诊断的414例肝硬化患者为研究对象。纳入标准:(1)经临床表现、实验室检查、影像检查或肝穿刺病理活检诊断为肝硬化患者;(2)符合《肝硬化门静脉高压症食管、胃底静脉曲张破裂出血诊治专家共识(2019版)》对肝硬化上消化道出血的诊断标准[4],即①患者既往有呕血、黑便史,且经内镜诊断为食管静脉曲张;②内镜下可见食管静脉曲张活动性出血。排除标准:(1)非肝硬化所致严重凝血功能障碍的患者;(2)既往已行脾切除术、经颈静脉肝内门体分流术(transjugular intrahepatic portosystemic shunt,TIPS)、内镜下套扎或硬化治疗的患者;(3)呼吸循环衰竭、肾衰竭或多器官衰竭的患者;(4)有严重心脑血管疾病患者及长期服用抗血小板(platele,PLT)、抗凝药物患者;(5)合并肝癌外其他恶性肿瘤者。414例患者中男273例,女141例,平均年龄(54.97±11.19)岁。病因:病毒性272例(65.7%),酒精性43例(10.4%),免疫性62例(15.0%),其他37例(8.9%)。 按是否出血分为未出血组(323例)和出血组(91例),再将未出血组按照胃镜下静脉曲张程度分为高出血风险组(红色征阳性或重度静脉曲张不伴红色征,107例)和低出血风险组(无静脉曲张或轻中度静脉曲张不伴红色征,216例)。
1.2 方法
回顾性收集各组临床数据:(1)一般资料,包括性别、年龄、肝硬化类型;(2)第1次静脉血的实验室检查结果,包括凝血酶原活性度(prothrombin activity,PTA)、国际标准化比值(international standardized ratio,INR)、凝血酶原时间(prothrombin time,PT)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、清蛋白(serum albumin,ALB)、γ-谷氨酰胺转移酶(γ-glutamine transferase,γ-GT)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆红素(total bilirubin,TBil)、胆碱酯酶(cholinesterase,CHE)、甲胎蛋白(alpha fetoprotein,AFP)、白细胞(white blood cell,WBC)、PLT、中性粒细胞(neutrophils,Neu)、降钙素原(procalcitonin,PCT)、肾小球滤过率(glomerular filtration rate,GFR)、肌酐清除率(creatinine clearance,Ccr)、血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN)。
1.3 统计学处理
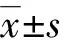
2 结 果
2.1 出血组与未出血组一般资料比较
两组PTA、INR、PT、ALT、AST、ALB、γ-GT、ALP、TBil、CHE、AFP、Neu比较,差异有统计学意义(P<0.05),见表1。
2.2 出血组与未出血组二元logistic回归分析
将肝硬化伴有上消化道出血作为自变量,因最小有效样本量为91,故因变量控制在9个以下最佳,故选取单因素分析中差异有统计学意义的9个指标作为因变量进行二元logistic分析,结果显示CHE升高是肝硬化患者发生上消化道出血的保护因素,Neu升高是危险因素(P<0.05),见表2。
2.3 高出血风险组与低出血风险组一般资料比较
两组AFP、WBC、PLT、Neu、PCT比较,差异有统计学意义(P<0.05),见表3。
2.4 高出血风险组与低出血风险组二元logistic回归分析
将胃镜下出血风险作为自变量,将单因素分析差异有统计学意义的指标作为因变量进行二元logistic分析,结果显示纳入的因素均不是胃镜下出血风险的影响因素(P>0.05),见表4。
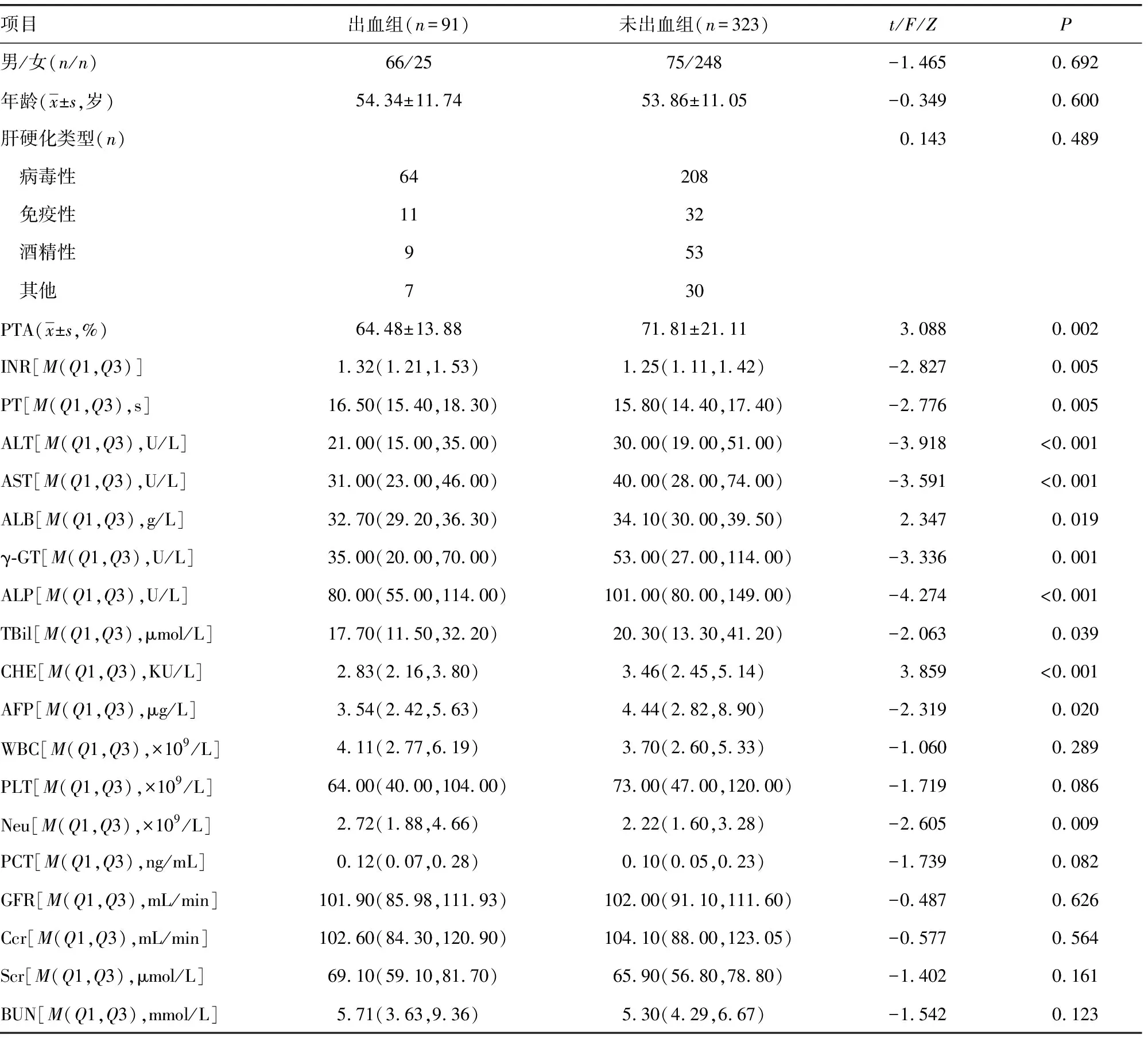
表1 未出血组与出血组一般资料比较
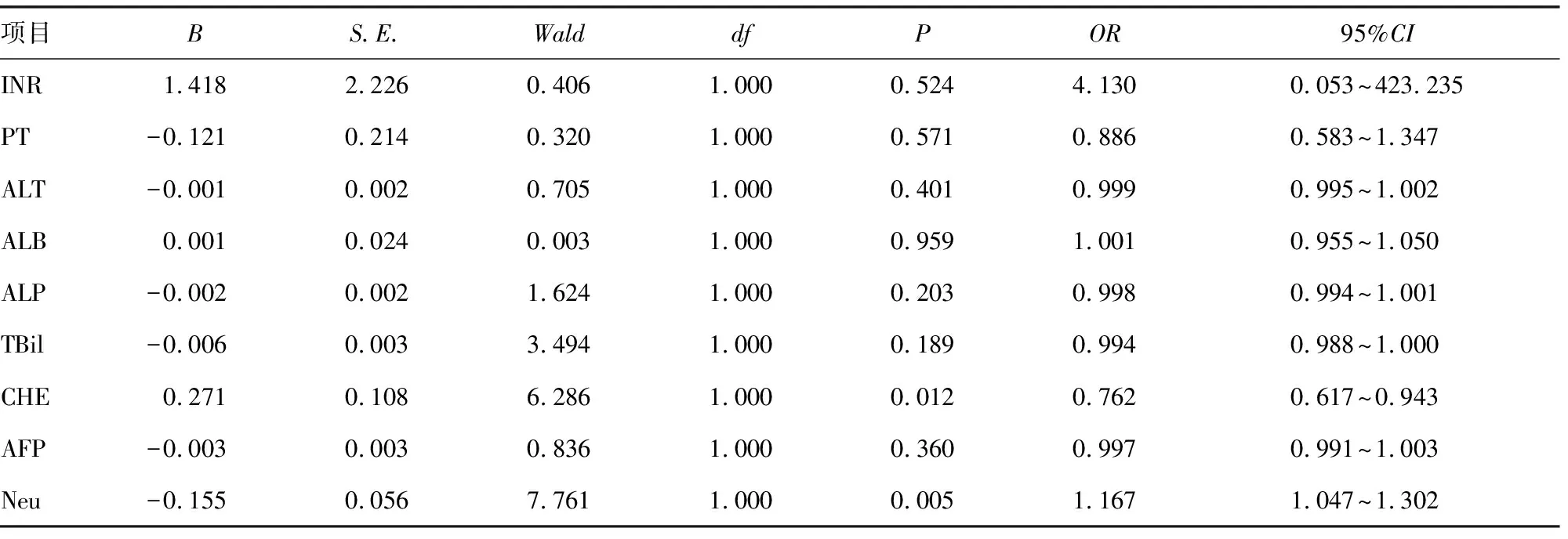
表2 出血组与未出血组二元logistic回归分析
表3 高出血风险组与低出血风险组一般资料比较
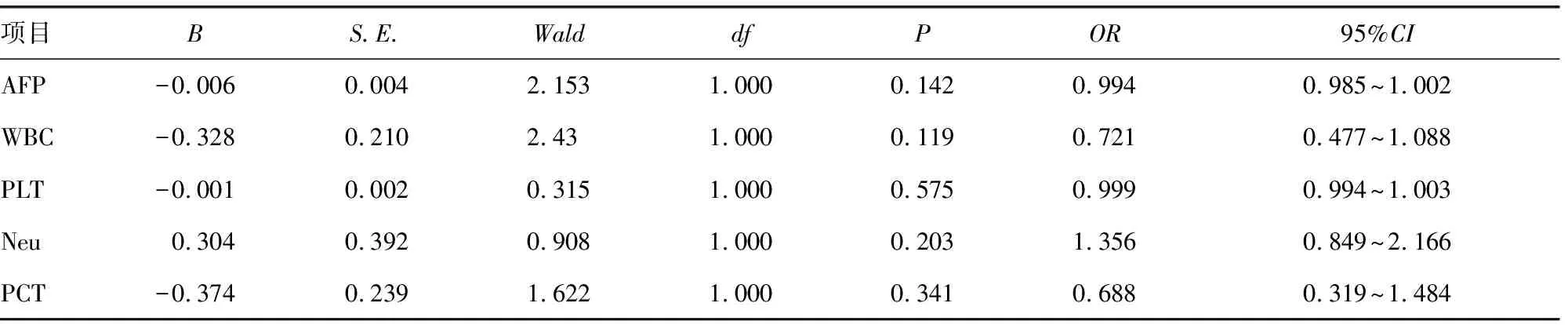
表4 高出血风险组与低出血风险组二元logistic回归分析
3 讨 论
我国最常见的肝硬化病因为乙型肝炎病毒感染。病理组织学上假小叶形成为肝硬化的金标准[5]。肝硬化上消化道出血为肝硬化失代偿期的常见临床表现之一,其中70%的上消化道出血为食管静脉曲张破裂出血,而门静脉压力是决定静脉曲张破裂出血严重程度的关键因素[4],HVPG即颈静脉插管测定肝静脉楔入压与游离压之差,为目前评估门静脉压力金标准[6]。HVPG正常值为3~5 mm Hg,HVPG>5 mm Hg认为存在门静脉高压,HVPG>10 mm Hg是发生静脉曲张、肝硬化失代偿期的预测因子,当HVPG>20 mm Hg是预后不良的有效预测因子[7]。
有研究表明肝病的严重程度与食管静脉曲张的分级相关,大约85% Child-Pugh C 级肝硬化患者有静脉曲张[8],而只有45%的Child-Pugh A级肝硬化患者有静脉曲张[9],即晚期肝病患者更容易发生食管静脉曲张,因此,上消化道出血的风险将增大。
本研究中出血组与未出血组PTA、INR、PT、ALT、AST、ALB、γ-GT、ALP、TBil、CHE、AFP、Neu比较,差异有统计学意义(P<0.05),对以上指标进行二元logistic分析,结果显示CHE升高为上消化道出血的保护因素,而Neu升高是危险因素(P<0.05)。两组Neu有明显差异,出血组平均水平高于未出血组。有研究显示,肝硬化患者Neu不仅数量减少[10]、寿命缩短[11],且其功能也存在不同程度的损伤,而Neu的数量减少与功能损伤是导致肝硬化患者易发感染的重要原因[12]。上消化道出血可增加感染风险[13],出血患者较未出血患者更易伴发感染,导致本研究出血组Neu水平高于未出血组,故不考虑Neu升高是食管静脉曲张破裂出血的危险因素。同理,在未出血患者中,低出血风险组WBC、Neu水平高于高出血风险组,符合上述结论。在正常范围内WBC及Neu稍高并不能代表感染的发生,但可以指示机体免疫力水平。本研究中,纳入高出血风险组与低出血风险组差异有统计学意义的单因素生化指标(AFP、WBC、PLT、Neu、PCT)进行多因素分析,结果显示差异无统计学意义(P>0.05),未找到与静脉曲张程度相关的生化因素,但当以上指标出现明显异常时仍需警惕肝硬化进展及发生上消化道出血。
值得注意的是,PLT作为出血疾病中重要的一个因素,在本研究中并没有明显价值。PLT是机体止血功能中不可或缺的一环,当血管创伤而失血时,PLT迅速黏附于创伤处,并聚集成团,形成较松软的止血栓子继而促进血液凝固并形成坚实的止血栓子。所以,PLT主要参与机体生理性止血,同时也有支持与营养血管的作用。但肝硬化患者上消化道出血的关键一环为门静脉压力升高而非凝血功能异常。
目前的指南建议使用Baveno Ⅵ标准[14](通过瞬时弹性成像测量的肝脏硬度值<20 kPa,加上PLT>150 000/L)来确定需要治疗的静脉曲张风险较低的患者[2]。根据Baveno Ⅵ标准,高危静脉曲张患者可避免约26%的内窥镜检查[15]。由于不必要的内窥镜检查的数量较多,因此,建立了扩大的Baveno Ⅵ标准(通过瞬时弹性成像测量的肝脏硬度值<25 kPa,PLT>110 000/L)[14]。此外,许多研究表明脾脏硬度是预测高风险食管静脉曲张存在的最佳单一参数[16-19]。
综上所述,本研究所纳入生化指标不足以准确预测患者出血风险,但在临床工作中仍可以指引判断患者病情严重程度从而予以进一步检查及治疗。此研究为回顾性研究,样本量较少,所研究指标较局限,临床资料不全面,研究结果必然存在一定偏差,故仍需更多、更完善的研究来探讨肝硬化上消化道出血患者的生化特征。
