基于生物信息学的乳腺癌细胞焦亡相关基因多组学分析及相关中药筛选预测
2022-09-20谢雁鸣黎元元席俊羽
刘 毅,谢雁鸣,黎元元,崔 鑫,席俊羽
·数据挖掘与循证医学·
基于生物信息学的乳腺癌细胞焦亡相关基因多组学分析及相关中药筛选预测
刘 毅,谢雁鸣*,黎元元*,崔 鑫,席俊羽
中国中医科学院中医临床基础医学研究所,北京 100700
基于生物信息学探究细胞焦亡相关基因在乳腺癌中的作用及临床意义,并筛选可对细胞焦亡起调控作用的中药。从TCGA、GEO数据库中获取乳腺癌相关数据集;使用R、Perl语言对细胞焦亡相关基因在乳腺癌细胞中的表达、变异进行评估;对数据集分别进行细胞焦亡基因分型及预后差异基因分型,并对各分型进行多组学分析;构建预后模型、进行风险评分,按照风险评分分组进行亚组多组学分析并检验对生存的预测能力;以细胞焦亡基因为靶点,利用TCMSP数据库及Cytoscape软件构建“细胞焦亡靶点-成分-中药”网络并进行拓扑学分析,进而得出核心中药及其相关属性。大多数细胞焦亡基因在乳腺癌中表达异常并具有拷贝数变异,细胞肿瘤抗原(cellular tumor antigen p53,)等11个基因发生了体细胞突变;细胞焦亡分型中A亚型预后好、细胞焦亡基因及免疫相关通路高表达、免疫细胞含量高;B型与之相反,且A、B两亚型差异明显,其分型差异基因有1223个。将不同的焦亡基因重新聚类,得到3个基因型,乳腺癌细胞焦亡预后差异基因分型中I组预后最好,II组最差,I组主要为基因及细胞焦亡基因高表达,II组主要呈现低表达。预后模型风险评分将患者分为高、低风险组,低风险组细胞焦亡基因高表达、预后好,高风险组相反,通过列线图可对患者不同临床特征进行预后评估;免疫细胞与风险评分相关性大多呈负相关;肿瘤微环境中基质细胞、免疫细胞及总评分均为高风险组更低,肿瘤突变负荷则高风险组更高;干细胞与风险得分呈正相关。“细胞焦亡靶点-成分-中药”网络得出木蝴蝶、红花等17味中药为核心药物,其性味主要为苦寒,次以辛温,辅以甘平之品,主要调节肝、肺、脾、胃等脏腑。细胞焦亡基因在乳腺癌的免疫中发挥重要作用,与乳腺癌患者预后具有明显相关性,调控细胞焦亡基因的中药主要有木蝴蝶、红花等17味药物,可为乳腺癌的诊疗及中药干预研究提供思路与参考。
细胞焦亡;生物信息学;中药;乳腺癌;多组学分析;木蝴蝶;红花
细胞焦亡(pyroptosis)是一种由炎症小体引发的裂解性程序性细胞死亡形式[1],该过程由促炎性半胱氨酸蛋白酶(Caspase)-1、4、5、11的底物gasdermin D介导并伴随炎症和免疫反应[2]。研究发现细胞焦亡可以影响肿瘤的增殖、侵袭和转移[3]。因此,有报道认为诱导肿瘤细胞焦亡是一种潜在的癌症治疗策略[4]。
乳腺癌(breast cancer)是目前最常见的恶性肿瘤之一,是女性癌症死亡的最常见原因[5],其终生患病概率为12.3%[6],对女性群体有极大的危害性。受益于诊断及影像技术发展与早期筛查,乳腺癌的死亡率已经大幅降低[7],但由于存在一定复发及转移风险,乳腺癌患者的预后仍然不佳[8-9]。目前乳腺癌的治疗主要包括手术、内分泌治疗、放疗、化疗、靶向治疗等[10-12],但这些治疗往往存在较严重的不良反应[13-15]。因此,鉴于细胞焦亡对癌症存在调控作用,以此研究方向为指导或可开发更加安全、有效的新药物。
中药对于乳腺癌治疗的有效性被广泛报道[16],而挖掘与细胞焦亡相关的中药则更有利于指导相关研究与临床应用。本研究通过生物信息学方法从多组学角度全面分析细胞焦亡相关基因的表达及其与乳腺癌生存、预后、免疫、肿瘤微环境等方面的相关性,并在此基础上筛选出可能对细胞焦亡有调控作用的中药。
1 资料与方法
1.1 数据收集及处理
在TCGA数据库(https://portal.gdc.cancer.gov/)中分别获取乳腺癌相关转录组、临床、突变及拷贝数数据。对其数据进行解压、ID转换并将其格式由FPKM(fragments per kilobase per million)转换为TPM(transcripts per million)。在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中检索“breast cancer survival”并限定数据类型(expression profiling by array)及物种(homo sapiens)进行筛选,获取基因表达及临床数据,然后对其数据进行基因符号注释。
1.2 乳腺癌细胞焦亡基因突变、拷贝数变异、差异、生存及预后分析
通过检索细胞焦亡相关文献获得细胞焦亡相关基因,将样品突变数据中的细胞焦亡相关基因利用R语言“maftools”包及Perl语言进行突变类型、频率、数目、碱基改变及负荷的统计分析,并将结果以瀑布图表示;然后检索UCSC Xena(https:// xena.ucsc.edu/)数据库并下载乳腺癌拷贝数相关数据,使用Perl语言提取样品中细胞焦亡相关基因的拷贝数,再使用R语言将样品细胞焦亡相关基因拷贝数结果绘制成拷贝数频率图及圈图;将TCGA及GEO数据库中的样品表达量数据使用R语言中的“limma”和“sva”包进行合并,并提取细胞焦亡基因的表达量,再将2个数据库所得临床数据中的生存时间、生存状态数据进行合并,使用R语言的“survival”和“surminer”包进行生存和预后分析并可视化。
1.3 乳腺癌细胞焦亡分型及分型基因生存分析、基因集变异分析(gene set variation analysis,GSVA)、免疫细胞差异分析(single sample gene set enrichment analysis,ssGSEA)和主成分分析(principal component analysis,PCA)和差异性分析
根据细胞焦亡的表达量使用R语言的“ConsensuClusterPlus”对乳腺癌细胞焦亡基因进行聚类分型,其中聚类算法为K-means,距离类型为欧氏距离;然后使用R语言的“RcolorBrewer”“GSVA”“PRGcluster”等将分型后的两组细胞焦亡基因进行生存分析、细胞焦亡基因表达分析、GSVA、ssGSEA、PCA并可视化,最后将细胞焦亡分型的两组样品基因表达量进行差异分析,并获得分型之间的差异基因。
1.4 乳腺癌细胞焦亡分型差异基因基因本体(gene ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析
将“1.3”项所得的细胞焦亡分型之间的差异基因使用R语言的“clusterProfiler”和“enrichplot”包分别进行GO的生物过程(biological process,BP)、分子功能(molecular function,MF)及细胞成分(cellular component,CC)富集分析和KEGG通路富集分析,按照<0.005进行筛选,并绘制GO及KEGG分析的气泡图。
1.5 乳腺癌细胞焦亡分型预后相关差异基因再分型及其生存与表达分析
根据“1.3”项所得分型差异基因的生存分析结果探寻预后相关的差异基因,再通过R语言聚类分析将预后相关差异基因进行聚类分型,选取准确性最高的聚类结果作为分型结果。根据分型结果比较不同分型之间的生存情况,并绘制生存曲线与差异基因热图。然后将“1.3”项所得基因分型的结果与“1.2”项所得细胞焦亡基因表达量数据使用R语言进行差异分析并绘制箱线图。
1.6 预后模型的构建、分析及其可视化
①将包含单因素显著基因表达数据和临床生存数据的集合进行随机分组,分为训练(train)组及验证(test)组;然后构建基因表达量及生存时间、状态的套索算法(least absolute shrinkage and selection operator,Lasso)回归模型并进行交叉验证,选择其中误差最小的点对应的基因作为Lasso回归模型显著基因,结合显著基因与其表达量构建COX回归模型。②利用训练组得出模型计算公式,即基因表达量乘以系数再求和,进一步根据公式计算训练组风险得分,根据得分中位数区分高、低风险组;验证组同理,即通过公式计算风险得分,并根据训练组的中位数区分验证组的高、低风险组;进行生存差异分析并得出差异的值、受试者工作特征曲线(receiver operating characteristic curve,ROC)、风险曲线及列线图。③将细胞焦亡分型、基因分型结果通过R语言分别进行预后分析,比较不同分型之间的差异性及风险得分并可视化;再分析高、低风险组之间细胞焦亡相关基因的差异性,并绘制箱线图。
1.7 免疫细胞浸润与免疫细胞含量分析
将“1.2”项中TCGA和GEO数据库所得数据的并集利用R语言CIBERSORT命令获得总量为1的免疫细胞相对含量;将免疫细胞相对含量的数据结果根据<0.05进行过滤,并与“1.6”项风险得分的结果取交集,最后对所有免疫细胞进行循环计算,得到风险得分、基因与免疫细胞的相关性结果。
1.8 肿瘤微环境分析、肿瘤突变负荷分析及干细胞分析
①将“1.2”项中TCGA和GEO数据库所得数据的并集使用R语言“estimate”包对肿瘤微环境进行基质细胞、免疫细胞、肿瘤纯度分析以及综合评分;利用评分结果与“1.6”项所得高、低风险组进行肿瘤微环境差异分析,并采用小提琴图表示。②将所有样品的风险数据与染色体突变位置数据利用Perl语言分析得出其按照高、低风险组区分的肿瘤突变数据,并使用R语言绘制瀑布图;利用R语言的“reshape2”包结合“1.7”项中样品风险数据及“1.5”项中分型数据获取肿瘤突变负荷数据,并以箱线图表示。③将泛癌干细胞打分数据结合“1.7”项中样品风险数据,利用R语言分析获得相关性结果并绘制散点图。
1.9 统计分析
使用R v.4.1.2软件进行统计分析。2组独立样品数据比较采用检验。3组及以上的数据,则采用单因素方差分析(ANOVA)及Kruskal-Wallis秩和检验,以<0.05表示存在统计学意义。
1.10 “细胞焦亡相关靶点-有效成分-中草药”网络构建与药物筛选
将细胞焦亡相关靶基因使用TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)查找靶点相关的有效成分并根据口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug likeness,DL)≥0.18进行筛选,然后通过有效成分筛选相关中药,使用CytoscapeV 3.8.0构建“靶点-成分-中药”网络并通过拓扑学分析获取核心中药。
2 结果
2.1 数据收集与处理结果
通过检索TCGA及GEO数据库,获得TCGA-乳腺癌中包含正常样品113个,肿瘤样品1109个;获得的GEO数据(GSE146558)中包含肿瘤样品109个。
2.2 乳腺癌细胞焦亡基因突变分析、拷贝数变异分析、差异分析、生存分析及预后分析结果
经过检索文献获得细胞焦亡基因52个,具体如表1所示。通过分析乳腺癌中细胞焦亡相关基因的拷贝数变异和基因突变的发生率,可知在986个突变数据样品中有394个样品发生了变异,突变比例占39.96%,其中突变率最高,达34%,其他为(2%)、(1%)、(1%)、(1%)、(1%)、(1%)、(1%)、(1%)、(1%)、(1%),如图1-A所示;图1-B则显示大多数细胞焦亡相关基因存在拷贝数的变化,而拷贝增加较缺失频率略大;由图1-C可进一步看出拷贝数变化的细胞焦亡相关基因所在染色体的位置;由图1-D可以看出71%的细胞焦亡基因在正常样品和肿瘤样品间表达存在显著性差异,其中、、、、、、、、、、、、、、、、、、、、、为肿瘤组表达上调,、、、、、、、、、、、、、、为肿瘤组表达下调。将TCGA与GEO数据合并后进行生存分析,结果见表2,其中风险率(hazard ratio,HR)>1的基因为高风险基因,<0.05则说明该基因为预后相关,根据图2-A可知,生存曲线中的预后相关基因有、、、、、、、、、、、、、、、、、、、、、、、、、、、、、,其大多为高表达则预后较好;然后进一步构建预后网络,如图2-B所示,其中紫色节点表示高风险基因,绿色节点表示低风险基因、节点大小表示值,红色连线表示正向共表达,蓝色连线表示负向共表达,由连线密度可知其中存在密切的联系。
2.3 乳腺癌细胞焦亡分型及分型基因生存分析、GSVA、ssGSEA、PCA和差异分析结果
通过对细胞焦亡相关基因表达量数据进行聚类分析,可将样品分为A和B 2个亚型(图3-A);对2个亚型进行生存分析,如图3-B所示,可知其存在统计学差异(<0.05),且A亚型预后较好;对2个亚型基因表达进行分析,如图3-C所示,可得A亚型多数呈现高表达,B亚型则相反;通过GSVA分析,则能看出A亚型主要对免疫相关通路呈现高表达,B亚型主要表现为低表达(图3-D);从ssGSEA分析结果(图3-E)可知,22个在两亚型间存在统计学差异的免疫细胞,其中活化B细胞、活化的CD4细胞、活化的CD8细胞、活化的树突状细胞、CD56bright自然杀伤细胞、嗜酸性粒细胞、γδT细胞、未成熟B细胞、未成熟的树突状细胞、骨髓源性抑制细胞、巨噬细胞、肥大细胞、单核细胞、自然杀伤T细胞、浆细胞样树突状细胞、调节性T细胞、滤泡辅助T细胞、1型T辅助细胞、17型T辅助细胞、2型T辅助细胞均在A亚型中含量高;唯有CD56dim自然杀伤细胞在B亚型中含量高;PCA分析(图3-F)显示,根据细胞焦亡相关基因的表达量可将A与B亚型明显区分;最后通过设置|log2FC|>0.585、<0.05,筛选出细胞焦亡分型的显著差异基因有1223个。
2.4 乳腺癌细胞焦亡分型差异基因GO富集分析和KEGG通路富集分析
通过对1223个细胞焦亡分型的显著差异基因进行GO分析,结果表明,BP主要涉及T细胞活化、细胞间黏附的调节、白细胞-细胞黏附、细胞因子产生的正调控、单核细胞分化、细胞活化的正调控、T细胞黏附的调节等免疫过程;MF主要涉及受体配体活性、信号受体激活剂活性、细胞因子受体结合、细胞因子活性、免疫受体等;CC主要涉及质膜筏的外侧、内吞囊泡、膜筏、膜微区等(图4-A)。KEGG通路富集分析显示,主要包括细胞因子-细胞因子受体相互作用、趋化因子信号通路、细胞黏附分子、爱泼斯坦-巴尔病毒感染、人类T细胞白血病病毒1感染、病毒蛋白与细胞因子和细胞因子受体的相互作用、造血细胞谱系、结核、吞噬体、破骨细胞分化、类风湿关节炎、核因子-κB(nuclear factor-κB,NF-κB)信号通路、Th17细胞分化、TNF信号通路等炎症、免疫相关通路(图4-B)。
表1 细胞焦亡相关基因
Table 1 Information of pyroptosis-related genes
序号基因符号基因名称 1BAK1B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)同源拮抗剂/杀伤剂(Bcl-2 homologous antagonist/killer) 2BAXBcl-2-相关X蛋白(Bcl-2 associated X protein) 3CASP1半胱氨酸天冬氨酸酶-1(Caspase-1) 4CASP3半胱氨酸天冬氨酸酶-3(Caspase-3) 5CASP4半胱氨酸天冬氨酸酶-4(Caspase-4) 6CASP5半胱氨酸天冬氨酸酶-5(Caspase-5) 7CHMP2A带电多泡体蛋白2a(charged multivesicular body protein 2a) 8CHMP2B带电多泡体蛋白2b(charged multivesicular body protein 2b) 9CHMP3带电多泡体蛋白3(charged multivesicular body protein 3) 10CHMP4A带电多泡体蛋白4a(charged multivesicular body protein 4a) 11CHMP4B带电多泡体蛋白4b(charged multivesicular body protein 4b) 12CHMP4C带电多泡体蛋白4c(charged multivesicular body protein 4c) 13CHMP6带电多泡体蛋白6(charged multivesicular body protein 6) 14CHMP7带电多泡体蛋白7(charged multivesicular body protein 7) 15CYCS细胞色素C(cytochrome C) 16ELANE中性白细胞弹性蛋白酶(neutrophil elastase) 17GSDMD焦孔素D(gasdermin D) 18GSDME焦孔素E(gasdermin E) 19GZMB粒酶B(granzyme B) 20HMGB1高迁移率基团蛋白B1(high mobility group protein B1) 21IL18白细胞介素-18(interleukin-18) 22IL1A白细胞介素-1α(interleukin-1alpha) 23IL1B白细胞介素-1β(interleukin-1beta) 24IRF1干扰素调节因子1(interferon regulatory factor 1) 25IRF2干扰素调节因子2(interferon regulatory factor 2) 26TP53细胞肿瘤抗原p53(cellular tumor antigen p53) 27TP63肿瘤蛋白63(tumor protein 63) 28AIM2干扰素诱导蛋白AIM2(interferon-inducible protein AIM2) 29CASP6半胱氨酸天冬氨酸酶-6(Caspase-6) 30CASP8半胱氨酸天冬氨酸酶-8(Caspase-8) 31CASP9半胱氨酸天冬氨酸酶-9(Caspase-9) 32GPX4磷脂过氧化氢谷胱甘肽过氧化物酶(phospholipid hydroperoxide glutathione peroxidase) 33GSDMA焦孔素A(gasdermin A) 34GSDMB焦孔素B(gasdermin B) 35GSDMC焦孔素C(gasdermin C) 36IL6白细胞介素6(interleukin-6) 37NLRC4含NLR家族CARD域蛋白4(NLR family CARD domain-containing protein 4) 38NLRP1核苷酸结合寡聚化结构域样受体蛋白1(NACHT, LRR and PYD domains-containing protein 1) 39NLRP2核苷酸结合寡聚化结构域样受体蛋白2(NACHT, LRR and PYD domains-containing protein 2) 40NLRP3核苷酸结合寡聚化结构域样受体蛋白3(NACHT, LRR and PYD domains-containing protein 3) 41NLRP6核苷酸结合寡聚化结构域样受体蛋白6(NACHT, LRR and PYD domains-containing protein 6) 42NLRP7核苷酸结合寡聚化结构域样受体蛋白7(NACHT, LRR and PYD domains-containing protein 7) 43NOD1核苷酸结合寡聚化结构域蛋白1(nucleotide-binding oligomerization domain-containing protein 1) 44NOD2核苷酸结合寡聚化结构域蛋白2(nucleotide-binding oligomerization domain-containing protein 2) 45PJVKpejvakin 46PLCG11-磷脂酰肌醇 4,5-二磷酸磷酸二酯酶γ-1(1-phosphatidylinositol 4,5-bisphosphate phosphodiesterase gamma-1) 47PRKACAcAMP依赖性蛋白激酶催化亚基α(cAMP-dependent protein kinase catalytic subunit alpha) 48PYCARD含有 CARD 的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD) 49SCAF11富含丝氨酸/精氨酸的剪接因子2相互作用蛋白11(serine/arginine-rich splicing factor 2-interacting protein 11) 50TIRAP受体结构域的衔接蛋白(Toll/interleukin-1 receptor domain-containing adapter protein Toll/interleukin-1) 51TNF肿瘤坏死因子(tumor necrosis factor) 52GZMA颗粒酶A(granzyme A)

a-细胞焦亡基因突变频率瀑布图(图中A为腺嘌呤,T为胸腺嘧啶,C为胞嘧啶,G为鸟嘌呤) b-拷贝数变异频率统计图 c-细胞焦亡基因拷贝数圈图 d-细胞焦亡基因差异分析箱线图 *P<0.05 **P<0.01 ***P<0.001,下同
2.5 乳腺癌细胞焦亡分型预后相关差异基因再分型及其生存分析与表达分析结果
通过对1223个细胞焦亡分型预后显著差异基因进行再分型,可得到3组分型基因,分别为I、II、III,如图5-A所示;对这3组分型基因进行生存分析,3组分型差异存在显著性差异(<0.05),且其中I组预后最好,II组预后最差(图5-B);对3组分型基因进行表达分析,可见I组主要表现为高表达,II组主要呈现低表达(图5-C),结合生存分析及基因表达分析可知,相关基因呈现高表达则预后较好,反之则预后较差,与预期一致;接下来对3组细胞焦亡基因分型进行差异分析,可知3组之间超过80%细胞焦亡基因存在显著性差异,其中超过60%细胞焦亡基因为I组高表达,超过70%细胞焦亡基因为II组低表达(图5-D)。
2.6 预后模型构建、预后分析及其可视化结果
2.6.1 预后模型Lasso回归结果及交叉验证 结果如图6-A、B所示,COX回归模型得出2组及总体的风险值;预后模型构建过程如图6-C所示,即首先根据细胞焦亡相关基因的表达量将样品分为2个亚型(A、B亚型),然后通过差异分析找出该2亚型中存在的差异基因,通过分析差异基因的表达量对基因进行分型(分型I、分型II和分型III);对差异基因进行生存分析以找出预后相关的差异基因并构建预后相关模型;再根据预后模型将患者分为高、低风险组,最终根据预后模型预测患者的生存期。
表2 细胞焦亡基因生存分析
Table 2 Survival analysis of pyroptosis genes
基因HRP值基因HRP值 BAK11.086 233 4160.087 484 657AIM20.931 151 0620.066 065 479 BAX0.970 691 3540.105 234 434CASP60.910 201 2930.084 018 105 CASP10.896 254 8790.010 444 668CASP80.818 232 0470.005 053 259 CASP31.067 483 8400.158 124 658CASP90.697 598 3540.002 007 942 CASP40.826 676 9950.014 357 829GPX40.852 816 8900.020 811 101 CASP50.928 306 5720.109 390 972GSDMB0.967 202 3440.064 985 900 CHMP2A0.848 139 8750.018 369 884GSDMC1.113 768 9640.004 412 956 CHMP2B1.345 011 5030.001 323 049IL61.004 507 1980.280 644 973 CHMP4B0.874 446 5480.046 762 979NLRC41.172 839 9550.030 111 467 CHMP4C1.190 235 2730.008 719 777NLRP10.942 709 2080.032 939 873 CHMP60.813 665 0390.005 475 246NLRP20.956 027 0220.068 839 075 CHMP70.943 839 4580.010 553 598NLRP30.944 446 0080.042 430 619 CYCS1.262 775 2940.005 881 638NLRP60.893 862 7040.022 686 052 ELANE0.877 124 5100.084 815 313NLRP70.928 231 6950.012 910 692 GSDMD0.917 067 5750.001 474 721NOD11.013 837 2360.087 182 922 GZMB0.880 111 2550.001 741 422NOD20.986 949 2810.054 333 534 HMGB11.001 715 0220.244 834 971PLCG11.035 148 3180.109 209 786 IL180.802 492 4070.000 842 706PRKACA1.082 406 9900.115 309 162 IL1A0.943 171 5880.008 360 707PYCARD0.872 856 3540.000 215 098 IL1B0.976 908 5220.050 530 822SCAF111.111 688 2610.036 312 269 IRF10.813 292 0160.001 267 743TIRAP1.223 149 4130.016 585 961 IRF20.636 756 1190.002 620 915TNF0.972 806 3410.129 396 207 TP531.125 176 5660.012 799 973GZMA0.867 120 1070.000 788 690 TP630.863 959 6550.000 120 009
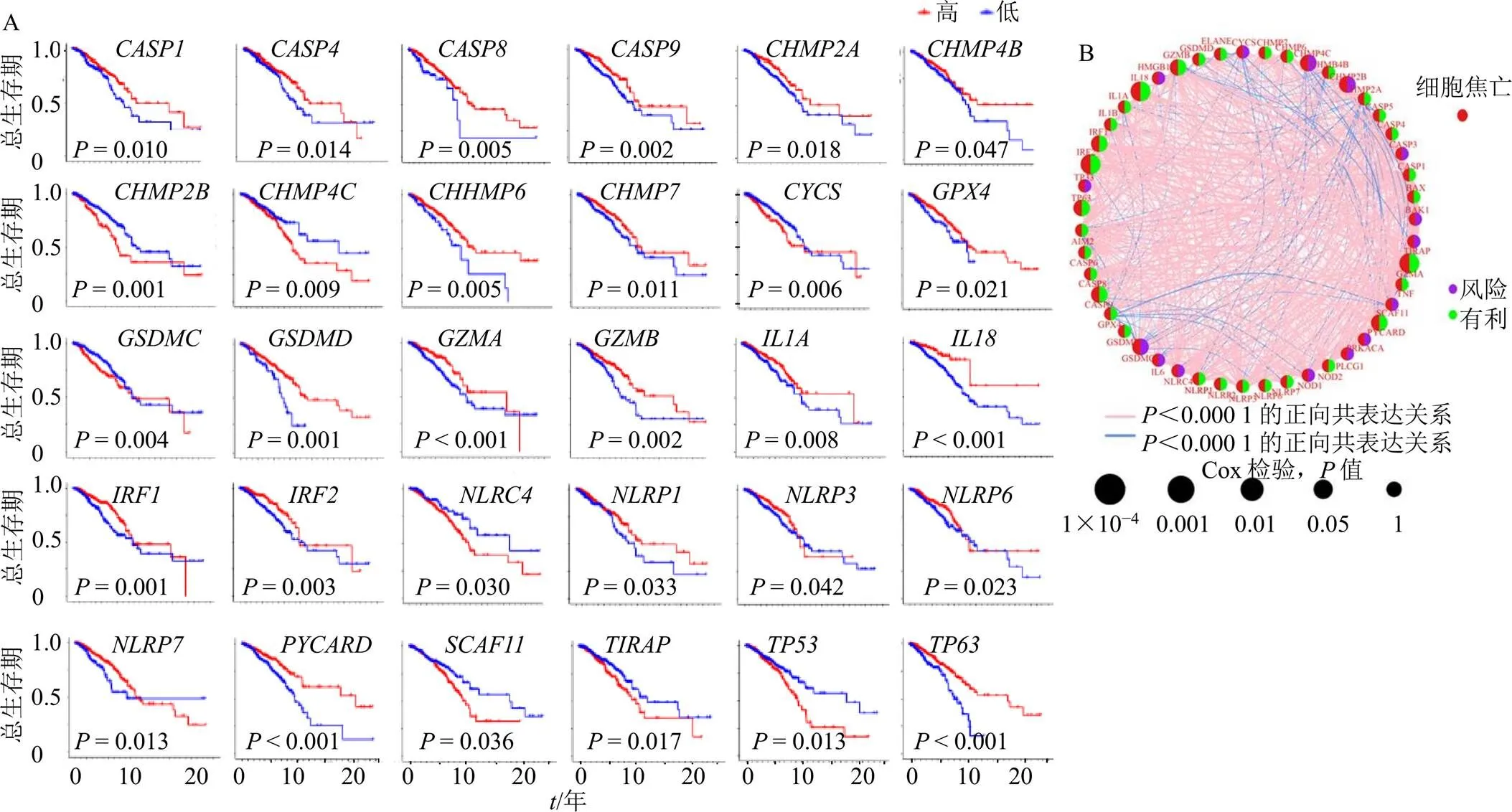
A-预后存在统计学差异的细胞焦亡基因生存曲线 B-细胞焦亡基因预后网络
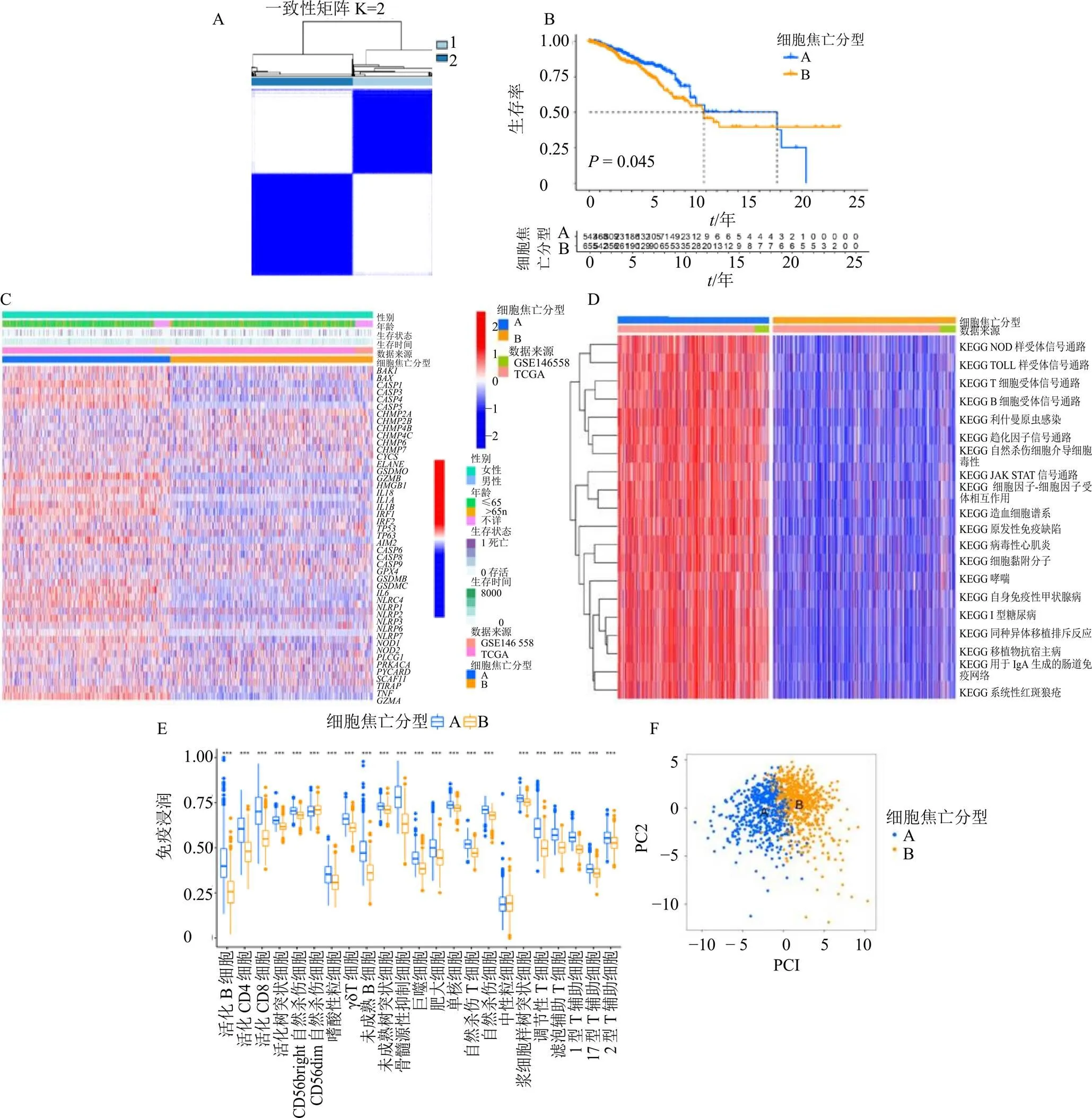
A-BRCA细胞焦亡聚类分型结果(1-聚类1,2-聚类2) B-细胞焦亡分型生存曲线 C-细胞焦亡分型热图 D-细胞焦亡分型GSVA分析热图 E-细胞焦亡分型免疫细胞差异分析箱线图 F-细胞焦亡分型PCA散点图
2.6.2 细胞焦亡分型风险得分的差异分析 结果表明A、B两亚型间差异有统计学意义,其中分型B的风险评分更高,如图6-D所示;基因分型风险得分的差异分析结果表明分型I、II及分型II、III之间差异有统计学意义,分型I、III之间则无统计学意义,同时可以看出分型II的风险评分最高,如图6-E所示。
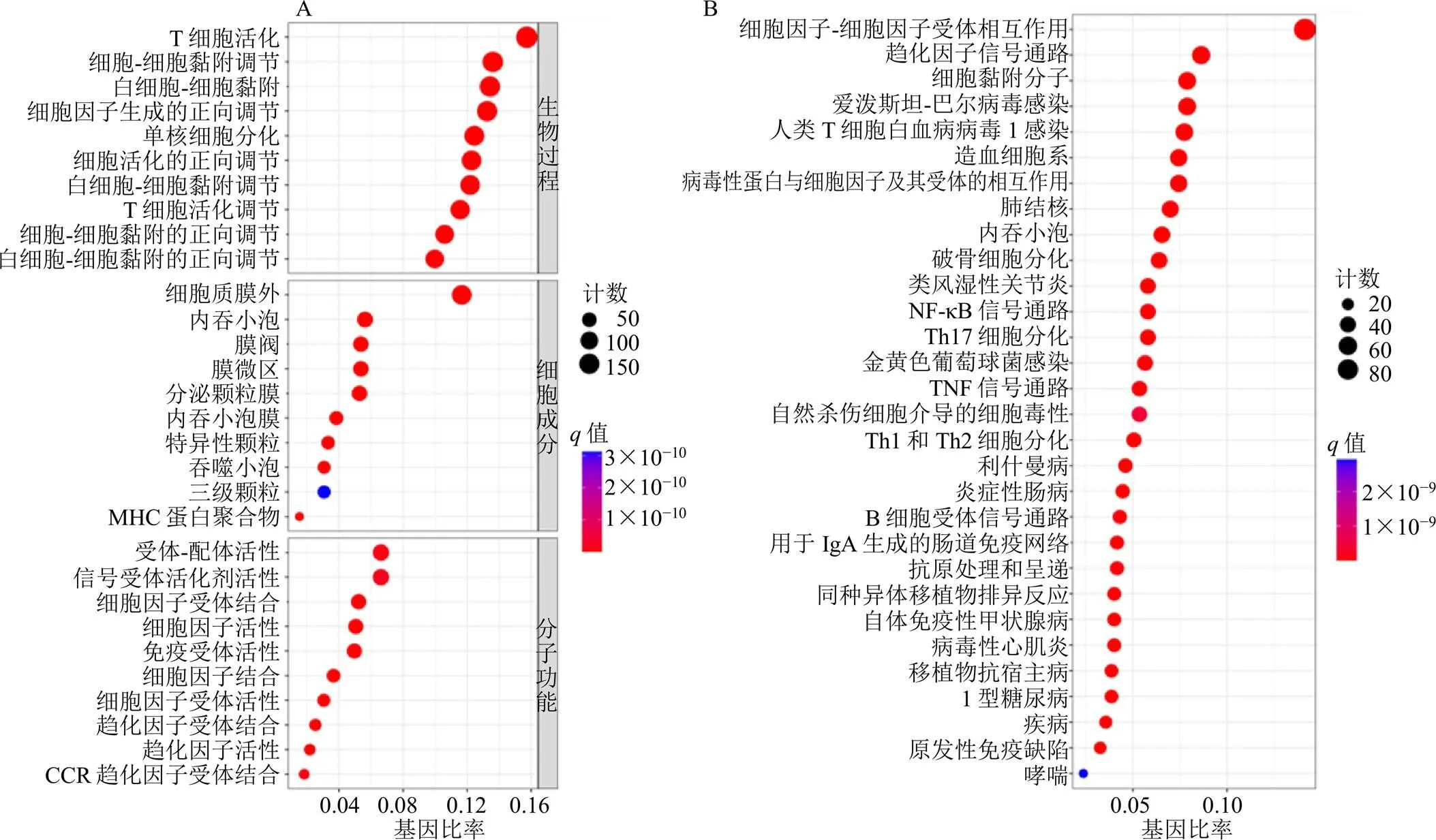
图4 细胞焦亡分型差异基因GO及KEGG富集分析气泡图
2.6.3 高、低风险组细胞焦亡基因表达量的差异分析 结果如图6-F所示,高、低风险组中细胞焦亡基因绝大多数(41/52)存在显著差异,且这些基因中除、、3个基因在高风险组为高表达外,其余均表现为低表达;此外由生存曲线(图6-G)可知,不论训练组、验证组还是总体组(训练组及验证组的总和)其高、低风险组的生存时间都存在显著差异,说明构建的预后模型可区分高、低风险组的患者;由ROC曲线(图6-H)可知,训练组线下面积最大而验证组线下面积最小,因此通过预后模型预测生存期训练组准确性最大而验证组最小,而不论训练组、验证组还是总体组线下面积都大于0.65,因此预后模型预测生存期准确性均较高;列线图可提供预后模型对患者不同临床特征生存期的预测,由图6-I可知女性、年龄62岁、高风险评分的患者预后差,其1年、3年、5年生存率分别为96.7%、83.4%、70.9%,图6-J则显示了列线图生存率预测的准确性;最后根据患者高、低风险排序绘制风险曲线(图6-K),不论训练组、验证组还是总体组3者都是随风险值增高而死亡人数增多,与预测相符,而风险热图则提示所列基因皆为低风险基因。
2.7 免疫细胞浸润与免疫细胞含量分析结果
通过CIBERSORT计算求得每种免疫细胞在每个样品中的相对含量作为免疫细胞浸润结果;利用该结果进一步得出风险得分与免疫细胞相关性,其中存在显著负相关性的有幼稚B细胞、静息树突状细胞、巨噬细胞M1、单核细胞、γδT细胞、CD8 T细胞、静息肥大细胞、静息CD4记忆T细胞、浆细胞;存在显著正相关性的有活化树突状细胞、M0巨噬细胞、M2巨噬细胞、活化肥大细胞、静息自然杀伤细胞,见图7-A。参与模型构建的基因与免疫细胞相关性如图7-B所示,其中大部分基因与免疫细胞存在相关性,且呈负相关性较正相关性者多。
2.8 肿瘤微环境分析、肿瘤突变负荷分析及干细胞分析结果
2.8.1 肿瘤微环境分析 首先获得肿瘤微环境TCGA、GEO两数据库临床样品的评分结果,包含基质细胞评分、免疫细胞评分、总评分以及肿瘤纯度4个方面;然后将肿瘤微环境评分结果按照高、低风险分组进行差异分析,由图8-A可知基质细胞评分、免疫细胞评分及总评分在高、低风险组间均具有统计学差异,且肿瘤微环境评分均为高风险组更低;使用瀑布图展示高、低风险组的突变数据,如图8-B、C所示,2组的突变率较接近(84.12%、85.89%),而高风险组突变率略高于低风险组。
2.8.2 肿瘤突变负荷相关性分析 结果显示高、低风险组间肿瘤突变负荷存在统计学差异,其中高风险组患者的肿瘤突变负荷较高(图8-D);对3组基因分型样品的风险评分及肿瘤突变负荷进行相关性分析,由图8-E可知二者相关性有统计学意义,且呈正相关。
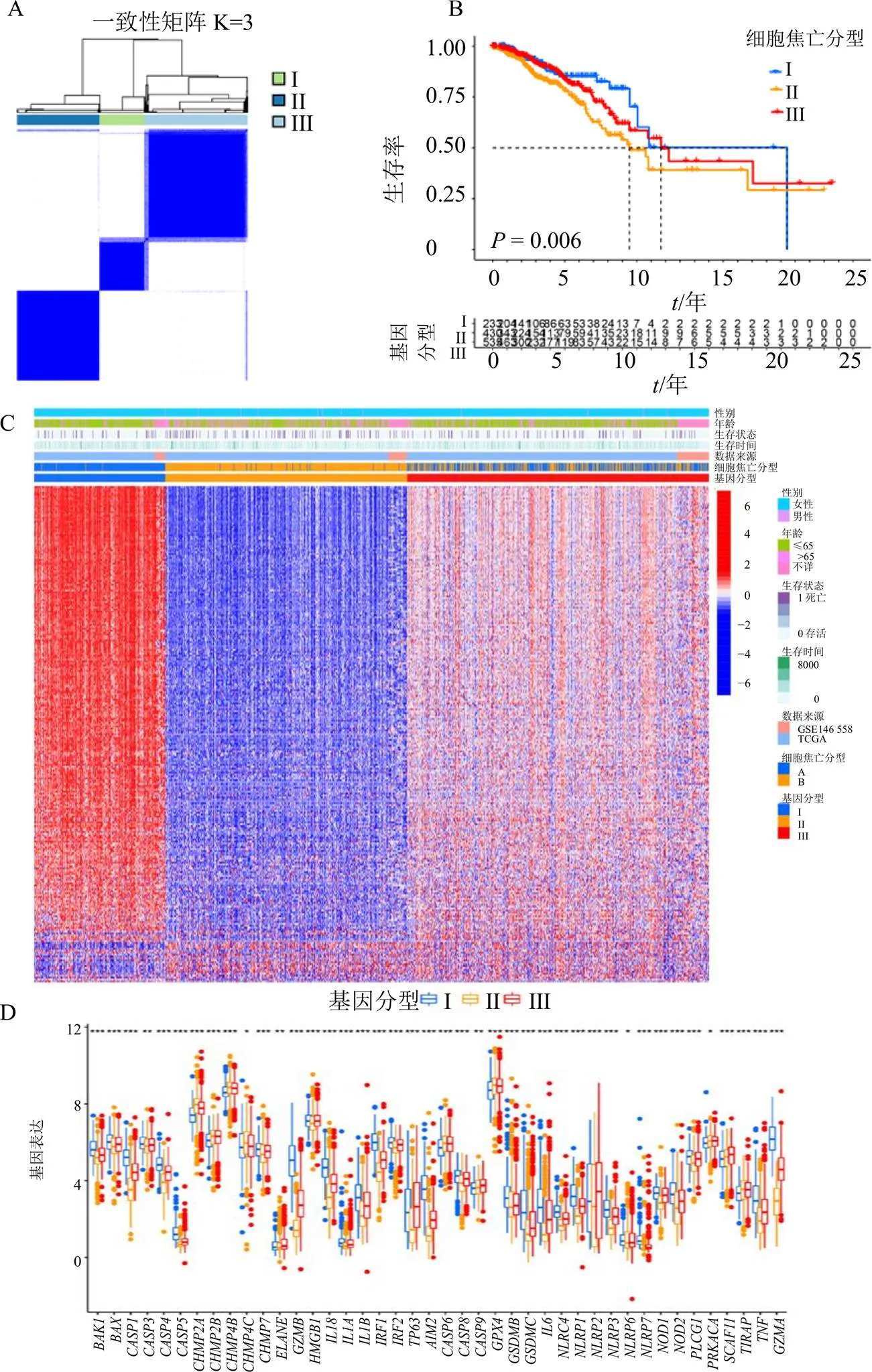
A-细胞焦亡分型预后差异基因再聚类分型结果 B-预后差异基因分型生存曲线 C-预后差异基因分型热图 D-预后差异基因分型的细胞焦亡基因差异分析箱线图
2.8.3 干细胞相关性分析 结果(图8-F)显示干细胞指数与风险评分之间存在相关性(<0.05),且二者呈正相关。
2.9 “细胞焦亡靶点-成分-中药”网络构建与中药筛选结果
通过检索TCMSP数据库,找到18个细胞焦亡靶点数据,将与该18个细胞焦亡靶点相关联的34种有效成分(表3)及380味中药进行网络构建(图9-A)并进行分析,分别通过节点度(degree)值筛选核心成分和核心中药,核心成分(度值>2.5倍中位数)主要包括槲皮素(quercetin)、β-谷甾醇(β-sitosterol)、木犀草素(luteolin)、山柰酚(kaempferol)、β-胡萝卜素(β-carotene)、金合欢素(acacetin)、黄芩素(baicalein)、汉黄芩素(wogonin)、芦荟大黄素(aloe-emodin)、表没食子儿茶精没食子酸酯 [(−)-epigallocatechin-3-gallate]、川陈皮素(nobiletin)、人参皂苷Rh2(ginsenoside Rh2)、柚皮素(naringenin);核心中药(度值>2.5倍中位数)主要包括木蝴蝶、红花、余甘子、白果、半枝莲、牛膝、菊花、香薷、马齿苋、连翘、连钱草、败酱草、枇杷叶、关黄柏、皂角刺、马鞭草、金银花17味。对380味中药进行性味归经统计分析,其中四气以温、寒、微寒、平为主;五味以苦、辛、甘为主;归经主要归肝、肺经,见图9-B、C、D。
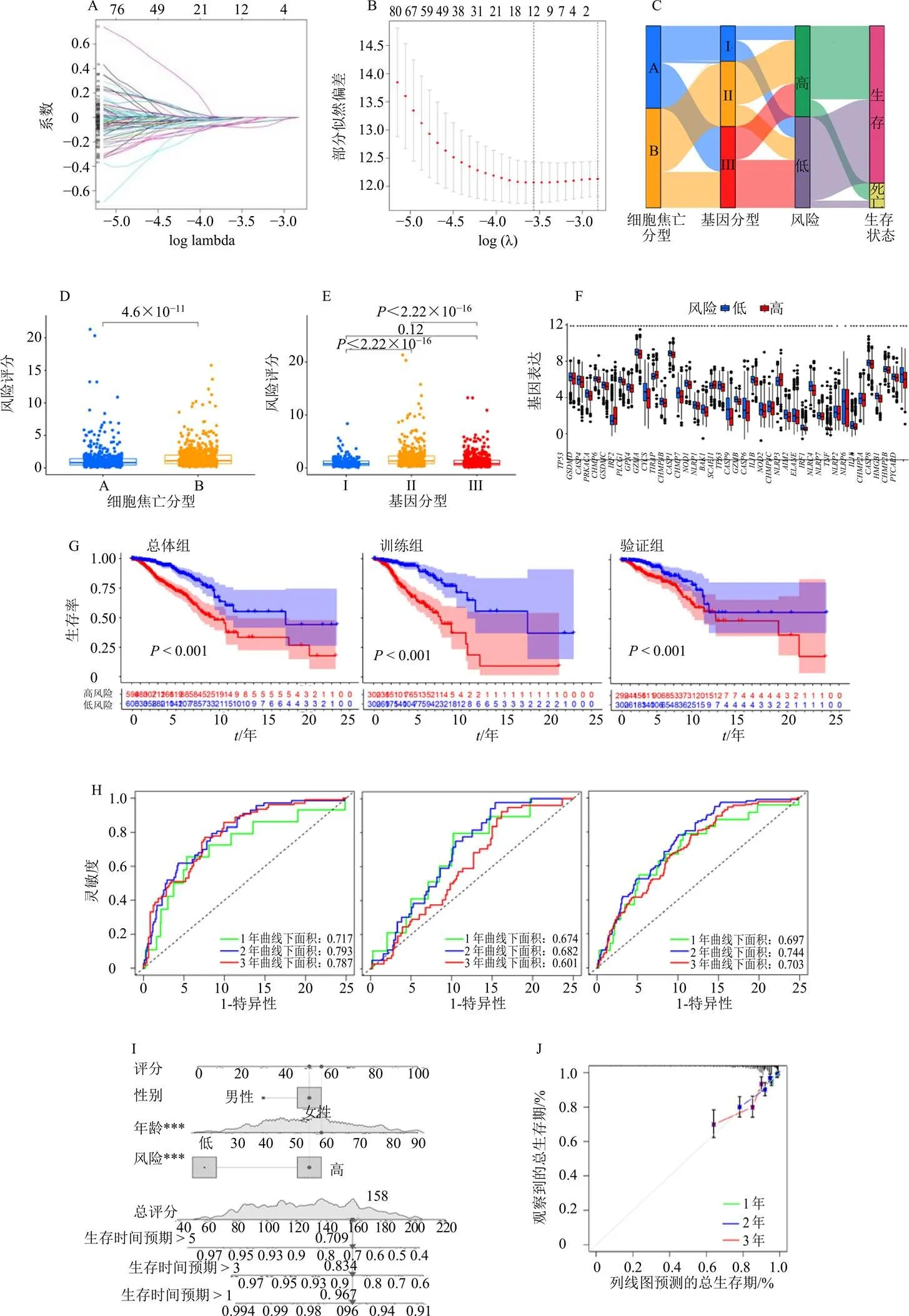
A-Lasso回归模型图 B-交叉验证图 C-预后模型构建过程桑基图 D-细胞焦亡分型风险得分差异分析图 E-预后差异基因分型风险得分差异分析图 F-高、低风险组细胞焦亡基因表达差异分析箱线图 G-训练组、验证组、总体组的高低风险生存分析曲线 H-训练组、验证组、总体组ROC曲线 I-生存期预测列线图 J-列线图校准曲线 K-训练组、验证组、总体组风险曲线
A-diagram of model of lasso regression B-cross-validation results C-alluvial diagram of prognostic model construction process D-diagram of differential analysis of risk score in different clusters of pyroptosis genes E-diagram of differential analysis of risk score in different clusters of prognostic differential genes F-box plot of differential analysis of pyroptosis genes’ expression in group of high or low risk G-survival curves of high or low risk in train, test and total groups H-ROC curves in train, test and total groups I-nomogram of life time prediction J-nomogram calibration curve K-risk curves of train, test and total groups
图6 预后模型构建、预后分析及其可视化结果
Fig. 6 Results of construction of prognostic model, prognostic analysis and their visualization
3 讨论
细胞焦亡作为一种受调节的促炎形式的细胞死亡,其在形态学、机制学和病理生理学上不同于包括细胞凋亡和坏死在内的其他形式的细胞死亡,其特点是质膜快速破裂,随后释放细胞内容物和促炎介质,包括IL-1β、IL-18和警报素高迁移率族蛋白1(high mobility group protein B1,HMGB-1)等[17]。细胞焦亡已被确认与心血管疾病、传染病、卵巢癌、肺癌等疾病有关,但是其与乳腺癌的关系却仍缺少相关研究证实[18-20],且相关的生物信息学研究也缺乏涉及中药方面的分析,因此本研究对3者的关系进行了一定程度探究。
本研究首先根据乳腺癌细胞焦亡基因突变分析可知突变频率远高于其他基因,而研究证实的突变可能是除乳腺癌1型易感蛋白(breast cancer type 1 susceptibility protein,)、乳腺癌2型易感蛋白(Breast cancer type 2 susceptibility protein,)外的另一个导致乳腺癌的关键因素,其与三阴性乳腺癌有关[21];肿瘤组和正常组的对比则可发现细胞焦亡相关基因的表达大多数在二者中存在显著差异,而肿瘤组表达上调者略多于表达下调者,研究认为[4]细胞焦亡与癌症的关系复杂,不同组织和遗传背景的细胞焦亡对癌症的影响不同而呈现促癌和抑癌2种作用。乳腺癌细胞焦亡基因生存分析显示,生存曲线差异显著且高风险的基因中高表达与乳腺癌患者较差的存活率相关[22],并可介导癌细胞中的非典型细胞焦亡途径,导致肿瘤坏死;在肿瘤组中低表达,有动物实验证明其表达上调可促进乳腺癌细胞凋亡[23];作为磷脂酶C的主要亚型,是细胞信号传导的重要介质,其在各种癌症中经常富集和突变,并参与肿瘤发生的过程,包括增殖、迁移和侵袭[24];有文献报道称其可作为乳腺癌细胞凋亡的生物标志物在化疗后表达增加[25];分析研究认为与乳腺癌的骨转移有关[26];所参与的通路则有促成雌激素诱导的乳腺癌细胞增殖和内分泌抵抗的作用[27];在包括乳腺癌在内的多种肿瘤组织中过度表达,且在乳腺癌生长、转移及治疗抵抗方面起作用[28]。总体来说细胞焦亡基因在乳腺癌中突变频率不高,但其突变大部分与预后相关。
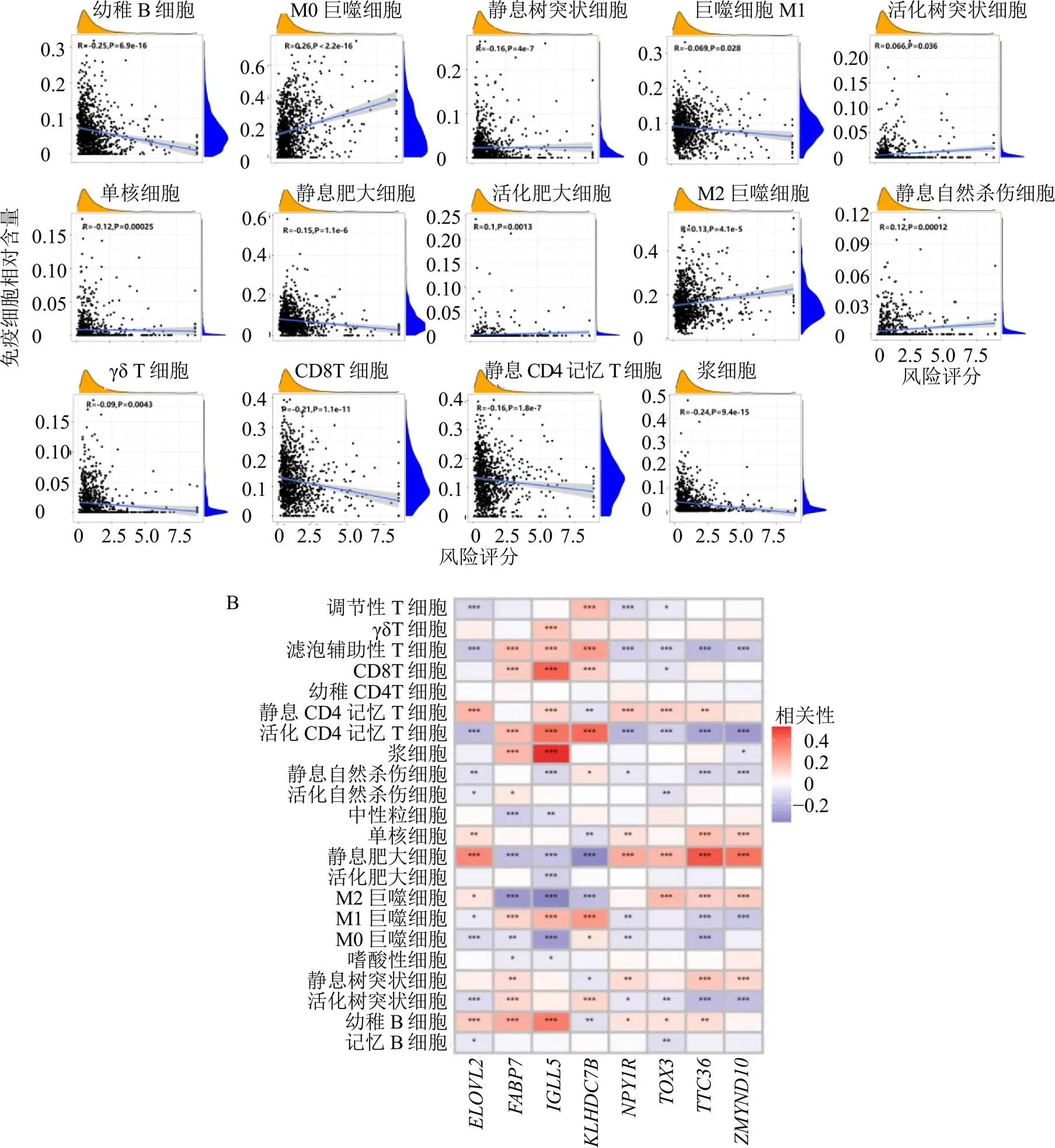
A-风险得分与免疫细胞相关性图 B-模型构建基因与免疫细胞相关性热图
通过将乳腺癌细胞焦亡基因进行聚类及分型,发现A亚型患者生存结局优于B亚型,且A亚型中细胞焦亡基因多数呈现高表达;GSVA、ssGSEA分析显示,炎症相关通路、免疫细胞均在A亚型中富集,A亚型特征为细胞焦亡基因高表达、免疫激活和免疫细胞浸润、有生存优势,B亚型与之相反。对细胞焦亡基因分型进行预后差异分析,得出差异基因1223个,并将之再次聚类获得3组基因分型,同样得到I组细胞焦亡基因表达最高、生存预期最好,II组细胞焦亡基因表达最低、生存预期最差,2次分型结果一致。通过构建预后模型并进行风险评分,得出高风险组预后差,低风险组细胞焦亡基因高表达,且有较高的准确性。不论免疫浸润还是肿瘤微环境分析都得出同一个结论,即高风险组预后较差、细胞焦亡基因低表达、生存期较短、免疫细胞浸润少;低风险组则与之相反,这也反映了细胞焦亡与乳腺癌及其肿瘤微环境、免疫反应之间的关系。研究认为,肿瘤微环境与乳腺癌的产生与进展密切相关[29-30],而其则表现为大量炎性细胞浸润,如B细胞浸润与晚期乳腺癌相关、CD4+、CD8+T细胞的浸润与乳腺癌预后相关[30-31]。
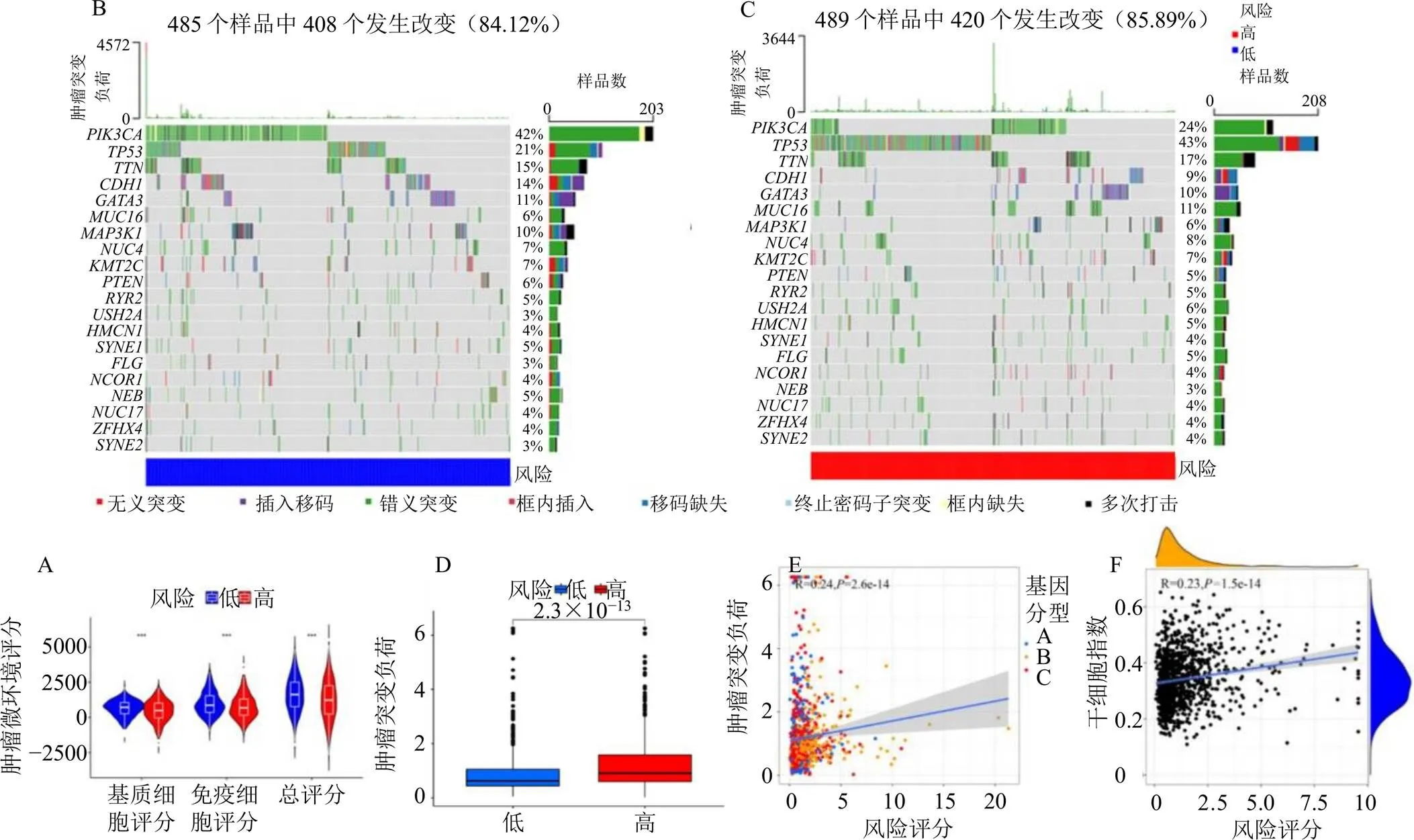
A-高、低风险组肿瘤微环境差异分析小提琴图 B-低风险组基因突变频率瀑布图 C-高风险组基因突变频率瀑布图 D-高、低风险组肿瘤突变负荷差异分析箱线图 E-风险评分与肿瘤突变负荷相关性散点图 F-风险评分与干细胞相关性分析散点图
表3 18个细胞焦亡靶点相关成分
Table 3 Related ingredients of 18 pyroptosis genes
MOLID化学成分OB/%DLMOLID化学成分OB/%DL MOL006821(−)-epigallocatechin-3-gallate55.090.77MOL003187triptolide51.290.68 MOL009135ellipticine30.820.28MOL005944matrine63.770.25 MOL000422kaempferol41.880.24MOL007154tanshinone iia49.890.40 MOL010616eckol87.060.63MOL002773β-carotene37.180.58 MOL000358β-sitosterol36.910.75MOL002928oroxylin A41.370.23 MOL005828nobiletin61.670.52MOL001592piperine42.520.23 MOL013179fisetin52.600.24MOL001714podophyllotoxin59.940.86 MOL000471aloe-emodin83.380.24MOL005916irisolidone37.780.30 MOL001689acacetin34.970.24MOL000546diosgenin80.880.81 MOL002714baicalein33.520.21MOL012920sinomenine30.980.46 MOL009593verticinone60.070.67MOL001924paeoniflorin53.870.79 MOL000173wogonin30.680.23MOL003627sophocarpine64.260.25 MOL005344ginsenoside Rh236.320.56MOL003680sophoridine60.070.25 MOL000098quercetin46.430.28MOL013079dl-praeruptorin A46.460.53 MOL004328naringenin59.290.21MOL004575astilbin36.460.74 MOL000006luteolin36.160.25MOL002662rutaecarpine40.300.60 MOL001439arachidonic acid45.570.20MOL002322isovitexin31.290.72
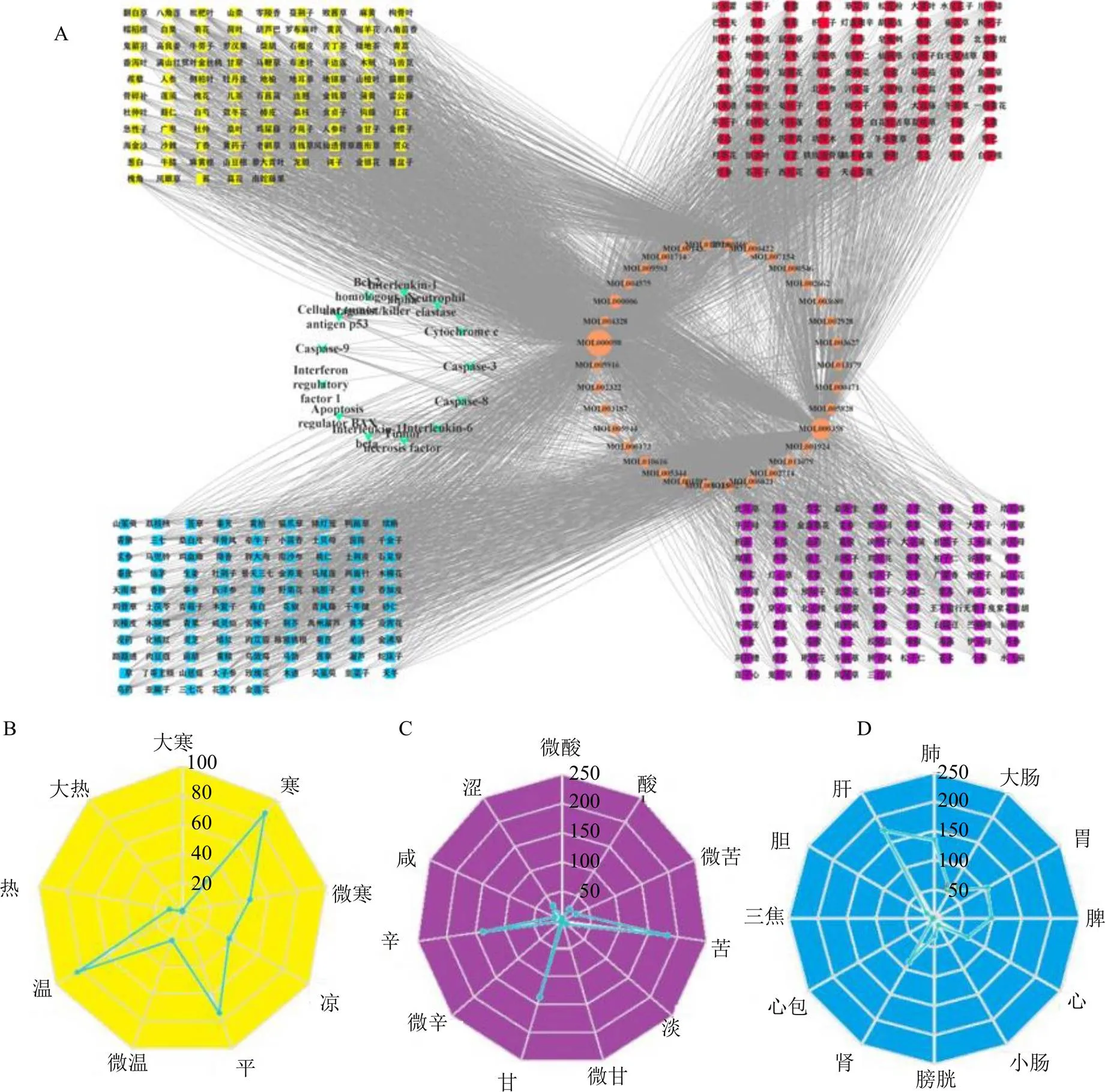
A-“细胞焦亡靶点-成分-中药”网络图 B-细胞焦亡相关中药四气分布 C-细胞焦亡相关中药五味分布 D-细胞焦亡相关中药归经分布
从上述分析可知,细胞焦亡与乳腺癌有显著的相关性,因此挖掘可调控细胞焦亡靶基因的中药则可为乳腺癌治疗药物的研发提供参考。乳腺癌属中医“乳岩”范畴,其发病主要为情志失调、脾胃损伤、冲任失调,痰浊、瘀血乘结乳房而生[32]。从数据挖掘结果来看,所得核心中药木蝴蝶、红花、余甘子、白果、半枝莲、牛膝、菊花、香薷、马齿苋、连翘、连钱草、败酱草、枇杷叶、关黄柏、皂角刺、马鞭草、金银花[33-49]等均具有抗肿瘤、调节免疫及抗炎作用,其所含成分中山柰酚可通过抑制Caspase-1的表达和活性、增加Toll样受体4和NLRP3的蛋白表达以及抑制GSDMD的分解来减少细胞焦亡[50];动物实验证明槲皮素可阻断氧化应激诱导的软骨细胞焦亡来抑制骨关节炎[51];木犀草素则被报道有助于减轻脓毒症诱导的肺损伤小鼠模型肺组织中Caspase-11依赖的细胞焦亡[52];黄芩素可上调微小RNA-192-5p(miR-192-5p)/硫氧还蛋白互作蛋白(thioredoxin-interacting protein,TXNIP)轴而抑制NLRP3/Caspase-1通路,从而调控细胞焦亡和炎症[53];汉黄芩素可通过抑制GSDMD介导的细胞焦亡,减轻顺铂诱导的小鼠心脏毒性[54];表没食子儿茶精没食子酸酯可抑制Caspase-1激活和IL-1β分泌[55];柚皮素可通过调节微小RNA-200b(miR-200b)/锌指蛋白802(zinc finger protein 802,JAZF1)轴抑制乳腺癌的发生[56]。根据生物信息学分析表明,乳腺癌中细胞焦亡过程涉及免疫浸润与炎性因子聚集,而炎性因子聚集多造成局部炎症发热,该过程与中医的“火毒”存在一定的相似性[57],因此其治疗用药以苦、寒为主;而内火多因“郁”而成,毒则为“聚而不散”所致,故用药应当辛散温通;中医历来强调顾护正气,正气存内,邪不可干,故甘平补益之品当为辅。从归经来看细胞焦亡相关药物主要归肝、肺、脾、胃经,因龙虎回环、脾升胃降皆为周身气机之枢,故细胞焦亡、乳腺癌此类“郁”所致的病理过程或疾患应以此为归经。
4 结论
本研究采用生物信息学方法对TCGA、GEO数据库的乳腺癌数据进行细胞焦亡相关多组学分析,从而得出细胞焦亡与乳腺癌有显著的相关性,其涉及肿瘤微环境免疫细胞浸润相关机制。而对细胞焦亡起调控作用的中药主要为木蝴蝶、红花、余甘子、白果、半枝莲、牛膝、菊花、香薷、马齿苋、连翘、连钱草、败酱草、枇杷叶、关黄柏、皂角刺、马鞭草、金银花,其主要为苦寒,次为辛温,辅以甘平之品,而主要调节肝、肺、脾、胃等脏腑,发挥清热解毒、调和肝脾之功。本研究结果可为中药的临床应用与进一步研究提供指导与参考。
利益冲突 所有作者均声明不存在利益冲突
[1] Shi J J, Gao W Q, Shao F. Pyroptosis: gasdermin-mediated programmed necrotic cell death [J]., 2017, 42(4): 245-254.
[2] Kovacs S B, Miao E A. Gasdermins: Effectors of pyroptosis [J]., 2017, 27(9): 673-684.
[3] Fang Y, Tian S W, Pan Y T,. Pyroptosis: A new frontier in cancer [J]., 2020, 121: 109595.
[4] Xia X J, Wang X, Cheng Z,. The role of pyroptosis in cancer: Pro-cancer or pro- “host”? [J]., 2019, 10(9): 650.
[5] Nagini S. Breast cancer: Current molecular therapeutic targets and new players [J]., 2017, 17(2): 152-163.
[6] Rojas K, Stuckey A. Breast cancer epidemiology and risk factors [J]., 2016, 59(4): 651-672.
[7] Li T, Mello-Thoms C, Brennan P C. Descriptive epidemiology of breast cancer in China: Incidence, mortality, survival and prevalence [J]., 2016, 159(3): 395-406.
[8] Fan L, Strasser-Weippl K, Li J J,. Breast cancer in China [J]., 2014, 15(7): e279-e289.
[9] Chetlen A, Mack J, Chan T. Breast cancer screening controversies: Who, when, why, and how? [J]., 2016, 40(2): 279-282.
[10] Pan H C, Gray R, Braybrooke J,. 20-year risks of breast-cancer recurrence after stopping endocrine therapy at 5 years [J]., 2017, 377(19): 1836-1846.
[11] Peart O. Metastatic breast cancer [J]., 2017, 88(5): 519M-539M.
[12] McDonald E S, Clark A S, Tchou J,. Clinical diagnosis and management of breast cancer [J]., 2016, 57(Suppl 1): 9S-16S.
[13] Condorelli R, Vaz-Luis I. Managing side effects in adjuvant endocrine therapy for breast cancer [J]., 2018, 18(11): 1101-1112.
[14] Taylor C W, Kirby A M. Cardiac side-effects from breast cancer radiotherapy [J].(), 2015, 27(11): 621-629.
[15] Lacouture M, Sibaud V. Toxic side effects of targeted therapies and immunotherapies affecting the skin, oral mucosa, hair, and nails [J]., 2018, 19(Suppl 1): 31-39.
[16] 李云祥, 梁引库, 高飞雄, 等. 中药治疗乳腺癌疾病研究进展 [J]. 中国实验方剂学杂志, 2019, 25(3): 211-219.
[17] Xu Y J, Zheng L, Hu Y W,. Pyroptosis and its relationship to atherosclerosis [J]., 2018, 476: 28-37.
[18] Zeng Z L, Li G H, Wu S Y,. Role of pyroptosis in cardiovascular disease [J]., 2019, 52(2): e12563.
[19] Man S M, Karki R, Kanneganti T D. Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases [J]., 2017, 277(1): 61-75.
[20] Zheng S S, Xie X Y, Guo X K,. Identification of a pyroptosis-related gene signature for predicting overall survival and response to immunotherapy in hepatocellular carcinoma [J]., 2021, 12: 789296.
[21] Sheikh A, Hussain S A, Ghori Q,. The spectrum of genetic mutations in breast cancer [J]., 2015, 16(6): 2177-2185.
[22] Hou J W, Zhao R C, Xia W Y,. PD-L1-mediated gasdermin C expression switches apoptosis to pyroptosis in cancer cells and facilitates tumour necrosis [J]., 2020, 22(10): 1264-1275.
[23] Ke H L, Wang X P, Zhou Z,. Effect of weimaining on apoptosis and Caspase-3 expression in a breast cancer mouse model [J]., 2021, 264: 113363.
[24] Jang H J, Suh P G, Lee Y J,. PLCγ1: Potential arbitrator of cancer progression [J]., 2018, 67: 179-189.
[25] Kadam C Y, Abhang S A. Apoptosis markers in breast cancer therapy [J]., 2016, 74: 143-193.
[26] Zohny S F, El-Shinawi M. Significance of survivin and Bcl-2 homologous antagonist/killer mRNA in detection of bone metastasis in patients with breast cancer [J]., 2011, 28(Suppl 1): S108-S114.
[27] Yang F, Xie H Y, Yang L F,. Stabilization of MORC2 by estrogen and antiestrogens through GPER1- PRKACA-CMA pathway contributes to estrogen-induced proliferation and endocrine resistance of breast cancer cells [J]., 2020, 16(6): 1061-1076.
[28] Masjedi A, Hashemi V, Hojjat-Farsangi M,. The significant role of interleukin-6 and its signaling pathway in the immunopathogenesis and treatment of breast cancer [J]., 2018, 108: 1415-1424.
[29] Soysal S D, Tzankov A, Muenst S E. Role of the tumor microenvironment in breast cancer [J]., 2015, 82(3/4): 142-152.
[30] Mittal S, Brown N J, Holen I. The breast tumor microenvironment: Role in cancer development, progression and response to therapy [J]., 2018, 18(3): 227-243.
[31] Wu J B, Zhu Y Y, Luo M M,. Comprehensive analysis of pyroptosis-related genes and tumor microenvironment infiltration characterization in breast cancer [J]., 2021, 12: 748221.
[32] Kresovich J K, O'Brien K M, Xu Z L,. Prediagnostic immune cell profiles and breast cancer [J]., 2020, 3(1): e1919536.
[33] 谭新华, 陆德铭. 中医外科学[M]. 北京: 人民卫生出版社, 1999: 396.
[34] Cao Y, Cao W J, Qiu Y M,. Oroxylin A suppresses ACTN1expression to inactivate cancer-associated fibroblasts and restrain breast cancer metastasis [J]., 2020, 159: 104981.
[35] Wu J Y C, Yu Z L, Fong W F,. Chemotherapeutic activities ofand its reversal effect on multidrug resistance in cancer cells [J]., 2013, 10(4): 36-40.
[36] Zhao H J, Liu T, Mao X,. Fructustannin fraction induces apoptosis and inhibits migration and invasion of human lung squamous carcinoma cellsvia MAPK/MMP pathways [J]., 2015, 36(6): 758-768.
[37] 夏梦雨, 张雪, 王云, 等. 白果的炮制方法、化学成分、药理活性及临床应用的研究进展 [J]. 中国药房, 2020, 31(1): 123-128.
[38] Powell C B, Fung P, Jackson J,. Aqueous extract of, a Chinese herb used for ovarian cancer, induces apoptosis of ovarian cancer cell lines [J]., 2003, 91(2): 332-340.
[39] 罗懿钒, 欧阳文, 唐代凤, 等. 牛膝中皂苷和甾酮类物质基础及药理活性研究进展 [J]. 中国现代中药, 2020, 22(12): 2122-2136.
[40] Li X F, Xu L, Jiang H,. Flash extraction of the active constituents and its antitumor activity from,,and[J]., 2021, 34(5): 1777-1782.
[41] 姚奕, 许浚, 黄广欣, 等. 香薷的研究进展及其质量标志物预测分析 [J]. 中草药, 2020, 51(10): 2661-2670.
[42] Zhou Y X, Xin H L, Rahman K,.L.: A review of phytochemistry and pharmacological effects [J]., 2015, 2015: 925631.
[43] Wang Z Y, Xia Q, Liu X,. Phytochemistry, pharmacology, quality control and future research of(Thunb.) Vahl: A review [J]., 2018, 210: 318-339.
[44] 吴西, 周雷罡, 邓维, 等. 连钱草化学成分及药理作用研究进展 [J]. 药品评价, 2021, 18(1): 4-7.
[45] Gong L N, Zou W, Zheng K Y,. The(Caprifoliaceae): A review on traditional uses, phytochemistry, pharmacology and quality control [J]., 2021, 265: 113264.
[46] Zar P P K, Yano S, Sakao K,.anticancer activity of loquat tea by inducing apoptosis in human leukemia cells [J]., 2014, 78(10): 1731-1737.
[47] 李先宽, 冯杉, 郑艳超, 等. 黄柏与关黄柏的化学成分及生物活性研究进展 [J]. 药物评价研究, 2019, 42(5): 1033-1037.
[48] 李文基, 马骏, 赵文秀. 皂角刺抗肿瘤药理作用及化学成分研究进展 [J]. 甘肃中医药大学学报, 2020, 37(6): 85-88.
[49] 刘雅琳, 苗晋鑫, 田硕, 等. 马鞭草化学成分及药理作用研究进展 [J]. 河南中医, 2021, 41(2): 294-299.
[50] He C L, Yang J, Jiang X L,. Kaempferol alleviates LPS-ATP mediated inflammatory injury in splenic lymphocytes via regulation of the pyroptosis pathway in mice [J]., 2019, 41(5): 538-548.
[51] Wang Q, Ying L J, Wei B,. Effects of quercetin on apoptosis and extracellular matrix degradation of chondrocytes induced by oxidative stress-mediated pyroptosis [J]., 2022, 36(2): e22951.
[52] Zhang Z T, Zhang D Y, Xie K,. Luteolin activates Tregs to promote IL-10 expression and alleviating caspase-11-dependent pyroptosis in-induced lung injury [J]., 2021, 99: 107914.
[53] Wang X Y, Cai H, Chen Z Y,. Baicalein alleviates pyroptosis and inflammation in hyperlipidemic pancreatitis by inhibiting NLRP3/Caspase-1 pathway through the miR-192-5p/TXNIP axis [J]., 2021, 101(Pt B): 108315.
[54] Xu J J, Zhang B, Chu Z L,. Wogonin alleviates cisplatin-induced cardiotoxicity in mice via inhibiting gasdermin D-mediated pyroptosis [J]., 2021, 78(4): 597-603.
[55] Zhang C, Li X, Hu X,. Epigallocatechin-3-gallate prevents inflammation and diabetes-Induced glucose tolerance through inhibition of NLRP3 inflammasome activation [J]., 2021, 93: 107412.
[56] Wang J G, Jian W J, Li Y,. Nobiletin promotes the pyroptosis of breast cancer via regulation of miR-200b/JAZF1axis [J]., 2021, 37(7): 572-582.
[57] 梁子成, 陈泓秀, 文璐, 等. 基于网络药理学及数据挖掘探讨中药调节细胞焦亡用药规律 [J]. 中国中医药信息杂志, 2021, 28(11): 27-33.
Multi-omics analysis of pyroptosis-related genes in breast cancer and screening prediction of related traditional Chinese medicines based on bioinformatics
LIU Yi, XIE Yan-ming, LI Yuan-yuan, CUI Xin, XI Jun-yu
Institute of Basic Research in Clinical Medicine, China Academy of Chinese Medical Sciences, Beijing 100700, China
To explore the role and clinical significance of pyroptosis related genes in breast cancer and screen traditional Chinese medicines (TCMs) that can regulate pyroptosis based on bioinformatics.Breast cancer related data sets were obtained from TCGA and GEO databases; The expression and variation of pyroptosis related genes in breast cancer was evaluate by R and Perl language; Pyroptosis genotyping and prognostic differential genotyping were performed on the data sets, and multi-omics analysis was performed for each genotype; The prognostic model were constructed, risk scores were performed, and sub-group multi-omics analysis was carried out according to risk scores to test the predictive power of survival. Finally, the pyroptosis related genes were used as the targets, and the TCMSP database and Cytoscape software were used to construct “target-component-Chinese herbal medicine” network and topological analysis to obtain core TCMs and their related attributes.Most genes related to pyroptosis were abnormally expressed in breast cancer and had copy number variation; Eleven genes such as cellular tumor antigen p53 () had somatic mutations. The A subtype of pyroptosis had good prognosis, high expression of pyroptosis genes and immune-related pathways, and high content of immune cells. Type B was the opposite, and type A and B had obvious differences, the number of differential genes was 1223. The differential genes of pyroptosis were reclustered to generate three genotypes. Among them, group I had the best prognosis, group II had the worst prognosis, and pyroptosis related genes were mainly highly expressed in group I, and lowly expressed in group II. The patients were divided into high and low risk groups according to risk scores of prognostic model. The low risk group showed high expression of pyroptosis gene and good prognosis, while the high risk group showed the opposit. The prognostic evaluation of different clinical characteristics of patients could be carried out through the nomogram; The correlation analysis of immune cells and risk scores showed that most of them were negatively correlated; In the tumor microenvironment, the stromal cell score, immune cell score and total score were lower in all high risk group, and tumor mutation burden was higher in the high risk group. Stem cells were also positively correlated with the risk score. The network of “target of pyroptosis-component-TCMs” obtained 17 TCMs, such as Muhudie () and Honghua (). Their nature and flavor were mainly bitter and cold, followed by pungent and warm, supplemented by sweet and light medicines, which mainly regulate the liver, lungs, spleen and stomach, etc.The pyroptosis genes play an important role in the immunity of breast cancer, and have obvious correlation with the prognosis of breast cancer patients. The main TCMs that regulate pyroptosis include 17 medicines such asand. The conclusion can provide ideas and references for further research.
pyroptosis; bioinformatics; traditional Chinese medicine; breast cancer; multi-omics analysis;;
R285
A
0253 - 2670(2022)18 - 5768 - 18
10.7501/j.issn.0253-2670.2022.18.020
2022-02-20
国家重点研发计划“中医药现代化研究”项目(2018YFC1707400);中国中医科学院科技创新工程中医临床基础学科创新团队项目(CI2021B003);2021年岐黄学者支持项目
刘 毅(1993—),男,山西长治人,博士研究生在读,研究方向为基于中成药真实世界证据与价值评估研究。E-mail: 709473245@qq.com
谢雁鸣(1959—),女,教授,研究员,博士生导师,中国中医科学院首席研究员,研究方向为中药上市后再评价方法学研究、中西医结合临床、老年病学。E-mail: ktzu2018@163.com
黎元元,博士,研究员,研究方向为中药上市后再评价。Tel: (010)64014411-3351 E-mail: chibjyy@163.com
[责任编辑 潘明佳]
