五倍子化学成分和药理作用的研究进展
2022-09-20刘天凤张朝晖
梁 正,徐 强,张 倩,刘天凤,张朝晖, *
五倍子化学成分和药理作用的研究进展
梁 正1,徐 强2,张 倩1,刘天凤1,张朝晖1, 2*
1. 广东药科大学中医药研究院,广东 广州 510006 2. 天津中医药大学第二附属医院,天津 300250
五倍子为一味收涩性的中药材,有敛肺降火、涩肠止泻、敛汗、止血、收湿敛疮的功效。五倍子化学成分多样,至今已被鉴定的化学成分主要包括鞣质、酚酸、氨基酸、脂肪酸、鞣花酸及其他成分等。现代研究表明,五倍子具有抗龋齿、抗菌、止泻、止血、抗炎、促进伤口愈合、抗癌、清除自由基、抗氧化等多种药理作用。对五倍子化学成分和药理作用的研究进展进行综述,以更好地了解五倍子的特征,扩大其应用范围,为其临床应用提供科学依据。
五倍子;鞣质;酚酸;鞣花酸;止泻;抗龋齿;抗菌;止泻
五倍子Mill.又名盐麸叶上球子、文蛤、百虫仓、木附子、漆倍子、旱倍子,主要由五倍子蚜(Bell) Baker寄生在漆树科植物盐肤木Mill.、青麸杨Maxim.或红麸杨Stew. var.(Diels) Rehd. et Wils叶上而形成的虫瘿,虫瘿是植物受到刺激后产生的增生组织,有敛肺降火、涩肠止泻、敛汗、止血和收湿敛疮的作用。五倍子的药用初载于唐朝《本草拾遗》[1],该书首先提出五倍子煎剂在肠道中起收敛剂的作用,从而止腹泻。唐代以后,五倍子逐渐在临床上用于治疗腹泻和慢性疮疡。宋代和晋元时期,五倍子的使用逐渐增多,临床上常与其他治疗疮、疥、痒、出血、遗精的药物配伍。清代创制了五倍子新的外用方,以促进降火的作用[1-2]。《中国药典》2020年版记载[3],该药味酸、涩,性寒,归肺、大肠和肾经,故五倍子临床上通常用于腹泻、出血、咳嗽、呕吐、出汗、痔疮、皮肤溃烂、肛门和子宫脱垂等疾病的治疗。中药通常具有非常复杂的成分,到目前为止,已经分离从五倍子中分离鉴定出了一些化学成分,且研究发现五倍子具有广泛的药理活性。本文主要对五倍子化学成分和药理作用的研究进展进行综述,为其临床用药提供依据,以期扩大五倍子的应用范围。
1 化学成分
迄今为止,五倍子中分离出来的化合物主要为鞣质,除此之外,还含有酚酸、氨基酸、脂肪酸和其他成分,且含有铜、锌、铁和钙等微量元素,其中钙含量最高,其次是铁、磷、锰、锌、铬和其他微量元素。
1.1 鞣质
鞣质是五倍子中主要的生物活性化合物,是广泛存在于天然药物中的多酚化合物,它们与蛋白质或生物碱结合形成沉淀物。鞣质又可分为水解鞣质和缩合鞣质。缩合鞣质是黄烷醇的衍生物,由于结构中不存在糖苷键和酯键,经酸或碱处理可水解。水解鞣质来源于没食子酸与葡萄糖的酯化反应及其氧化反应产物,其中没食子酸是最基本的供体。水解鞣质主要包括葡萄糖没食子苷、没食子鞣质、鞣花鞣质及其衍生物[4]。水解鞣质是许多常用中药如五倍子、大黄和地榆的活性物质,可被酸、碱和酶水解[5]。五倍子中鞣质化合物的具体信息见表1,化学结构见图1。
表1 五倍子中的鞣质
Table 1 Tannins in G. chinensis
编号化合物名称分子式文献 11,2,6-tri-O-galloyl-β-D-glucoseC27H24O18 6 21,2,3,6-tetra-O-galloyl-β-D-glucoseC34H28O22 6 31,2,4,6-tetra-O-galloyl-β-D-glucoseC34H28O22 7 41,2,3,4,6‐penta‐O‐galloyl‐β‐D‐glucoseC41H32O26 6 5石榴皮鞣素C34H22O22 8 61,3-digalloyl-4,6-hhdp-glucoseC34H26O22 8 72-O-digalloyl-1,3,4,6-tetra-O-galloyl-β-D-glucoseC48H36O30 8 8表没食子儿茶素没食子酸酯C22H18O11 9 9表儿茶素没食子酸酯C22H18O109 10benzoic acid-3,4-dihydroxy-5-[(3,4,5-trihydroxybenzoyl)oxy]-5-ethoxycarbonyl-2,3-dihydroxyphenyl esterC23H18O1310 11三没食子酸C41H32O2610

图1 五倍子中鞣质的化学结构
1.2 酚酸
酚酸是自然界中广泛分布的一大类有机化合物,具有广泛的药理活性。酚酸是非类黄酮家族中的简单酚类化合物。它们通过莽草酸途径合成,能够以结合或游离形式存在[11]。五倍子中分离出的酚酸化合物有没食子酸(12)[12]、原儿茶酸(13)[9]、2-羟基-6-十五烷基苯甲酸(14)[13]、4-羟基-3-甲氧基苯甲酸(15)[12],化学结构见图2。

图2 五倍子中酚酸的结构
1.3 氨基酸
五倍子中富含氨基酸,氨基酸是含有碱性氨基和酸性羧基的有机化合物,有较高的营养和药用价值。其中含量最高的是精氨酸,质量分数高于1.0%,胱氨酸和蛋氨酸的质量分数在0.1%左右,其余氨基酸的质量分数基本都在0.2%~0.8%。五倍子中氨基酸化合物的具体信息见表2,化学结构见图3。
1.4 脂肪酸
脂肪酸是由碳、氢和氧组成的一类化合物,是中性脂肪、磷脂和糖脂的主要成分。五倍子中脂肪酸主要有8种,其中月桂酸、肉豆蔻酸、棕桐酸含量较高且无明显差异。五倍子中脂肪酸化合物的化学结构见图4,具体信息见表3。
1.5 其他
从五倍子中分离出的其他成分还有没食子酸甲酯、没食子酸乙酯、鞣花酸、myricetin-3--rhamnoside、表没食子儿茶素、银杏酚、β-谷甾醇、二十五烷、莽草酸等。具体信息见表4,化学结构见图5。
表2 五倍子中的氨基酸
Table 2 Amino acids in G. chinensis
编号化合物名称分子式文献 16天冬氨酸C4H7NO414 17苏氨酸C4H9NO314 18丝氨酸C3H7NO314 19谷氨酸C5H9NO414 20脯氨酸C5H9NO214 21甘氨酸C2H5NO214 22丙氨酸C3H7NO214 23胱氨酸C6H12N2O4S214 24缬氨酸C5H11NO214 25蛋氨酸C5H11NO2S14 26异亮氨酸C6H13NO214 27亮氨酸C6H13NO214 28酪氨酸C9H11NO314 29苯丙氨酸C9H11NO214 30组氨酸C6H9N3O214 31赖氨酸C6H14N2O214 32精氨酸C6H14N2O214
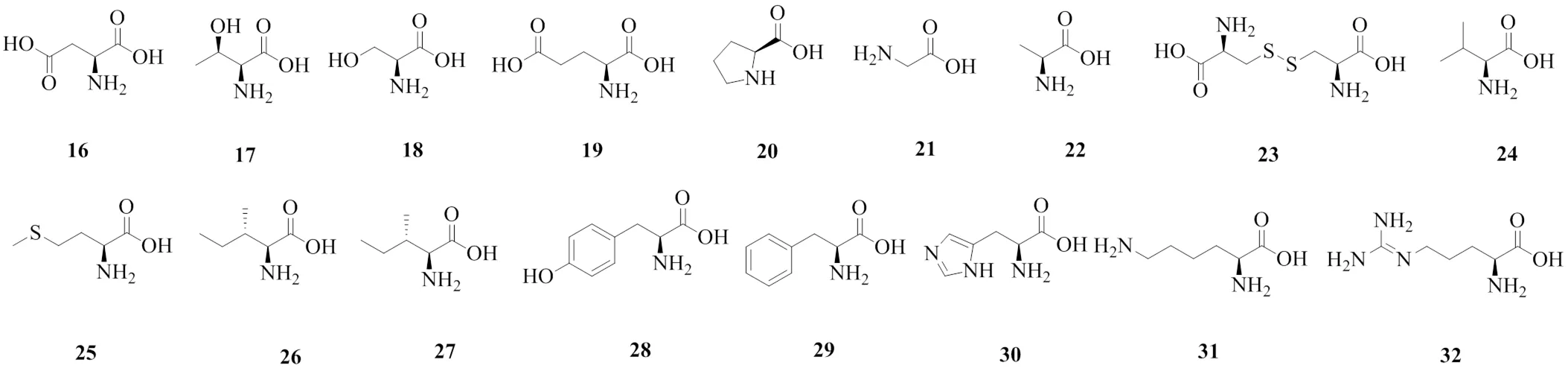
图3 五倍子中氨基酸的化学结构

图4 五倍子中脂肪酸的结构
表3 五倍子中的脂肪酸
Table 3 Fatty acids in G. chinensis
编号化合物名称分子式文献 33油酸C18H34O215 34亚油酸C18H32O215 35亚麻酸C18H30O215 36癸酸C10H20O215 37月桂酸C12H24O215 38肉豆蔻酸C14H28O215 39棕榈酸C16H32O215 40硬脂酸C18H36O215
表4 五倍子中的其他化合物
Table 4 Other compounds in G. chinensis
编号化合物名称分子式文献 41没食子酸甲酯C8H8O516 42没食子酸乙酯C9H10O516 43鞣花酸C14H6O816 44myricetin-3-O-rhamnosideC21H20O12 9 45表没食子儿茶素C15H14O710 46银杏酚C21H34O12 47β-谷甾醇C29H50O12 48二十五烷C25H5212 49莽草酸C7H10O511

图5 五倍子中其他化合物的化学结构
2 药理作用
药理研究发现,五倍子具有广泛的药理活性,其化学成分在体内和体外都产生至关重要的生物活性,如抗龋齿和抗菌、止泻、止血、抗炎、促进伤口愈合、抗癌、抗氧化等作用。
2.1 抗龋齿和抗菌
龋齿是一种在口腔传染病中非常普遍的生物膜依赖性疾病,伴随着膳食碳水化合物细菌发酵产生的酸性副产物对易感牙齿硬组织的局部破坏[17]。龋齿发生的主要病理变化是无机物的脱矿化,有机物的分解和牙齿晶体结构的转变。
研究表明,五倍子通过抑制脱矿化,增强再矿化作用和抑制口腔细菌机制发挥抗龋作用[18-19]。而牙齿硬组织再矿化过程中,Ca2+是其必需元素,通过对五倍子的主要有机成分和无机离子进一步的研究分析发现,Ca2+在五倍子中占无机离子的比例最大[20]。没食子酸是五倍子中负责抑制牙釉质脱矿的主要活性成分,抗脱矿质作用可能归因于其沉淀蛋白质的能力[21],当含有没食子酸的溶液与牙釉质接触时,钙离子与牙釉质形成交联,从而影响各种牙釉质蛋白的沉淀[20]。进而推测没食子酸可以作为Ca2+载体,为龋损的中间层提供钙离子,从而通过提供Ca2+晶体修复来增强再矿化[22-23]。
变形链球菌是一种兼性厌氧革兰阳性菌,是人类龋齿生物膜形成过程中最重要的病原体之一[24],牙齿表面生物膜的形成是由变形链球菌葡糖基转移酶B(glucosyltransferase B,GTFB)、葡糖基转移酶C(glucosyltransferase C,GTFC)和葡糖基转移酶D(glucosyltransferase D,GTFD)的协同作用产生的[25],GTFB结合到牙齿表面和细菌表面,能够催化水不溶性葡聚糖的合成,从而导致牙齿表面的持续定植[26],GTFC、GTFD催化蔗糖合成水不溶性、水溶性和碱溶性葡聚糖(α-1,6-连接),从而维护生物膜形成和结构的稳定[26]。此外,变形链球菌葡聚糖结合蛋白B(glucan binding protein B,GBPB)有助于细菌黏附到葡聚糖上,从而使生物膜成熟[27],随后的碳水化合物(如蔗糖)细菌发酵成有机酸导致牙齿生物膜的酸化[28],变形链球菌生物膜内的产酸性进一步由细菌质子释放出F型ATP酶维持,产生葡萄糖基转移酶[29],该酶催化蔗糖合成胞外聚合物,能够使细菌有效地定植牙齿表面并有助于形成高度致龋的生物膜[30]。变形链球菌还发酵糖以产生在牙齿表面积聚的有机酸,导致局部低pH环境、牙釉质溶解,并最终引发龋齿[31]。
没食子酸和没食子酸乙酯具有抗病毒和抗真菌活性[32]。在ATCC 25175生物膜模型中[32],没食子酸和没食子酸乙酯通过减少活细胞的数量和碱溶性葡聚糖的产生,降低碱溶性葡聚糖的产酸能力和下调、和基因的表达来干扰生物膜的形成。没食子酸和没食子酸乙酯处理的生物膜扫描电子显微镜图像显示,变形链球菌的生物量、胞外多糖和微菌落减少。二者能使活细胞的数量减少,微生物细胞的积累被抑制,使得保护生物膜中细菌的聚合物基质减少[33]。没食子酸和没食子酸乙酯显著降低了变形链球菌生物膜中的产酸量,二者使细胞对酸化敏感,导致pH值显著升高,从而促进细胞膜上质子渗透性的中断,进而减少生物膜中的糖酵解和酸生成[34]。变形链球菌的酸度主要归因于脂肪酸转运蛋白(fatty acid transporter protein,F-ATP)酶的质子泵[35],没食子酸通过抑制GTF,促进15%和20%葡聚糖合成的轻微减少[34]。
除此之外,通过使用定量逆转录聚合酶链反应评估编码、、、和酶的基因表达[36],结果显示没食子酸乙酯显著降低了、和的基因表达,有助于抑制细菌黏附到葡聚糖上,抑制细菌黏附是干扰变形链球菌重要毒力因子的指示[37],同时没食子酸乙酯抑制了变形链球菌的F-ATP酶,使生物膜内的产酸性无法得到维持。
没食子酸辛酯除了能显著减少固体表面上暴露的变形链球菌生物膜的形成,并以剂量相关方式抑制了产酸性,阻止了pH值水平的降低,用没食子酸辛酯处理的产生生物膜的细菌基因(、、)表达显著降低[38]。在体外实验中[38],随着五倍子浓度的增加,变形链球菌、血链球菌和口腔链球菌的生长受到抑制,变形链球菌生物膜的微观结构亦发生改变。研究发现,五倍子纳米银颗粒能够减少葡聚糖介导的黏附到唾液包被的羟基磷灰石,对变形链球菌和嗜酸乳杆菌具有一定的抗菌和抗菌膜活性[39]。这些结果表明,五倍子作为抑制龋齿发展的新型抗真菌和抗菌剂有巨大潜力。
2.2 止泻
腹泻是常见的肠道性疾病,多与病毒及细菌感染有关。研究发现,产肠毒素大肠杆菌(enterotoxigenic,ETEC)被认为是导致腹泻的最常见细菌[40]。ETEC是一组不同的病原体,主要分泌不耐热肠毒素和耐热肠毒素2种主要类型的毒素,它们具有共同定植小肠的能力[41],通过激活囊性纤维化跨膜电导调节,从而导致水从细胞净流入肠腔,导致大量水样腹泻[42]。
五倍子富含鞣质[43],鞣质是抵抗大肠杆菌的活性化合物之一[44],鞣质对肠毒素引起的分泌性腹泻具有抑制作用,可能与囊性纤维化跨膜电导调节通道功能的过度激活有关。鞣质已被证明可抑制人克隆结肠腺癌Caco2细胞、大鼠甲状腺FRT细胞、结肠腺癌肺转移T84细胞和结肠上皮HT29-CL19A细胞中囊性纤维化跨膜电导调节依赖性Cl−的分泌[45],五倍子口服溶液(oral solution,GOS)在蓖麻油诱导的小鼠腹泻模型中显示出显著的止泻活性[46],表明鞣质可以抑制肠毒素的产生和活性[47]。研究发现表明,在小鼠腹泻模型中[48],GOS可以剂量相关性地提高ETEC感染小鼠的存活率。GOS能剂量相关性地降低促炎细胞因子γ干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6和IL-8的表达,并增加抗炎细胞因子IL-4的水平。GOS治疗后,大肠杆菌数量显著降低,同时乳酸杆菌和双歧杆菌等益生菌的数量显著增加。GOS可以减少液体分泌剂量,抑制ETEC引起的诱导过度分泌和肠道蠕动[49],表明GOS可以减少ETEC感染引起的小鼠体液分泌。抗感染的部分原因是由于存在足够水平的血清和分泌性免疫球蛋白,尤其是抗原特异性抗体免疫球蛋白G(immunoglobulin G,IgG)和分泌型抗体IgA(secretory immunoglobulin A,slgA)[50],GOS可提高血清中IgG和回肠末端sIgA的浓度,GOS诱导的IgG和sIgA升高对机体感染具有重要意义。此外,鞣质还具有诱导排泄参数、组织结构和黏蛋白分泌的恢复,以及毒蕈碱乙酰胆碱受体和G蛋白信号的恢复作用[51]。
GOS是一种强效止泻剂,预期可用于治疗ETEC感染引起的急性腹泻。研究表明GOS保护或恢复了肠黏膜和杯状细胞数量,阻止了ETEC O101对结肠黏膜结构的破坏[52],保护了结肠杯状细胞,提供了其抗菌活性的证据。通过改变细胞因子和免疫球蛋白的水平,调节肠道细菌,保护结肠黏膜的结构,对ETEC感染具有治疗和保护作用。
2.3 止血
鞣质能够以非特异性方式浓缩原生质体和微生物中的各种酶,与蛋白质、可沉淀的许多重金属离子、生物碱、苷等反应形成不溶性复合物,在传统医学治疗中还可用作止血喷雾剂和创伤治疗的软膏[53-54]。研究表明,将鞣质涂层纱布与血液孵育后,发现释放的血红蛋白浓度开始下降,表明鞣质涂层纱布上出现了更多的血栓素。在动物伤口模型,鞣质涂层的高效止血性能主要归因于鞣质涂层在与血液接触时吸收了大量的蛋白质,尤其是纤维蛋白原,纤维蛋白原转化为不溶性纤维蛋白凝块[55],进一步诱导凝血酶催化的凝血[56]。
2.4 抗炎
皮肤受伤后会引起炎症反应,表皮屏障被破坏,角质形成细胞释放预存的炎症细胞因子,包括IL-1、IL-6和IL-10[57-58],在伤口大鼠模型中,鞣质能够显著降低血清和组织中促炎细胞因子IL-1和IL-6含量,同时升高碱性成纤维细胞生长因子、细胞外信号调节激酶1/2(extracellular signal-regulated-kinase 1/2,ERK1/2)和p-ERK1/2在ERK1/2通路中的蛋白水平,进而应对损伤,并促进老鼠胚胎细胞的生长。
2.5 促进伤口愈合
鞣质是一种天然植物多酚收敛剂,大量存在于五倍子中,研究表明,鞣质通过ERK1/2介导的信号通路有效促进伤口愈合,组织病理学研究中,鞣质治疗加速了毛囊的再上皮化和生长,减少瘢痕形成,其中含有大量鞣质的五倍子溶液可以以剂量相关的方式改善感染真菌的狗的皮肤损伤和脱发[59]。五倍子能够显著增加细胞数量和迁移,减少细胞死亡和乳酸脱氢酶的释放,以及诱导I型胶原和III型胶原的mRNA过度表达,增加胶原蛋白的总溶解度,并激活潜在的抗氧化特性,从而加速伤口愈合[60]。
2.6 抗癌
癌症是起源于上皮组织的恶性肿瘤,是可以影响全身任何器官系统的多种疾病的总称[61]。五倍子可以剂量相关地抑制表皮生长因子受体(不同人类恶性肿瘤的有效靶标)的活性[62]。五倍子中的没食子酸、鞣花酸、没食子酸甲酯、β-谷甾醇、1,2,3,4,6-penta--galloyl-β--glucose和黄酮类化合物等已被报道在体外或体内具有抗癌活性[63-69],因此它们可以认为是五倍子抗癌活性的物质基础。
没食子酸是在动物模型和体外癌细胞系中显示抑制致癌作用报道最多的化合物[70-72]。没食子酸通过对细胞周期、细胞凋亡、血管生成、侵袭和转移的作用发挥抗肝癌活性[73-74]。在各种类型的人类或啮齿动物癌细胞中鉴定出没食子酸的分子机制包括调节凋亡相关蛋白、激活丝氨酸-苏氨酸蛋白激酶、抑制核糖核苷酸还原酶、抑制环氧合酶、抑制谷胱甘肽、抑制尿苷二磷酸葡萄糖脱氢酶、抑制血管内皮生长因子,抑制去整合素金属蛋白酶、抑制核因子-κB(nuclear factor kappa-B,NF-κB)[75-81]。
没食子酸乙酯是一种多酚化合物,其抗癌特性已得到充分研究,没食子酸乙酯的生长抑制作用已在一系列体外和体内癌症实验模型中确定[82],其可通过调节线粒体依赖性信号通路、细胞周期信号级联、蛋白激酶C信号通路、转化生长因子-β/Smad3通路等多种亚细胞信号通路来触发细胞凋亡并抑制癌细胞的增殖、血管生成、迁移和侵袭,同时没食子酸乙酯通过增加Caco2细胞和人结肠癌HCT-116细胞中Sub-G1期的细胞数量来引起细胞毒性和细胞抑制作用[83]。
没食子酸甲酯通过对凋亡分子的改变,以及蛋白激酶、NF-κB、ERK1/2、磷酸肌醇-3-激酶和非受体酪氨酸激酶/信号传导及转录激活因子信号通路的阻断导致癌细胞的凋亡[84],此外其还可以通过抑制CD4+CD25+调节性T细胞的肿瘤浸润来逆转免疫抑制,从而发挥抗肿瘤活性[85]。
1,2,3,4,6-penta--galloyl-β--glucose通过靶向抑制人乳酸脱氢酶-A的过表达和人乳腺癌细胞的代谢来实现出抗癌活性[86]。侵袭性恶性肿瘤的一个特征是乳酸脱氢酶-A的过度表达,1,2,3,4,6-penta--galloyl-β--glucose是一种有效的人乳酸脱氢酶-A抑制剂,并且具有显著阻止人乳腺癌细胞增殖的能力。在分子对接研究中[86],数据显示1,2,3,4,6-penta--galloyl-β--glucose竞争性结合在人乳酸脱氢酶-A的烟酰胺腺嘌呤二核苷酸结合辅因子位点内,且其与烟酰胺腺嘌呤二核苷酸的竞争性结合清楚地表明该位点对1,2,3,4,6-penta--galloyl-β--glucose的亲和力高于烟酰胺腺嘌呤二核苷酸。
黄酮类化合物以前被认为是一种癌症化学预防剂,在体外刺激许多类型癌细胞系的细胞周期停滞和细胞凋亡[87],分子机制主要涉及对人过氧化物酶体增殖物激活受体γ和线粒体发出的内在途径的作用[88]。此外,还能抑制NF-κB和血管内皮生长因子的表达,从而抑制肿瘤血管生成和转移[89]。
2.7 抗氧化
自由基理论认为活性氧诱导的氧化损伤在衰老的病理生理学中起必要作用[90-91]。大量证据表明,氧自由基与信号识别、蛋白质表达和免疫反应密切相关。然而,过量的活性氧对人体有不利影响,包括DNA损伤、增加膜脂过氧化和激活细胞凋亡,最终导致细胞损伤[92]。五倍子中鞣花酸已被证明具有体内和体外清除自由基的能力[93-94]。研究发现,鞣花酸能使-半乳糖致衰老大鼠的过氧化氢酶、谷胱甘肽过氧化物酶、超氧化物歧化酶和总抗氧化能力的抗氧化酶活性显著提升,减少了肝脏和大脑中丙二醛的产生,并能清除自由基来恢复抗氧化防御系统,从而减轻-半乳糖诱导衰老大鼠肝脏和大脑的氧化损伤[95]。
2.8 抗凋亡
研究发现,鞣花酸对体内-半乳糖致衰老大鼠的肝脏和大脑有保护作用,使肝组织中检测到肝细胞凋亡和炎性细胞浸润,以及海马CA1区的凋亡细胞和具有不规则神经元的杂乱神经纤维炎的情况得到改善[96]。B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白是抑制凋亡的关键因子,其过表达可有效阻止过氧化氢、自由基和微生物污染所诱导的凋亡[97]。Bcl-2关联X(Bcl-2-associated X,Bax)蛋白的主要功能是加速凋亡,并与Bcl-2一起调节细胞凋亡。然而,凋亡中的核心分子是半胱氨酸蛋白酶,它是已知的哺乳动物凋亡的关键因子[98]。通常认为Bcl-2作用于半胱氨酸蛋白酶激活的下游,因此,抑制细胞凋亡是通过抑制半胱氨酸蛋白酶的激活来实现的[99],结果表明,鞣花酸干预显著下调了Bcl-2和Bax蛋白的表达,上调了半胱氨酸蛋白酶的表达。结果表明,鞣花酸治疗模型大鼠通过抑制半胱氨酸蛋白酶的激活[100],降低了Bax和Bcl-2的比值,从而对-半胱氨酸诱导的肝脏和脑细胞衰老损伤产生了抗AP光效应[101]。
2.9 其他
鞣花酸可减轻高血压期间血管组织中的血浆碱性磷酸酶活性、钙含量和肥大,故鞣花酸可以改善高血压引起的心血管损害[102]。鞣花酸的肠道代谢物尿石素对肝癌HepG2细胞显示出有效的抗增殖活性[103],当尿石素诱导细胞死亡时,发现β-连环蛋白、核蛋白类癌基因和细胞周期蛋白D1的表达降低,T细胞因子/淋巴增强子结合因子转录激活显著下调,同时还增加了p53、p38-丝裂原活化蛋白激酶(protein 38-mitogen-activated protein kinase,p38-MAPK)和含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)的蛋白表达,抑制了NF-κB p65和其他炎症介质的表达,尿石素对HepG2细胞存活具有抗增殖和抗氧化作用。
五倍子中可水解的鞣质通过下调破骨细胞生成的关键调节因子以及破骨细胞相关基因的表达[104],显著抑NK-κB配体诱导的破骨细胞分化,从而表明,鞣质可能是治疗破骨细胞介导骨骼疾病的天然化合物。没食子酸甲酯可降低NF-κB的抑制蛋白降解、NF-κB p65、即刻早期原癌基因的核转位以及ERK1/2、p38和JNK磷酸化,通过抑制NF-κB信号传导和MAPK通路减轻Toll样受体配体诱导的炎症[105]。
3 结语与展望
五倍子在我国已有1400多年的药用历史,对多种疾病皆有可靠疗效。随着科技的进步,五倍子中越来越多的的生物活性物质被鉴定,如鞣质、酚酸、氨基酸、脂肪酸和其他化学成分,且其含有铜、锌、铁和钙等微量元素。现今,在临床使用前,五倍子的处理方法通常是去除杂质和非药用成分,或添加醋、酒精、茶等,通常以粉末、软膏、口服汤剂或丸剂的形式使用。现代药理学研究证实了五倍子的多种药理活性,如抗龋齿、抗菌、止泻、止血、抗炎、促进伤口愈合、抗癌、抗氧化等作用,同时对五倍子的一些传统用途原理进行了深入研究,特别是在治疗腹泻以及促进伤口愈合方面。通过现代研究验证五倍子的作用机制至关重要,中药成分复杂,因此五倍子中的多种生物活性成分可能比单一生物活性成分更加有效,并可能通过多种靶标和通路提供多种治疗效果。未来可通过药动学,尝试鉴别五倍子进入人体后其化学成分的吸收、转变、分布、代谢、排泄、毒性等,来揭示中药在复杂化学成分和临床作用下的潜力,对五倍子进行更深入的临床研究来评估其对体表感染、疮疡和肿瘤潜在的治疗效果以期开发出中药衍生新药品,促进中医中药的推广发展。
利益冲突 所有作者均声明不存在利益冲突
[1] 杨雅西, 平静, 于鹰, 等. 五倍子古今应用探要 [J]. 山西中医学院学报, 2012, 13(3): 11-14.
[2] 李杨, 吴侠, 邢效铭. 五倍子本草考证 [J]. 山东中医杂志, 2020, 39(5): 509-512.
[3] 中国药典 [S]. 一部. 2020: 68.
[4] Cai Y E, Zhang J M, Chen N G,. Recent advances in anticancer activities and drug delivery systems of tannins [J]., 2017, 37(4): 665-701.
[5] Wu L F, Yuan Y B, Wang K F,. Research progress on chemistry and pharmacology of hydrolyzable tannin monomer [J]., 2014, 45(2): 290-299.
[6] Duan D L, Li Z Q, Luo H P,. Antiviral compounds from traditional Chinese medicines Galla Chinese as inhibitors of HCV NS3 protease [J]., 2004, 14(24): 6041-6044.
[7] Kwon O J, Bae J S, Lee H Y,. Pancreatic lipase inhibitory gallotannins fromwith inhibitory effects on adipocyte differentiation in 3T3-L1 cells [J]., 2013, 18(9): 10629-10638.
[8] 王冬梅, 林森森, 郑司浩, 等. 五倍子抑制表皮生长因子受体活性及活性部位的UPLC/Q-TOF-MS分析 [J]. 中草药, 2013, 44(18): 2515-2519.
[9] 周红超, 陈平, 张建博, 等. 不同pH条件下五倍子中EGCG, EGC, ECG含量测定及分析 [J]. 云南中医中药杂志, 2016, 37(9): 78-80.
[10] 杨寒冰, 杨文强, 宋敏, 等. 五倍子中酚性化学成分及其抗病毒活性 [J]. 中国药科大学学报, 2016, 47(5): 566-569.
[11] Tarnawski M, Depta K, Grejciun D,. HPLC determination of phenolic acids and antioxidant activity in concentrated peat extract: A natural immunomodulator [J]., 2006, 41(1): 182-188.
[12] 李春远, 丁唯嘉, 渠桂荣. 五倍子化学成分研究 [J]. 中草药, 2008, 39(8): 1129-1132.
[13] Cheng L, Li J Y, Hao Y Q,. Effect of compounds ofand their combined effects with fluoride on remineralization of initial enamel lesion[J]., 2008, 36(5): 369-373.
[14] 刘兰香, 査玉平, 陈京元, 等. 肚倍在各生长期的主要成分含量变化分析 [J]. 生物资源, 2017, 39(5): 366-372.
[15] 易盛国, 雷绍荣. 五倍子油化学成分的研究 [J]. 化学研究与应用, 1998, 10(2): 192-194.
[16] 谷竹义. 五倍子中化合物的分离与鉴定 [D]. 大连: 辽宁师范大学, 2012.
[17] Kassebaum N J, Bernabé E, Dahiya M,. Global burden of untreated caries: A systematic review and metaregression [J]., 2015, 94(5): 650-658.
[18] Zhang T T, Chu J P, Zhou X D. Anti-carious effects of: A systematic review [J]., 2015, 29(12): 1837-1842.
[19] Cheng L, Li J Y, Hao Y Q,. Effect of compounds ofand their combined effects with fluoride on remineralization of initial enamel lesion[J]., 2008, 36(5): 369-373.
[20] Huang X L, Liu M D, Li J Y,. Chemical composition ofextract and the effect of its main component(s) on the prevention of enamel demineralization[J]., 2012, 4(3): 146-151.
[21] Zou L, Zhang L L, Li J Y,. Effect ofextract and chemical fractions on demineralization of bovine enamel[J]., 2008, 36(12): 999-1004.
[22] Cheng L, Li J Y, Hao Y Q,. Effect of compounds ofand their combined effects with fluoride on remineralization of initial enamel lesion[J]., 2008, 36(5): 369-373.
[23] Cheng L, ten Cate J M. Effect ofon theremineralization of advanced enamel lesions [J]., 2010, 2(1): 15-20.
[24] Lemos J A, Quivey R G, Koo H,.: A new gram-positive paradigm? [J]., 2013, 159(Pt 3): 436-445.
[25] Ooshima T, Matsumura M, Hoshino T,. Contributions of three glycosyltransferases to sucrose-dependent adherence of[J]., 2001, 80(7): 1672-1677.
[26] Li J H, Wu T T, Peng W W,. Effects of resveratrol on cariogenic virulence properties of[J]., 2020, 20(1): 99.
[27] Matsumoto-Nakano M. Role ofsurface proteins for biofilm formation [J]., 2018, 54(1): 22-29.
[28] Lemos J A, Palmer S R, Zeng L,. The biology of[J]., 2019, doi: https://doi.org/10.1128/microbiolspec.GPP3-0051-2018.
[29] Gong Y X, Tian X L, Sutherland T,. Global transcriptional analysis of acid-inducible genes in: Multiple two-component systems involved in acid adaptation [J]., 2009, 155(Pt 10): 3322-3332.
[30] Yang Y, Mao M Y, Lei L,. Regulation of water-soluble glucan synthesis by thedexA gene effects biofilm aggregation and cariogenic pathogenicity [J]., 2019, 34(2): 51-63.
[31] Quivey R G Jr, Grayhack E J, Faustoferri R C,. Functional profiling in: Construction and examination of a genomic collection of gene deletion mutants [J]., 2015, 30(6): 474-495.
[32] Passos M R, Almeida R S, Lima B O,. Anticariogenic activities of, gallic acid and ethyl gallate againstin biofilm model [J]., 2021, 274: 114059.
[33] Li J H, Wu T T, Peng W W,. Effects of resveratrol on cariogenic virulence properties of[J]., 2020, 20(1): 99.
[34] Gabe V, Kacergius T, Abu-Lafi S,. Inhibitory effects of ethyl gallate onbiofilm formation by optical profilometry and gene expression analysis [J]., 2019, 24(3): E529.
[35] Sendamangalam V, Choi O K, Kim D,. The anti-biofouling effect of polyphenols against[J]., 2011, 27(1): 13-19.
[36] Wu H, Moser C, Wang H Z,. Strategies for combating bacterial biofilm infections [J]., 2015, 7(1): 1-7.
[37] Gabe V, Kacergius T, Abu-Lafi S,. Suppressive effects of octyl gallate onbiofilm formation, acidogenicity, and gene expression [J]., 2019, 24(17): 3170.
[38] Kim E J, Jin B H. Antibacterial effect of different concentrations ofextract on cariogenic bacteria in a biofilm model [J]., 2020, 44(1): 13.
[39] Chittrarasu M, Ahamed A S, Ravi V. Antimicrobial efficacy of green synthesis of silver nanoparticles against cariogenic pathogens-anstudy [J]., 2021, 13(Suppl 2): S1188-S1192.
[40] Walker R I, Steele D, Aguado T,. Analysis of strategies to successfully vaccinate infants in developing countries against enterotoxigenic.(ETEC) disease [J]., 2007, 25(14): 2545-2566.
[41] Fleckenstein J M, Hardwidge P R, Munson G P,. Molecular mechanisms of enterotoxigenicinfection [J]., 2010, 12(2): 89-98.
[42] Madhavan T P V, Sakellaris H. Colonization factors of enterotoxigenic[J]., 2015, 90((9)): 155-197.
[43] Abdel-Salam E.[M]. New York: Academic Press, 2011: 1187-1189.
[44] Dubreuil J D. Antibacterial and antidiarrheal activities of plant products against enterotoxinogenic[J]., 2013, 5(11): 2009-2041.
[45] Zhang W Q, Fujii N, Naren A P. Recent advances and new perspectives in targeting CFTR for therapy of cystic fibrosis and enterotoxin-induced secretory diarrheas [J]., 2012, 4(3): 329-345.
[46] Yang Y, Luo H H, Song X,. Preparation oforal solution as well as its stability, safety, and antidiarrheal activity evaluation [J]., 2017, 2017: 1851459.
[47] Girard M, Bee G. Invited review: Tannins as a potential alternative to antibiotics to prevent coliform diarrhea in weaned pigs [J]., 2020, 14(1): 95-107.
[48] Song X, Yang Y, Li J Z,. Tannins extract fromcan protect mice from infection by EnterotoxigenicO101 [J]., 2021, 21(1): 84.
[49] Dickinson B, Surawicz C M. Infectious diarrhea: An overview [J]., 2014, 16(8): 399.
[50] Nieman D C, Nehlsen-Cannarella S L. The effects of acute and chronic exercise of immunoglobulins [J]., 1991, 11(3): 183-201.
[51] Kim J E, Go J, Koh E K,. Gallotannin-enriched extract isolated frommay be a functional candidate with laxative effects for treatment of loperamide-induced constipation of SD rats [J]., 2016, 11(9): e0161144.
[52] Xu C L, Wang Y M, Sun R,. Modulatory effects of vasoactive intestinal peptide on intestinal mucosal immunity and microbial community of weaned piglets challenged by an enterotoxigenic(K88) [J]., 2014, 9(8): e104183.
[53] Canon F, Paté F, Cheynier V,. Aggregation of the salivary proline-rich protein IB5 in the presence of the tannin EgCG [J]., 2013, 29(6): 1926-1937.
[54] Natarajan V, Krithica N, Madhan B,. Preparation and properties of tannic acid cross-linked collagen scaffold and its application in wound healing [J]., 2013, 101(4): 560-567.
[55] Motlagh D, Yang J, Lui K Y,. Hemocompatibility evaluation of poly(glycerol-sebacate)for vascular tissue engineering [J]., 2006, 27(24): 4315-4324.
[56] Johne J, Blume C, Benz P M,. Platelets promote coagulation factor XII-mediated proteolytic cascade systems in plasma [J]., 2006, 387(2): 173-178.
[57] Barrientos S, Stojadinovic O, Golinko M S,. Growth factors and cytokines in wound healing [J]., 2008, 16(5): 585-601.
[58] Werner S, Grose R. Regulation of wound healing by growth factors and cytokines [J]., 2003, 83(3): 835-870.
[59] Sun K, Song X, Jia R Y,.evaluation ofsolution in the topical treatment of dermatophytosis [J]., 2017, 2017: 3843595.
[60] Ren Y Y, Zhang X R, Li T N,., a traditional Chinese medicine: Comprehensive review of botany, traditional uses, chemical composition, pharmacology and toxicology [J]., 2021, 278: 114247.
[61] Powers S, Pollack R E. Inducing stable reversion to achieve cancer control [J]., 2016, 16(4): 266-270.
[62] Wang Z H, Lin S S, Wang D M,. Anti-epidermal growth factor receptor tyrosine kinase activities of traditional Chinese medicine for cancer treatment [J]., 2014, 6(5): 565-570.
[63] Pithayanukul P, Nithitanakool S, Bavovada R. Hepatoprotective potential of extracts from seeds ofand nutgalls of[J]., 2009, 14(12): 4987-5000.
[64] Chaudhuri D, Ghate N B, Singh S S,. Methyl gallate isolated fromexhibits anticancer activity against human glioblastoma by induction of apoptosis and sustained extracellular signal-regulated kinase 1/2 activation [J]., 2015, 11(42): 269-276.
[65] Chen J H, Chen W L, Liu Y C. Amentoflavone induces anti-angiogenic and anti-metastatic effects through suppression of NF-κB activation in MCF-7 cells [J]., 2015, 35(12): 6685-6693.
[66] Han N R, Kim H M, Jeong H J. The potential anti-proliferative effect of β-sitosterol on human mast cell line-1 cells [J]., 2015, 93(11): 979-983.
[67] Salimi A, Roudkenar M H, Sadeghi L,. Ellagic acid, a polyphenolic compound, selectively induces ROS-mediated apoptosis in cancerous B-lymphocytes of CLL patients by directly targeting mitochondria [J]., 2015, 6: 461-471.
[68] Lu Y C, Lin M L, Su H L,. ER-dependent Ca2+-mediated cytosolic ROS as an effector for induction of mitochondrial apoptotic and ATM-JNK signal pathways in gallic acid-treated human oral cancer cells [J]., 2016, 36(2): 697-705.
[69] Sun G J, Zhang S Q, Xie Y R,. Gallic acid as a selective anticancer agent that induces apoptosis in SMMC-7721 human hepatocellular carcinoma cells [J]., 2016, 11(1): 150-158.
[70] Giftson Senapathy J, Jayanthi S, Viswanathan P,. Effect of gallic acid on xenobiotic metabolizing enzymes in 1, 2-dimethyl hydrazine induced colon carcinogenesis in Wistar rats: A chemopreventive approach [J]., 2011, 49(4): 887-892.
[71] Wang K, Zhu X, Zhang K,. Investigation of gallic acid induced anticancer effect in human breast carcinoma MCF-7 cells [J]., 2014, 28(9): 387-393.
[72] Weng S W, Hsu S C, Liu H C,. Gallic acid induces DNA damage and inhibits DNA repair-associated protein expression in human oral cancer SCC-4 cells [J]., 2015, 35(4): 2077-2084.
[73] Kuo C L, Lai K C, Ma Y S,. Gallic acid inhibits migration and invasion of SCC-4 human oral cancer cells through actions of NF-κB, Ras and matrix metalloproteinase-2 and-9 [J]., 2014, 32(1): 355-361.
[74] Tan S, Guan X, Grün C,. Gallic acid induces mitotic catastrophe and inhibits centrosomal clustering in HeLa cells [J]., 2015, 30(1 Pt B): 506-513.
[75] Kim N S, Jeong S I, Hwang B S,. Gallic acid inhibits cell viability and induces apoptosis in human monocytic cell line U937 [J]., 2011, 14(3): 240-246.
[76] Hsu J D, Kao S H, Ou T T,. Gallic acid induces G2/M phase arrest of breast cancer cell MCF-7 through stabilization of p27(Kip1) attributed to disruption of p27(Kip1)/Skp2 complex [J]., 2011, 59(5): 1996-2003.
[77] Liao C L, Lai K C, Huang A C,. Gallic acid inhibits migration and invasion in human osteosarcoma U-2 OS cells through suppressing the matrix metalloproteinase-2 /-9, protein kinase B (PKB) and PKC signaling pathways [J]., 2012, 50(5): 1734-1740.
[78] Madlener S, Illmer C, Horvath Z,. Gallic acid inhibits ribonucleotide reductase and cyclooxygenases in human HL-60 promyelocytic leukemia cells [J]., 2007, 245(1/2): 156-162.
[79] Lu Y, Jiang F, Jiang H,. Gallic acid suppresses cell viability, proliferation, invasion and angiogenesis in human glioma cells [J]., 2010, 641(2/3): 102-107.
[80] You B R, Park W H. Gallic acid-induced lung cancer cell death is related to glutathione depletion as well as reactive oxygen species increase [J]., 2010, 24(5): 1356-1362.
[81] He Z P, Chen A Y, Rojanasakul Y,. Gallic acid, a phenolic compound, exerts anti-angiogenic effects via the PTEN/AKT/HIF-1α/VEGF signaling pathway in ovarian cancer cells [J]., 2016, 35(1): 291-297.
[82] Umesalma S, Nagendraprabhu P, Sudhandiran G. Ellagic acid inhibits proliferation and induced apoptosis via the Akt signaling pathway in HCT-15 colon adenocarcinoma cells [J]., 2015, 399(1/2): 303-313.
[83] Yousef A I, El-Masry O S, Abdel Mohsen M A. Impact of cellular genetic make-up on colorectal cancer cell lines response to ellagic acid: Implications of small interfering RNA [J]., 2016, 17(2): 743-748.
[84] Afsar T, Trembley J H, Salomon C E,. Growth inhibition and apoptosis in cancer cells induced by polyphenolic compounds of: Involvement of multiple signal transduction pathways [J]., 2016, 6: 23077.
[85] Lee H, Lee H, Kwon Y,. Methyl gallate exhibits potent antitumor activities by inhibiting tumor infiltration of CD4+CD25+regulatory T cells [J]., 2010, 185(11): 6698-6705.
[86] Deiab S, Mazzio E, Eyunni S,. 1,2,3,4,6-penta--galloylglucose withininhibits human LDH-A and attenuates cell proliferation in MDA-MB-231 breast cancer cells [J]., 2015, 2015: 276946.
[87] Pei J S, Liu C C, Hsu Y N,. Amentoflavone induces cell-cycle arrest and apoptosis in MCF-7 human breast cancer cells via mitochondria-dependent pathway [J]., 2012, 26(6): 963-970.
[88] Lee E J, Shin S Y, Lee J Y,. Cytotoxic activities of amentoflavone against human breast and cervical cancers are mediated by increasing of PTEN expression levels due to peroxisome proliferator-activated receptor γ activation [J]., 2012, 33(7): 2219-2223.
[89] Chen J H, Chen W L, Liu Y C. Amentoflavone induces anti-angiogenic and anti-metastatic effects through suppression of NF-κB activation in MCF-7 cells [J]., 2015, 35(12): 6685-6693.
[90] Yang C, Du Y K, Wang J,. Transplanted adipose-derived stem cells ameliorate testicular dysfunction in AD-galactose-induced aging rat model [J]., 2015, 230(10): 2403-2414.
[91] Zhen Y Z, Lin Y J, Li K J,. Effects of rhein lysinate on-galactose-induced aging mice [J]., 2016, 11(1): 303-308.
[92] Xu L Q, Xie Y L, Gui S H,. Polydatin attenuates d-galactose-induced liver and brain damage through its anti-oxidative, anti-inflammatory and anti-apoptotic effects in mice [J]., 2016, 7(11): 4545-4555.
[93] Omur A D, Coyan K. Protective effects of the antioxidants curcumin, ellagic acid and methionine on motility, mitochondrial transmembrane potential, plasma membrane and acrosome integrity in freeze-thawed Merino ram sperm [J]., 2016, 61(1): 10-16.
[94] Yousef A I, El-Masry O S, Abdel Mohsen M A. Impact of cellular genetic make-up on colorectal cancer cell lines response to ellagic acid: Implications of small interfering RNA [J]., 2016, 17(2): 743-748.
[95] Schmedes M, Aadland E K, Sundekilde U K,. Lean-seafood intake decreases urinary markers of mitochondrial lipid and energy metabolism in healthy subjects: Metabolomics results from a randomized crossover intervention study [J]., 2016, 60(7): 1661-1672.
[96] Lakshmi B V S, Sudhakar M, Prakash K S. Protective effect of selenium against aluminum chloride-induced Alzheimer’s disease: Behavioral and biochemical alterations in rats [J]., 2015, 165(1): 67-74.
[97] Shaikh N H, Deshmukh V M, Walvekar M V. Alteration in testicular morphology and sperm count due to glycowithanolides treatment during aging [J]., 2015, 8(3): 72-77.
[98] Feng Y, Yu Y H, Wang S T,. Chlorogenic acid protects-galactose-induced liver and kidney injury via antioxidation and anti-inflammation effects in mice [J]., 2016, 54(6): 1027-1034.
[99] Grippa A, Buxó L, Mora G,. The seipin complex Fld1/Ldb16 stabilizes ER-lipid droplet contact sites [J]., 2015, 211(4): 829-844.
[100]Neprasova M, Maixnerova D, Novak J,. Toward noninvasive diagnosis of IgA nephropathy: A pilot urinary metabolomic and proteomic study [J]., 2016, 2016: 3650909.
[101]Ortiz-Ruiz C V, Berna J, Tudela J,. Action of ellagic acid on the melanin biosynthesis pathway [J]., 2016, 82(2): 115-122.
[102]Jordão J B R, Porto H K P, Lopes F M,. Protective effects of ellagic acid on cardiovascular injuries caused by hypertension in rats [J]., 2017, 83(10): 830-836.
[103]Wang Y, Qiu Z P, Zhou B H,.antiproliferative and antioxidant effects of urolithin A, the colonic metabolite of ellagic acid, on hepatocellular carcinomas HepG2 cells [J]., 2015, 29(5): 1107-1115.
[104]Ihn H J, Kim T H, Kim K,. 2--digalloyl-1,3,4,6-tetra--galloyl-β--glucose isolated fromsuppresses osteoclast differentiation and function by inhibiting NF-κB signaling [J]., 2019, 52(6): 409-414.
[105]Correa L B, Seito L N, Manchope M F,. Methyl gallate attenuates inflammation induced by Toll-like receptor ligands by inhibiting MAPK and NF-κB signaling pathways [J]., 2020, 69(12): 1257-127.
Research progress on chemical constituents and pharmacological effects of
LIANG Zheng1, XU Qiang2, ZHANG Qian1, LIU Tian-feng1, ZHANG Zhao-hui2
1. Institute of Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China 2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China
is a kind of astringent Chinese herbal medicine, which has the effect of astringent lung and fire, astringent intestine and diarrhea, astringent sweat, hemostasis, dampness and sores. The chemical constituents ofare diverse, and its chemical constituents that have been identified so far mainly include tannins, phenolic acids, amino acids, fatty acids, ellagic acid and other chemical constituents. Modern research shows thathas many pharmacological effects, such as anti caries, antibacterial, antidiarrheal, hemostatic, anti-inflammatory, promoting wound healing, anti-cancer, scavenging free radicals, anti-oxidation and so on. Research progress on chemical constituents and pharmacological effects ofwere reviewed in this paper, to better understand the characteristics of, expand its application scope, and provide reference for its clinical application.
Mill.; tannin; phenolic acid; ellagic acid; anti caries; antibacterial; antidiarrheal
R282.710.5
A
0253 - 2670(2022)18 - 5908 - 12
10.7501/j.issn.0253-2670.2022.18.033
2022-06-07
国家重点研发计划课题(2019YFC1709303);国家自然科学基金青年基金资助项目(81904211)
梁 正,男,硕士研究生,从事中西医结合治疗疮疡病及周围血管病基础与临床研究工作。E-mail: 395458464@qq.com
张朝晖,教授,主任医师,博士生导师,从事中医药防治疮疡病及周围血管病基础与临床研究工作。Tel: (022)60637062 E-mail: zzh45@aliyun.com
[责任编辑 崔艳丽]
