小檗碱药理作用及其相关作用机制研究进展
2022-09-20陈美琳李芝奇范琦琦杨星月顾渝林郭思敏林瑞超赵崇军
陈美琳,李芝奇,范琦琦,蔡 琼,杨星月,顾渝林,郭思敏,林瑞超,赵崇军
小檗碱药理作用及其相关作用机制研究进展
陈美琳,李芝奇,范琦琦,蔡 琼,杨星月,顾渝林,郭思敏,林瑞超*,赵崇军*
北京中医药大学 中药品质评价北京市重点实验室,北京 102488
小檗碱是许多中药的一种常见活性物质,数千年来被广泛应用于消化系统相关疾病。现代药理研究表明小檗碱在预防和保护代谢性疾病及主要脏器损伤等方面也具有显著的药理活性。因此,在前期文献研究的基础上,整理和总结了近年小檗碱在脏器损伤如神经损伤、肝脏损伤、肾脏损伤、生殖系统损伤、胃肠道损伤、心血管疾病以及代谢性疾病如阿尔茨海默症、糖尿病及相关并发症、炎症等疾病的保护作用及其相关机制,并针对亟需解决的的问题提出了建议,以期为小檗碱的临床安全使用和新药研发提供参考。
小檗碱;脏器损伤;代谢性疾病;炎症;临床安全;新药研发
小檗碱是一种天然的以季异喹啉为基础的生物碱,常见3种存在形式,见图1。小檗碱存在于多种清热解毒类中药中,如小檗科三颗针、毛茛科黄连、芸香科黄柏等。传统药理研究认为小檗碱及相关中药具有显著的抗炎、抗菌、抗病毒作用,如《伤寒论》中记载:“伤寒胸中有热,胃中有邪气,腹中痛,欲呕吐者,黄连汤主之”“热利下重者,白头翁汤主之”,因此其被长期应用于多种细菌引起的消化系统疾病。而现代研究者发现小檗碱在脏器损伤、心血管及代谢性疾病的预防和治疗方面效果显著,且没有明显的不良反应报道,并不断对其研究进展进行系统整理和报道[1-3]。因此,基于小檗碱的主要生物功能,在前期文献研究整理基础上,本文重点收集、整理和总结了小檗碱在脏器损伤保护和代谢性疾病等方面的最新进展,以期为小檗碱的新药研发和临床应用提供思路和参考。
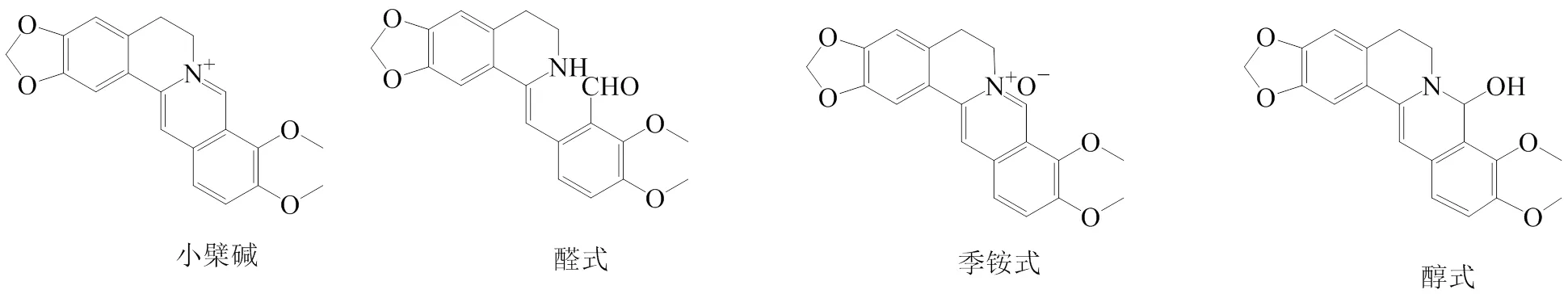
图1 小檗碱的化学结构
1 对神经系统的保护作用
1.1 阿尔茨海默病(Alzheimer’s disease,AD)
AD是中老年人群中常见的一种神经退行性疾病,主要临床表现为记忆力减退及认知功能缺失,其典型病理特征为β淀粉样蛋白(amyloid β-protein,Aβ)沉积、神经纤维缠结和神经元细胞死亡等[4]。小檗碱能增强脑内血小板-内皮细胞黏附分子、血管内皮生长因子(vascular endothelial growth factor,VEGF)、人血管生成素-1等表达,降低Aβ积累并抑制神经元凋亡,促进脑微血管形成和脑血流量恢复,改善AD模型(3×Tg-AD)转基因小鼠的认知功能障碍[5]。不仅如此,小檗碱还能通过磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinase,p-ERK)/真核翻译启动因子2α(eukaryotic translation initiation factor 2α,eIF2α)/淀粉蛋白前β-分解酶1(β-secretase 1,BACE1)信号通路抑制Aβ42的产生[6],增强Aβ自噬清除来缓解Aβ产生过程[7],抑制神经元凋亡,改善神经纤维缠结状态,从而改善AD模型大鼠海马区认知学习和记忆保持能力。此外,AD的发生进程与淀粉样前体蛋白(amyloid precursor protein,APP)表达相关。研究发现小檗碱不仅能通过显著上调Aβ25~35诱导的人神经母细胞瘤SK-N-SH细胞中的表达,下调APP表达[8],降低APP和APP C端片段的高度磷酸化来调节APP过程[9],还能通过抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase,p70S6K)信号通路活化,降低Aβ在/小鼠中的表达[10],抑制内质网应激p-ERK/eIF2α信号转导的APP裂解酶水平等多种途径降低细胞凋亡率,发挥其保护作用[11]。
1.2 抑郁和焦虑
抑郁症是一种慢性情绪障碍,其发病机制较复杂,涉及环境、遗传、生理等多种因素。小檗碱能够显著改变5XFAD转基因小鼠和去卵巢大鼠在旷场实验、高架十字迷宫实验中的抑郁和焦虑行为学指标[12-13]。另外,小檗碱能缓解抑郁模型小鼠强迫游泳实验不动时间和蔗糖偏好实验中糖水偏爱比的变化水平,减少乳酸和丙酮酸含量,而这些作用可能与促进腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)含量和5′-单磷酸腺苷激活的蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)蛋白表达、促进脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)表达从而逆转和对抑郁行为和海马神经元生长的调控有关[14-15]。
1.3 神经损伤
神经细胞损伤在一定程度上会引起细胞凋亡,引起神经系统功能损失,该过程受脑内胶质细胞、神经元的成熟度、细胞因子、炎症因子等影响。研究发现小檗碱通过激活mTOR磷酸化,抑制内质网应激和自噬过程来提高氧糖剥夺/再灌注肾上腺嗜铬细胞瘤PC12细胞的活力[16],通过上调过氧化物酶体增殖物激活受体γ(peroxisome proliferators-activated receptor γ,PPARγ)、抑制核因子-κB(nuclear factor kappa-B,NF-κB)等因子发挥对大鼠海马神经元体外氧糖剥夺模型的保护作用[17]。小檗碱还能通过p-ERK//C/EBP同源蛋白(C/EBP homologous protein,CHOP)/半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)、蛋白激酶B(protein kinase B,Akt)/糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)/ERK、磷酸肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)/Akt、沉默调节蛋白1(silent mating type information regulation 2 homolog 1,SIRT1)、低氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)/p53等多个信号通路来影响脑神经凋亡相关通路,发挥对脑损伤模型的保护作用[18-19]。不仅如此,小檗碱可促进海马CA1-CA3区中小白蛋白免疫反应神经元和神经纤维数量,调节神经元中Ca2+水平,从而对抗神经元损伤[20]。
此外,小檗碱能缓解化疗、物理损伤导致的神经损伤。研究发现小檗碱可通过抑制脑组织中胶质纤维酸性蛋白、NF-κB和Caspase-3等蛋白水平,上调过氧化物酶体增殖受体γ辅激活因子-1α(peroxisome proliferators-activated receptor γ coactivator-1α,PGC-1α)和锰超氧化物歧化酶来激活抗氧化和炎症防御,进而减轻阿霉素诱发的病理组织异常、认知障碍和行为缺陷[21-22];可通过下调NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体信号通路,减少炎症因子白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)释放,降低降钙素基因相关肽表达水平,提高眶下神经缩窄术制备三叉神经痛大鼠神经面部感觉区域的机械痛阈值[23]。
1.4 帕金森病
帕金森病是世界上第2大神经退行性疾病,且帕金森病炎症过程与NLR家族NLRP3炎症小体激活密切相关。研究发现小檗碱可增强黑质自噬活性,降低NLRP3炎性小体水平;可通过调节长链非编码RNALINC00943/微小RNA-142-5p/KPNA4/NF-κB和激活单磷酸腺苷、AMPK,降低α突触核蛋白、微管相关蛋白1轻链3II(microtubule-associated protein 1 light chain 3II,LC3II)水平等来抑制炎症和凋亡,保护1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导帕金森病小鼠和1-甲基-4-苯基吡啶离子诱导小鼠小胶质瘤BV2细胞的神经元退化和损伤[24-26]。此外,小檗碱可以穿透血脑屏障,实现在线粒体中积累,进而抑制患帕金森病斑马鱼大脑六羟基多巴损伤细胞抑癌基因诱导的假定激酶1(PTEN induced putative kinase 1,PINK1)蛋白积累和LC3蛋白过表达,进而缓解斑马鱼多巴胺能神经元的损失[27]。
肠道菌群可能也是小檗碱多功能作用的靶点。苯基丙氨酸-酪氨酸-多巴胺通路能向大脑提供多巴胺,而酪氨酸羟化酶(tyrosine 3-monooxygenase,TH)以四氢生物蝶呤(tetrahydrobiopterin,BH4)为辅酶,是羟化酪氨酸并生成左旋多巴的限速酶。临床研究发现小檗碱通过细菌产生的二氢小檗碱供应硝基还原酶,促进二氢小檗碱产生BH4,进而增强TH的活性来加速肠道细菌产生左旋多巴,且粪肠或屎肠球菌移植与小檗碱联用更能显著增加帕金森病小鼠的脑多巴胺水平,改善帕金森病症状[28]。
2 对心血管系统的保护作用
心血管疾病也是世界范围内的首要健康问题。小檗碱是治疗心血管疾病更安全、经济、有前途的天然衍生药物之一[29],对多种疾病均具有一定保护作用[30-31]。小檗碱能抑制血性心肌病大鼠模型Toll样受体4(Toll-like receptor 4,TLR4)/NF-κB信号通路激活,通过抑制TLR4、p65、TNF-α和IL-1β水平发挥保护作用[32]。在心肌肥厚大鼠模型中,小檗碱能够降低组织中心房钠尿肽、脑钠肽、磷酸化Akt(phosphorylated Akt,p-Akt)及磷酸化糖原合成酶激酶-3水平,抑制左心室舒张末期后壁厚度,缓解左心室舒张末期内径、左心室射血分数减少水平[33]。在缺血再灌注损伤大鼠模型大鼠心肌组织损伤中,小檗碱还能够升高PINK1、LC3B等蛋白,抑制TNF-α、IL-6、Caspase-3、IL-10蛋白水平,抑制炎症反应和细胞凋亡[34-35]。不仅如此,小檗碱还可提高饮食诱导肥胖小鼠心脏Krüppel样因子4水平,改善心功能参数,上调线粒体质量、ATP生产和氧消耗的水平,保护心脏线粒体的生物发生和活性[36];能够丰富人蛋白激酶Cα(protein kinase Cα,PKCα)膜定位,促进PKCα的磷酸化水平和PKCα的活性,逆转硝酸甘油的耐受性[37];减少CD4+和CD8+T细胞浸润和抑制同种异体移植中的T细胞功能来保护心肌细胞[38];抑制心房快速起搏模型的心房结构重构,预防心房颤动[39]。
3 对肝脏的保护作用
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一种与代谢综合征密切相关的病理性疾病。小檗碱可通过调节多种机制来发挥保肝用[40]。临床上,小檗碱能降低NAFLD患者的三酰甘油、血清总胆固醇(serum total cholesterol,TC)、胰岛素抵抗(insulin resistance,IR)等,通过调节糖脂代谢等来改善相关症状[41]。在高脂饲料诱导大鼠NAFLD中,小檗碱能通过提高肝脏及粪便中总胆汁酸水平,上调肝脏细胞色素7A1、微粒体三酰甘油转移蛋白,下调肝X受体α、胆固醇调节元件结合蛋白、细胞内胆固醇转运体1、脂肪酸合成酶(fatty acid synthase,FAS)、硬脂酰辅酶α1、重组人脂肪酸结合蛋白1和肉毒碱棕榈酰基转移酶1A蛋白水平,抑制脂肪酸合成和肠道-肝脏复合物I,来促进脂肪代谢和粪便脂质排泄[42-44];能通过抑制巨噬细胞浸润、中性粒细胞和肝星状细胞激活、促炎巨噬细胞极化和细胞外基质异常沉积来改善脂肪变性和结构病变情况[45-46]。此外,研究证明小檗碱还能激活高脂饮食小鼠肝脏能量代谢感知通路AMPK/SIRT1轴,增加PPARγ脱乙酰、产热蛋白的表达来促进脂肪组织重塑、分布和生热作用[47]。不仅如此,小檗碱还能增加遗传性肥胖小鼠模型体内双歧杆菌和嗜黏蛋白阿克曼菌盲肠内容物,缓解高三酰甘油血症和炎症等变化水平[48];能够降肝缺血再灌注大鼠损伤模型组织中NLRP3、含有凋亡相关微粒蛋白、Caspase-1等炎症小体相关蛋白表达水平,缓解细胞凋亡[49]。在非酒精性脂肪性肝炎模型中,小檗碱能明显改善促炎细胞因子和游离脂肪酸等变化水平,降低肝脏中趋化素、人趋化样因子受体1和趋化因子C-C-基元受体2蛋白表达,恢复大鼠肝内调节性T细胞/辅助性T细胞17的值[50]。不仅如此,小檗碱还能够拮抗药物诱导肝损伤,如小檗碱能下调p38-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、NF-κB和Kelch样环氧氯丙烷相关蛋白-1,有效降低甲氨蝶呤的肝毒性[51];能够降低脂肪酸合酶和羟甲基戊二酸单酰辅酶A还原酶表达水平,逆转槟榔水提取物诱发的肝脏脂肪变性、血脂异常等[52]。
小檗碱药物联用在治疗NAFLD中可展现出更好的效果,如小檗碱与几内亚油松、栀子咖啡联用可通过调节、和肠道微生物组来改善高脂饮食诱导NAFLD模型[53];与西格列汀联合能通过抑制p-ERK/ERK表达,升高脂联素受体2表达,进而促进高脂血症大鼠脂肪组织重塑[54]。
4 对肾脏的保护作用
小檗碱对肾损伤模型也表现出显著的保护作用。研究发现小檗碱能降低人肾皮质近曲小管上皮HK-2细胞损伤模型线粒体活性氧生成,促进生长抑制特异性基因的表达[55];能上调钙黏蛋白E并下调NLRP3及Caspase-1蛋白的表达,降低Caspase-1酶活力和IL-1β的分泌来发挥对HK-2细胞损伤的保护作用[56]。在阿霉素诱导的大鼠肾脏损伤模型中,小檗碱能通过降低转化生长因子-β(transforming growth factor-β,TGF-β)、Caspase-3和NF-κB表达,减少氧化应激来缓解组织结构的改变,降低尿素、肌酐等水平,实现保护作用[57]。不仅如此,小檗碱还能通过降低血清铬和血尿素氮浓度、肾脏IL-1β和TNF-α含量,抑制肾脏组织中SIRT1/核因子E2相关因子2(nuclear factor NF-E2-related factor 2,Nrf2)信号通路及相关Caspase-1和NLRP3表达水平来实现对肾缺血再灌注损伤模型的保护作用[58];通过显著降低血清尿酸、尿素氮和肌酐水平,下调NLRP3、Caspase-1和IL-1β的表达来保护低氧嗪酸钾和次黄嘌呤诱导高尿酸血症小鼠的肾损伤[59];通过抑制肾脏中α平滑肌肌动蛋白、IL-1β蛋白,升高钙黏蛋白E,从而缓解非代谢性经典肾脏纤维化模型小鼠部分肾小球代偿性肥大,管周间隙增宽,炎症细胞浸润等症状[60]。研究发现小檗碱和马兜铃酸会形成超分子自组装结构来阻断马兜铃酸的代谢,保护机体肠道菌群的稳态,进而显著降低马兜铃酸的急性肾损伤[61]。
5 对生殖系统的保护作用
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是一种伴有生殖和内分泌紊乱的临床综合征,而小檗碱在治疗PCOS方面具有显著疗效[62],如改善患者的卵巢包膜厚度、卵巢体积、卵泡数量和卵泡直径,卵巢动脉平均血流速度、规律月经比例、排卵比例等[63]。临床前研究表明小檗碱可以干预和逆转ip丙酸睾酮诱导PCOS大鼠的卵泡数、黄体数的变化趋势,能降低血清黄体生成素和TC、整合素和溶血磷脂酸受体3蛋白表达水平,增加黄体生成素/绒毛膜促性腺激素受体、细胞色素卵巢蛋白及颗粒细胞mRNA表达水平[64]。此外,小檗碱能通过PI3K/Akt途径,改变血清激素水平、恢复卵巢形态病变、改善IR、细胞活力和抑制凋亡,实现对曲唑诱导PCOS的保护作用[65];可上调猪卵母细胞转录水平,降低心型脂肪酸结合蛋白、固醇调节元件结合转录因子1、过氧化物酶体增生激活受体γ表达,增加过氧化物酶体增生激活受体γ磷酸化,抑制c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)磷酸化,增强猪卵母细胞体外成熟模型脂质紊乱模型中脂质代谢水平和提高猪卵母细胞质量[66]。
6 对胃-肠道的保护作用
6.1 肠道损伤
小檗碱及相关中药如黄连数千年来一直被广泛应用治疗腹泻等胃肠道疾病。研究发现小檗碱能缓解脱氧雪腐镰刀菌醇暴露对仔猪空肠形态参数和小肠的损伤。进一步研究发现小檗碱能增加小肠血清抗氧化酶和T细胞表面抗原表达,减少促炎细胞因子释放,升高回肠和空肠黏膜紧密连接蛋白、封闭蛋白和跨膜蛋白,降低空肠和回肠中ERK、JNK和NF-κB水平[67]。此外,小檗碱能通过改善氧化应激,调节Nrf2、SIRT1、叉形头转录因子、GSK3β、Akt、mTOR、蛋白酪氨酸激酶和信号转导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)水平来显著恢复甲氨蝶呤诱导的大鼠肠损伤组织的病理学异常[68];能通过降低肠通透性,保护肠黏膜屏障,降低5-羟色胺受体4、F2R样凝血酶/胰蛋白酶受体3、神经肽Y、促肾上腺皮质素释放激素受体2、IL-1β、血管活性肠肽、水通道蛋白8含量,增加一氧化氮合酶含量能明显改善双氯芬酸对SD大鼠肠损伤状态[69];小檗碱可增加紧密连接和黏附连接蛋白而减轻其损伤,改善微绒毛的形态来改善小鼠结肠上皮屏障受损状态。此外,在创面愈合实验中,小檗碱可通过促进细胞迁移,改善结肠肠上皮屏障功能障碍,促进细胞功能的恢复[70];通过抑制全身IL-6、IL-1β和TNF-α的产生,上调表达;同时,在诱导NF-κB抑制蛋白α(inhibitor of NF-κB α,IκBα)表达的同时,小檗碱能抑制叉头框蛋白A1、p-IκBα、p65的表达,进而发挥对盲肠浆液诱导小鼠肠道损伤的保护作用[71]。
6.2 肠炎
临床上,小檗碱能够显著缓解急性肠胃炎患者呕吐、腹痛和腹泻症状,缩短急性胃肠炎症状消失时间,改善白细胞计数和中性粒细胞百分比[70-72]。而且,小檗碱联合双歧杆菌四联活菌片能够促进感染性腹泻患儿体温恢复正常、改善腹泻及腹痛症状,降低内毒素、C-反应蛋白(C-reactive protein,CRP)、TNF-α、-乳酸、二胺氧化酶水平[73];联合美沙拉嗪可缓解远端溃疡性结肠炎患者机体炎症反应[74]。在溃疡性结肠炎模型中,小檗碱还能缓解动物体质量、结肠组织大体形态及结肠黏膜损伤指数的变化水平,降低血清和结肠组织促炎因子IL-6、IL-1β、TNF-α含量及蛋白水平,增加抗炎因子IL-10、TGF-β、IL-4含量及蛋白水平[75],降低一氧化氮合成酶、NF-κB亚基、mRNA表达,升高精氨酸酶mRNA表达水平和M2/M1巨噬细胞值[76]。不仅如此,小檗碱还能以宿主依赖的方式增加小鼠嗜黏蛋白阿克曼菌的丰度,显著增加黏液蛋白产生基因转录和黏液蛋白的分泌,促进粪便中多胺的产生过程且不受真核多胺合成酶抑制剂的影响[69-77]。
6.3 慢性胃炎
在大鼠慢性萎缩性胃炎中,小檗碱可以改善胃组织病理特征,降低胃泌素,抑制炎症因子NF-κB、TNF-α、环氧合酶-2、IL-6α、IL-17a、I型γ干扰素、以及TGF-β1轴相关信号TGF-β1、PI3K、p-Akt/Akt、p-mTOR/mTOR、p70核糖体蛋白S6激酶表达,促进蛋白酪氨酸磷酸酶、LC3II表达[78-79]。
7 抗糖尿病及其并发症
2型糖尿病是世界范围内发病率日益增高的代谢性疾病之一,且临床上往往伴随多种并发症。研究发现小檗碱能通过多靶点、多通路调控治疗2型糖尿病及其相关并发症,且具有良好的安全性[80]。
7.1 降糖作用
小檗碱能改善高脂加链脲佐菌素诱导糖尿病大鼠IR、瘦素、空腹血糖、TC、三酰甘油等指标,降低TNF-α、IL-6及p-ERK/eIF2α通路相关蛋白的表达水平[81-82];可抑制糖尿病大鼠的乙酰胆碱酯酶活性,上调血清中乙酰胆碱水平和肝组织中α7烟碱乙酰胆碱受体表达,下调IL-1β、TNF-α和NF-κB表达[83];可显著降C57BL/6J糖尿病小鼠相关生化指标,促进维甲酸X受体α的表达,降低肝脏中核受体亚家族3C组成员1表达[84];能够改善高脂饲料喂养小鼠糖耐量、IR指数,通过miR-146b/SIRT1途径降低肝脏IR[85];通过提高miR-106b的甲基化水平,激活β-catenin/转录因子4(transcription factor 4,TCF4)信号通路,促进肠道L细胞产生胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)[86]。
7.2 糖尿病肾病
小檗碱能通过多途径来实现对糖尿病肾损伤的保护作用,如通过抑制IL-6、IL-1β、TNF-α、miR-1290等炎症因子[87]、通过降低p-Akt、p-p65、p-IκBα等蛋白表达水平,升高肾母细胞瘤、足突蛋白蛋白表达水平抑制细胞迁移和促进划痕愈合率[88-89],通过调节AMPK/PGC-1α途径来调控自噬活性[90],通过Nrf2/血红素加氧酶-1(heme oxygenase-1,HO-1)/谷胱甘肽过氧化酶4(glutathione peroxidase 4,GPX4)通路降低环加氧酶2和长链脂酰辅酶A合成酶4的水平来缓解高糖诱导的细胞质膜起泡、线粒体皱缩、细胞凋亡等过程,进而降低高糖诱导小鼠肾足MPC5细胞损伤。此外,研究还发现小檗碱能通过显著上调钠/葡萄糖协同转运蛋白1 mRNA和蛋白表达,促进小鼠小肠内分泌STC-1细胞分泌GLP-1和葡萄糖消耗,进而发挥保护作用[91]。
7.3 妊娠糖尿病
小檗碱可改善妊娠糖尿病相关的并发症。小檗碱能缓解高脂饲料诱导的妊娠期和哺乳期野生型C57BL/6雌性小鼠后代体质量,胰岛素分泌减少,心脏收缩时间增加等症状[92],缓解后代心脏中心脏指数含量升高水平,增加脂肪酸摄取、氧化和电子传递链亚基相关心肌酶的表达,改善线粒体功能[93]。
7.4 对糖尿病和认知障碍的保护
认知障碍也是2型糖尿病的并发症。研究发现小檗碱辅助治疗可降低糖尿病患者精神分裂的症状[94]。小檗碱在改善糖代谢、降低IR的同时,还能有效降低海马Tau、Aβ和Tau异常磷酸化表达,减少Aβ42生成,激活丝氨酸/苏氨酸p21激活激酶/磷酸肌醇依赖性蛋白激酶-1信号通路,改善大鼠海马神经元结构,抑制海马神经元凋亡[95-96];能通过抑制Rho/Rho相关蛋白激酶通路来提高糖尿病脑病大鼠基质金属蛋白酶水平,减轻糖尿病大鼠空间学习记忆能力受损、皮质神经元紊乱、神经元凋亡等认知功能障碍和病理损伤[97]。此外,小檗碱和二甲双胍联用能显著改善db/db转基因小鼠神经行为、脑海马区中神经细胞组织结构和细胞形态[98-99],与人参皂苷Rb1联用可降低应激下血浆皮质醇和促肾上腺皮质激素水平,减少慢性不可预测轻度应激诱导的抑郁样行为,上调BDNF蛋白表达,与绞股蓝皂苷或联苯芬酯低剂量联合给药可以改善2型糖尿病小鼠和db/db小鼠代谢异常[100]。
7.5 糖尿病勃起障碍
Adefegha等[101]发现小檗碱能改善糖尿病诱发勃起功能障碍模型阴茎组织的组织学结构,提高睾酮、促黄体生成素和促卵泡激素水平,降低催乳素、乙酰胆碱酯酶、血管紧张素-1转化酶水平。
7.6 糖尿病视网膜病变
Yin等[102]发现小檗碱可保护db/db转基因小鼠糖尿病视网膜病变模型的视网膜形态,降低糖原积累和TNF-α、IL-1β含量,下调动物视网膜中VEGF、VEGF受体2、缺氧诱导因子-1α和NF-κB、p65蛋白表达水平。
7.7 血管并发症
研究发现小檗碱可通过抑制CRP、IL-6和TNF-α水平,提高脂联素水平;通过抑制胸主动脉血管平滑肌细胞增殖和迁移,降低TGF-β1、IL-6、TNF-α水平,来改善2型糖尿病大鼠胸主动脉的病理状态,缓解肺动脉收缩减弱及对非内皮依赖性松弛反应增强的变化程度[103]。此外,小檗碱和双乙酰丙酮氧钒联用不仅降糖效果较单用更好,还能显著改善模型动物血管中膜结构、钙化水平及机体抗氧化应激能力,缓解血脂紊乱情况进而实现对血管损伤的保护作用[104]。
8 抗炎作用
炎症在健康和多种病理生理过程中发挥着关键作用。研究发现,小檗碱能通过抑制花生四烯酸或脂多糖诱导人单核细胞中TNF-α、单核细胞趋化蛋白-1、IL-6、IL-8和环氧合酶-2等因子水平,抑制NF-κB转位进入细胞核而显著减弱炎症反应[105];能抑制双链RNA诱导RAW264.7小鼠巨噬细胞中中性粒细胞数、前列腺素E2、FAS、白血病抑制因子、趋化因子和人巨噬细胞炎症蛋白2的产生以及钙的释放,抑制p38 MAPK、ERK1/2、IκBα和STAT3的磷酸化[106];能抑制脂多糖诱导内皮细胞、人脐静脉内皮细胞和人肺微血管内皮细胞中LC3II/LC3I值水平,促进p62表达缓解自噬过程[107];能抑制脂多糖诱导牛子宫内膜上皮炎症模型细胞中CRP、IL-1β、IL-6和TNF-α表达,调节Nrf2活性来发挥其抗炎活性[108]。不仅如此,在脂多糖诱导处理外周血单核细胞模型中,小檗碱能抑制和mRNA和蛋白表达以及其细胞因子分泌[109]。不仅如此,小檗碱吸入和注射2种方式均可抑制TLR4/ NF-κB和JAK2/STAT3信号通路,降低支气管肺泡灌洗液和血清中促炎因子,减轻脂多糖诱导急性呼吸窘迫综合征的病理过程[110]。
9 结语及展望
小檗碱在预防和治疗器官损伤及代谢性疾病方面具有良好的临床应用前景,见图2,且小檗碱也是许多中药的主要质控指标之一。基于此,研究者对小檗碱展现出极大兴趣,对小檗碱药理活性进行了广泛研究、总结和报道[111],申请了许多重要专利[112],并构建了一系列的衍生物进行新药筛选和研发[113]。但是,为了保证小檗碱的临床安全合理使用,仍然需要研究者对小檗碱面临的关键问题进行更加深入的研究。
9.1 完善标准,关注安全性问题
在西方国家,小檗碱提取物补充剂作为非处方药可以在药店和正规市场出售,不需要医疗处方和医疗监督。虽然研究报道小檗碱补充剂被认为是耐受性良好和安全的,但其临床指导原则的不完善有可能导致不良反应的发生。总的来说,食品和药品监管机构应该尽快建立严格的法规监管小檗碱作为膳食补充剂的生产和销售。
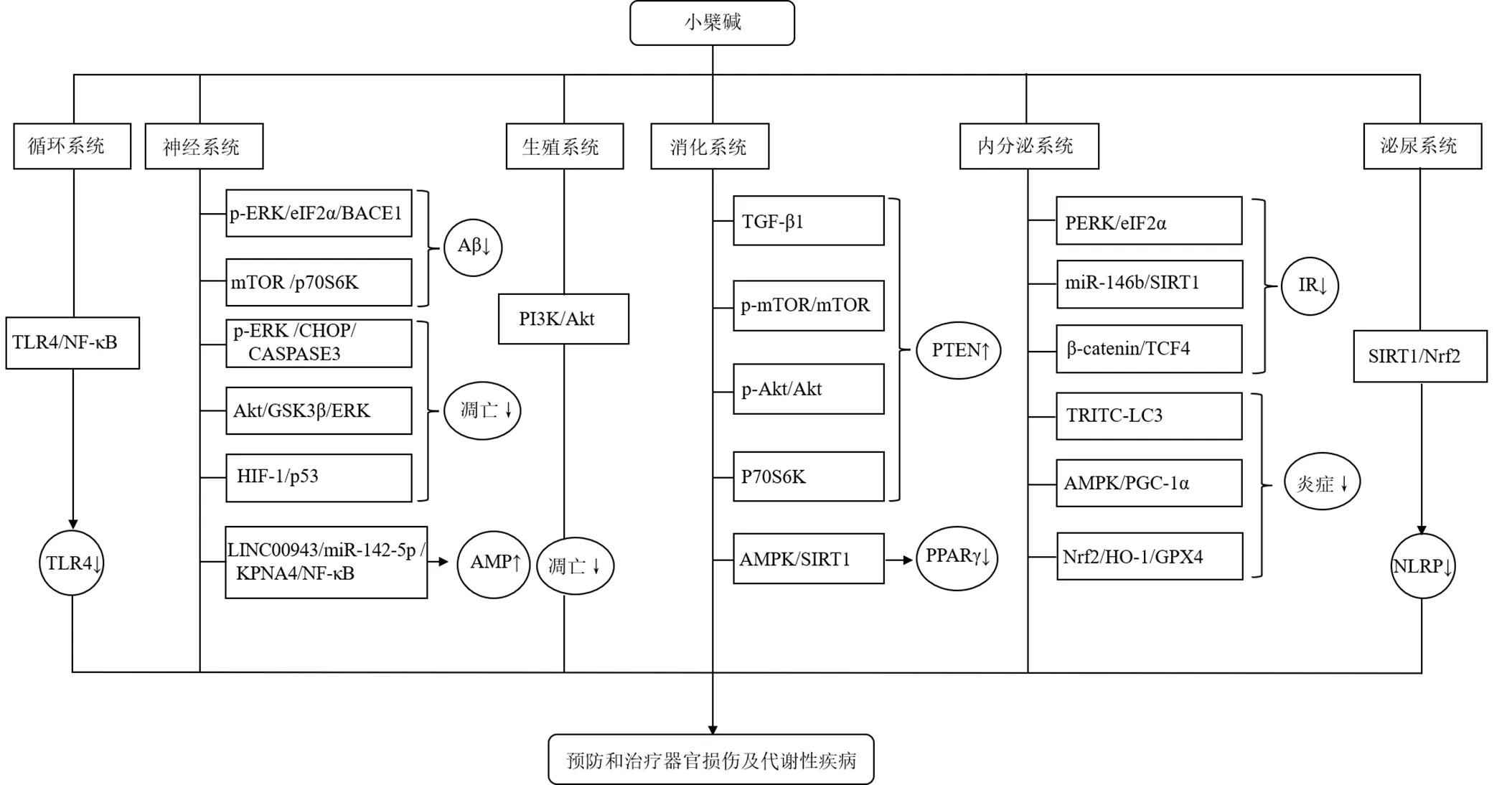
图2 小檗碱在脏器损伤保护和代谢性疾病等方面的相关信号通路图
9.2 改善小檗碱的生物利用度
小檗碱是一种重要的先导化合物,在药物开发中具有很大的优化潜力。小檗碱水溶性极低,口服吸收不良,口服生物利用度较差,是限制小檗碱临床应用的主要因素[114-115]。因此,研究者应该尽可能通过现代技术,尝试使用不同的剂型、给药系统和技术,如固体分散体、微胶囊、纳米粒、脂质体、和自纳米乳化等新型药物载体来进一步提高其生物利用度和治疗效果。此外,根据小檗碱在植物中的生长环境和相应的代谢产物[116],根据不同成分之间的协同作用,利用特定的原生植物代谢物来制备相应的靶向给药系统,以期改善小檗碱在新药研发中的瓶颈问题。
9.3 采用新技术明确小檗碱的作用靶点
小檗碱生物分子靶点不明确直接制约了小檗碱在制药领域的发展。非编码RNA转录本和编码mRNA上的非编码区域在生物活动中的作用被逐渐挖掘[117]。因此,建议研究者可以尝试针对RNA(包括编码区和非编码区)进行小檗碱相关疾病治疗性药物的开发。此外,肠道菌群的结构和功能与药物代谢产物、药效存在着密切的关系。因此,深入研究肠道菌群变化、探讨不同物种、不同状态下细菌对小檗碱应答的物种特异性和物种间功能共性[118-119]、生理病理状态(如糖尿病和健康状态下)对小檗碱吸收、代谢和药效的影响,有助于更深入地了解小檗碱在不同疾病治疗中的作用。
9.4 基于临床真实使用环境深入探讨小檗碱的意义
小檗碱在中药真实使用环境中的作用和意义仍没有被完全挖掘,如Feng等[120]发现小檗碱具有明显抑制CYP3A4酶的活性。而且小檗碱的这种活性主要是通过降低孕烷X受体水平来抑制3A4的转录水平、通过泛素途径来加速3A4的蛋白降解来实现的[121]。而中药中的许多有效物质,主要是毒性物质,都是通过CYP3A4代谢酶进行代谢,那么从CYA3A4的角度进行小檗碱配伍减毒的机制研究,对于阐释中药临床配伍使用是非常有益的。
利益冲突 所有作者均声明不存在利益冲突
[1] Ye Y, Liu X F, Wu N H,. Efficacy and safety of berberine alone for several metabolic disorders: A systematic review and meta-analysis of randomized clinical trials [J]., 2021, 12: 653887.
[2] 李璐, 王玉琳, 秦鸿宇, 等. 小檗碱调节肠肝轴治疗非酒精性脂肪肝病的研究进展 [J]. 中草药, 2021, 52(5): 1501-1509.
[3] Cai Y, Xin Q Q, Lu J J,. A new therapeutic candidate for cardiovascular diseases: Berberine [J]., 2021, 12: 631100.
[4] Akbar M, Shabbir A, Rehman K,. Neuroprotective potential of berberine in modulating Alzheimer’s disease via multiple signaling pathways [J]., 2021, 45(10): e13936.
[5] Ye C H, Liang Y B, Chen Y,. Berberine improves cognitive impairment by simultaneously impacting cerebral blood flow and β-amyloid accumulation in an APP/tau/PS1 mouse model of Alzheimer's disease [J]., 2021, 10(5): 1161.
[6] Wu Y, Chen Q J, Wen B,. Berberine reduces Aβ42deposition and tau hyperphosphorylationameliorating endoplasmic reticulum stress [J]., 2021, 12: 640758.
[7] Ghareeb D A, Khalil S, Hafez H S,. Berberine reduces neurotoxicity related to nonalcoholic steatohepatitis in rats [J]., 2015, 2015: 361847.
[8] 周景芬, 张开, 张林英, 等. 小檗碱通过上调miR-137抑制APP表达调控阿尔茨海默病的发生发展 [J]. 中国老年学杂志, 2021, 41(17): 3766-3770.
[9] Kneynsberg A, Combs B, Christensen K,. Axonal degeneration in tauopathies: Disease relevance and underlying mechanisms [J]., 2017, 11: 572.
[10] Wang Y Y, Yan Q, Huang Z T,. Ameliorating ribosylation-induced amyloid-β pathology by berberine via inhibiting mTOR/p70S6K signaling [J]., 2021, 79(2): 833-844.
[11] Liang Y B, Ye C H, Chen Y L,. Berberine improves behavioral and cognitive deficits in a mouse model of Alzheimer’s disease via regulation of β-amyloid production and endoplasmic reticulum stress [J]., 2021, 12(11): 1894-1904.
[12] 余伟, 丁立, 陈玉倩, 等. 小檗碱改善5XFAD小鼠抑郁和焦虑 [J]. 神经损伤与功能重建, 2021, 16(9): 497-501.
[13] Fang Y, Zhang J D, Zhu S W,. Berberine ameliorates ovariectomy-induced anxiety-like behaviors by enrichment in equol generating gut microbiota [J]., 2021, 165: 105439.
[14] 卢帅菲, 汪保英, 白明, 等. 小檗碱对抑郁小鼠脑海马组织能量代谢的影响 [J]. 中华中医药杂志, 2021, 36(6): 3580-3584.
[15] Zhan Y H, Han J Y, Xia J,. Berberine suppresses mice depression behaviors and promotes hippocampal neurons growth through regulating the miR-34b-5p/miR-470-5p/BDNF axis [J]., 2021, 17: 613-626.
[16] Xie P, Ren Z K, Lv J,. Berberine ameliorates oxygen-glucose deprivation/reperfusion-induced apoptosis by inhibiting endoplasmic reticulum stress and autophagy in PC12 cells [J]., 2020, 40(6): 1047-1056.
[17] Zhao Y N, Li Z K, Lu E R,. Berberine exerts neuroprotective activities against cerebral ischemia/ reperfusion injury through up-regulating PPAR-γ to suppress NF-κB-mediated pyroptosis [J]., 2021, 177: 22-30.
[18] Zhao L N, Li H M, Gao Q,. Berberine attenuates cerebral ischemia-reperfusion injury induced neuronal apoptosis by down-regulating the CNPY2 signaling pathway [J]., 2021, 12: 609693.
[19] 田悦, 王奇, 罗玉敏. 小檗碱介导的抗脑缺血凋亡通路研究进展 [J]. 实用药物与临床, 2021, 24(5): 461-465.
[20] Szalak R, Kukula-Koch W, Matysek M,. Effect of berberine isolated from barberry species by centrifugal partition chromatography on memory and the expression of parvalbumin in the mouse hippocampus proper [J]., 2021, 22(9): 4487.
[21] Ibrahim Fouad G, Ahmed K A. Neuroprotective potential of berberine against doxorubicin-induced toxicity in rat’s brain [J]., 2021, 46(12): 3247-3263.
[22] Shaker F H, El-Derany M O, Wahdan S A,. Berberine ameliorates doxorubicin-induced cognitive impairment (chemobrain) in rats [J]., 2021, 269: 119078.
[23] 梁自飞, 吴安石, 沈文振, 等. 基于NLRP3炎症小体信号通路探讨盐酸小檗碱对三叉神经痛大鼠的影响 [J]. 中国医院用药评价与分析, 2021, 21(6): 658-662.
[24] Li X Q, Su Y, Li N,. Berberine attenuates MPP+-induced neuronal injury by regulating LINC00943/mir-142-5p/KPNA4/NF-κB pathway in SK-N-SH cells [J]., 2021, 46(12): 3286-3300.
[25] Huang S X, Liu H Q, Lin Y W,. Berberine protects against NLRP3 inflammasome via ameliorating autophagic impairment in MPTP-induced Parkinson's disease model [J]., 2021, 11: 618787.
[26] Deng H, Ma Z G. Protective effects of berberine against MPTP-induced dopaminergic neuron injury through promoting autophagy in mice [J]., 2021, 12(18): 8366-8375.
[27] Wang L Z, Sheng W L, Tan Z S,. Treatment of Parkinson's disease in Zebrafish model with a berberine derivative capable of crossing blood brain barrier, targeting mitochondria, and convenient for bioimaging experiments [J]., 2021, 249: 109151.
[28] Wang Y, Tong Q, Ma S R,. Oral berberine improves brain dopa/dopamine levels to ameliorate Parkinson’s disease by regulating gut microbiota [J]., 2021, 6(1): 77.
[29] 郭莎莎, 李焱, 苏文革. 小檗碱抗动脉粥样硬化的作用及机制研究进展 [J]. 中华中医药学刊, 2021, 39(12): 46-51.
[30] Cao R Y, Zheng Y T, Zhang Y,. Berberine on the prevention and management of cardiometabolic disease: Clinical applications and mechanisms of action [J]., 2021, 49(7): 1645-1666.
[31] Chen C, Lin Q, Zhu X Y,. Pre-clinical evidence: Berberine as a promising cardioprotective candidate for myocardial ischemia/reperfusion injury, a systematic review, and meta-analysis [J]., 2021, 8: 646306.
[32] Chen H Q, Liu Q, Liu X Q,. Berberine attenuates septic cardiomyopathy by inhibiting TLR4/NF-κB signalling in rats [J]., 2021, 59(1): 121-128.
[33] 刘盛祥, 黄宇鹏, 杨国康, 等. 小檗碱对大鼠压力超负荷肥厚心肌组织miR-21-3p表达的影响及其干预心肌肥厚的作用机制 [J]. 疑难病杂志, 2021, 20(9): 879-882.
[34] 孙建利, 赵庆伟, 李朋朋, 等. 小檗碱对心肌缺血再灌注损伤大鼠线粒体自噬及对PINK1/Parkin通路的影响 [J]. 现代药物与临床, 2021, 36(4): 637-644.
[35] Abdulredha A, Abosaooda M, Al-Amran F,. Berberine protests the heart from ischemic reperfusion injury via interference with oxidative and inflammatory pathways [J]., 2021, 75(3): 174-179.
[36] Ding L L, Li S F, Wang F,. Berberine improves dietary-induced cardiac remodeling by upregulating Kruppel-like factor 4-dependent mitochondrial function [J]., 2021, 402(7): 795-803.
[37] Zhang H N, Dong J H, Lau C W,. Berberine reverses nitroglycerin tolerance through suppressing protein kinase C alpha activity in vascular smooth muscle cells [J]., 2022, 36(4): 633-643.
[38] Ma Y H, Yan G L, Guo J J,. Berberine prolongs mouse heart allograft survival by activating T cell apoptosis via the mitochondrial pathway [J]., 2021, 12: 616074.
[39] 王洋, 张建, 辛芳冉, 等. 基于网络药理学预测小檗碱治疗心房颤动作用靶点及通路 [J]. 创伤与急危重病医学, 2021, 9(3): 165-170.
[40] Ren S C, Ma X, Wang R L,. Preclinical evidence of berberine on non-alcoholic fatty liver disease: A systematic review and meta-analysis of animal studies [J]., 2021, 12: 742465.
[41] 郑吉敏, 李苹苹, 崔子瑾, 等. 小檗碱治疗代谢相关脂肪性肝病合并腹泻型肠易激综合征临床观察 [J]. 河北医药, 2021, 43(8): 1233-1235.
[42] Chen P, Li Y S, Xiao L. Berberine ameliorates nonalcoholic fatty liver disease by decreasing the liver lipid content via reversing the abnormal expression of MTTP and LDLR [J]., 2021, 22(4): 1109.
[43] 张东行, 郭彩娟, 方沐潮, 等. 小檗碱的降胆固醇作用及对CYP7A1、NPC1L1表达的影响 [J]. 中药材, 2021, 44(2): 416-421.
[44] Yu M Y, Alimujiang M, Hu L L,. Berberine alleviates lipid metabolism disorders via inhibition of mitochondrial complex I in gut and liver [J]., 2021, 17(7): 1693-1707.
[45] Wang Y Y, Tai Y L, Zhao D,. Berberine prevents disease progression of nonalcoholic steatohepatitis through modulating multiple pathways [J]., 2021, 10(2): 210.
[46] Li D, Yang C, Zhu J Z,. Berberine remodels adipose tissue to attenuate metabolic disorders by activating sirtuin 3 [J]., 2022, 43(5): 1285-1298.
[47] Xu Y X, Yu T H, Ma G J,. Berberine modulates deacetylation of PPARγ to promote adipose tissue remodeling and thermogenesis via AMPK/SIRT1 pathway [J]., 2021, 17(12): 3173-3187.
[48] Neyrinck A M, Sánchez C R, Rodriguez J,. Prebiotic effect of berberine and curcumin is associated with the improvement of obesity in mice [J]., 2021, 13(5): 1436.
[49] 朱虹燕, 王胜军, 户占飞, 等. 小檗碱预处理对大鼠肝缺血再灌注损伤的影响 [J]. 中国实验诊断学, 2021, 25(2): 259-263.
[50] Lu Z S, Lu F B, Wu L Y,. Berberine attenuates non-alcoholic steatohepatitis by regulating chemerin/CMKLR1 signalling pathway and Treg/Th17 ratio [J]., 2021, 394(2): 383-390.
[51] Shalkami A S, Hassanein E H M, Sayed A M,. Hepatoprotective effects of phytochemicals berberine and umbelliferone against methotrexate-induced hepatic intoxication: Experimental studies and in silico evidence [J]., 2021, 28(47): 67593-67607.
[52] Bhattacharjee K, Nath M, Choudhury Y. Berberine is as effective as the anti-obesity drug Orlistat in ameliorating betel-nut induced dyslipidemia and oxidative stress in mice [J]., 2021, 1(3): 100098.
[53] Cossiga V, Lembo V, Nigro C,. The combination of berberine, tocotrienols and coffee extracts improves metabolic profile and liver steatosis by the modulation of gut microbiota and hepatic miR-122 and miR-34a expression in mice [J]., 2021, 13(4): 1281.
[54] Mehrdoost S, Yaghmaei P, Jafary H,. The therapeutic effects of berberine plus sitagliptin in a rat model of fatty liver disease [J]., 2021, 24(4): 451-459.
[55] Xu J, Liu L Q, Gan L,. Berberine acts on C/EBPβ/lncRNA Gas5/miR-18a-5p loop to decrease the mitochondrial ROS generation in HK-2 cells [J]., 2021, 12: 675834.
[56] 梅昭, 蔡文丽, 郑铁骑, 等. 小檗碱调控NLRP3炎症小体对TGF-β1诱导HK-2细胞转分化的影响 [J]. 中国药师, 2021, 24(5): 829-834.
[57] Ibrahim Fouad G, Ahmed K A. The protective impact of berberine against doxorubicin-induced nephrotoxicity in rats [J]., 2021, 73: 101612.
[58] 孙琳琳, 郝明月, 盛明薇, 等. SIRT1/Nrf2信号通路在小檗碱减轻小鼠肾缺血再灌注损伤中的作用 [J]. 中华麻醉学杂志, 2021(5): 598-602.
[59] Li Q P, Huang Z W, Liu D F,. Effect of berberine on hyperuricemia and kidney injury: A network pharmacology analysis and experimental validation in a mouse model [J]., 2021, 15: 3241-3254.
[60] 高智宏. 盐酸小檗碱对小鼠UUO模型诱导的肾脏纤维化的保护作用及其相关机制研究 [D]. 太原: 山西医科大学, 2021.
[61] Wang P L, Guo W B, Huang G R,. Berberine-based heterogeneous linear supramolecules neutralized the acute nephrotoxicity of aristolochic acid by the self-assembly strategy [J]., 2021, 13(28): 32729-32742.
[62] Mirzaee F, Razmjouei P, Shahrahmani H,. The effect and safety of Berberine on polycystic ovary syndrome: A systematic review [J]., 2021, 41(5): 684-689.
[63] 杨丹丹, 桑敏. 枸橼酸氯米芬联合小檗碱对多囊卵巢综合征患者卵巢形态及血流动力学的影响 [J]. 中国医药, 2021, 16(7): 1070-1073.
[64] Wang Z, Nie K X, Su H,. Berberine improves ovulation and endometrial receptivity in polycystic ovary syndrome [J]., 2021, 91: 153654.
[65] Yu J, Ding C F, Hua Z J,. Protective effects of berberine in a rat model of polycystic ovary syndrome mediated via the PI3K/AKT pathway [J]., 2021, 47(5): 1789-1803.
[66] Dai J G, Huang X M, Zhang C,. Mechanisms of lipid metabolism promoted by berberine via peroxisome proliferator-activated receptor gamma duringmaturation of porcine oocytes [J]., 2021, 92(1): e13582.
[67] Tang M, Yuan D X, Liao P. Berberine improves intestinal barrier function and reduces inflammation, immunosuppression, and oxidative stress by regulating the NF-κB/MAPK signaling pathway in deoxynivalenol-challenged piglets [J]., 2021, 289: 117865.
[68] Hassanein E H M, Kamel E O, Ali F E M,. Berberine and/or zinc protect against methotrexate-induced intestinal damage: Role of GSK-3β/Nrf2 and JAK1/STAT-3 signaling pathways [J]., 2021, 281: 119754.
[69] Chao G Q, Wang Q Q, Ye F X,. Gene expression analysis in NSAID-induced rat small intestinal disease model with the intervention of berberine by the liquid chip technology [J]., 2021, 43(1): 32.
[70] Zhang D L, Jiang L, Wang M L,. Berberine inhibits intestinal epithelial barrier dysfunction in colon caused by peritoneal dialysis fluid by improving cell migration [J]., 2021, 264: 113206.
[71] Li B H, Niu S P, Geng H L,. Berberine attenuates neonatal sepsis in mice by inhibiting FOXA1 and NF-κB signal transduction via the induction of miR-132-3p [J]., 2021, 44(6): 2395-2406.
[72] 林洁锋. 盐酸小檗碱片治疗饮酒相关急性胃肠炎的临床研究 [J]. 医学理论与实践, 2021, 34(8): 1323-1325.
[73] 张俊波, 张亚光, 李泳锋. 盐酸小檗碱联合双歧杆菌四联活菌片治疗小儿感染性腹泻的临床效果 [J]. 河南医学研究, 2021, 30(23): 4356-4358.
[74] 王亚钦, 李旭飞. 盐酸小檗碱片联合美沙拉嗪治疗远端溃疡性结肠炎患者的效果评价 [J]. 河南医学研究, 2021, 30(23): 4371-4372.
[75] Jiang Y, Zhao L, Chen Q,. Exploring the mechanism of berberine intervention in ulcerative colitis from the perspective of inflammation and immunity based on systemic pharmacology [J]., 2021, 2021: 9970240.
[76] 熊亚立, 陈诚, 胡光明, 等. 小檗碱通过促进巨噬细胞M2极化缓解溃疡性结肠炎 [J]. 西北药学杂志, 2021, 36(3): 414-419.
[77] Dong C R, Yu J Q, Yang Y N,. Berberine, a potential prebiotic to indirectly promotegrowth through stimulating gut mucin secretion [J]., 2021, 139: 111595.
[78] Tong Y L, Liu L P, Wang R L,. Berberine attenuates chronic atrophic gastritis induced by MNNG and its potential mechanism [J]., 2021, 12: 644638.
[79] Tong Y L, Zhao X, Wang R L,. Therapeutic effect of berberine on chronic atrophic gastritis based on plasma and urine metabolisms [J]., 2021, 908: 174335.
[80] Khashayar A, Bahari Z, Elliyeh M,. Therapeutic effects of berberine in metabolic diseases and diabetes mellitus [J]., 2021, 31(3): 272-281.
[81] 郭志利, 姚克青, 姚玉英. 小檗碱对高脂加链脲佐菌素诱导的糖尿病大鼠的影响 [J]. 中医学报, 2021, 36(6): 1272-1277.
[82] 李阳, 高明松, 肖方喜, 等. 小檗碱对糖尿病大鼠主动脉病变及其PERK/eIF2α表达的作用 [J]. 药物分析杂志, 2021, 41(5): 826-831.
[83] Wang D K, Ren Y L, Sun W,. Berberine ameliorates glucose metabolism in diabetic rats through the alpha7 nicotinic acetylcholine receptor-related cholinergic anti-inflammatory pathway [J]., 2022, 88(1): 33-42.
[84] Di S, Han L, An X D,. In silico network pharmacology andanalysis of berberine-related mechanisms against type 2 diabetes mellitus and its complications [J]., 2021, 276: 114180.
[85] Sui M, Jiang X F, Sun H P,. Berberine ameliorates hepatic insulin resistance by regulating microRNA-146b/SIRT1 pathway [J]., 2021, 14: 2525-2537.
[86] Wang J, Wei L R, Liu Y L,. Berberine activates the β-catenin/TCF4 signaling pathway by down-regulating miR-106b to promote GLP-1 production by intestinal L cells [J]., 2021, 911: 174482.
[87] 杨晶晶, 沈宗姮, 何沛原, 等. 小檗碱通过下调miR-1290缓解高糖诱导的足细胞损伤研究 [J]. 中草药, 2021, 52(18): 5620-5625.
[88] 汪佳佳. 小檗碱对糖尿病肾病足细胞保护作用及对长链非编码RNA的初步调节作用研究 [D]. 合肥: 安徽医科大学, 2021.
[89] 鄢秀, 师朗, 陈景, 等. 小檗碱通过腺苷酸活化蛋白激酶、过氧化物酶体增殖物激活受体γ共激活因子-1α调节自噬减轻高糖环境下足细胞损伤的机制研究 [J]. 中国糖尿病杂志, 2021, 29(7): 528-534.
[90] 关锡梅, 解勇圣, 倪伟建, 等. Nrf2/HO-1/GPX4对高糖诱导足细胞铁死亡的影响及小檗碱的干预机制研究 [J]. 中国药理学通报, 2021, 37(3): 396-403.
[91] 杨欣妤, 黄明月, 时正媛, 等. 基于肠道L细胞葡萄糖转运体表达的小檗碱降糖机制研究 [J]. 中华中医药杂志, 2021, 36(4): 1926-1930.
[92] Cole L K, Zhang M, Chen L,. Supplemental berberine in a high-fat diet reduces adiposity and cardiac dysfunction in offspring of mouse dams with gestational diabetes mellitus [J]., 2021, 151(4): 892-901.
[93] Cole L K, Sparagna G C, Vandel M,. Berberine elevates cardiolipin in heart of offspring from mouse dams with high fat diet-induced gestational diabetes mellitus [J]., 2021, 11(1): 15770.
[94] Li M J, Liu Y, Qiu Y Y,. The effect of berberine adjunctive treatment on glycolipid metabolism in patients with schizophrenia: A randomized, double-blind, placebo-controlled clinical trial [J]., 2021, 300: 113899.
[95] Zhang J H, Zhang J F, Song J,. Effects of berberine on diabetes and cognitive impairment in an animal model: The mechanisms of action [J]., 2021, 49(6): 1399-1415.
[96] 王嘉雯, 吴宁华, 李寰, 等. 小檗碱激活PAK1/PDK1缓解胰岛素抵抗治疗糖尿病脑病的作用 [J]. 中国医院药学杂志, 2021, 41(8): 790-795.
[97] Tian L, Ri H, Qi J P,. Berberine elevates mitochondrial membrane potential and decreases reactive oxygen species by inhibiting the Rho/ROCK pathway in rats with diabetic encephalopathy [J]., 2021, 17: 1744806921996101.
[98] 曹月盈, 孟祥宝, 孙桂波, 等. 二甲双胍联合小檗碱对db/db小鼠糖尿病认知功能障碍的改善作用 [J]. 中国新药杂志, 2021, 30(8): 690-700.
[99] Zhang J H, Yang H Z, Su H,. Berberine and ginsenoside Rb1 ameliorate depression-like behavior in diabetic rats [J]., 2021, 49(5): 1195-1213.
[100]Zhang M, Li J, Guo X,. Co-administration of berberine/gypenosides/bifendate ameliorates metabolic disturbance but not memory impairment in type 2 diabetic mice [J]., 2021, 7(1): e06004.
[101]Adefegha S A, Oboh G, Dada F A,. Berberine modulates crucial erectogenic biomolecules and alters histological architecture in penile tissues of diabetic rats [J]., 2021, 53(7): e14074.
[102]Yin Z J, Tan R R, Yuan T M,. Berberine prevents diabetic retinopathy through inhibiting HIF-1α/VEGF/NF-κB pathway in db/db mice [J]., 2021, 76(4): 165-171.
[103]Wu Z G, Gu L, Si Y K,. Macrovascular protecting effects of berberine through anti-inflammation and intervention of BKCa in type 2 diabetes mellitus rats [J]., 2021, 21(7): 1270-1281.
[104]孙媛花, 李思宇, 边远, 等. 双乙酰丙酮氧钒和小檗碱联用对1型糖尿病大鼠影响的研究 [J]. 中国糖尿病杂志, 2021, 29(4): 300-305.
[105]Reddi K K, Li H X, Li W,. Berberine, A phytoalkaloid, inhibits inflammatory response induced by LPS through NF-kappaB pathway: Possible involvement of the IKKα [J]., 2021, 26(16): 4733.
[106]Kim H J, Kim Y J, Park W. Berberine modulates hyper-inflammation in mouse macrophages stimulated with polyinosinic-polycytidylic acid via calcium-CHOP/STAT pathway [J]., 2021, 11(1): 11298.
[107]Guo J P, Chen W, Bao B B,. Protective effect of berberine against LPS-induced endothelial cell injury via the JNK signaling pathway and autophagic mechanisms [J]., 2021, 12(1): 1324-1337.
[108]Fu K Q, Wang Z Z, Cao R F. Berberine attenuates the inflammatory response by activating the Keap1/Nrf2 signaling pathway in bovine endometrial epithelial cells [J]., 2021, 96: 107738.
[109]Ghorbani N, Sahebari M, Mahmoudi M,. Berberine inhibits the gene expression and production of proinflammatory cytokines by mononuclear cells in rheumatoid arthritis and healthy individuals [J]., 2021, 17(1): 113-121.
[110]Xu G H, Wan H Q, Yi L T,. Berberine administrated with different routes attenuates inhaled LPS-induced acute respiratory distress syndrome through TLR4/NF-κB and JAK2/STAT3 inhibition [J]., 2021, 908: 174349.
[111]Singh S, Pathak N, Fatima E,. Plant isoquinoline alkaloids: Advances in the chemistry and biology of berberine [J]., 2021, 226: 113839.
[112] Kong Y, Li L, Zhao L G,. A patent review of berberine and its derivatives with various pharmacological activities (2016-2020) [J]., 2022, 32(2): 211-223.
[113]Gaba S, Saini A, Singh G,. An insight into the medicinal attributes of berberine derivatives: A review [J]., 2021, 38: 116143.
[114]Feng X C, Wang K, Cao S J,. Pharmacokinetics and excretion of berberine and its nine metabolites in rats [J]., 2020, 11: 594852.
[115]Zhou H, Li W Y, Sun L,. A rapid LC-MS/MS method for simultaneous determination of berberine and irbesartan in rat plasma: Application to the drug-drug pharmacokinetic interaction study after oral administration in rats [J]., 2021, 35(9): e5144.
[116]Zhao J, Zhou T, Lu J Z,. Intra-herb interactions: Primary metabolites inextract improved the pharmacokinetics of oral berberine hydrochloride in mice [J]., 2021, 12: 675368.
[117]Satpathi S, Endoh T, Podbevšek P,. Transcriptome screening followed by integrated physicochemical and structural analyses for investigating RNA-mediated berberine activity [J]., 2021, 49(15): 8449-8461.
[118]Wolf P G, Devendran S, Doden H L,. Berberine alters gut microbial function through modulation of bile acids [J]., 2021, 21(1): 24.
[119]Du H, Xu T, Yi H,. Effect of gut microbiota on the metabolism of chemical constituents ofextract based on UHPLC-orbitrap-MS technique [J]., 2021, doi.org/10.1055/a-1617-9489.
[120]Feng P F, Zhao L, Guo F F,. The enhancement of cardiotoxicity that results from inhibiton of CYP 3A4 activity and hERG channel by berberine in combination with statins [J]., 2018, 293: 115-123.
[121]Feng P F, Zhu L X, Jie J,. The intracellular mechanism of berberine-induced inhibition of CYP3A4 activity [J]., 2021, 27(40):4179-418
Research progress on pharmacological action and related mechanism of berberine
CHEN Mei-lin, LI Zhi-qi, FAN Qi-qi, CAI Qiong, YANG Xing-yue, GU Yu-lin, GUO Si-min,LIN Rui-chao, ZHAO Chong-jun
Beijing Key Laboratory for Quality Evaluation of Chinese Materia Medica, School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
Berberine is a common active substance in many traditional Chinese medicine, which was widely used to treat the digestive system related diseases for thousands of years. Modern pharmacological studies showed that berberine also has significant pharmacological activities in preventing and protecting main organs damage, including nerve damage, heart damage, kidney damage, reproductive system damage, gastrointestinal tract damage, and metabolic disease, including Alzheimer’s disease, diabetes and related complications, as well as the inflammation. Therefore, based on the previous research, pharmacological activities of berberine in organ injury such as nerve damage and liver damage as well as the metabolic diseases were organized and summarized in this paper, and some suggestions were made to solve the urgent problems, in order to provide reference for safe use of berberine in clinic and the development of new drugs in the future.
berberine; organs damage; metabolic disease; inflammation; clinical safety; research and development of new drugs
R282.710.5
A
0253 - 2670(2022)18 - 5861 - 12
10.7501/j.issn.0253-2670.2022.18.029
2022-06-20
国家科技重大专项(2018ZX09735005);国家中医药管理局公益性中医药行业科研专项(201507004)
陈美琳(1999—),女,硕士研究生,研究方向为中药毒性评价。E-mail: erdongXD@163.com
赵崇军(1988—),男,助理研究员,研究方向为中药安全性评价及主要活性/毒性物质基础筛选。E-mail: 1014256537@qq.com
林瑞超(1954—),教授,研究方向为中药品质评价。E-mail: linrch307@sina.com
[责任编辑 崔艳丽]
