基于E2F5研究强心苷类化合物21-hydroxy-neriaside抑制胃癌细胞增殖的作用机制
2022-09-20植韵诗李晨阳
植韵诗,李晨阳,陈 铁*
基于E2F5研究强心苷类化合物21-hydroxy-neriaside抑制胃癌细胞增殖的作用机制
植韵诗1, 2,李晨阳1,陈 铁1, 2*
1. 深圳大学 医学部药学院,广东 深圳 518055 2. 深圳大学 广东省天然小分子创新药物工程技术研究中心,广东 深圳 518055
探究强心苷类单体化合物21-hydroxy-neriaside的抗胃癌作用及机制。采用CCK-8法考察21-hydroxy-neriaside对胃癌HGC27、MGC803、GT0603和GT112细胞增殖的影响;观察21-hydroxy-neriaside对HGC27、MGC803、GT0603和GT112细胞形态的影响;考察21-hydroxy-neriaside对HGC27、GT0603和GT112细胞集落形成的影响;采用RNA测序探究21-hydroxy-neriaside抑制胃癌细胞增殖的可能机制;采用qRT-PCR验证RNA测序结果;考察shRNA-E2F转录因子5(E2F transcription factor 5,E2F5)对GT112细胞E2F5表达的影响;采用Western blotting检测21-hydroxy-neriaside对HGC27、GT0603和GT112细胞E2F5、骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,c-Myc)、细胞周期D1(Cyclin D1)、细胞周期E2(Cyclin E2)和剪切型聚腺苷酸二磷酸核糖转移酶[cleaved poly(ADP-ribose)polymerase,cleaved PARP]蛋白表达的影响。CCK-8实验、形态学观察和细胞克隆形成实验均表明21-hydroxy-neriaside具有抑制胃癌细胞增殖的活性,与时间和药物浓度呈正相关。RNA测序、qRT-PCR和shRNA-E2F5慢病毒转染实验表明21-hydroxy-neriaside通过调控E2F5影响细胞周期通路,从而抑制肿瘤细胞生长。Western blotting实验结果表明21-hydroxy-neriaside组细胞中E2F5、c-Myc、Cyclin D1和Cyclin E2蛋白表达水平均明显降低(<0.05、0.01、0.001),cleaved PARP蛋白表达水平显著升高(<0.001)。21-hydroxy-neriaside具有抗胃癌活性,能够通过下调E2F5表达来影响细胞周期通路相关蛋白,抑制胃癌细胞生长,从而促使肿瘤细胞凋亡。
21-hydroxy-neriaside;强心苷类化合物;胃癌细胞;E2F转录因子5;细胞凋亡
国际癌症研究机构(International Agency for Research on Cancer,IARC)2020年报道,胃癌是世界范围内最常见的恶性肿瘤之一,其发病率和死亡率分别占所有肿瘤发病率和死亡率的第5位和第4位[1]。胃癌具有发病率高、预后差、细胞和分子异质性等特点,是严重危害人类健康的疾病之一[2]。我国属于胃癌的高发区,胃癌患病率和死亡率超过世界平均水平的2倍,故胃癌是我国癌症研究和防治的重点[3]。
当前我国对于胃癌的治疗主要为手术切除和化疗[4],但对于中晚期胃癌,化疗发挥更为重要的作用。因此,发现新型、高效且低毒的化疗药物用以延长晚期胃癌患者的生存期、提高患者的生存质量和减轻患者的经济负担势在必行。长春新碱、紫杉醇等新型化疗药物均直接或间接来源于天然产物,具有较好的抗肿瘤作用。近年研究发现,天然来源的强心苷类化合物具有一定的抗癌作用,能够抑制恶性细胞增殖[5],使乳腺癌细胞形态发生改变,并促进癌细胞凋亡[6-10]。21-hydroxy-neriaside(图1)是从夹竹桃L.叶中提取的强心苷类单体化合物,外观为白色无定形粉末,其分子式为C30H46O8,相对分子质量为534.68。本课题组前期研究发现,21-hydroxy-neriaside抗癌活性强,具有良好的药物研究和临床应用价值[11]。目前尚未有关于21-hydroxy-neriaside在抗胃癌方面的报道。本研究采用CCK-8法、细胞克隆形成实验、RNA测序、qRT-PCR、shRNA-E2F5慢病毒转染和Western blotting技术,初步探究21-hydroxy-neriaside抑制胃癌细胞增殖的机制,进一步明确强心苷类化合物的抗癌机制,为强心苷类化合物抗肿瘤的深入研究提供依据。
1 材料
1.1 细胞
胃癌HGC27、MGC803细胞购自江苏凯基生物技术股份有限公司;原位胃癌GT0603、GT112细胞由本课题组分离培养[12]。
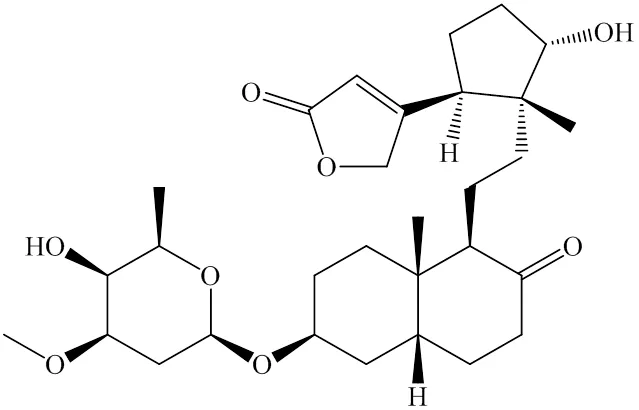
图1 21-hydroxy-neriaside的化学结构
1.2 药品与试剂
21-hydroxy-neriaside(质量分数为90%)为天津中医药大学姜苗苗教授惠赠;胎牛血清(批号2176404)、PBS(批号8120015)购自美国Gibco公司;胰酶(批号J210006)、青链霉素(批号J210031)、DMEM培养基(批号AG29871451)购自上海HyClone公司;发光A液和B液(批号1735602)购自美国Millpore公司;蛋白酶抑制剂(批号HY-K0010)、磷酸酶抑制剂(批号HY-K0021)、Marker(批号01022134)购自美国Thermo Fisher Scientific公司;CCK-8凋亡试剂盒(批号BJ05203090)购自北京Bioss公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号SHBH2446V)购自美国Sigma公司;PVDF膜(批号R7KA8936A)购自美国Immobilon-PSQ公司;E2F转录因子5(E2F transcription factor 5,E2F5)抗体(批号9)、骨髓细胞瘤病毒癌基因(cellular-myelocytomatosis viral oncogene,c-Myc)抗体(批号12)、细胞周期E2(Cyclin E2)抗体(批号7)、细胞周期D1(Cyclin D1)抗体(批号4)、剪切型聚腺苷酸二磷酸核糖转移酶[cleaved poly(ADP-ribose)polymerase,cleaved PARP]抗体(批号15)、β-actin抗体(批号32)、脱脂奶粉(批号17)、HPR标记的羊抗兔IgG抗体(批号24)、HPR标记的羊抗鼠IgG抗体(批号31)购自美国CST公司;RNA提取试剂盒(批号DP315-R)购自北京天根生化科技公司;荧光定量PCR试剂盒(批号RR820A)购自大连宝生物工程公司;RIPA细胞裂解液(批号MAO152-Jan-18H)购自北京索莱宝科技有限公司;TRIzol试剂盒(批号251808)购自美国Invitrogen公司。
1.3 仪器
AC2-4S8-NS型二级生物安全柜、371型细胞CO2培养箱、NanoDrop 2000c型超微量分光光度计(美国Thermo Fisher Scientific公司);AXIO-Axiocam 503 color型倒置显微镜(德国Carl Zeiss公司);6000 EXP TOUCH型凝胶成像分析系统(上海勤翔科学仪器公司);EPOCH2NS型吸收光酶标仪(美国Bio Tek公司);Mini-PROTEAN Tetra Cell小型垂直电泳仪、T100型PCR仪(美国Bio-Rad公司)。
2 方法
2.1 细胞培养
HGC27、MGC803、GT0603和GT112细胞用含100 U/mL双抗(青霉素和链霉素)、10%胎牛血清的DMEM培养基,于37 ℃、5% CO2培养箱中培养。
2.2 CCK-8法测定细胞存活率
取处于对数生长期的HGC27、MGC803、GT0603和GT112细胞,消化离心后调整细胞密度为1×105个/mL,取100 μL细胞悬液接种到96孔板中,培养24 h至细胞贴壁。分别加入终浓度为4、8、12、16、20 μmol/L的21-hydroxy-neriaside,每个浓度设置3个复孔,对照组加入等体积DMSO。分别培养24、48、72 h后,每孔加入10 μL CCK-8试剂,培养1~2 h后取出,振荡1 min后,采用酶标仪测定450 nm处的吸光度()值。
2.3 形态学观察
按“2.2”项下方法处理细胞,分别加入终浓度为8、16、20 μmol/L的21-hydroxy-neriaside,对照组加入等体积DMSO,培养48 h后,于倒置显微镜下观察细胞形态学变化并拍照记录。
2.4 细胞克隆形成实验
取处于对数生长期的HGC27、GT0603和GT112细胞,调整细胞密度为500个/mL,每孔加入1 mL细胞悬液至12孔板中,培养48 h后,分别加入终浓度为16、20 μmol/L的21-hydroxy-neriaside,对照组加入等体积DMSO。培养48 h后更换为新鲜预温不含药物的培养基,继续培养1~2周后弃去培养基,每孔用PBS清洗2次后,无水甲醇固定15 min,弃无水甲醇,每孔加入0.5 mL结晶紫染液染色20 min,洗净多余染料后室温干燥并拍照。计数每孔中染色的集落数,以DMSO处理的肿瘤细胞为对照,计算肿瘤细胞集落形成抑制率。
集落形成抑制率=(对照组集落数-给药组集落数)/对照组集落数
2.5 RNA测序
取处于对数生长期的HGC27、MGC803、GT0603和GT112细胞,调整细胞密度为1.25×105个/mL,加入4 mL细胞悬液至6 cm2培养皿中,培养24 h至细胞贴壁。加入终浓度为16 μmol/L的21-hydroxy-neriaside,对照组加入等体积DMSO。培养48 h后,弃去培养基,加入1 mL的TRIzol试剂,反复吹打均匀后转移EP管中,对提取的RNA样本进行Illumina建库测序后,得到原始数据及clean-reads,将原始基因表达量进行标准化。采用R语言包对差异表达基因进行分析,通过Metascape数据平台对差异表达基因进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
2.6 cDNA合成及qRT-PCR验证
“2.5”项下提取出的总RNA满足质检条件后,根据常规反应体系配制反应混合液置于PCR仪中反转录得到cDNA。取足够实验使用体积的对照组及给药组cDNA,采用SYBR Green实时荧光定量PCR试剂盒配制PCR反应液(β-actin作为内参),根据差异基因上下调表达情况选择候选基因,设计引物进行扩增,采用2−ΔΔCt方法计算趋势表达基因mRNA相对表达量,重复3次。通过Primer Bank查询引物序列并合成引物(表1)。
2.7 shRNA-E2F5慢病毒转染
取处于对数生长期的GT112细胞,调整细胞密度为1×105个/mL,取2 mL细胞悬液接种到6孔板中,培养至细胞贴壁,对其进行慢病毒转染(shRNA-序列为GGAGGTACCCATTCCAGAAAT)。转染48 h后,于荧光显微镜下观察E2F5表达情况,并统计转染效率。
表1 引物序列
Table 1 Primer sequences
基因序列 (5’-3’)大小/bp E2F5F: TTCAGCAGGATCTATTAGTGGAG191 R: AGATAACAGTCCCAAGTTTCCAT191 β-actinF: TGTCACCAACTGGGACGATA165 R: GGGGTGTTGAAGGTCTCAAA165
2.8 Western blotting检测E2F5、c-Myc、Cyclin D1、Cyclin E2和cleaved PARP蛋白表达
取处于对数生长期的HGC27、GT0603和GT112细胞,调整细胞密度为1.25×105个/mL,加入4 mL细胞悬液至6 cm2培养皿中,培养24 h后,加入终浓度为16 μmol/L的21-hydroxy-neriaside,对照组加入等体积DMSO,培养48 h,收集细胞,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液,冰上裂解30 min,4 ℃、12 000 r/min离心10 min,取上清液。采用BCA蛋白定量试剂盒测定蛋白浓度,加入6×Loading buffer,100 ℃加热10 min使蛋白变性。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭1 h;分别加入相应抗体,4 ℃孵育过夜;PBST洗涤3次,每次5 min;加入二抗,室温孵育1 h,PBST洗涤3次,每次5 min,显影。
2.9 统计学方法
采用Graphpad Prism 9、Image J和SPSS 16.0软件进行统计分析,每个实验至少重复3次,所有统计数据以表示,组间比较采用检验。
3 结果
3.1 21-hydroxy-neriaside对HGC27、MGC803、GT0603和GT112细胞增殖的影响
如图2所示,随着21-hydroxy-neriaside浓度的增加,其对HGC27、MGC803、GT0603和GT112细胞存活率的抑制作用逐渐增强。如表2所示,随着作用时间的积累,21-hydroxy-neriaside对GT0603和MGC803细胞的半数抑制浓度(half inhibitory concentration,IC50)呈下降趋势,药物的抑制作用增强;而21-hydroxy-neriaside对GT112和HGC27细胞的IC50在药物处理72 h后略微上升,但仍低于药物处理24 h的IC50,说明21-hydroxy-neriaside对其增殖有一定的抑制作用。21-hydroxy-neriaside对GT112、GT0603和HGC27细胞的增殖抑制作用较强,故以上述3个细胞株进行后续实验,后续实验21-hydroxy-neriaside的浓度设置为16、20 μmol/L,处理时间为48 h。
3.2 21-hydroxy-neriaside对HGC27、MGC803、GT0603和GT112细胞形态的影响
如图3所示,对照组细胞生长旺盛,伸展性良好,细胞间排列紧密,形状基本上是不规则的多边形(MGC803细胞则相对规则),胞体饱满,漂浮细胞较少;各给药组细胞随药物浓度增加,细胞的增殖速度减慢,胞间的缝隙明显变大,胞体逐渐萎缩变圆,从培养皿脱落并漂浮于培养基表面,体积和密度显著降低而失去正常细胞形态。21-hydroxy-neriaside对4种胃癌细胞的生长均有抑制作用,其结果与CCK-8实验基本相符。
3.3 21-hydroxy-neriaside对HGC27、GT0603和GT112细胞集落形成的影响
胃癌细胞经16、20 μmol/L的21-hydroxy-neriaside处理48 h后,观察细胞克隆数目和克隆体积大小,如图4所示,各给药组细胞克隆数显著减少(<0.01、0.001),且呈剂量相关性,表明21- hydroxy-neriaside对3种胃癌细胞的增殖均有抑制作用,与CCK-8实验结果基本相符。
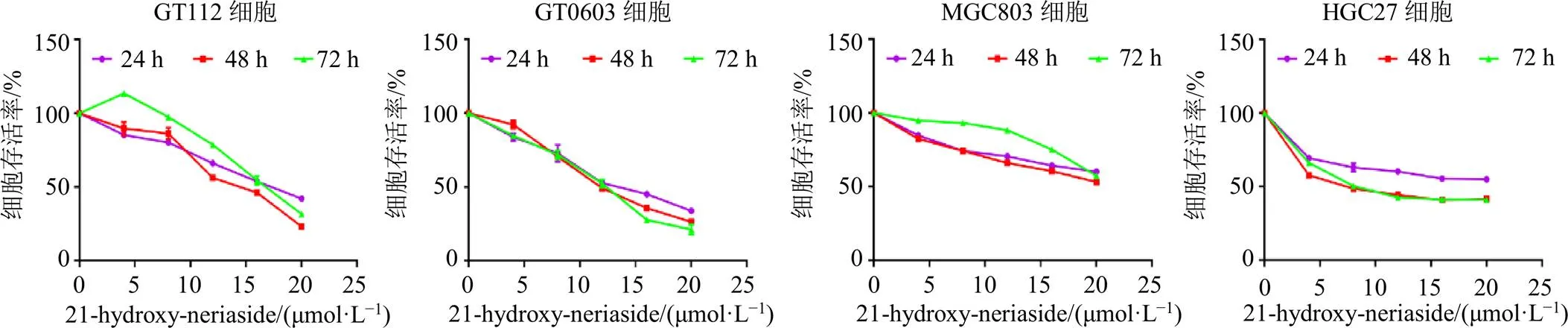
图2 21-hydroxy-neriaside对HGC27、MGC803、GT0603和GT112细胞存活率的影响(, n = 3)
表2 各细胞系在21-hydroxy-neriaside处理下不同时间点的IC50
Table 2 IC50 of each cell line at different time points under the treatment of 21-hydroxy-neriaside
细胞系t/hIC50/(μmol·L−1)细胞系t/hIC50/(μmol·L−1) GT112细胞2417.38±0.01MGC803细胞2434.06±0.02 4813.93±0.01 4824.59±0.01 7216.64±0.01 7222.44±0.01 GT0603细胞2413.53±0.01HGC27细胞2431.34±0.04 4812.07±0.01 487.60±0.02 7211.50±0.01 729.40±0.02

图3 21-hydroxy-neriaside对HGC27、MGC803、GT0603和GT112细胞形态的影响
3.4 RNA测序探究21-hydroxy-neriaside抑制胃癌细胞增殖的可能机制
如图5所示,对GT112、GT0606、HGC27细胞的给药组和对照组进行差异分析,分别筛选出483、825、361个基因,3个细胞的共有差异基因为44个。
经过筛查44个差异基因发现,3个胃癌细胞株的共同下调基因有36个,共同上调基因有1个。为了探究21-hydroxy-neriaside抑制胃癌细胞增殖所涉及到的细胞通路调控过程,对上述44个共有差异基因进行KEGG通路富集分析,将相关基因与KEGG数据库进行比对(图6),在20条差异基因富集的通路中,富集显著的通路有细胞周期、-谷氨酰胺和-谷氨酸代谢、细胞衰老、转化生长因子β信号通路等。其中,细胞周期通路中有4个重要差异基因[、细胞周期蛋白依赖性激酶抑制剂1A(cyclin dependent kinase inhibitor 1A,)、细胞分裂后期促进复合物亚基13(anaphase promoting complex subunit 13,)、透明质酸结合蛋白4(hyaluronan binding protein 4,)]在表达量上发生了显著变化。
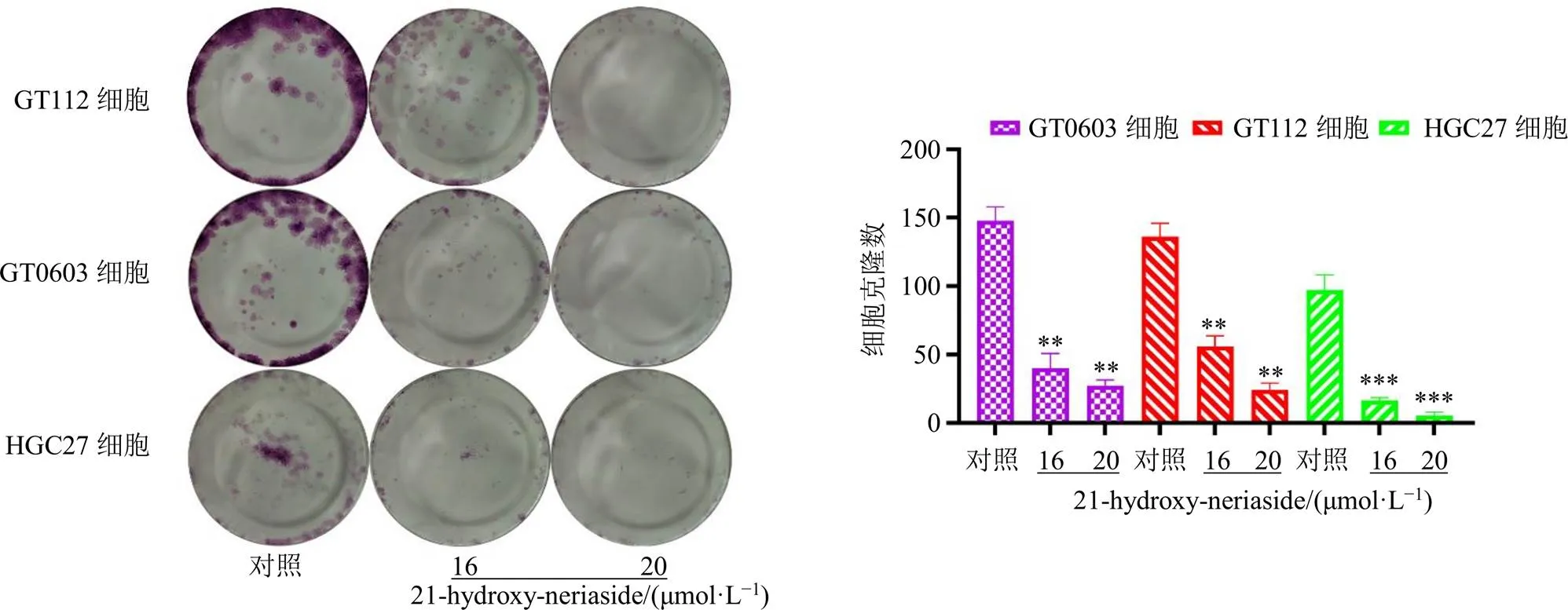
与对照组比较:**P<0.01 ***P<0.001
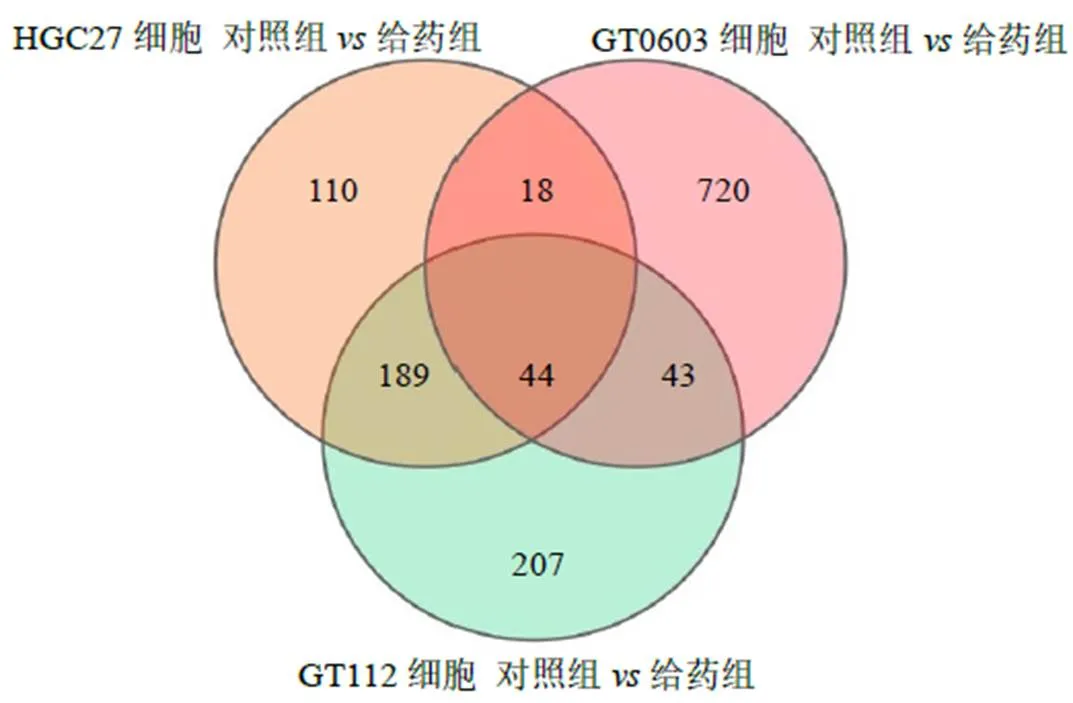
图5 21-hydroxy-neriaside处理后HGC27、GT0603和GT112细胞的差异基因Venn图
3.5 qRT-PCR验证RNA测序结果
根据RNA测序的结果,4个重要差异基因中只有、、基因共同下调。和下调促进癌细胞生长;而下调抑制癌细胞增殖,据此本研究选择作为研究对象,采用qRT-PCR技术对重要差异基因的表达情况进行检测,验证21-hydroxy-neriaside调控肿瘤细胞增殖的机制。如图7所示,经21-hydroxy-neriaside处理后,HGC27、GT0603和GT112细胞中基因表达水平均显著降低(<0.01、0.001),与RNA测序结果一致。
3.6 shRNA-E2F5对GT112细胞E2F5表达的影响
如图8所示,shRNA-E2F5慢病毒转染效率大于95%,且成功转染E2F5后,细胞中E2F5蛋白表达显著下调(<0.001),能够抑制癌细胞增殖,达到杀伤胃癌细胞的作用。
3.7 Western blotting检测21-hydroxy-neriaside对HGC27、GT0603和GT112细胞E2F5、c-Myc、Cyclin D1、Cyclin E2和cleaved PARP蛋白表达的影响
KEGG分析显著富集的通路有细胞周期,细胞周期信号通路中、、为E2F5的下游基因。如图9所示,与对照组比较,给药组c-Myc、Cyclin D1、Cyclin E2、E2F5的蛋白表达水平均明显下降(<0.05、0.01、0.001),cleaved PARP蛋白表达水平显著升高(<0.001)。表明21-hydroxy-neriaside通过调控细胞周期,促进胃癌细胞凋亡。
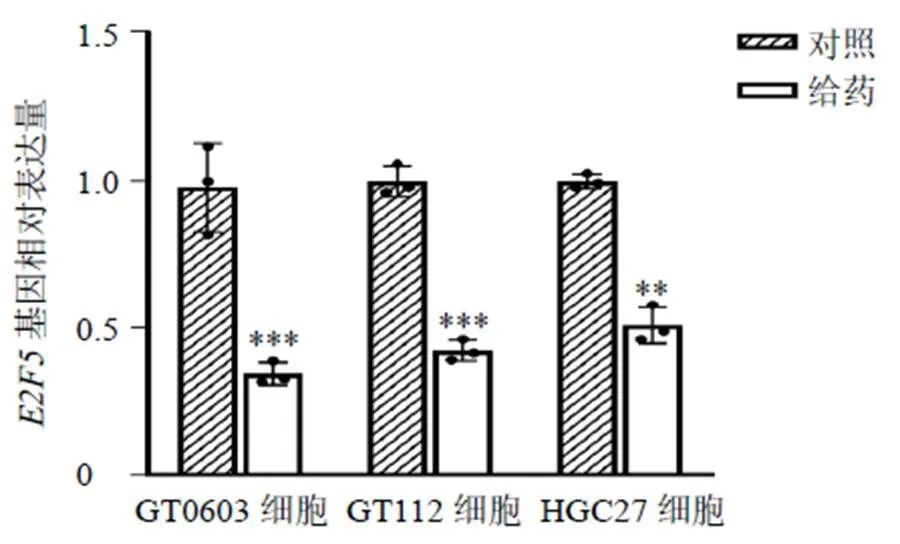
与对照组比较:**P<0.01 ***P<0.001
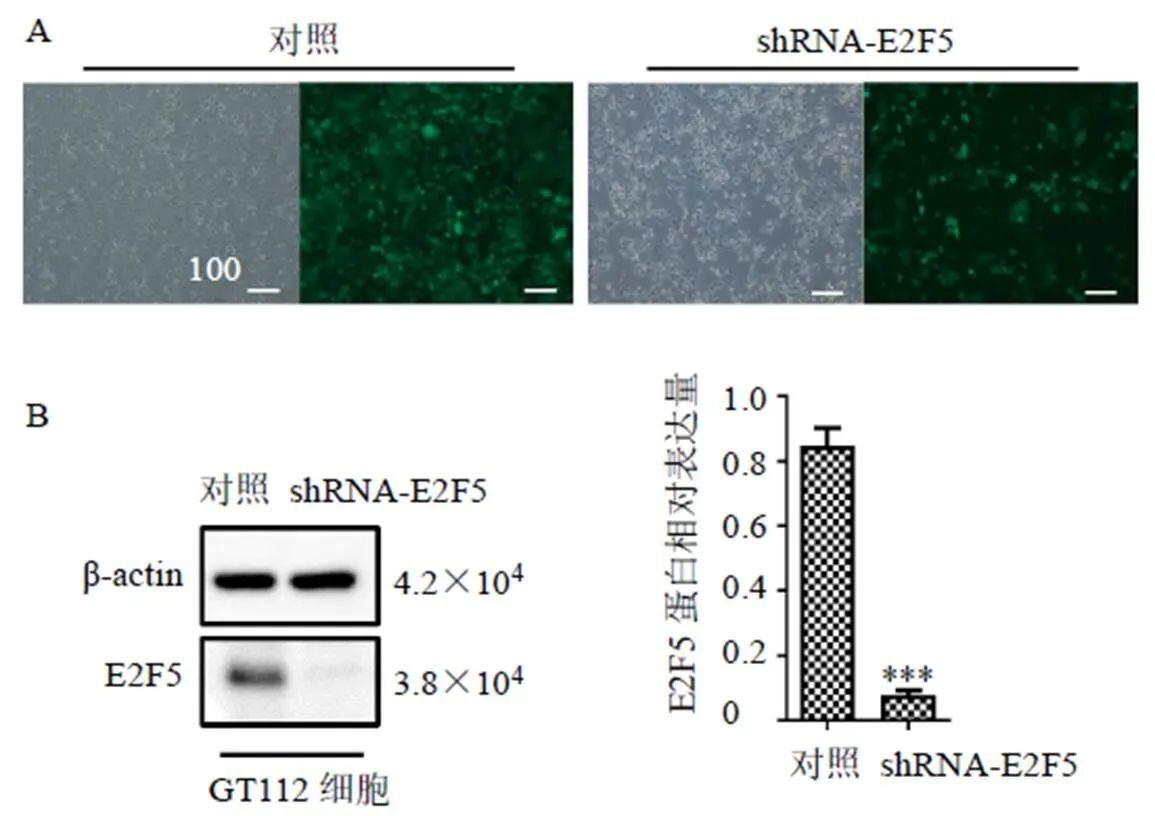
A-免疫荧光检测慢病毒转染后GT112细胞中E2F5蛋白表达 B-Western blotting检测慢病毒转染后GT112细胞中E2F5蛋白表达 与对照组比较:***P<0.001
4 讨论
当前胃癌的发病率仍然偏高,且病死率一直居高不下。近年来,化疗药取得了长足的进步,然而在胃癌治疗中,化疗药选择有限,而且在长期的药物治疗中,还存在细胞耐药性的问题。因此开发潜在有效的抗肿瘤药物并明确其抗肿瘤机制将有效改善目前胃癌治疗的困境。本研究通过CCK-8法、形态学观察和细胞克隆形成实验初步证实21-hydroxy-neriaside的体外抗肿瘤作用。RNA测序表明,细胞周期通路上有4个重要差异基因(、、、)的表达发生了显著变化,然而,只有、、基因明显下调。
E2F5是一种重要的转录激活因子,其结合位点存在于许多基因的启动子中,其下游转录基因与细胞增殖密切相关,能够调控细胞周期。研究表明,在前列腺肿瘤细胞和肝肿瘤细胞中,E2F5的表达上调[13-14]。CDKN1A是一种抑癌基因,参与由DNA损伤引起的p53/TP53介导的细胞增殖抑制,并抑制细胞周期蛋白依赖性激酶(cyclin-dependent kinases,CDKs)活性,从而阻断关键的细胞周期蛋白依赖性激酶底物磷酸化,进而抑制细胞周期。在胃癌细胞中,CDKN1A表达水平较低[15]。ANAPC13是细胞分裂后期促进复合物/环体(anaphase-promoting complex/cyclosome,APC/C)的组成部分,同时也是一种调节细胞周期的E3泛素连接酶(E3 ubiquitin ligase mind bomb 2,MIB2),可以控制有丝分裂和调控细胞周期G1期。APC/C复合物主要通过细胞分裂周期蛋白20(cell division cycle 20,CDC20)和E-钙黏蛋白基因来协同调控细胞周期,二者的失调会引起细胞染色体的异常变化或癌症的发生[16-17]。
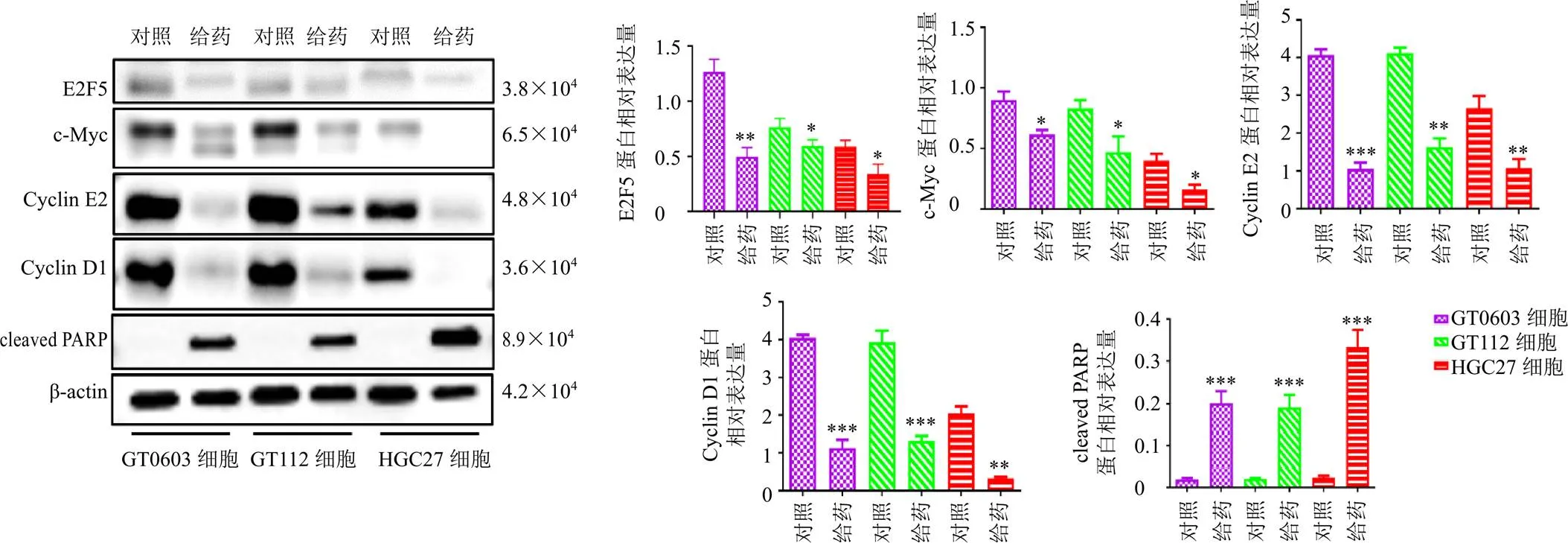
与对照组比较:*P<0.05 **P<0.01 ***P<0.001
CDKN1A和ANAPC13的正常表达不利于肿瘤细胞生长,其表达下调则利于癌细胞生长;而E2F5的正常表达利于肿瘤细胞的生长,其表达下调则可抑制癌细胞的增殖。qRT-PCR和shRNA-E2F5慢病毒转染表实验表明,经21-hydroxy-neriaside处理后,胃癌细胞E2F5表达下调,与RNA测序的结果一致,可以证明RNA测序结果的正确性。研究表明,c-Myc为E2F5调控的下游蛋白,Cyclin E2、Cyclin D1为c-Myc调控的下游蛋白,能够调控细胞周期,并促进细胞增殖[18-21]。Western blotting实验结果表明,经21-hydroxy-neriaside处理后,GT112、GT0603和HGC27细胞中c-Myc、Cyclin E2和Cyclin D1蛋白表达水平降低,与RNA测序结果一致;cleaved PARP蛋白表达水平升高,表明21-hydroxy-neriaside可诱导胃癌细胞凋亡。
综上,21-hydroxy-neriaside可能通过调控E2F5来影响细胞周期通路,从而诱导肿瘤细胞凋亡。
利益冲突 所有作者均声明不存在利益冲突
[1] Sung H, Ferlay J, Siegel R L,. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2021, 71(3): 209-249.
[2] Smyth E C, Nilsson M, Grabsch H I,. Gastric cancer [J]., 2020, 396(10251): 635-648.
[3] Zhang T C, Chen H, Yin X L,. Changing trends of disease burden of gastric cancer in China from 1990 to 2019 and its predictions: Findings from Global Burden of Disease Study [J]., 2021, 33(1): 11-26.
[4] Wang F H, Shen L, Li J,. The Chinese Society of Clinical Oncology (CSCO): Clinical guidelines for the diagnosis and treatment of gastric cancer [J]., 2019, 39(1): 10.
[5] Newman R A, Yang P Y, Pawlus A D,. Cardiac glycosides as novel cancer therapeutic agents [J]., 2008, 8(1): 36-49.
[6] Shiratori O. Growth inhibitory effect of cardiac glycosides and aglycones on neoplastic cells:andstudies [J]., 1967, 58(6): 521-528.
[7] Haux J. Digitoxin is a potential anticancer agent for several types of cancer [J]., 1999, 53(6): 543-548.
[8] Haux J, Klepp O, Spigset O,. Digitoxin medication and cancer; case control and internal dose-response studies [J]., 2001, 1: 11.
[9] Haux J, Lam M, Marthinsen A,. Digitoxin, in nontoxic concentrations, induces apoptotic cell death in Jurkat T cells[J]., 1999, 31: 14-20.
[10] Pathak S, Multani A S, Narayan S,. Anvirzel, an extract of, induces cell death in human but not murine cancer cells [J]., 2000, 11(6): 455-463.
[11] Cao Y L, Zhang M H, Lu Y F,. Cardenolides from the leaves of[J]., 2018, 127: 293-300.
[12] Chen T, Yang K, Yu J H,. Identification and expansion of cancer stem cells in tumor tissues and peripheral blood derived from gastric adenocarcinoma patients [J]., 2012, 22(1): 248-258.
[13] Zhao J, Wu X Y, Ling X H,. Analysis of genetic aberrations on chromosomal region 8q21-24 identifies E2F5 as an oncogene with copy number gain in prostate cancer [J]., 2013, 30(1): 465.
[14] Zou C C, Li Y G, Cao Y Y,. Up-regulated microRNA-181a induces carcinogenesis in hepatitis B virus-related hepatocellular carcinoma by targeting E2F5 [J]., 2014, 14: 97.
[15] Sun C, Ma P, Wang Y,. KLF15 inhibits cell proliferation in gastric cancer cells via up-regulating CDKN1A/p21 and CDKN1C/p57 expression [J]., 2017, 62(6): 1518-1526.
[16] Barford D. Structure, function and mechanism of the anaphase promoting complex (APC/C) [J]., 2011, 44(2): 153-190.
[17] 李淑晶, 毕海连, 伍会健. 泛素连接酶APC/C和SCF复合物与肿瘤的关系 [J]. 北京大学学报: 医学版, 2010, 42(2): 243-245.
[18] Ren B, Cam H, Takahashi Y,. E2F integrates cell cycle progression with DNA repair, replication, and G(2)/M checkpoints [J]., 2002, 16(2): 245-256.
[19] Dimova D K, Dyson N J. The E2F transcriptional network: Old acquaintances with new faces [J]., 2005, 24(17): 2810-2826.
[20] Bretones G, Delgado M D, León J. Myc and cell cycle control [J]., 2015, 1849(5): 506-516.
[21] Vermeulen K, Berneman Z N, Van Bockstaele D R. Cell cycle and apoptosis [J]., 2003, 36(3): 165-175.
Mechanisms of cardiac glycoside monomeric compound 21-hydroxy-neriaside on inhibiting proliferation of gastric cancer cells based on E2F5
ZHI Yun-shi1, 2, LI Chen-yang1, CHEN Tie1, 2
1. School of Pharmaceutical Sciences, Health Science Center, Shenzhen University, Shenzhen 518055, China 2. Guangdong Natural Small Molecule Innovative Drug Engineering Technology Research Center, Shenzhen University, Shenzhen 518055, China
To explore anti-tumor effect and mechanisms of cardiac glycoside monomeric compound 21-hydroxy-neriaside against gastric cancer.The effect of 21-hydroxy-neriaside on proliferation of gastric cancer HGC27, MGC803, GT0603 and GT112 cells was investigated by CCK-8 method; The effect of 21-hydroxy-neriaside on morphology of HGC27, MGC803, GT0603 and GT112 cells was observed; The effect of 21-hydroxy-neriaside on colony formation of HGC27, GT0603 and GT112 cells was observed; RNA sequencing was used to explore the possible mechanism of 21-hydroxy-neriaside inhibiting gastric cancer cell proliferation; qRT-PCR was used to verify RNA sequencing results; The effect of shRNA-E2F transcription factor 5 (E2F5) on E2F5 expression of GT112 cells was investigated; Western blotting was used to detect the effect of 21-hydroxy-neriaside on E2F5, cellular-myelocytomatosis viral oncogene (c-Myc), cell cycle D1 (Cyclin D1), cell cycle E2 (Cyclin E2) and cleaved poly(ADP-ribose) polymerase (cleaved PARP) protein expressions in HGC27, GT0603 and GT112 cells.CCK-8 assay, morphological observation and cell clone formation assay showed that 21-hydroxy-neriaside had the activity of inhibiting the proliferation of gastric cancer cells, which was positively correlated with time and drug concentration. RNA sequencing, qRT-PCR and shRNA-E2F5 lentiviral transfection experiments showed that 21-hydroxy-neriaside affected cell cycle pathways by regulating E2F5, thereby inhibiting tumor cell growth. The results of Western blotting showed that the protein expression levels of E2F5, c-Myc, Cyclin D1 and Cyclin E2 in 21-hydroxy-neriaside group were significantly decreased (< 0.05, 0.01, 0.001), and cleaved PARP protein expression level was significantly increased (< 0.001).21-Hydroxy-neriaside has anti-gastric cancer activity. It can affect cell cycle pathway-related proteins by down-regulating E2F5 expression, inhibit the growth of gastric cancer cells, and promote tumor cell apoptosis.
21-hydroxy-neriaside; cardiac glycoside; gastric tumor cells; E2F transcription factor 5; apoptosis
R285.5
A
0253 - 2670(2022)18 - 5712 - 08
10.7501/j.issn.0253-2670.2022.18.014
2022-05-23
广东省医学科学技术研究基金资助项目(B2020031)
植韵诗(1997—),女,硕士研究生,研究方向为胃癌药理学。E-mail: 2070245062@email.szu.edu.cn
陈 铁,男,硕士生导师,研究方向为消化道肿瘤干细胞的靶向治疗和肿瘤药理。E-mail: tiechen@szu.edu.cn
[责任编辑 李亚楠]
