黄芩浸提动力学研究及生物效应评价
2022-09-19仲晓露张兴德刘永海井山林狄留庆郁红礼陈希宇胡若楠
仲晓露,沈 烨,张兴德,3,5*,刘永海,井山林,4,谢 辉,狄留庆,5,郁红礼,3,4,陈希宇,胡若楠
(1.南京中医药大学 药学院,江苏 南京 210023;2.南京中医药大学附属医院盐城市中医院,江苏盐城 224001;3.江苏省中药炮制重点实验室,江苏 南京 210023;4.江苏省经典名方工程研究中心,江苏 南京 210023;5. 江苏省中药高效给药系统工程技术研究中心,江苏 南京 210023)
黄芩始载于《五十二病方》[1],为唇形科植物黄芩ScutellariaebaicalensisGeorgi 的干燥根,性苦、寒,归肺、胆、脾、大肠、小肠经,具清热利湿、降火解毒、止血安胎等功效[2]。现代研究表明,黄芩在抗氧化、抗肿瘤和抗炎等方面作用良好[3],其化学成分包括黄酮类、挥发油类、多糖类等,以黄酮类化合物占比最大[4],是黄芩主要的药效物质基础。
提取是影响中药产品质量和疗效的重要单元,目前车间的提取生产仍以人工操作控制模式为主。2016年,国家工信部《医药工业发展规划指南》[5]提出:“采用过程分析技术(PAT)优化制药工艺和质量控制,实现药品从研发到生产的技术衔接产品质量一致性”,要求将PAT 技术、提取工艺优化和过程质控相融合。因此,课题组以黄芩为研究对象,通过建立黄芩中黄酮类单成分的浸提动力学模型,为黄芩提取的工艺优化提供理论基础,同时有效控制浸提过程;通过对黄芩浸提液进行生物效应评价,从制药源头保证药品质量。
1 实验材料
1.1 药品与试剂
黄芩饮片(批号:20200801,永州市永靛中药饮片有限公司),经南京中医药大学陈建伟教授鉴定为唇形科植物黄芩ScutellariaebaicalensisGeorgi 的干燥根;黄芩苷对照品(批号:MUST-20030408,纯度:98.95%)、汉黄芩苷对照品(批号:MUST-21120601,纯度:99.06%)、黄芩素对照品(批号:MUST-21101117,纯度:98.71%)和汉黄芩素对照品(批号:MUST-21030911,纯度:99.77%)均购于成都曼思特生物科技有限公司。甲醇、乙腈、磷酸为色谱纯;乙醇为分析纯;蒸馏水(广州屈臣氏食品饮料有限公司);DPPH(上海源叶生物科技有限公司);胎牛血清(美国Gibico 公司);DMEM(武汉普诺赛生命科技有限公司);LPS(上海麦克林生化科技有限公司);NO 检测试剂盒(上海碧云天生物技术有限公司)。
1.2 主要仪器
MEI04E 型电子天平[梅特勒-托利多科技(中国)有限公司];e2695 型高效液相色谱仪(美国Waters 公司);T6 新世纪型紫外-可见分光光度计(北京普析通用仪器有限责任公司);Spectra Max i3X 型多功能酶标仪(美国Molecular Devices 公司)。
2 方法与结果
2.1 黄酮类单成分含量测定方法的建立
2.1.1 色谱条件 Hedera ODS-2柱(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.1% 磷酸水溶液(B),梯度洗脱50 min,洗脱程序见表1;流速为1.0 mL/min;检测波长为276 nm;柱温为25℃;进样量为10 μL。

表1 黄酮类单成分含量测定梯度洗脱表Tab. 1 Gradient elution table for determination of flavonoid single component content
2.1.2 溶液的制备 (1) 对照品溶液的制备精密称定黄芩苷、汉黄芩苷、黄芩素和汉黄芩素对照品适量,加流动相溶解,定容至10 mL,摇匀,制成质量浓度分别为 0.322 0 mg/mL、0.084 2 mg/mL、0.054 4 mg/mL 和0.020 7 mg/mL 的对照品储备液。精密吸取上述储备液1、0.5、0.1、0.1 mL 配制成混合对照品溶液,0.45 μm 微孔滤膜滤过,进样量为10 μL,色谱图见图1。
(2) 供试品溶液的制备 称定黄芩饮片10.0 g,置于圆底烧瓶中,加入蒸馏水100 mL,回流提取1 h。趁热过滤,0.45 μm 微孔滤膜滤过,即得供试品溶液,进样量为10 μL,色谱图见图1。
2.1.3 方法学考察 (1) 标准曲线的绘制 精密量取混合对照品溶液1、5、10、15、20、25、30、35 和40 μL,按“2.1.1”项下色谱条件进样测定。以峰面积(Y)为纵坐标,进样量(X,μg)为横坐标,绘制标准曲线,得回归方程,结果见表2。
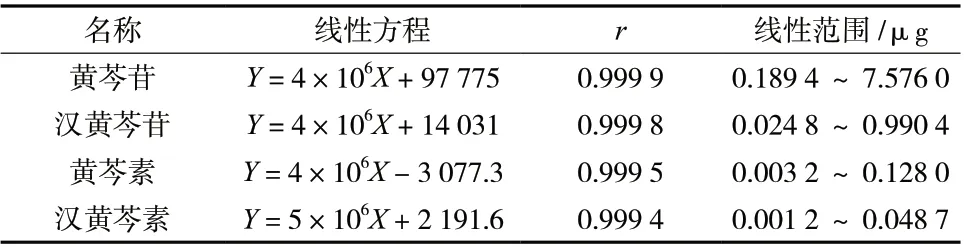
表2 黄酮类单成分线性回归方程表Tab. 2 Single component linear regression equation of flavonoid
(2) 精密度试验 取混合对照品溶液,进样10 μL,连续测定6 次,记录峰面积。计算得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素峰面积的RSD 分别为0.26%、0.40%、0.58%和0.72%,表明仪器精密度良好。
(3) 稳定性试验 精密量取同一供试品溶液,分别在配制后的0、2、4、8、12、24 h 进样,记录峰面积。计算得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素峰面积的RSD 分别为0.65%、1.36%、1.60%和1.64%,表明提取液制备后在室温放置24 h内稳定。
(4) 重复性试验 精密称定黄芩饮片10.0 g,按“2.1.2”项下方法制备供试品溶液进样测定,重复操作6 次。计算得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素平均含量分别为26.58 mg/g、6.23 mg/g、1.02 mg/g、0.44 mg/g,RSD分别为1.60%、1.87%、1.55%和1.86%,表明方法重复性良好。(5) 加样回收试验 精密称取已知含量的黄芩饮片6 份,分别准确加入混合对照品适量,按“2.1.2”项下制备供试品溶液,按“2.1.1”项下色谱条件进样测定。计算得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素平均加样回收率分别为99.47%、98.89%、98.16%和98.40%,RSD 分别为0.78%、1.31%、2.88%和2.97%,表明方法准确度良好。
2.1.4 样品测定 称定黄芩饮片10.0 g,加入蒸馏水130 mL 进行回流提取,分别在5、10、15、20、25、30、40、50 和60 min 取提取液5 mL 并补充5 mL 蒸馏水,按“2.1.2”项下方法制备供试品溶液进样测定,结果见表3。

表3 黄芩HPLC 含量测定结果(n = 2)Tab. 3 Determination results of Scutellariae Radix by HPLC(n = 2)
2.2 浸提动力学方程的构建
2.2.1 理论基础 本实验采用基于Fick’s 扩散定律,通过简化带入、参数融合等手段,推导形成中药煎煮过程的动力学方程。
根据Fick’s 扩散定律[6-7]和Higbie 传质穿透模型理论[8],韩林辛等[9]推导出适于多数药材的提取动力过程总方程:
2.2.2 动力学模型的建立和验证 (1) 干药材吸溶剂率R的测定 称定药材约 2.0、4.0、6.0、8.0、10.0 g,将其分别置于 500 mL 的圆底烧瓶中,加蒸馏水300 mL,加热回流30 min,滤过,取出称重。以吸水量(Y)对饮片干重(X)进行线性回归,结果见图2。方程的斜率即为干药材吸溶剂率R,即R=1.512 5。
(2)f1的测定与计算:f1可用公式(4)表示:
其中,C1b-C10即为C有效成分,基于本实验,该值代表本批黄芩饮片中四种黄酮类单成分的含量。以2020 年版《中国药典》(一部)“黄芩”项下含量测定中对供试品溶液的处理方法制备黄芩饮片的供试品溶液,按“2.1”项下含量测定方法进行测定,得本次实验所用黄芩饮片中得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的f1分别为0.070 0、1.612×10-2、2.443×10-3和8.143×10-4。
(3) n 和α 值的测定与计算 固定溶剂倍量M= 5 mL/g,在提取30、60、90、120、150 min 时,分别取出提取液5 mL 并补充5 mL,提取液放冷后测定;固定溶剂倍量M= 10、15、20 mL/g 重复上述操作。通过实验数据做ln[t1/2/(M-R)]和lnCB的线性回归,将所得回归方程与公式(3)中相应数值联立,可得n和α的值,结果见图3。将回归方程和公式(3)中相应数值联立,得黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的1/(1-n)的值分别为0.770 5、0.796 2、0.793 2、0.769 5,1/(1-n)lnαf1的值分别为1.860 7、0.405 5、-1.495 6、-2.403 7,即黄芩苷、汉黄芩苷、黄芩素和汉黄芩素的n值分别为-0.297 9、-0.256 0、-0.260 7 和-0.299 5,α值分别为159.841 9、0.010 3、6.211×10-5和5.403×10-7。
(4) 模型的建立 将以上求得的R值、f1值、n值和α值代入公式(5)中求得本次研究所建立的黄芩中黄酮类单成分浸提动力学方程,黄芩苷:CB= [11.188 9×t1/2/(M-1.512 5)]0.7705、汉黄芩苷:CB= [1.660 4×10-4×t1/2/(M-1.512 5)]0.7962、黄芩素:CB= [1.517 3×10-7×t1/2/(M-1.512 5)]0.7932、汉黄芩素:CB= [4.399 7×10-10×t1/2/(M-1.512 5)]0.7695。
根据所建立的动力学方程式,在溶剂倍量为13倍的情况下,对黄芩提取液在5、10、15、20、25、30、40、50 和60 min 时四种黄酮类单成分的浓度进行预测,发现只有黄芩苷的预测结果良好,结果见表4。由表4 中数据可知,黄芩苷的预测值(Cpre)和真实值(Cexp)吻合良好,标准偏差值与工业要求相符。因此,本实验所建立的黄芩苷浸提动力学模型能够较好地反映黄芩饮片中黄芩苷的溶出规律。

表4 黄芩苷动力学模型验证结果Tab. 4 Validation results of baicalin kinetic model
2.3 生物效应评价
2.3.1 抗氧化试验 (1) 溶液的制备 黄芩浸提液:称取黄芩饮片10.0 g,加蒸馏水100 mL,浸泡30 min 后100℃提取150 min,分别在0、10、20、30、40、50、60、90、120、150 min 取3 mL 提取液并补充蒸馏水3 mL。
DPPH 溶液:精密称取7.91 mg 的DPPH 粉末,用无水乙醇定容至100 mL,配制成0.2 mmol/L 的DPPH 储备液,0℃保存。
(2) DPPH清除率的测定 分别取提取液1 mL于试管中,加入0.2 mmol/L 的DPPH 溶液4 mL 振荡混匀,常温下密封后置于避光处反应30 min。在517 nm处测定其吸光度 (A样品)。再测定4 mL 的0.2 mmol/L的DPPH 溶液与1 mL 无水乙醇的吸光度A空白,样品液1 mL 加4 mL 无水乙醇的吸光度(A对照),计算DPPH清除率,DPPH 清除率=[1- (A样品-A对照)/A空白]×100%)。重复操作3 次,结果见图4,发现黄芩浸提液在浸提的不同时间点对DPPH 自由基均有良好的清除效果,长时间的加热对浸提液抗氧化活性并无裨益。
2.3.2 抗肿瘤试验 (1) 溶液的制备 同“2.3.1”。
(2) sgc-7901 细胞增殖抑制测定 取对数生长期且生长状态良好的细胞,离心(1 000 rpm,5 min,室温),收集细胞,用完全培养基重悬细胞并用细胞计数板计数,将细胞稀释至1×105个/mL,每孔100 μL 细胞悬液,接种于96 孔板中。24 h 后,细胞贴壁,吸出培养基,给药。设置空白组(不加细胞不给药)、对照组(加细胞不给药)和给药组(加细胞给药),每组设置5 个复孔。37 ℃、5% CO2环境下培养24 h 后,向每孔加入10 µL 的CCK-8 溶液,37 ℃下孵育1 h,使用酶标仪测定波长450 nm下的各孔吸光度值(OD)。重复实验3 次,计算细胞增殖抑制率{细胞增殖抑制率(%)= [1-(OD给药组-OD空白组)/(OD对照组-OD空白组)]×100%},并 以Graphpad Prism 软件作图,结果见图5。由图5 可知,黄芩浸提液对胃癌细胞sgc-7901 的增殖具抑制作用,随着加热提取时间的推移,抗肿瘤作用逐渐减弱,说明黄芩中的抗肿瘤活性物质对热不稳定,在实际生产中应控制提取时间不宜过长。
2.3.3 抗炎试验 (1) 溶液的制备 同“2.3.1”。
(2) 浸提液对RAW264.7细胞活力的影响 取对数生长期且生长状态良好的细胞,离心(1 000 rpm,5 min,室温),收集细胞,用完全培养基重悬细胞并用细胞计数板计数,将细胞稀释至2×104个/mL,每孔100 μL 细胞悬液,接种于96 孔板中。24 h 后,细胞贴壁,吸出培养基,给药。设置空白组(不加细胞不给药)、对照组(加细胞不给药)和给药组(加细胞给药),每组设置5 个复孔。37℃、5%CO2环境下培养24 h 后,向每孔加入10 µL 的CCK-8 溶液,37 ℃下孵育1 h,使用酶标仪测定波长450 nm 下的各孔吸光度值(OD)。计算细胞存活率:
并以Graphpad Prism 软件作图,结果见图6。由图6 可知,浸提液中细胞在各个时间点存活率均大于80%,说明选择的药液浓度对RAW264.7 细胞活力无明显影响,可进行下一步实验。
(3) 浸提液对LPS 诱导的RAW264.7 细胞NO释放的影响 将细胞稀释至2×105个/mL,每孔100 μL 细胞悬液,接种于96 孔板中。设置空白组(不给LPS 不给药)、对照组(给LPS 不给药)和给药组(给LPS 给药),每组设置5 个复孔。37 ℃、5%CO2环境下培养24 h 后取上清,用NO 试剂盒测定,实验重复三次。以Graphpad Prism 软件作图,结果见图7。由图7 可知,与空白组相比,对照组的NO 含量明显升高;与对照组比较,黄芩在提取20 min 后其浸提液能明显降低细胞上清液中NO 含量。
3 讨论
目前,中药提取存在着劳动强度高、工艺参数波动大、批次间产品质量不均一等问题,其根本原因是提取理论的缺乏。课题组在黄芩饮片的提取研究时发现,以响应面法优化浸提工艺的传统方式并不符合实际生产要求。基于文献资料,发现通过对中药提取过程进行动力学研究可解决上述问题。提取动力学数学模型可表达中药成分在水中溶出的动态过程,阐明提取机理,从而有效控制提取过程。课题组前期以拟合结果和应用范围为评判标准,比较了多种经验模型和物理模型[12],最终选定基于Fick’s 扩散定律建立的物理模型作为黄芩浸提动力学研究模型。目前该模型多应用于中药饮片中某类成分(如黄酮类、多糖类)的提取研究。本实验探索性地将该模型应用于四种黄酮类单成分,结果表明,仅黄芩苷的溶出符合此模型,其浸提动力学方程为:CB= [11.188 9×t1/2/(M-1.512 5)]0.7705。猜测汉黄芩苷、黄芩素和汉黄芩素不适用于该动力学模型的原因是这三者在黄芩饮片中的含量较低。基于所构建的黄芩苷浸提动力学方程,可快速预判提取因素变化对黄芩苷溶出的影响,缩短对浸提阶段的研究时间,并有效控制提取过程。
现代研究发现,自由基、肿瘤和炎症三者相互关联[13]。目前对中药浸提液抗氧化、抗肿瘤和抗炎效果的评价多以终产物为研究对象,缺乏对浸提过程中生物效应变化的评价。故本研究从抗氧化、抗肿瘤和抗炎三个方面对浸提过程中黄芩浸提液的生物效应进行评价,发现黄芩浸提液的抗肿瘤活性物质对热不稳定,提示在黄芩实际生产中应避免长时间加热提取。同时,抗炎结果表明黄芩浸提液在提取20 min后方可明显抑制炎症因子NO 的释放,因此,如何平衡提取时间是制药企业在实际生产中须关注的问题。课题组后续将针对该问题深入研究,以期为黄芩浸提液的生产和质量控制提供参考。
4 结论
本研究构建了黄芩饮片中主要药效成分黄芩苷的浸提动力学方程,从细胞层面明确了浸提过程中黄芩的相关药效变化,为黄芩浸提的工艺选择和质量控制提供理论依据。但目前研究仅在实验室范围内进行,后续将扩大样本量进一步研究并进行中试放大试验,以期与实际生产相结合。
