偏穗鹅观草胚轴愈伤组织诱导体系建立
2022-09-19金丹青顾鹏程王玉杰胡尚钦汪军成马小乐司二静姚立蓉李葆春
金丹青,顾鹏程,王玉杰,胡尚钦,汪军成,马小乐,司二静,姚立蓉,李葆春
(1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070;2.省部共建干旱生境作物学国家重点实验室/甘肃省作物遗传改良与种质创新重点实验室,甘肃 兰州 730070;3.甘肃农业大学 农学院,甘肃 兰州 730070)
禾本科鹅观草属是小麦族中最大的属,在抗病方面的农艺学特性值得被关注[1-4]。偏穗鹅观草(Roegneria komarovii(Nevski)Nevski)为鹅观草属多年生草本植物,原产于我国,除新疆、青海、西藏外,分布遍及全国,多生长在海拔100~2 300 m的山坡和草地[5]。它具有较强的抗寒能力,对土壤要求不严格,抗旱、耐盐碱,在抗病性鉴定中表现为抗条锈病,是小麦的二级基因源。除此之外,其粗蛋白含量高,可消化率高,是优良的牧草,同时在涵养水源、防风固沙、调节小气候等方面也起到了不可忽略的作用。通过体细胞杂交技术将偏穗鹅观草的有利基因引入小麦,创造优异变异材料,对于小麦抗性遗传改良具有重要意义。良好的偏穗鹅观草愈伤组织诱导体系的建立,能够为建立偏穗鹅观草与小麦的原生质体融合技术,创建远缘杂交后代,利用该优良基因库奠定基础。
关于偏穗鹅观草愈伤组织诱导的研究,国内外尚无相关报道。邢莉萍等[6]以鹅观草属的鹅观草为材料,利用其幼穗未成熟种子幼胚为外植体,使用MS基础培养基,添加终质量浓度为2~5 mg/L的2,4-D,3~6 mg/L的麦草畏,0~0.5 mg/L的6-BA中的任意1种或2种,在黑暗条件下成功诱导出鹅观草的愈伤组织,但试验过程中采用的是升汞对种子进行消毒处理,升汞属剧毒化学品,不易处理,对环境造成伤害。关于偏穗鹅观草无毒条件下种子消毒及其愈伤组织诱导的研究报道很少[7-8],同时对于偏穗鹅观草无菌实生苗胚轴愈伤组织的快速诱导及繁殖方法更是未见报道。
本研究探讨无升汞处理偏穗鹅观草种子并以其无菌苗的叶片、叶柄、胚轴为外植体,通过调整培养基配方来获得偏穗鹅观草大量优质的愈伤组织,调整继代培养基,获得继代培养愈伤组织,以便获取大量有活力的细胞及细胞团,为下一步的细胞悬浮培养及小麦与偏穗鹅观草原生质体融合做准备。
1 材料和方法
1.1 试验材料
供试偏穗鹅观草(Roegneria komarovi(iNevski)Nevski)种子由中国农业科学院草原研究所提供。
1.2 试验方法
1.2.1 无菌苗的获取分别采用不同体积分数(45%、50%、55%)的浓硫酸对偏穗鹅观草种子进行脱皮催芽处理,配合酒精及次氯酸钠进行消毒,并分别设置消毒时间对消毒效果进行比较(表1),筛选无菌苗培养最佳条件。发芽条件统一为黑暗环境,温度28℃,MS基础培养基,pH值5.8。统计了不同方法和处理时间对偏穗鹅观草种子消毒效果及消毒后种子发芽率的影响,以期筛选出最适消毒条件。

表1 偏穗鹅观草种子消毒的不同方法和处理时间设置Tab.1 Different sterilization methods and processing time of seeds of Roegneria komarovii(Nevski)Nevski
1.2.2 愈伤诱导外植体选择分别选取无菌实生苗的叶片、叶柄和胚轴作为诱导愈伤组织的外植体,分别接入培养基1(MS+2.0 mg/L 2,4-D+1.0 mg/L 6-BA+0.5 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂)、培养基2(MS+1.0 mg/L氨氯吡啶酸+1.0 mg/L 6-BA+0.5 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂)中25~30 d,诱导愈伤发生,每种外植体在2种培养基中均处理6瓶,每瓶中接入外植体4~20个,通过对愈伤组织诱导情况的观察来初步筛选较优激素组合[9-10]和外植体。
培养条件:温度(25±1)℃,光照培养,光照强度为1 500 lx,湿度70%,pH值5.8。
1.2.3 胚轴的愈伤诱导采用正交试验设计9种培养基(表2),将长0.5~1.0 cm的无菌苗胚轴接种到培养基中,研究6-BA、2,4-D和NAA对愈伤组织诱导的影响,所用基础培养基是MS培养基,30 g/L蔗糖、5 g/L琼脂、0.1 g/L肌 醇,pH值5.8。每个处理3次重复,每次重复包含30个胚轴,培养30 d后统计胚轴的诱导率。根据诱导率筛选适合偏穗鹅观草胚轴愈伤组织的外源激素。

表2 愈伤诱导正交试验因素水平Tab.2 Factors and levels of orthogonal test for callus induction
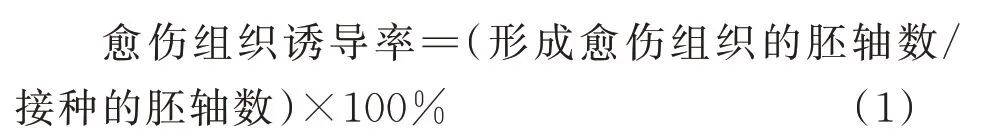
1.2.4 外源激素用量的选择 首先根据1.2.3优选出适合诱导偏穗鹅观草胚轴愈伤组织的外源激素[11-13],在此基础上,继续对外源激素用量进行优化[14-16],设最佳外源激素质量浓度分别为1、5、7 mg/L等3个梯度,所用基础培养基是MS培养基,30 g/L蔗糖、5 g/L琼脂、0.1 g/L肌醇,pH值5.8。将培养7 d的实生苗胚轴组织接种于以上3种不同质量浓度外源激素的诱导培养基中。
1.2.5 愈伤组织的继代培养挑选颜色鲜亮、质地疏松的愈伤组织接种于诱导愈伤组织效果较好的培养基中,观察愈伤组织继代培养的生长状况。根据第1次继代培养的结果,以后每25~30 d继代一次,每次继代选择增殖力较强的愈伤。
1.3 数据分析
数据采用Excel 2003处理,采用正交设计统计分析方法,对数据分别进行直观分析,用minitab 15软件进行方差分析。
2 结果与分析
2.1 无菌实生苗的获取
偏穗鹅观草种子最适催芽和消毒方法为:种子置于50%的浓硫酸中在条件为30℃,210 r/min的摇床里振荡1 h做脱皮催芽处理,之后用蒸馏水洗去浓硫酸并置于超净工作台。随后用无菌水清洗种子,然后75%的酒精振荡冲洗3 min,紧接着用无菌水将种子表面的酒精清洗干净,再用20%的次氯酸钠振荡冲洗15 min,最后用无菌水将种子表面的次氯酸钠清洗干净,获得偏穗鹅观草无菌种子(图1)。之后用无菌滤纸吸干接入MS培养基内培养7 d后得到无菌苗。

图1 偏穗鹅观草无菌实生苗Fig.1 Sterile seedlings of Roegneria komarovii(Nevski)Nevski
2.2 愈伤组织外植体选择
利用组合培养基1(MS+2.0 mg/L 2,4-D+1.0 mg/L 6-BA+0.5 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂)、培养基2(MS+1.0 mg/L氨氯吡啶酸+1.0 mg/L 6-BA+0.5 mg/L NAA+30 g/L蔗糖+5.0 g/L琼脂)分别培养偏穗鹅观草叶片、叶柄和胚轴。结果显示(表3),胚轴最易诱导出愈伤组织,叶柄诱导次之,而叶片的诱导效果最差。2种培养基愈伤组织生长速度无明显差别,以培养基1为例,10 d左右部分胚轴的两端切口处开始膨大,呈淡黄色(图2-a);15 d后发现胚轴两端不同程度膨大(图2-b);20 d左右发现胚轴在接触培养基的部位有少量愈伤形成(图2-c);28 d后绝大部分茎段有黄绿色愈伤生成(图2-d)。从材料来源分析,偏穗鹅观草愈伤组织诱导是胚轴优于叶柄、叶片,且培养基1比培养基2更容易诱导胚轴形成愈伤组织。

表3 不同外植体及不同培养基诱导率Tab.3 Induction rates of different explants and culture mediums %

图2 不同时期偏穗鹅观草愈伤组织Fig.2 Callus of Roegneria komarovii Nevski)Nevski in different periods
2.3 植物生长调节剂及其浓度对于胚轴诱导愈伤组织的影响
2.3.1 正交试验的极差分析 由表4可知,R2,4-D>R6-BA>RNAA,因素B(2,4-D)的极差最大,因素C(NAA)的极差最小。说明这3个因素对无菌苗胚轴愈伤组织诱导的影响大小为:2,4-D>6-BA>NAA。正交表中均值越大,则说明代表该因子的水平越好。比较各因子的K值,最大值分别是:因素A的K1、因素B的K2和因素C的K3。从诱导率的极差分析结果可知,最优组合为A1B2C3,即0.5 mg/L 6-BA+1.0 mg/L 2,4-D+0.6 mg/L NAA。

表4 偏穗鹅观草胚轴愈伤组织诱导正交试验结果Tab.4 Results of orthogonal test of callus induction with hypocotyl from Roegneria komarovii(Nevski)Nevski
2.3.2 正交试验的方差分析对所有数据进行方差分析以反映各因子之间的差异,结果表明(表5),因素B(2,4-D)对胚轴的影响显著,因素A(6-BA)、C(NAA)对胚轴的诱导作用不显著,此结果与极差分析的结果相符合(表4)。所以,最终确定2,4-D为本试验中诱导偏穗鹅观草愈伤组织的最佳激素。在此基础上,进一步设定2,4-D质量浓度梯度,筛选出最优2,4-D为5.0 mg/L。

表5 偏穗鹅观草胚轴诱导的方差分析Tab.5 Variance analysis of hypocotyl induction of Roegneria komarovii(Nevski)Nevski
2.4 偏穗鹅观草愈伤组织增殖培养
将得到的颜色黄绿、质地疏松的愈伤组织切割成直径约0.1~0.2 cm的小块,然后转接到诱导愈伤组织最佳增殖培养基(MS+5.0 mg/L 2,4-D+0.1 g肌醇+30 g/L蔗糖+5 g琼脂)中,培养25~30 d后继续转接到新的诱导愈伤组织增殖培养基中进行继代增殖,最终获得颜色黄绿、结构致密的优良愈伤组织材料(图3),将作为原生质体培养的材料及其他研究材料。

图3 偏穗鹅观草愈伤组织的继代培养Fig.3 Subculture of callus of Roegneria komarovii(Nevski)Nevski
3 结论与讨论
本研究筛选到偏穗鹅观草愈伤组织诱导最佳外植体为胚轴,胚轴愈伤组织诱导的最适培养基为MS+5.0 mg/L 2,4-D+0.1 g肌 醇+30 g/L蔗糖+5 g琼脂。利用此培养基能够成功对诱导出的愈伤组织进行继代培养,为小麦和偏穗鹅观草原生质体融合提供技术支持。
根据细胞全能性理论,植物的任何器官都可以作为外植体,但不同组织器官培养成功的难易程度不同,同一植物不同的组织器官再生能力也有很大差异,并且接种材料的部位、植株年龄以及植株的生理状态等都会直接影响组织器官的再生。本试验所选的3种外植体中,胚轴诱导的效果最好,叶柄次之,叶片最差,这可能与取材部位的细胞分化程度有关系,胚轴在幼苗阶段处于旺盛的生长状态,分生细胞丰富,易诱导分化;也可能是不同外植体中所含有的内源激素不同或细胞的极性差异。
愈伤组织培养初期,一定浓度的生长素类物质是诱导脱分化、愈伤组织生长的必要条件[17]。从正交试验分析可以看出,2,4-D对诱导偏穗鹅观草胚轴形成愈伤影响最大,可见,2,4-D对外植体诱导愈伤起着关键作用,这与张献龙等[18]的报道相一致。除此之外,也有研究者配合使用2,4-D和6-BA[19-22]或NAA[23-24]进行愈伤组织诱导,但是在分析过程中,并没有对2,4-D和6-BA的交互作用进行分析。本试验研究了2,4-D、6-BA及NAA这3种植物生长物质对偏穗鹅观草愈伤诱导的影响,获得的愈伤多疏松,但其他植物生长物质对愈伤诱导的影响及不同形态愈伤的诱导还有待进一步研究。
