一株烟草黑胫病拮抗菌Y12的鉴定及发酵条件优化
2022-09-19何明川钮徐融曾舒泉谢永辉戴恩李美燕吴国星张忠王志江
何明川,钮徐融*,曾舒泉,谢永辉,戴恩,李美燕,吴国星,张忠,王志江
(1.云南农业大学植物保护学院,云南 昆明 650201;2.云南省烟草公司昆明市公司,云南 昆明 650051;3.山东第一医科大学生命科学学院,山东 泰安 271016)
烟草黑胫病是目前世界上危害较严重的烟草真菌性病害之一,对世界烟草生产造成巨大的冲击和威胁,受到广泛关注[1,2]。近年来在该病害流行预测预报、化学及生物农药防治等相关领域取得了较大进展,对烟草黑胫病的防控手段主要为种植抗病品种、优化烟草栽培管理技术和化学与生物防治[3,4]。但由于烟草疫霉的侵染过程伴有其他病原微生物的发生,易使抗病品种抗性丧失,且该病原菌游动孢子形成速度快且数量大、侵染寄主后发病快,所以田间监测与管理难度较大[5],化学防治被广泛运用以控制病害。相比化学防治,生物防治在长期研究与实际运用中表现出无污染、无公害、不易产生抗药性、药效持续时间长等优点[6],应进行深入的研究并予以广泛运用。目前用于防治烟草黑胫病的拮抗菌多分离自根际土壤和植物根茎叶[7-9],而分离自昆虫体内的具有拮抗烟草黑胫病特性的细菌却鲜有报道。本课题在前期从美洲大蠊肠道内分离出一株对烟草疫霉具有拮抗作用的Y12菌株,本试验通过形态学、生理生化特征及16S rRNA基因序列测定等方法对该菌株进行鉴定,采用单因素试验确定其最佳培养基和最适发酵条件,为利用该菌对烟草黑胫病进行生物防治和菌剂制备等奠定基础,同时对利用昆虫肠道微生物进行生物防治提供理论支撑。
1 材料与方法
1.1 试验材料
本试验于2021年7—12月在云南农业大学植物保护学院生物化学实验室进行。拮抗菌Y12分离自美洲大蠊肠道内,保存于-80℃超低温冰箱。
1.2 供试培养基
蛋白胨酵母蔗糖(YSP)培养基:蛋白胨10.0 g,酵母浸粉5.0 g,蔗糖20.0 g,琼脂15.0 g,加蒸馏水至1 L;牛肉膏酵母(NYBD)培养基:牛肉浸膏8.0 g,酵母浸粉5.0 g,葡萄糖10.0 g,琼脂15.0 g,加蒸馏水至1 L;细菌基础(CM)培养基:葡萄糖5.0 g,(NH4)2SO42.0 g,柠檬酸钠1.0 g,MgSO4∙7H2O 0.2 g,K2HSO44.0 g,KH2SO46.0 g,琼脂15.0 g,加蒸馏水至1 L;牛肉膏蛋白胨琼脂(NA)培养基:蛋白胨10.0 g,牛肉膏3.0 g,NaCl 5.0 g,琼脂15.0 g,加蒸馏水至1 L;蛋白胨酵母(LB)培养基:蛋白胨10.0 g,酵母浸粉5.0 g,NaCl 10.0 g,琼脂15.0 g,加蒸馏水至1 L;燕麦(OA)培养基:燕麦30.0 g,琼脂18.0 g,加蒸馏水至1 L。
1.3 Y12菌株抑菌效果测定
采用平板对峙法对拮抗菌Y12的抑菌效果进行测定。利用6 mm打孔器在已活化的烟草疫霉平板上打取菌饼,接种于新的OA平板中央,将已分离纯化的Y12菌株单菌落使用接种环接种于OA平板距菌饼十字对称2.2 cm处,于28℃恒温培养箱中培养3~5 d后取出并测量抑菌圈半径,计算抑菌率。以不接拮抗菌作为空白对照,每个处理3个重复[10]。
抑菌率(%)=(对照平板菌落直径-处理平板菌落直径)/对照平板菌落直径×100。
1.4 拮抗菌的鉴定
1.4.1 形态学与生理生化鉴定 挑取Y12单菌落接种于LB培养基,28℃培养48 h,观察菌落形态特征,并参考«常见细菌系统鉴定手册»等对菌株进行生理生化特征鉴定[11,12]。
1.4.2 16S rRNA基因序列分析 以27F(5′-AGAGTTGACCTGGCTCA-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)为引物扩增Y12菌株的16S rRNA基因序列。扩增体系(50μL):PCR Mix 25μL,上游引物2μL,下游引物2μL,DNA模板3μL,ddH2O 18μL。扩增程序:94.8℃预变性2.5 min;98℃变性10 s,55℃退火10 s,72℃延伸20 s,30个循环;72℃延伸2 min。采用1.0%琼脂糖电泳检测PCR产物,送北京擎科生物科技有限公司昆明分公司测序。测序结果在NCBI上进行BLAST比对后将同源性较高的序列用MEGA 7和clustal x1.83软件构建系统发育树[13]。
1.5 拮抗菌株发酵条件优化
1.5.1 种子液的制备 挑取Y12菌株单菌落于100 mL LB液体培养基中,28℃、180 r/min振荡培养24 h后备用。
1.5.2 培养基优化 分别取50μL种子液接种于100 mL的YSP、NYBD、CM、NA和LB液体培养基中,于25℃、220 r/min、正常光照环境下培养24 h,使用分光光度法测定菌液在600 nm波长处的OD值以确定该菌在不同培养基中的生长状况[14]。
1.5.3 培养基组分优化 以1.5.2中的最适培养基作为基础培养基,分别以麦芽糖、乳糖、葡萄糖、蔗糖以及淀粉作为碳源。接种50μL种子液于25℃、220 r/min条件下培养24 h,利用分光光度法测定各组培养后的菌液在600 nm波长处的OD值[15]。
以1.5.2中的最适培养基作为基础培养基,分别以氯化铵、酵母浸粉、硝酸铵、甘氨酸以及蛋白胨作为氮源。接种50μL种子液于25℃、220 r/min条件下培养24 h,利用分光光度法测定各组培养后的菌液在600 nm波长处的OD值[15]。
1.5.4 温度对拮抗菌生长的影响 将50μL Y12种子液加入最佳培养基中,于不同温度(16、20、24、28、32、36、40℃)条件下、220 r/min振荡培养24 h,利用分光光度法测定各组菌液在600 nm波长处的OD值[14]。
1.5.5 初始pH值对拮抗菌生长的影响 将50 μL Y12种子液加入最佳培养基中,利用HCl与NaOH调整pH值至4、5、6、7、8、9、10,于最适温度下、220 r/min振荡培养24 h后利用分光光度法测定各组培养后的菌液在600 nm波长处的OD值[15]。
1.5.6 装液量对拮抗菌生长的影响 250 mL三角瓶中分别加入20、40、80、120、160 mL最佳培养基,50μL Y12种子液接种于培养基中,于最适温度下、220 r/min振荡培养24 h后利用分光光度法测定各组培养后的菌液在600 nm波长处的OD值[14]。
1.5.7 发酵时间对拮抗菌生长的影响 将50μL Y12种子液加入最佳培养基中,于最适温度下、220 r/min、正常光照下振荡培养,每隔2 h利用分光光度法测定菌液在600 nm波长处的OD值并绘制Y12生长曲线以确定Y12的最佳发酵时间[14]。
1.5.8 转速对细菌生长的影响 将50μL Y12种子液加入最佳培养基中,于最适温度、不同转速下(140、160、180、200、220、240 r/min)振荡培养至最适发酵时间后利用分光光度法测定各组培养后的菌液在600 nm波长处的OD值[14]。
1.5.9 光照时间对细菌生长的影响 将50μL Y12种子液加入最佳培养基中,于最适温度、最适转速、不同光照时间下(0、4、8、12、16、20、24 h)培养至最适发酵时间后利用分光光度法测定各组培养后的菌液在600 nm波长处的OD值[14]。
1.5.1 0 初始接菌量对细菌生长的影响 接入不同初始菌量(0.05%、0.10%、0.50%、1.00%、2.00%、2.50%、3.00%)至最佳培养基中,于最适温度、最适转速下培养至最适发酵时间后利用分光光度法测定各组培养后的菌液在600 nm波长处的OD值[16]。
1.6 数据处理与分析
采用Microsoft Excel 2010进行数据处理,利用DPS 7.05进行统计分析,用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 Y12菌株抑菌效果
如图1所示,处理组疫霉菌落平均半径为(16.30±0.05)mm,抑制率为62.95%±0.11%。
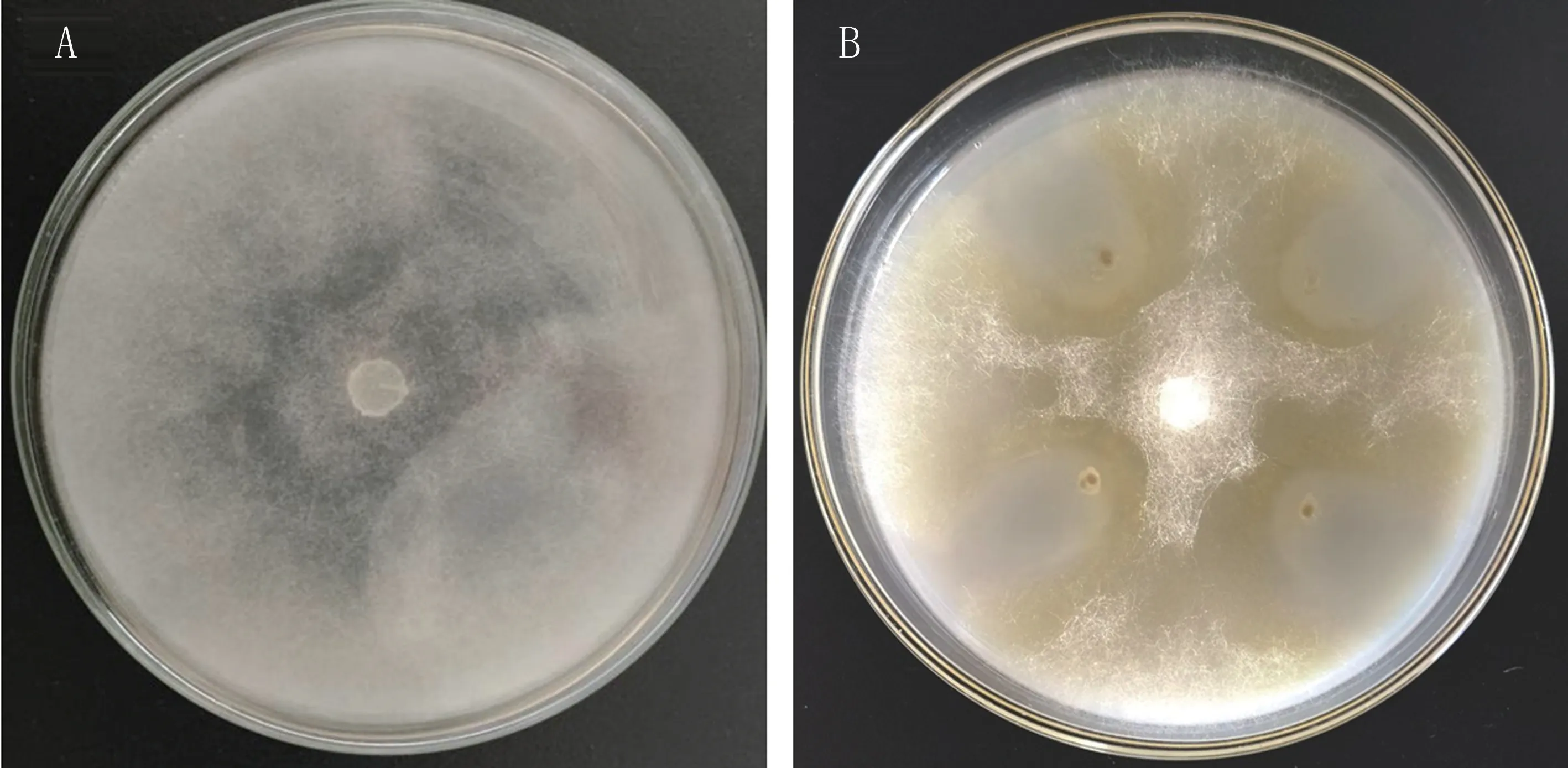
图1 拮抗菌Y12的抑菌效果
2.2 Y12菌株的鉴定
2.2.1 形态学与生理生化特征 菌株的菌落直径0.86~3.60 mm,近圆形,随培养时间延长由铜绿色渐渐变为黄褐色,表面湿润隆起且边缘略透明呈波状。菌体短杆状至椭球状,(0.28~0.36)μm×(0.71~1.36)μm,未观察到芽孢,革兰氏阴性菌(图2)。生理生化特征如表1所示。

图2 Y12菌株菌落形态及革兰氏染色结果

表1 拮抗细菌Y12的生理生化特征
2.2.2 16S rRNA基因序列分析结果 将Y12菌株16S rRNA基因测序结果与GenBank数据库中已有序列进行Blast比对,发现该菌与Pseudo-monas aeruginosaDSM 50071(NR117678.1)相似度最高(99%)。结合2.2.1中所得结果和系统发育树(图3),鉴定该菌为铜绿假单胞菌(P.aeruginosa)。
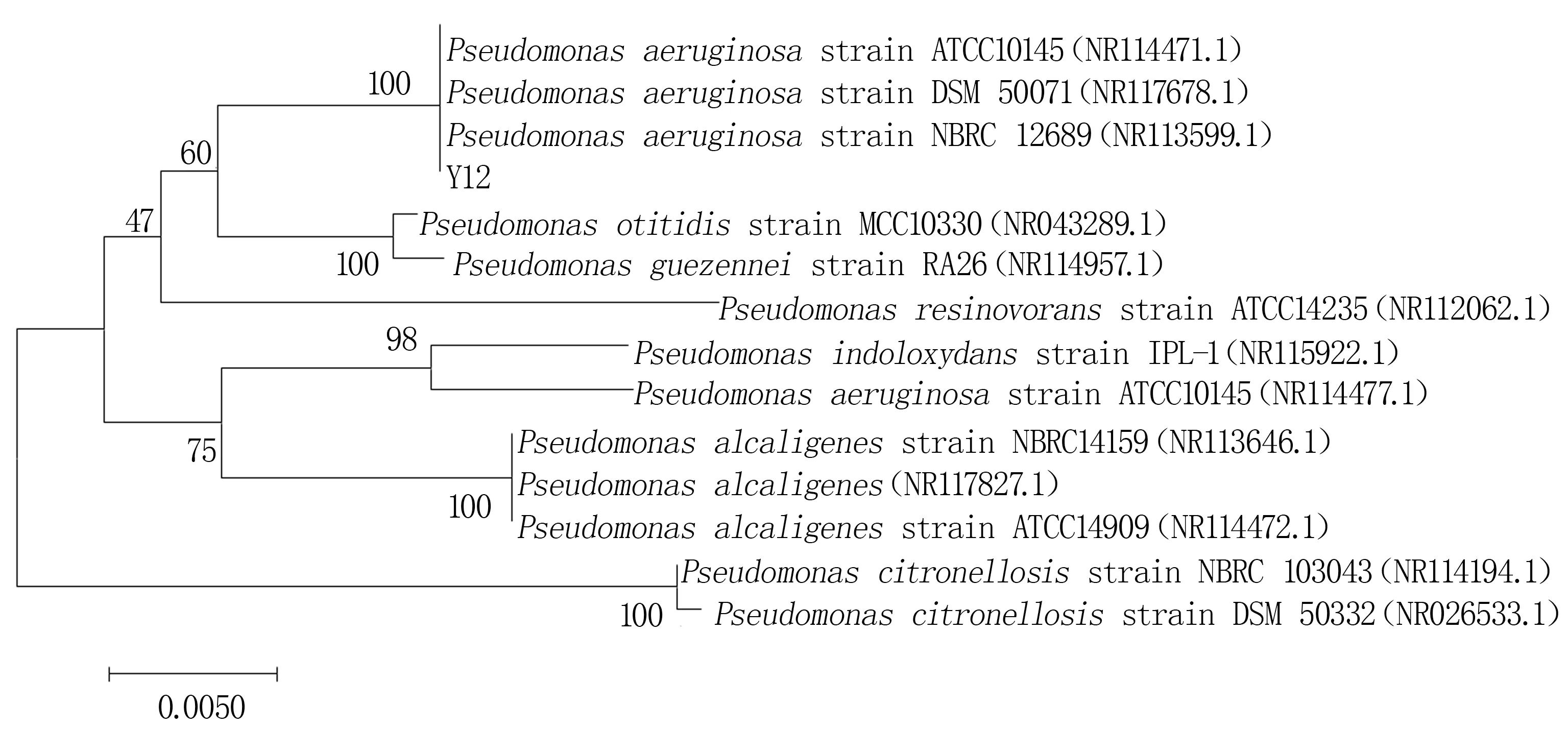
图3 基于16S rRNA基因序列构建的Y12菌株系统进化树
2.3 Y12菌株发酵条件优化
2.3.1 培养基种类优化 由图4可知,Y12菌株在NYBD培养基上的生长速度最快(OD600值为2.25),在YSP、CM、LB、NA培养基上的生长较慢(YSP培养基上最慢),且显著低于NYBD培养基。表明NYBD培养基为该菌的最适培养基。
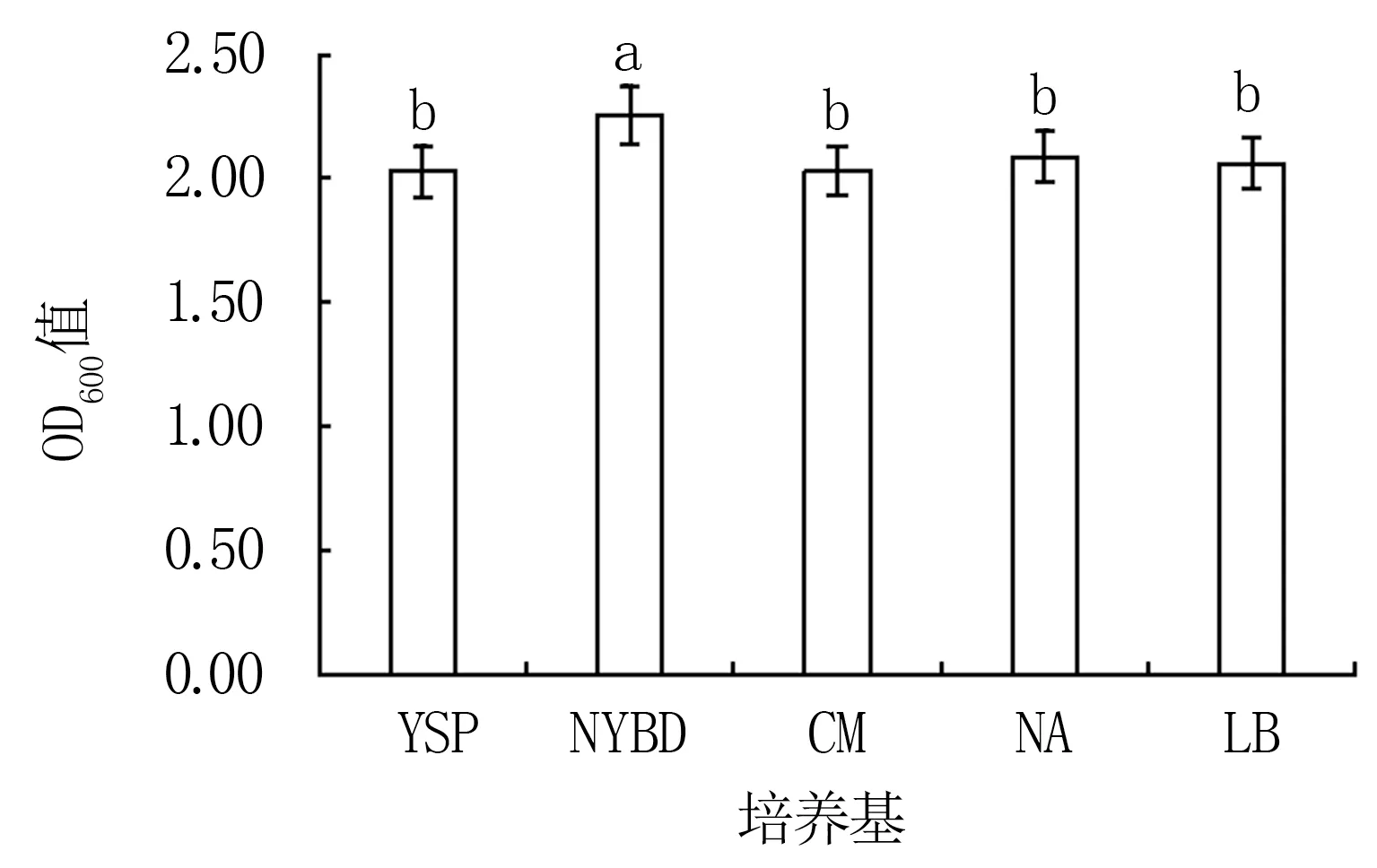
图4 不同培养基对Y12菌株生长的影响
2.3.2 培养基组分优化 由图5可知,Y12菌株在以葡萄糖为碳源的培养基中生长状况最佳(OD600值为2.07),而后依次为乳糖、麦芽糖和蔗糖,以淀粉为碳源的处理显著(P<0.05)低于葡萄糖、乳糖和麦芽糖处理。表明Y12的最适碳源为葡萄糖。
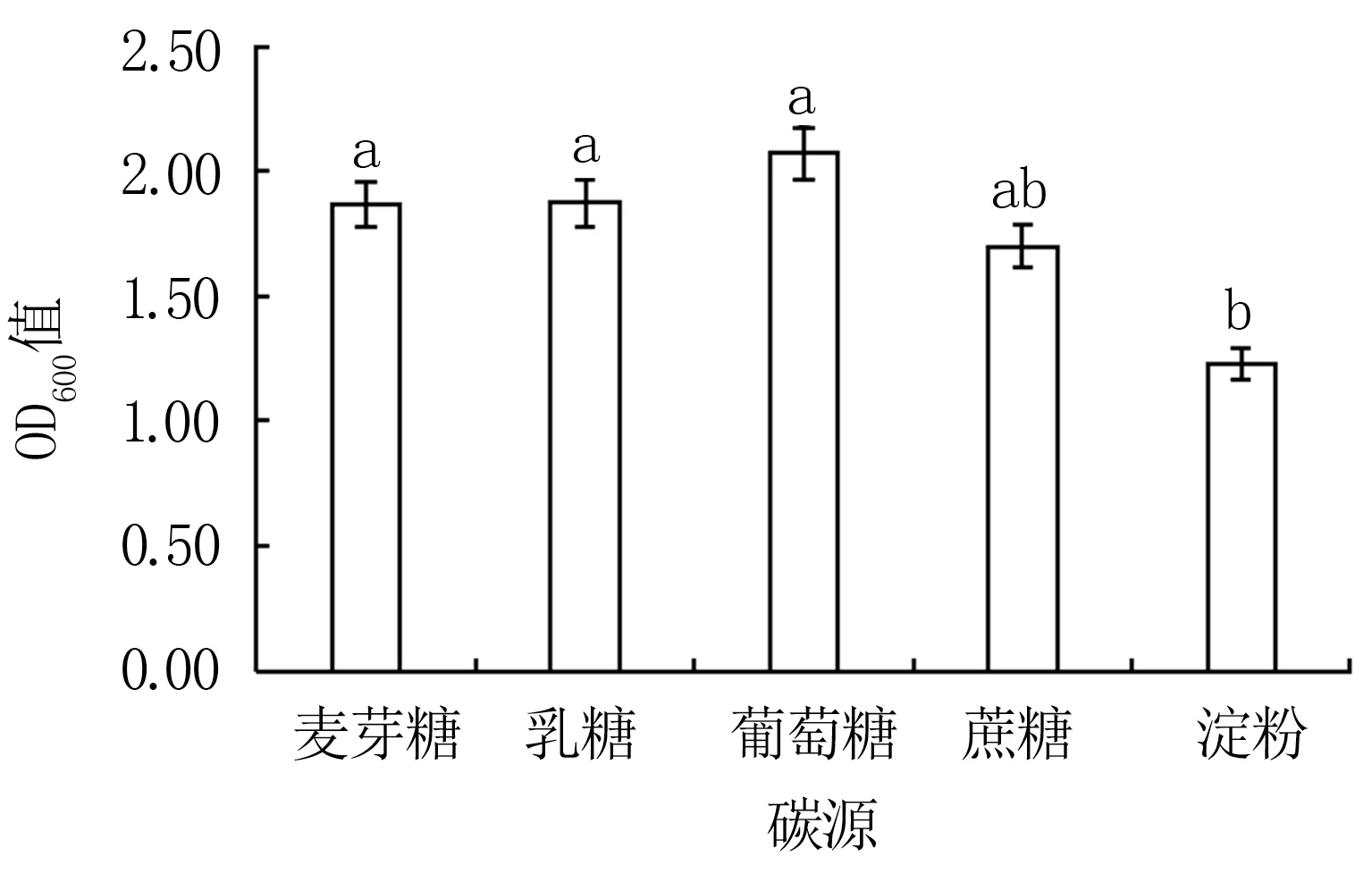
图5 不同碳源对Y12菌株生长的影响
由图6可知,Y12菌株在以酵母浸粉为氮源的培养基中生长最快(OD600值为2.24),而后依次为氯化铵、蛋白胨和硝酸铵,以甘氨酸为氮源的处理与酵母浸粉处理存在显著差异(P<0.05)。表明Y12的最适氮源为酵母浸粉。
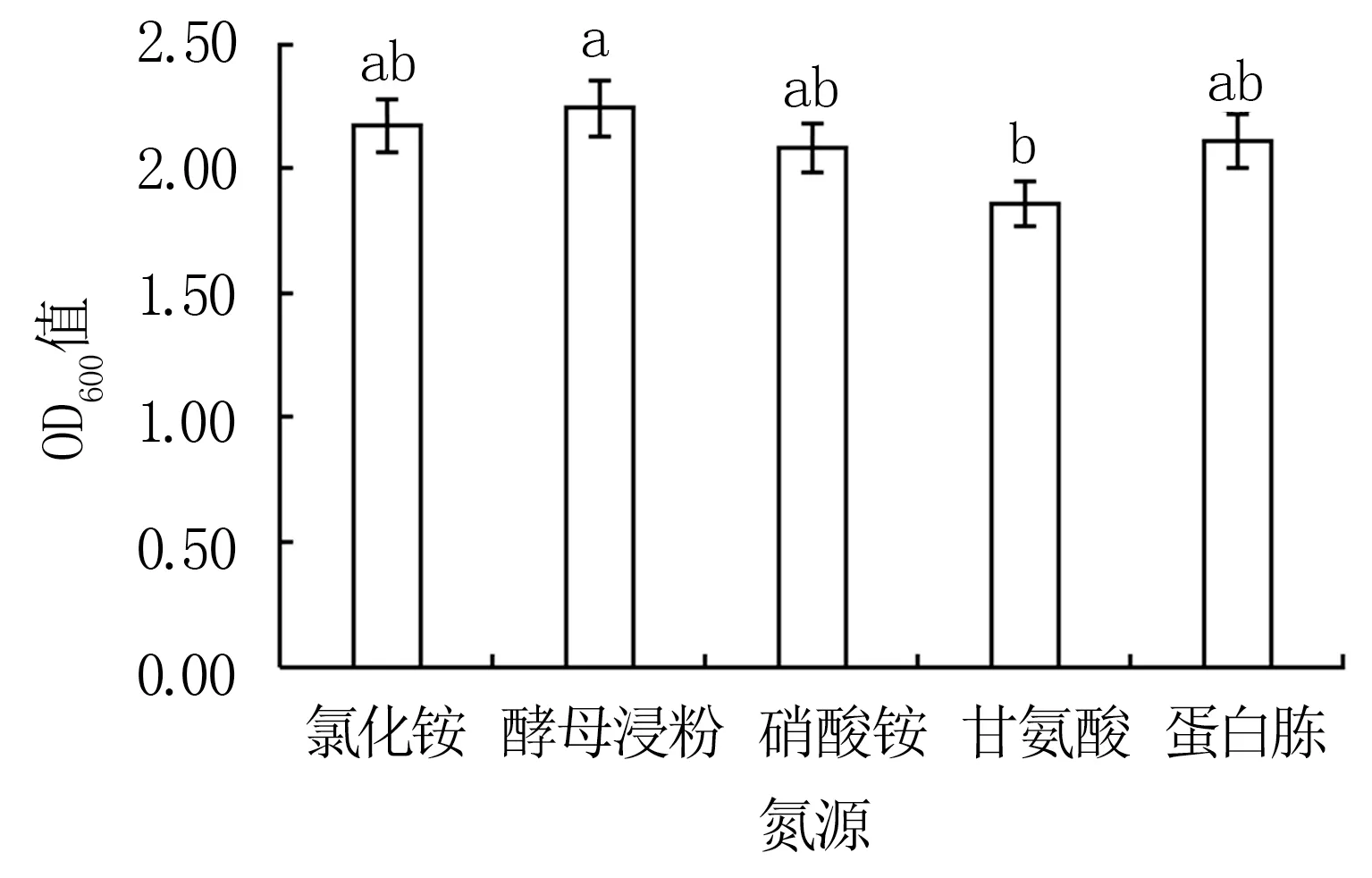
图6 不同氮源对Y12菌株生长的影响
2.3.3 温度对Y12菌株生长的影响 由图7可得,在一定温度范围内(16~40℃),Y12菌株的生长量差异不显著,说明一定范围温度变化对Y12生长的影响较小。其中,28℃为该菌的最适生长温度。
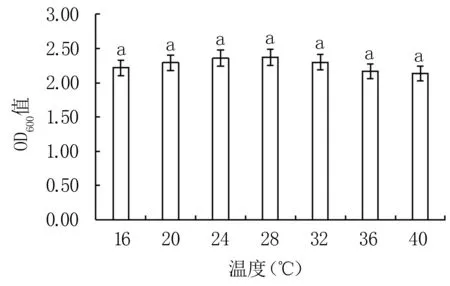
图7 不同温度对Y12菌株生长的影响
2.3.4 初始pH值对Y12菌株生长的影响 pH=7时Y12生长状况最好(OD600值为2.56),pH=4、pH=5的生长环境对Y12具有显著的抑制作用(图8),这表明该菌不适于生存在强酸性环境下,而在弱酸至碱性环境中能较好的生存。
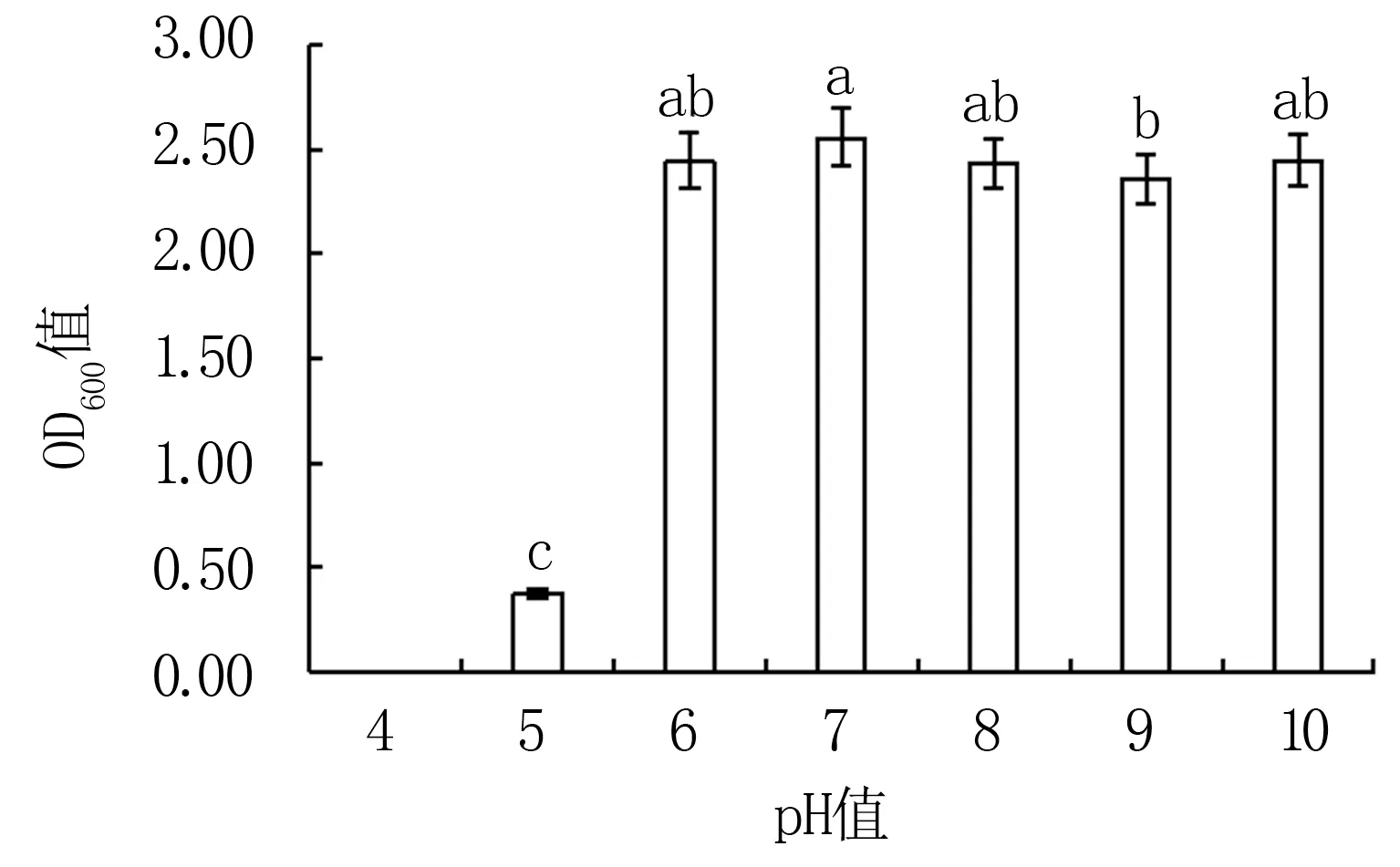
图8 不同pH值对Y12菌株生长的影响
2.3.5 装液量对Y12菌株生长的影响 由图9可知,装液量为20 mL时最有利于该菌生长(OD600值为2.54),在装液量为40、80、120、160 mL时的培养效果显著低于20 mL处理(P<0.05)。装液量越多,氧气含量越少,Y12菌株的生长受到抑制,这表明该菌为好氧型细菌,其生长对氧气含量有较高的要求。
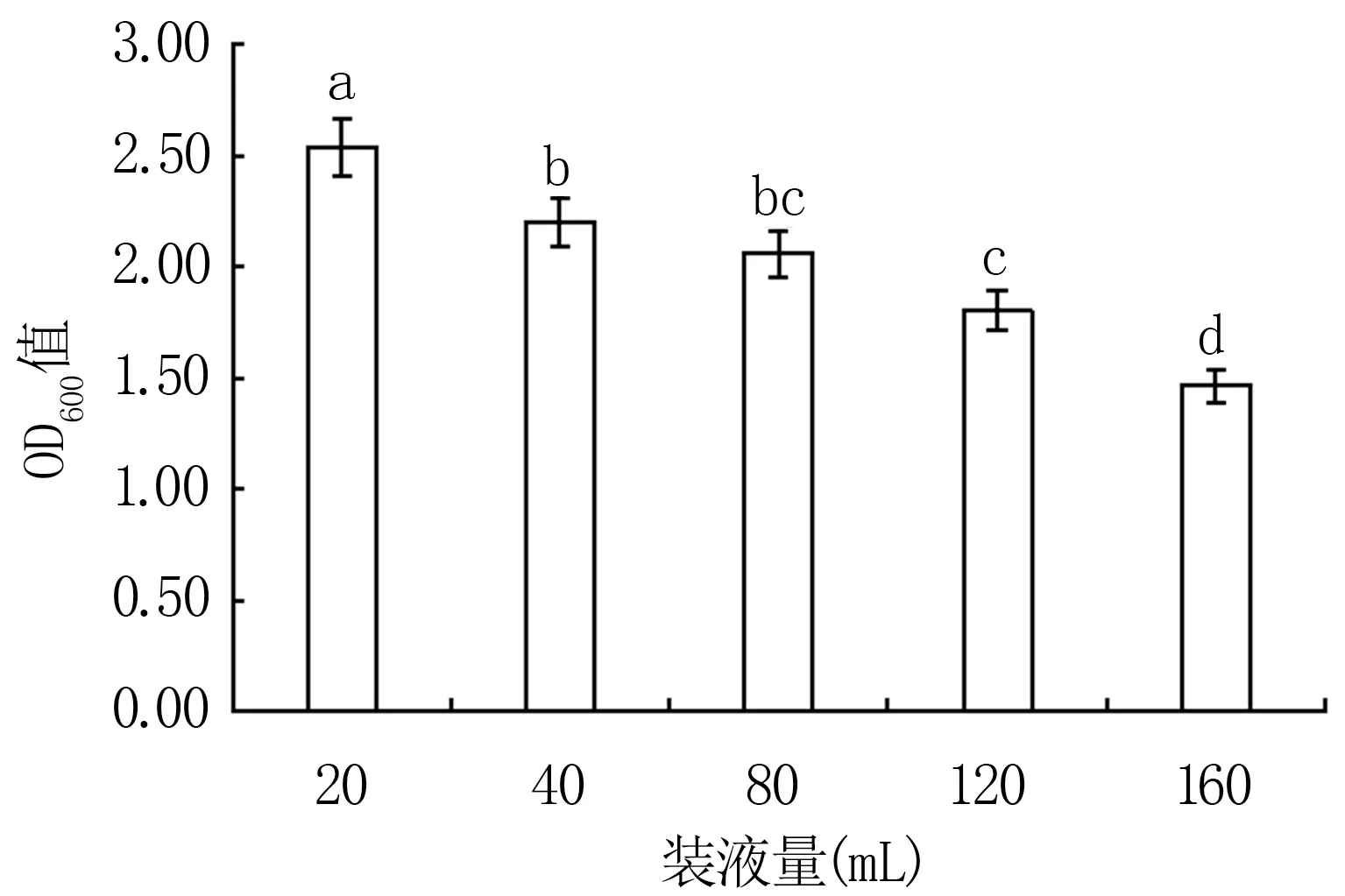
图9 不同装液量对Y12菌株生长的影响
2.3.6 发酵时间对Y12菌株生长的影响 由图10可知,Y12菌株的生长曲线呈“S”型。0~12 h内菌液浓度较低且变化缓慢,处于生长迟缓期。12 h后细菌生长速度急剧加快,菌液浓度不断增大,48 h后该菌生长趋于稳定。故12~48 h为Y12的对数生长期,生长速度最快。60 h时菌液浓度达到峰值,OD600值为2.17,60 h后细菌浓度逐渐下降,进入衰亡期。
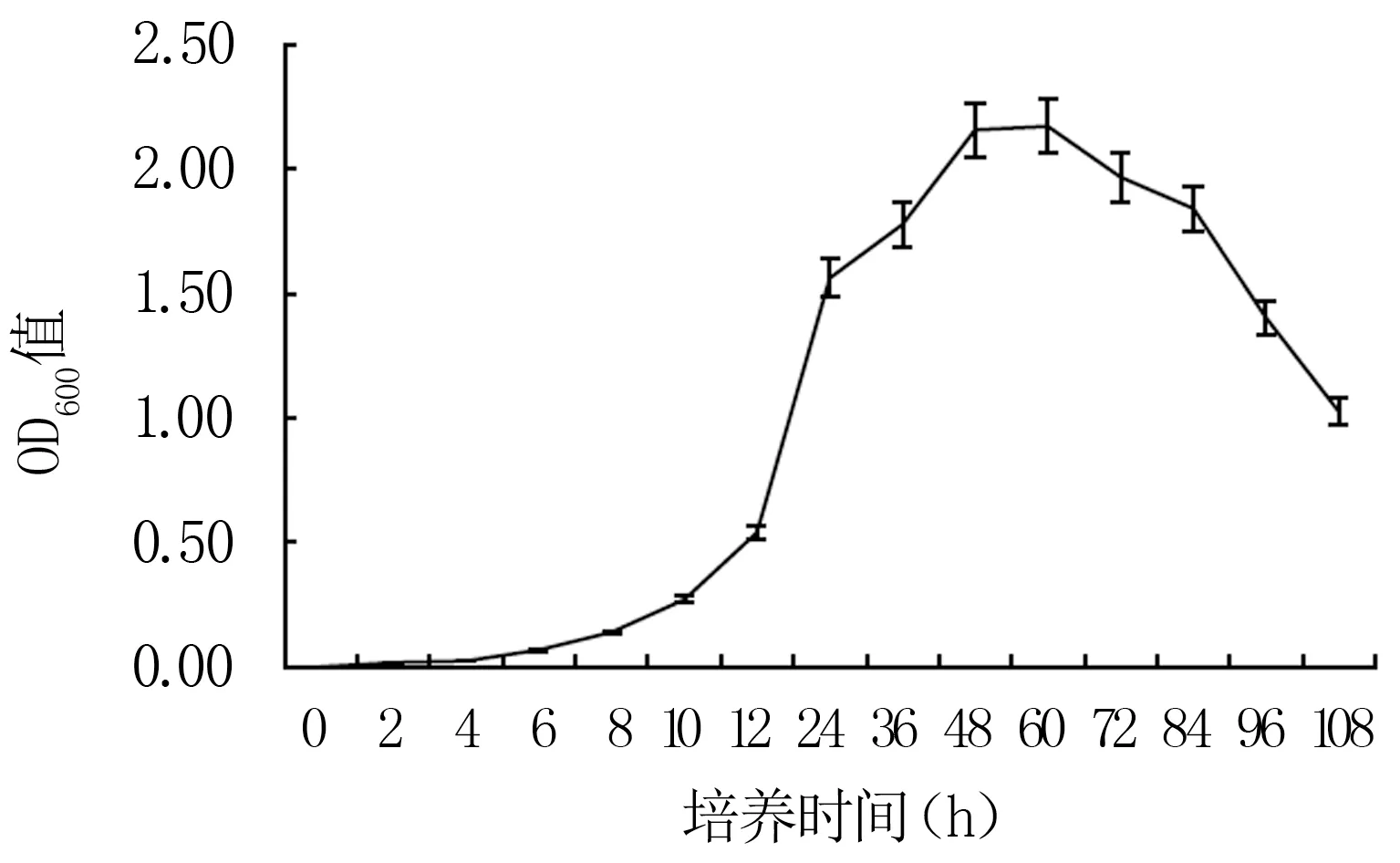
图10 Y12菌株生长曲线
2.3.7 转速对Y12菌株生长的影响 160、220 r/min和240 r/min培养效果较好,其中以220 r/min最优(OD600值为1.91);140、180 r/min培养效果略差;200 r/min培养效果最差,且显著低于160、220、240 r/min处理(P<0.05,图11)。
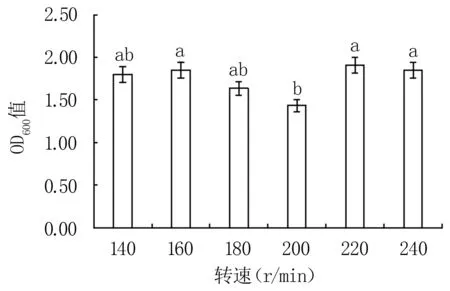
图11 不同转速对Y12菌株生长的影响
2.3.8 光照对细菌生长的影响 由图12可知,每日光照8 h的培养效果最优(OD600值为2.36),其次为4 h和0 h处理。12 h和24 h光照处理下的培养效果较差且与8 h光照处理组存在显著差异(P<0.05),16 h和20 h处理效果显著低于其它处理(P<0.05)。
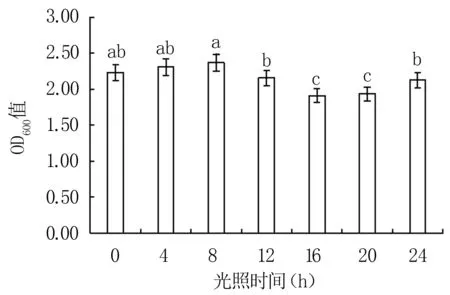
图12 不同光照时间对Y12菌株生长的影响
2.3.9 初始接菌量对Y12菌株生长的影响 由图13可知,不同初始接菌量对Y12菌株生长的影响差异不显著,其中接菌量为0.10%时最适宜Y12菌株生长(OD600值2.23)。
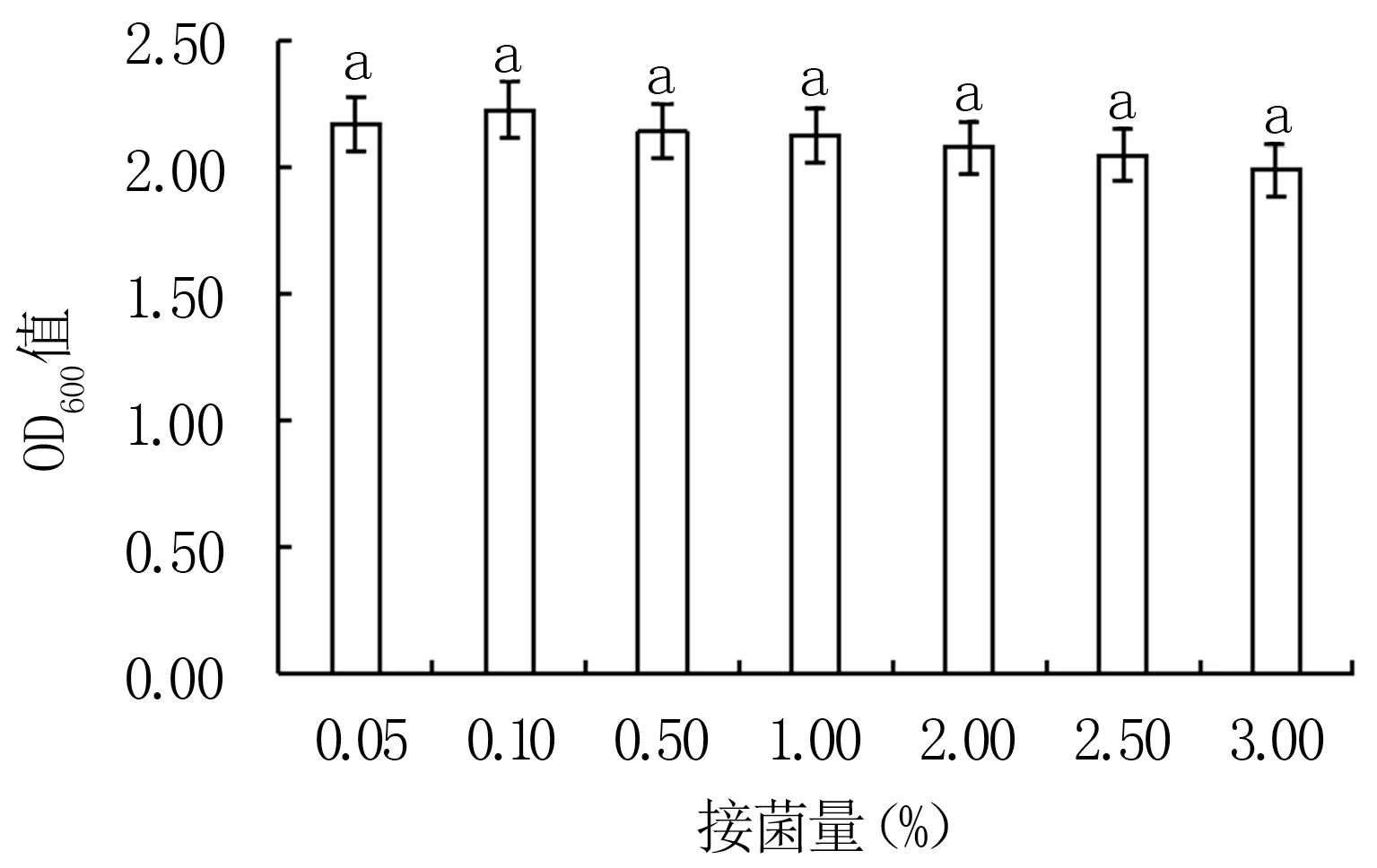
图13 不同接菌量对Y12菌株生长的影响
3 讨论与结论
前期从美洲大蠊肠道内分离到一株对烟草黑胫病拮抗作用较好的Y12菌株,通过形态学、生理生化特征及16S rRNA基因序列分析,确定该菌为铜绿假单胞菌(P.aeruginosa)。假单胞菌是自然界中种类和数量较多、分布最广泛的微生物之一,其丰富的遗传多样性为人类对其的研究提供了繁多的资源,拥有广阔的研究前景和应用价值[17,18]。有研究表明某些假单胞属生防菌对烟草黑胫病有良好的拮抗效果,可开发为生物农药用于田间防治[19]。关于将假单胞菌作为生防菌防治烟草黑胫病的研究已较为深入。例如许煜泉等[20]研究发现假单胞菌JKD-2能分泌铁载体以抑制稻瘟病菌(Piricularia orzae)的生长;谯天敏等[19]分离得到的一株铜绿假单胞菌ZB27,对杂交竹梢枯病病原菌具有较强的抑制作用;王远山等[21]的研究表明绿针假单胞菌(Pseudomonas choloraphis)可能因分泌某种抗生素类物质而表现出对烟草疫霉的拮抗作用;董国菊等[22,23]的研究发现荧光假单胞菌(Pseudomonas fluorescens)可通过分解纤维素、蛋白质和结合Fe3+,破坏烟草黑胫病病原菌细胞壁,从而抑制其生长。另外,荧光假单胞产生的抗生素吩嗪酸(PCA)和2,4-二乙酰藤黄酚(Ph1)被认为在抑制小麦全蚀菌Gaeamuuomyces gramiaisvar.tritici上起重要作用[24]。目前,相关研究中具有拮抗作用的铜绿假单胞菌多为根际土壤和植物体内分离所得[7-9],而Y12菌株由美洲大蠊肠道中分离得到,为昆虫内生菌用于生物防治提供了资源。
Y12最适培养基与发酵条件的筛选结果表明,该菌最适培养基成分为:牛肉浸膏8.0 g,酵母浸粉5.0 g,葡萄糖10.0 g,琼脂15.0 g,加蒸馏水至1 L;最适发酵条件为培养温度28℃、pH=7、装液量20 mL、发酵时间60 h、转速220 r/min、光照时间8 h/d、接菌量0.10%。相较于对病原真菌起拮抗作用的铜绿假单胞菌2016NX1的最佳发酵条件[25],Y12发酵的最适转速更高、发酵温度更低。采用最适培养基在最适条件下培养Y12可明显提高其发酵速度、增加其发酵产出效率,为利用Y12菌株开展菌剂制备等研究工作奠定了基础。Y12菌株对烟草黑胫病的拮抗效果仅通过平板对峙试验进行测定,并未在感病植株上进行抗病防治试验,后期需对其田间防治效果进行验证。
本研究表明铜绿假单胞菌Y12对烟草黑胫病病菌具有较明显的拮抗作用,为烟草黑胫病的生物防治提供了理论基础。
