猪繁殖与呼吸综合征病毒的流行病学研究进展
2022-09-19刘桂秀覃新云吕其壮黄婷雷小晓卢成淑
刘桂秀覃新云吕其壮黄婷雷小晓卢成淑
(1.玉林师范学院生物与制药学院,广西 玉林 537000;2.广西农产资源化学与生物技术重点实验室,广西 玉林 537000)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)属动脉炎病毒属的一种有囊膜的单股正链RNA病毒,因其能够导致发病猪出现短暂性的两耳皮肤紫绀,故又称为蓝耳病病毒。自1987年在美国首次发现以来,PRRSV已于全球范围内广泛存在,常引起母猪发热、厌食和繁殖障碍以及仔猪呼吸道疾病,给世界养猪业造成了巨大经济损失。中国于20世纪90年代中期发现该病并将其列为二类动物疫病,该病可在猪群中持续存在,单一感染或与其他病原体混合感染猪群,尤其是感染后产生的并发和继发感染使感染猪群的临床症状加重,死亡率增加,因此猪繁殖与呼吸障碍综合症(PRRS)是目前制约我国养猪业发展最为重要的病毒性传染病之一。但目前人们对于PRRSV流行病学特征的认识尚不全面,为此,本文结合有关PRRSV流行病学研究的最新成果对其流行病学研究进展情况进行系统分析,以期为后续相关研究提供参考。
1 流行病学研究
1.1 易感动物
PRRSV的宿主范围较广,包括猪、苍蝇、蚊虫、禽类等,但多种哺乳动物(啮齿类、浣熊、狗、猫)和某些鸟类(麻雀、椋鸟)对PRRSV有一定的抵抗能力,不易感染或传播[1-3]。研究表明,猪是唯一不区分大小均易感染PRRSV的易感动物,以母猪和仔猪最易感[4]。PRRSV感染的猪体组织器官范围极广,在肠、肝、肺、脾、肾、血液、淋巴结、胸腺、扁桃体、卵巢、子宫、睾丸、前列腺、尿道球腺、附睾等中均可检测到,甚至脑部也偶见阳性,提示PRRSV在猪体大部分组织中均可复制;但PRRSV又具严格的细胞嗜性,其主要靶细胞为肺泡巨噬细胞和单核细胞,且在体外主要感染猴肾细胞MA-104及其衍生的细胞系[5-8]。进一步研究发现,PRRSV从体外感染猪时,经呼吸道与猪肺泡巨噬细胞(PAMs)表面的受体相结合,从而借助这些特殊受体介导的内吞作用感染肺部细胞,并在细胞内快速增殖,导致细胞崩裂溶解,巨噬细胞数量下降,大量的病毒粒子被释放,再经血液循环传播至各组织器官[9]。另有资料显示,硫酸乙酰肝素(HepS)、唾液酸黏附素(Sn)、CD163受体、非肌肉肌动蛋白Ⅱ型重链A(non-muscle myosinⅡA)、波形蛋白(vimentin)、CD151、非肌球蛋白重链9(MYH9)、CD209和Siglec-10共9种受体已被确定为PRRSV侵入宿主细胞的主要受体[10,11]。随着对PRRSV受体研究的不断深入,未来有望为制定PRRS防控措施开辟新的思路,如研发相应受体阻断剂、设计新型疫苗以及抗病育种等。
2020年,冯晓慧等[1]从PRRSV阳性猪场采集感染病猪的淋巴结以及猪舍环境里的苍蝇进行研究,结果表明苍蝇源和猪场以及其他PRRSV代表株在基因上均存在不同程度的差异,并为飞行类昆虫作为媒介传播PRRSV提供了参考依据,但苍蝇源的出处还有待确定。除此之外,目前尚不确定人是否也可以感染PRRSV。
1.2 传播途径
感染猪是PRRS的重要传染源,PRRSV感染猪的淋巴结、脾脏、肺脏等组织后可以存活很长时间,并可以不断复制向外排毒[4]。PRRSV的传播途径可以分为垂直传播和水平传播,其中垂直传播为主要传播途径,也是PRRSV流行病学的重要特性。对于正处在繁殖期的猪群,主要是由感染母猪妊娠期通过胎盘以及感染公猪的精液传播。在感染母猪妊娠期传播过程中,由于妊娠母猪与胎儿血液之间相隔母体内皮层、子宫内膜结缔组织、子宫上皮、滋养层、胎儿胎盘间质和胎儿内皮层共6层组织,使得PRRSV难以直接穿越,但目前较多人认可的是母体巨噬细胞/单核细胞协助PRRSV穿过子宫上皮和滋养层抵达胎儿胎盘,并于胎盘某些位点高效复制,PRRSV阳性细胞由脐循环感染胎儿血管和器官[12];在感染公猪精液的传播过程中,PRRSV可感染生殖组织里生精小管的精细胞、精母细胞和睾丸间质巨噬细胞等上皮生殖细胞,导致被感染的生发细胞和巨噬细胞释放到感染公猪的精液中,从而使精液带毒,但生殖组织不可能是一个持续的来源,精液带毒可能是被感染的巨噬细胞和单核细胞从其他能够长时间隐匿病毒的位置迁移过来的[7]。水平传播是通过污染物(猪场工作人员的衣物、鞋、用品及场外购进的货品、运载工具等)、生物媒介、气溶胶等传播,其中以呼吸道传播为主[3]。因此,做好定期严格消毒,及时清理猪场排泄物,对污染物进行无害化处理等防控措施显得尤为重要。
1.3 流行特点
1.3.1 流行历史和基因分型 目前,PRRSV已遍布全球各国。尽管PRRS于1992年才被国际兽疫局(OIE)列为B类传染病,但研究表明PRRSV最早于1987年在美国首次暴发并流行起来,随后加拿大(1987年)、日本(1989年)、德国(1990年)、荷兰(1991年)等国家也陆续报道了此病[13,14],至今PRRSV已成为全球养猪行业的重要危害之一。在我国,PRRS最早出现于1995年,由郭宝清[15]、杨汉春[16]等先后分离出均属PRRSV2的毒株,分别被命名为CH-1a和BJ-4。Chen等[17]首次在中国检测到PRRSV1的分离毒株,初步为中国猪群中PRRSV1和PRRSV2的共存提供了事实依据。
PRRSV基因组约15 kb,包含至少10个开放阅读框(ORFs),其两侧分别有5′和3′非翻译区以及3′多聚腺苷尾酸,包括结构蛋白编码区(GP2、E、GP3、GP4、GP5、M、N、GP5a)和非结构蛋白编码 区(NSP1a、NSP1b、NSP2~NSP6、NSP7a、NSP7b、NSP8~NSP12)[18,19]。在PRRSV毒株变异过程中,不同于突变和重组,缺失可能发生在所有PRRSV基因组,其主要出现在NSP2和ORF5区域,且常被认为是新品系的特征[20]。目前,根据基因组序列和抗原特性之间的差异,可将PRRSV分为2个血清型,即PRRSV1(以Lelystad virus毒株为代表)和PRRSV2(以VR2332毒株为代表),该分类方法是根据Shi等[21,22]提出的PRRSV谱系进行划分,也是目前国际上比较公认的分类法。在中国,PRRSV2又可分为八个基因亚型,分别是lineage 1(NADC30、JL580等毒株)、lineage 3(QYYZ、GM2等近年来在华南地区流行的低致病毒株)、lineage 5(代表毒株VR-2332)、lineage 8(TJ、JXA1、TA-12等高致病毒株)、lineage 9(以CH-1a等为代表的经典毒株及2011年于新疆地区发现的毒株)以及本团队鉴定出的亚型6、亚型7、亚型8。2015年之前以高致病毒株为主,2015年之后NADC30/NADC34样毒株的检出率呈现明显的上升趋势[22-26]。最新研究表明,自2020年10月份以来,美国暴发多起PRRSV 1-4-4 Lineage 1C新型变异株疫情,可伴发严重的继发性细菌感染和引起感染母猪死亡,已成为美国现在检出率最高的毒株类型,但现有疫苗对其保护效果不佳[27]。目前尚不清楚PRRSV 1-4-4 Lineage 1C是否已传入中国猪群,仍需进一步监测。
1.3.2 感染率、发病率和死亡率 PRRSV在诸多猪场中具有较高的感染率。华东、华南和华中地区的感染率(23.89%~37.10%)较高,西北地区的感染率(15.10%)较低[28-32];在不同生长阶段的猪群中,保育仔猪(64.90%~68.30%)和妊娠母猪(38.09%~65.30%)最为易感,种猪感染率最低(12.65~15.6%)[33,34]。PRRSV在不同季节也表现出不同的感染率,以春季(15.44%~24.00%)和冬季(23.86%~25.44%)感染率较高[35,36],这与相应季节的温度、流动人员、猪种来源复杂和猪场管理易出现漏洞等密切相关,但也有部分地区PRRSV阳性率的检测结果显示无明显季节性[37],推测这可能受地区气候以及地势影响。针对PRRSV与其他病原混合感染情况的调查发现,与PCV2的混合感染率最高(10.77%~20.70%)[5,33,38]。一般情况下,PRRSV的发病率和死亡率与感染毒株种类、猪群管理因素等密切相关,其发病率可达50%~100%,死亡率可达20%~100%[39]。刘天真[40]研究发现,分娩季节、母猪胎次、种猪品种、障碍性疾病等复合性因素会在一定程度上影响母猪繁殖性能,可能也间接性地影响PRRSV发病率和死亡率。上述流行病学数据表明,PRRSV仍存在较大的隐患风险,其防控仍是我国养猪行业重要的关注点和突破点。
1.3.3 临床症状和病理特征 (1)临床症状:研究表明,各个阶段的生猪都极易受到感染,且不同生长阶段的猪感染所体现的临床症状有所区别,尤其以新生仔猪和断奶猪感染较严重,而且感染不同毒株表现也不同。猪群感染PRRSV后的典型症状表现为食欲不振、发热、呼吸障碍、繁殖障碍、淋巴结损伤及全身性的败血症[4,5]。被感染的怀孕母猪可表现为皮肤损伤与变色、早产、产死胎、产弱仔、部分自溶胎和木乃伊胎,产后还出现不规则发情、胎衣停滞、分泌物增加和泌乳困难等症状;新生哺乳仔猪会呈现严重的呼吸困难、急促,腹泻、颤抖、毛发杂乱,断奶前死亡率高,可达100%;断奶后是PRRSV感染病猪最易发病的阶段,感染猪仔又表现为生长迟缓,容易变为僵猪;种公猪经常仅表现为短暂性发热、精神抑郁、精子活力低、食欲不振[4,41]。值得注意的是,部分感染猪不一定会出现显著的临床特征,而是呈现隐性感染,因此要加强规范猪场内环境卫生及定期进行抗体检测等,及时发现,及时治疗[42]。
(2)病理特征:通常PRRSV感染猪全身淋巴结肿大,肺淤血、出血,间质增宽,肾脏表面、皮下、心脏、扁桃体可看到有出血点或出血斑,脾脏边缘或表面出血性梗死,肠系膜淋巴结出血、肿大[18,41]。PRRSV经鼻上皮细胞、扁桃体,最终侵入肺巨噬细胞,引起感染猪肺炎、心肌炎、脑炎、鼻炎、血管炎、淋巴结肿大等病理特征,其中最常见的病理变化是间质性肺炎,在组织学检查中可见肺泡壁增厚,出现炎性单核细胞和巨噬细胞浸润,肺泡上皮细胞变性,肺泡腔内常含细胞碎片或者其他蛋白质等,较多肺泡巨噬细胞被破坏[33,43]。病猪脑部的病变主要在脑干,脑干部的毛细血管周围会形成由浆细胞、巨噬细胞、核碎片及淋巴细胞等构成的“血管套”[44]。
1.4 地域、季节、年龄和品种
PRRSV是一种世界性生猪原发性病毒,在全球范围内均有分布。自在美国北卡罗林那州被发现以来,美国多个州的猪群均报道过PRRSV感染,随后美洲(加拿大、巴西、智利等)、欧洲(德国、荷兰、比利时等)、亚洲(日本、中国、韩国等)均有相关报道,说明PRRSV已在世界范围内流行,且无地理区域分布差异[14,45-47]。众多研究结果表明,PRRSV主要以地方性流行为主,偶尔存在暴发性流行[28,30,31,48]。PRRSV感染具有明显的季节性,经典PRRSV主要以秋末到春季为高发期,高致病性PRRSV主要以夏秋高温季节为高发期[35,37]。不同年龄、性别和品种(野猪及家猪如大白、长白、杜洛克等)的猪均可感染PRRSV,且可能存在隐性感染现象[4,42,49]。
1.5 共感染
研究发现,PRRSV可以和多种病原体[50-68][包括猪圆环病毒2型(PCV2)[50]、猪流行性腹泻病毒(PEDV)[51]、猪伪狂犬病病毒(PRV)[50]等]共同感染(表1),表现明显的呼吸疾病综合征,并呈现高死亡率。其中,以PRRSV与PCV2的共感染最为普遍,且死亡率较高[38,69],如王小敏等[69]在对我国7个省份的样品进行混合感染的流行病学调查研究中检测到PRRSV和PCV2的混合感染率达35.9%。即使PRRSV与其他多种病毒之间存在多重感染现象,但在混合感染病例中所起的作用以及各病原体之间的协同作用还有待进一步研究。

表1 与PRRSV相关的共感染病原体
2 小结
综上所述,PRRSV具有全球性、高感染率、高变异性、持续感染性等,给世界养猪业甚至人类生活带来隐患。PRRSV能够通过垂直感染和水平感染传播,传播范围广,感染率具有明显的季节性,可感染不同阶段的猪,且存在隐性感染、混合感染。除此之外,猪并非是PRRSV的唯一宿主,其还可以感染禽类(野鸭、鸟类等)、昆虫(家蝇、蚊虫等),提示PRRSV可能还存在其他未知宿主。由于PRRSV具有机体免疫逃避机制[39]、易重组变异等特性,有关PRRSV的致病机制仍需进一步研究。
目前,该病还没有可靠的治疗方法,只能依靠疫苗和控制传染源来控制PRRSV传播。疫苗免疫接种是当前防治该病的一种重要手段,我国当前主要的商用疫苗有灭活疫苗[德国勃林格殷格翰公司的Ingelvac®PRRS(P120株)疫苗、西班牙海博莱生物制药公司的Suipravac-PRRS(5710株)疫苗、山东齐鲁动物保健品有限公司的PRRSV-SD1灭活疫苗等)]、弱毒疫苗[西班牙Syva公司的Pyrsvac-183®(All-183株)弱毒疫苗、中国农业科学院哈尔滨兽医研究所的CH-1R弱毒苗等]以及近几年新上市的基因工程嵌合疫苗(武汉中博生物股份有限公司的PC株)[70-74](表2)。灭活疫苗制作工艺简单且运输方便,少有活病原体污染,不足之处主要体现在免疫效果低,需进行多次免疫,还可能存在诱发其他疾病的情况;弱毒疫苗对同源性野生毒株可提供保护作用,异种性毒株提供部分保护作用,但也有研究报道其有效性会随着PRRSV毒株的变异而逐渐降低、毒力反强、与现有毒株共感染等情况;基因工程嵌合疫苗同其他疫苗相比,其生产工艺较简单且成分单一,免疫剂量小,安全性相对较高,具有较好的应用前景,但与此相关的许多技术仍不成熟,其所带来的潜在危害还不清楚[75]。
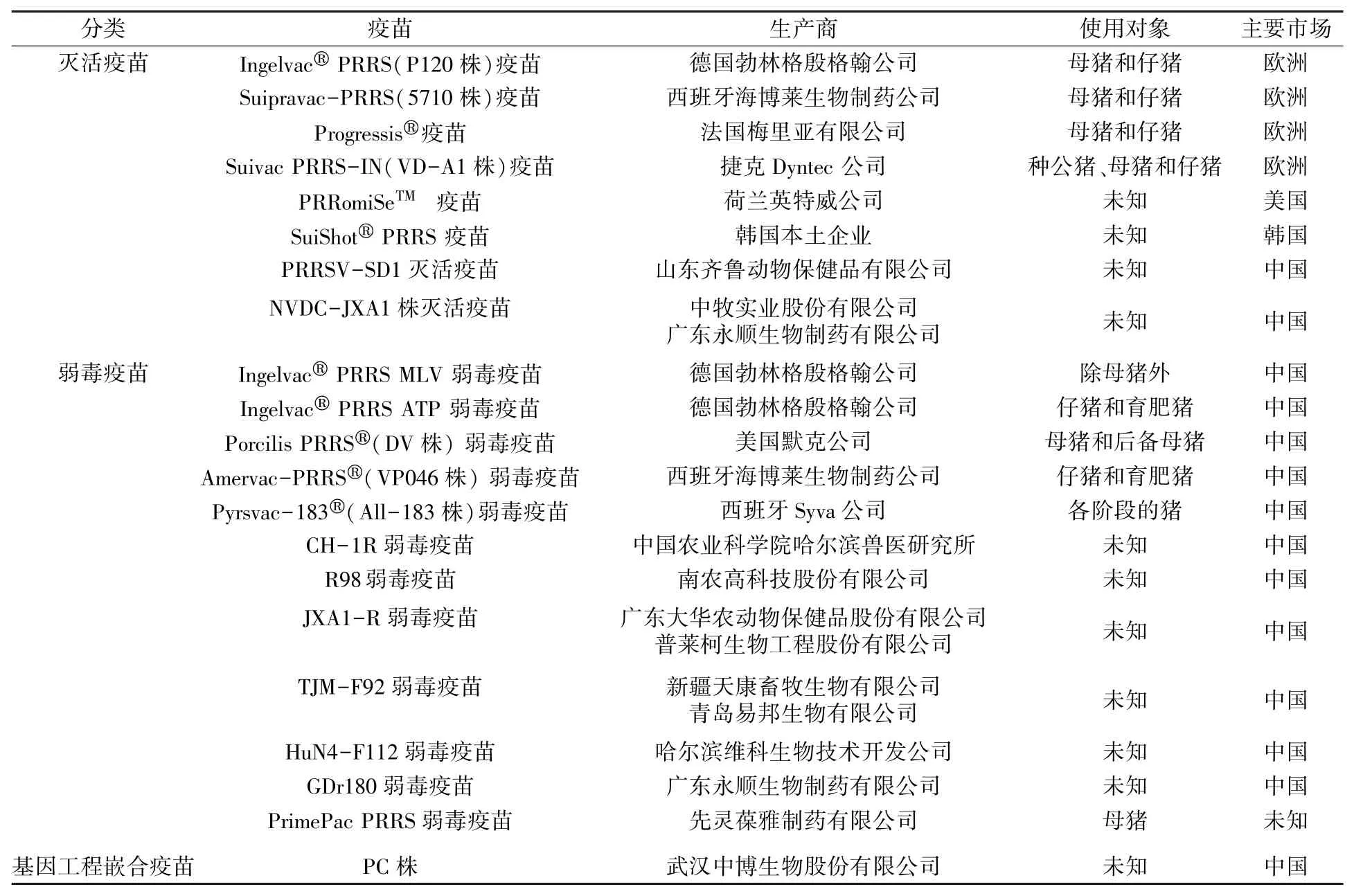
表2 猪繁殖与呼吸综合征疫苗信息
由于PRRSV的流行毒株不断变异,现有的PRRSV商品化疫苗的弊端也逐渐突显。随着PRRSV疫苗在国内所占份额增加以及基因工程技术的发展,人们正在不断向着开发新型、微量、无毒、高效、无杂质、不浪费免疫能力的疫苗前进。
