舟山新木姜子(Neolitsea sericea)幼苗对不同盐胁迫的光合生理响应
2022-09-17谷雅馨岳春雷周星怡李贺鹏
谷雅馨, 岳春雷, 周星怡, 李贺鹏
舟山新木姜子()幼苗对不同盐胁迫的光合生理响应
谷雅馨1,2, 岳春雷2,*, 周星怡3, 李贺鹏2
1. 浙江农林大学林业与生物技术学院, 临安 318020 2. 浙江省林业科学研究院, 杭州 310023 3. 南京农业大学生命科学学院, 南京 210095
为评价舟山新木姜子()的耐盐性, 对其在不同盐胁迫下的光合生理特性进行实验研究。以舟山新木姜子2年实生幼苗为试验材料进行盆栽实验, 通过添加不同浓度的NaCl溶液, 设置4个不同土壤盐分处理(土壤含盐量分别为0、0.3%、0.6% 和0.9%)。分别在第10 d、20 d、30 d、40 d, 测定舟山新木姜子幼苗在不同处理条件下的叶片叶绿素含量()、净光合速率(P)和最大光化学效率()等指标。结果表明:在不同处理之间, 在相同的胁迫阶段, 叶片无显著性差异(>0.05);在各胁迫阶段, 随着土壤含盐量的增大,叶片P、最大光合速率(P)和光饱和点()都呈现下降趋势。在轻度盐胁迫(0.3%)舟山新木姜子幼苗叶片介于0.74—0.78之间, 与对照无显著性差异(<0.05), 中度(0.6%)和重度盐胁迫(0.9%)最终都显著降低了叶片; 在胁迫初期, 0.3%、0.6%和0.9%土壤盐分处理条件下P与CK相比分别下降了29.46%、52.51%、97.91%; 在胁迫初期,随土壤含盐量的增加而升高, 0.3%土壤盐分处理条件下叶片随胁迫时间的延长呈现先下降后上升的趋势。研究表明, 舟山新木姜子幼苗在轻度盐胁迫下(土壤含盐量0.3%)生长受到了一定程度的抑制, 但仍能正常存活, 表现出一定的耐盐性; 在中度(土壤含盐量0.6%)和重度盐胁迫下(土壤含盐量0.9%)则无法存活。该研究结果为该物种迁地保护和滨海盐碱地造林树种选择提供了理论科学依据。
舟山新木姜子; 盐胁迫; 耐盐性; 光合特性; 叶绿素荧光参数
0 前言
植物光合作用是植物生长、发育的基础, 是植物体内物质和能量代谢的关键[1]。光合作用与植物的生存环境密切相关, 而且是一个极其复杂的生理过程, 受到植物本身生理特性和外界环境因子的影响, 其中光照、水分、CO2浓度、温度等都是影响光合速率的重要因素[2-3]。土壤盐分也是影响植物光合作用的主要环境因子之一。盐胁迫通过限制CO2扩散、改变光合代谢机制或抑制光化学系统运行, 直接或间接地影响植物光合作用, 成为许多地区农林业生产与发展的障碍之一[4-5]。我国有将近1亿公顷的盐碱地, 大约占世界总盐碱地面积的十分之一[6]。因此, 研究植物光合作用对盐胁迫的响应特征对于科学评价植物的耐盐性, 筛选耐盐植物进行盐碱地造林有重要意义。
目前关于盐胁迫下光合作用的研究大多集中在农作物或草本植物上, 而对木本植物的研究则较少[7], 仅限于榆树()、绒毛白蜡)、厚叶石斑木()、海桐()、海滨木槿()等少数种类[8-11]。舟山新木姜子()是樟科()新木姜子属()的常绿乔木, 主要分布于我国浙江省舟山与上海崇明, 朝鲜[14]及日本也有分布记录, 对研究东亚植物区系和海岛植物区系有重要意义[12-14]。该种植物野外生长环境恶劣,植株数量稀少, 已被列入国家重点保护野生植物名录(第一批), 为国家二级重点保护植物[15]。目前对舟山新木姜子的研究主要集中在种群结构、群落遗传多样性等方面[16-17]。本文以2年生舟山新木姜子植株为实验材料, 研究舟山新木姜子幼苗光合生理生态特性对土壤盐胁迫的响应, 探讨其对土壤盐胁迫的适应能力和濒危机理, 为其种群恢复和滨海盐碱地造林树种选择提供理论依据。
1 材料与方法
1.1 试验材料
选取无病虫害、健康生长且长势一致的2年实生舟山新木姜子植株作为供试植物。采用盆栽法进行实验, 选用上口直径25.5 cm, 下口直径16.0 cm, 高19.0 cm的塑料花盆, 每盆栽植1株。栽培基质为苗圃熟土, 其理化特性见表1。
1.2 试验设计
2018年5月将舟山新木姜子2年生盆栽植株移入浙江省林科院苗圃大棚内缓苗, 期间正常供水。经过3个月的适应性生长后, 进行土壤盐胁迫处理。为防止盐分渗漏, 塑料花盆下方垫有托盘。试验设置4个不同的盐胁迫处理, 试验时一次性浇入不同浓度的NaCl溶液, 使栽培土壤含盐量分别为0%(CK, 0 g·kg-1)、0.3%(3 g·kg-1)、0.6%(6 g·kg-1)和0.9%(9 g·kg-1)。每个处理3个重复。每10d测定1次供试植株的光合指标。
1.3 数据测量
1.3.1 光合—光响应曲线的测定
天气晴朗的上午9:00—11:30使用Li-6400便携式光合作用测定系统(Licor, USA), 选取植株顶端向下的第3或第4个叶片, 通过红蓝光源(red blue 6400-02B)从低到高设定光合有效辐射(PAR)0、20、50、100、200、400、600、800、1000、1200、1500 和2000 μmol·m-2·s-1, 测定供试植株的净光合速率(P)[18]。
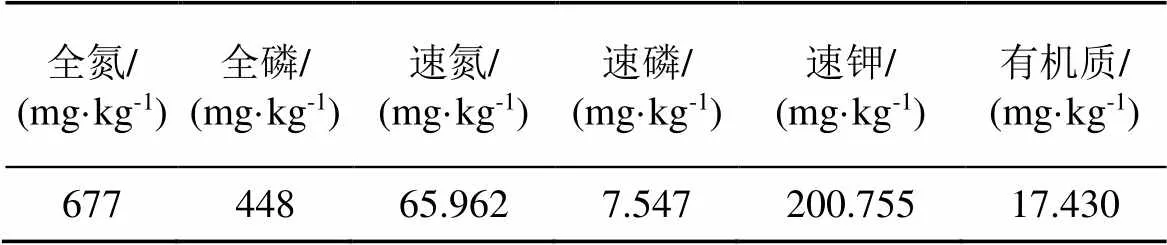
表1 舟山新木姜子幼苗栽培基质的理化特性
1.3.2 叶绿素含量测定
选取与光响应曲线测定相同位置和发育阶段的叶片, 采用丙酮、无水乙醇和蒸馏水的混合液提取叶绿素[19], 并用紫外分光光度计测定吸光值, 最后计算出叶绿素总含量。
1.3.3 叶绿素荧光参数测定
天气晴朗的上午9:00—11:30选用Li-6400标准荧光叶室(6400-40 Default Flurometer)进行叶绿素荧光参数测定。选取与光响应曲线测定相同位置和发育阶段的叶片, 首先采用配套的Li-Cor暗适应夹对叶片进行30 min的暗处理, 然后测定其初始荧光()、最大荧光()和光化学效率()。
1.4 数据处理
采用双曲线修正模型(式1)对光响应曲线进行拟合, 计算出最大光合速率(P)、光补偿点()、光饱和点()[20]。应用SPSS 23.0进行统计分析, 运用LSD法进行多重比较和显著性检验, 使用Origin2018软件绘图。
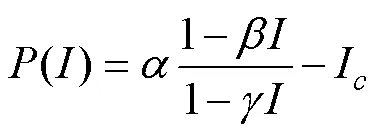
式1中()为净光合速率,为光合有效辐射,为光响应曲线的初始斜率,和为修正系数,I为暗呼吸速率(R)。
2 结果与分析
2.1 舟山新木姜子幼苗生长对盐胁迫的响应
在不同土壤含盐量下, CK的幼苗生长状况最好, 植物顶端萌发新芽; 0.3%处理幼苗存活, 生长情况较CK略差, 但仍能正常生长; 0.6%处理10 d幼苗叶片开始干枯, 20 d大部分叶片尖端变干枯, 30 d叶片脱落, 40 d全部死亡; 0.9%处理幼苗从胁迫处理3 d开始, 顶端叶片萎蔫, 6 d叶片出现枯斑, 10 d大部分叶片干枯、脱落, 20 d植株全部死亡。
2.2 舟山新木姜子幼苗光合速率对盐胁迫的响应
由图1可以看出, 实验初期(A), CK、0.3%、0.6%处理幼苗叶片的光响应曲线呈现相似的变化趋势, 且随着土壤含盐量的上升, 在相同PAR下,P呈下降趋势。0.9%处理的植株接近死亡,P在0 μmol·m-2·s-1附近。20 d(B)时CK幼苗叶片的光响应曲线与第10 d无明显变化, 0.3%处理幼苗的光合作用受到进一步的抑制, 其P明显降低, 降幅约为50%; 0.6%处理的幼苗仍然存活, 但幼苗叶片的P接近0 μmol·m-2·s-1; 0.9%处理幼苗已死亡。30 d时, CK、0.3%、0.6%处理幼苗叶片的光响应曲线与第20 d无明显变化。40 d时0.3%处理幼苗光响应曲线与第20 d和第30 d无明显变化, 0.6%处理的幼苗死亡。总体来说, 随着土壤盐度的增大舟山新木姜子幼苗光合速率呈现明显下降。
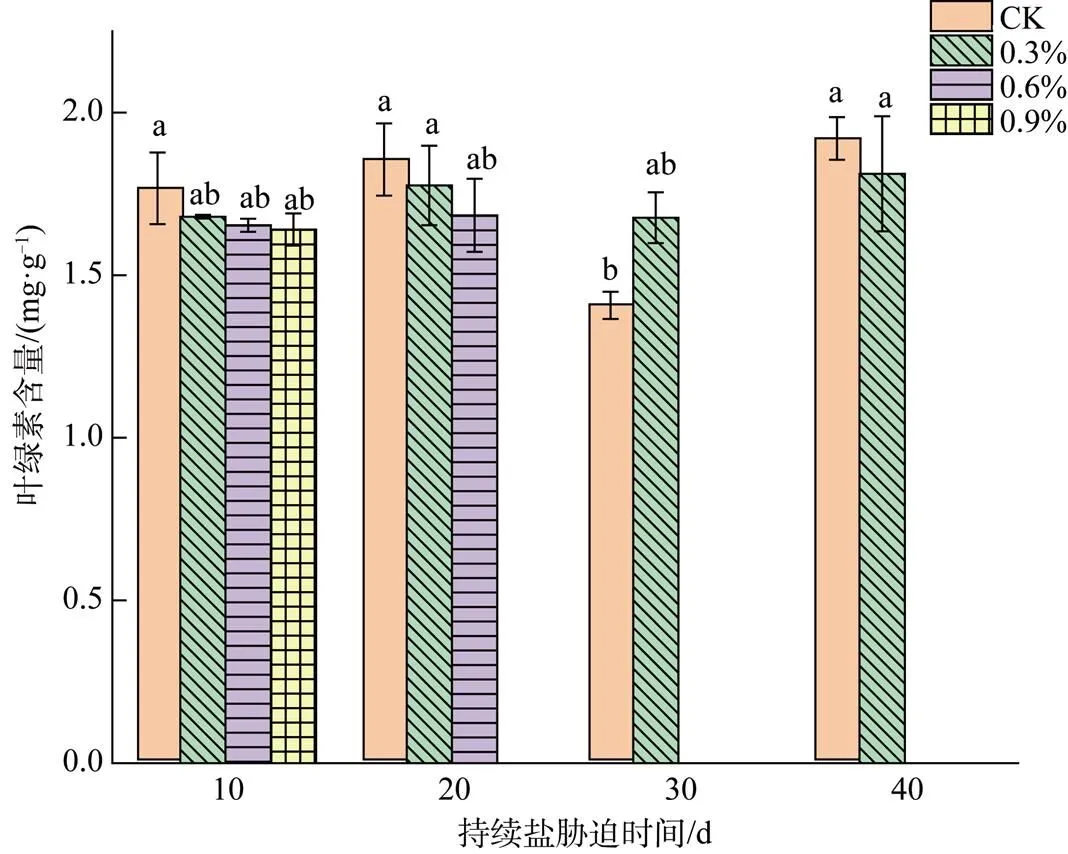
2.3 舟山新木姜子幼苗叶绿素含量对盐胁迫的响应
由图2可以看出, 舟山新木姜子幼苗叶片的叶绿素含量()在胁迫初期随着土壤含盐量的上升有轻微的下降, 但差异均不显著(>0.05)。CK植株的在10 d、20 d、40 d时均为最高; 0.3%处理的植株在持续的盐胁迫下变化不大, 总体维持在1.65—1.82 mg·g-1的区间中; 0.6%处理的植株在第10 d、20 d时无显著变化, 但在30 d时大部分叶片脱落; 0.9%处理的植株在10 d时和其它处理之间差异不显著(>0.05), 在20 d时植株死亡。总体而言, 各处理的存活植株在相同的胁迫时期内均无显著差异(>0.05), 盐胁迫对舟山新木姜子幼苗的并无明显影响。
2.4 舟山新木姜子幼苗叶绿素荧光对盐胁迫的响应
由图3可以看出, 舟山新木姜子幼苗叶片/总体随着土壤含盐量的上升而下降。在10 d时CK、0.3%、0.6%处理的幼苗叶片/随着土壤盐度上升有轻微下降趋势, 但差异不显著(>0.05); 0.9%处理的幼苗叶片/为0.57, 显著低于其它处理(<0.05)。在20 d时/随着土壤含盐量上升依旧呈现轻微下降趋势, 分别为0.80、0.78、0.76, 但差异不显著(>0.05); 0.9%处理的幼苗已死亡。在30 d时, CK与0.3%处理的幼苗叶片/无明显的变化, 分别为0.78、0.74, 但0.6%处理的幼苗叶片/大幅下降, 为0.49, 显著低于CK与0.3%处理(<0.05)。在40 d时CK与0.3%处理的幼苗叶片/无明显变化, 分别为0.81、0.78; 0.6%处理的植株幼苗已死亡。40 d时0.3%处理的幼苗叶片/相对于30 d时有轻微上升。总体来说, 轻度盐胁迫(0.3%)对舟山新木姜子幼苗叶片的/无显著影响, 中度(0.6%)和重度盐胁迫(0.9%)最终都显著降低了舟山新木姜子幼苗叶片的/。

注: A、B、C和D分别代表盐胁迫的第10、20、30和40天。
Figure 1 The light response curves of net photosynthetic rate forseedlings under different soil salt treatments
注: 不同小写字母表示不同处理间差异显著(P<0.05), 下同。
Figure 2 Chlorophyll content in leaves ofseedlingsunder different soil salt treatments

图3 不同土壤盐分处理下舟山新木姜子的叶绿素荧光
Figure 3 Maximal photochemical efficiency ofⅡ() ofseedlings under different soil salt treatments
2.5 舟山新木姜子幼苗光合生理参数对盐胁迫的响应
P反应了舟山新木姜子对强光的利用能力[21]。从表2可以看出, 同一胁迫时间的舟山新木姜子幼苗叶片的P随着土壤含盐量的增加出现了明显的下降, 0.3%、0.6%、0.9%处理下各个胁迫时间的P均显著低于CK(<0.05)。0.3%、0.6%与0.9%处理下幼苗叶片的P在10d时与CK相比分别下降了29.46%、52.51%与97.91%, 0.9%处理的幼苗叶片P在10d时仅为0.108 μmol·m-2·s-1; 0.6%处理的幼苗叶片P在20d时降至0.257 μmol·m-2·s-1, 在30d时降至0.171 μmol·m-2·s-1, 已无法进行正常的光合反应; 0.3%处理的幼苗叶片P则稳定在了1.4—1.8 μmol·m-2·s-1, 虽与CK处理有显著的下降(<0.05), 但仍然存活。R为舟山新木姜子幼苗对光合产物的消耗速率, 与植物的生理活性有关[22]。从表2可以看出, 不同处理的舟山新木姜子幼苗叶片的R在不同胁迫时间无明显变化趋势, 无法反映土壤盐胁迫对舟山新木姜子生理活性的影响。通过测量计算能够直观地反映舟山新木姜子幼苗对弱光的适应能力, 而能够有效地反映舟山新木姜子幼苗对强光的适应能力。从表2可以看出, 除0.9%处理的植株在10d已不能进行正常的光合反应,无法计算以外, 同一胁迫时间舟山新木姜子幼苗的随着土壤含盐量的增加出现了明显的下降, 10d时0.3%、0.6%处理植株叶片的与CK相比分别降低了18.37%与52.22%; 0.3%处理植株叶片的在20d时大幅度下降至363.946 μmol·m-2·s-1, 与10d时相比下降了64.11%, 随后在30d与40d时回升至510.687与593.104 μmol·m-2·s-1; 0.6%处理的植株叶片在20d时已无法测量与。在胁迫初期,随着土壤含盐量的上升而增加, 0.3%处理的随着胁迫时间的延长出现了先下降后上升的现象。
3 讨论
国内外均有研究表明, 盐胁迫对植物的生长有明显的抑制作用[23-25]。土壤盐胁迫期间, 对照处理的舟山新木姜子幼苗长势良好; 轻度(0.3%)处理的幼苗生长正常; 但在土壤含盐量为0.9%处理的舟山新木姜子幼苗在10 d已经出现了叶片萎蔫和凋落现象, 表明其无法在重度(0.9%)盐胁迫的环境下存活; 并且在土壤含盐量为0.6%处理的舟山新木姜子幼苗在30 d出现了严重的凋落现象, 植株均接近死亡, 表明舟山新木姜子幼苗在盐含量大于0.6%的土壤中不能长期存活。
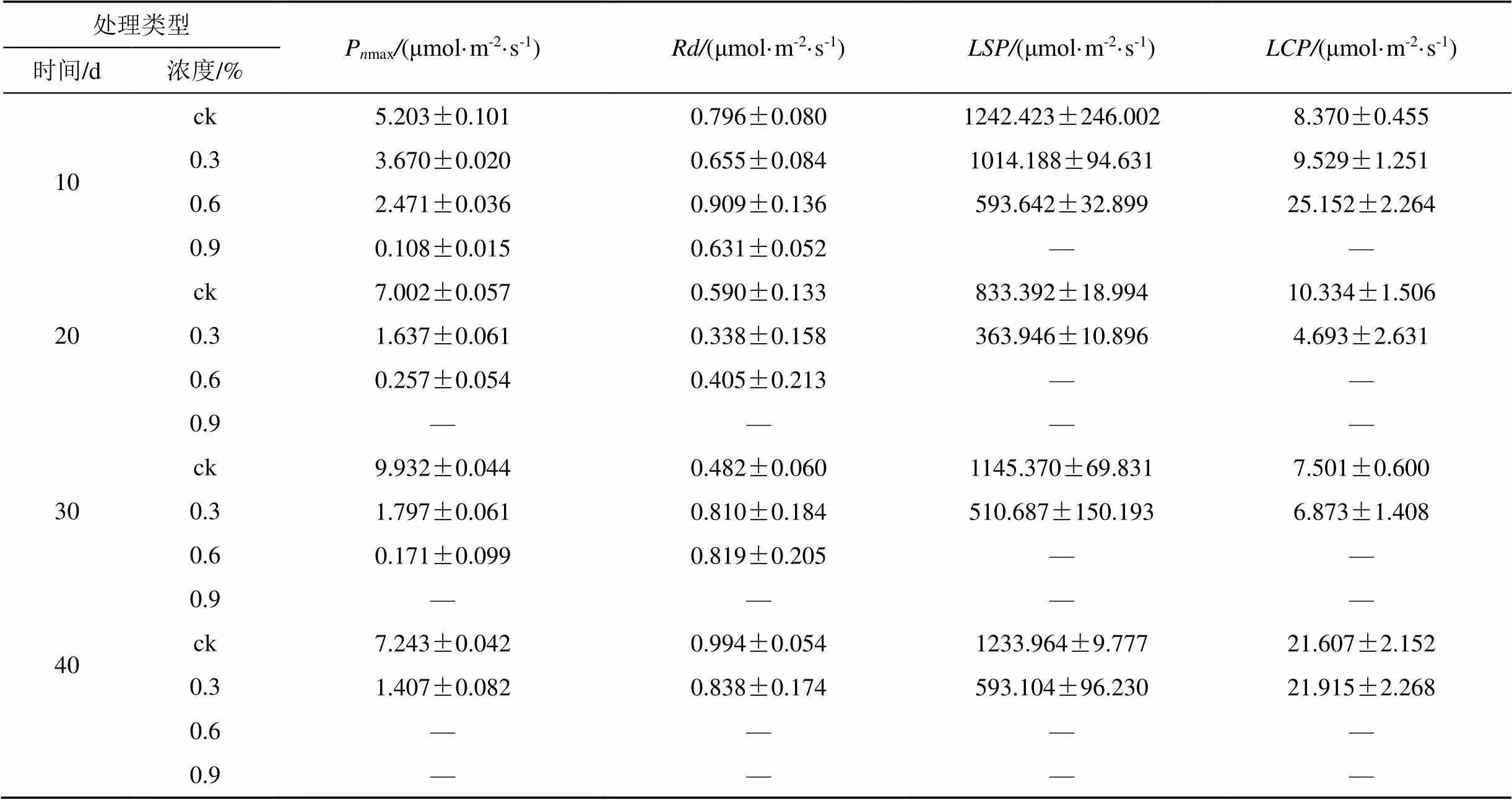
表2 不同土壤盐分处理下舟山新木姜子的光合生理参数
注:Pmax: 最大净光合速率;R: 暗呼吸速率;: 光饱和点;:光补偿点。
3.1 舟山新木姜子幼苗光响应特征参数对盐胁迫的响应
胁迫环境下植物的光响应特征参数有助于判定植物光合机构的运转状况, 即其光合作用能力与效率受环境变化影响的程度[26]。舟山新木姜子幼苗叶片的与土壤含盐量总体成负相关; 轻度盐胁迫植株叶片在胁迫初期随着土壤含盐量的增加而增加, 之后出现了先下降后上升的趋势。植物光合作用是其生长发育的重要基础[27]。通过测量植物叶片P, 可以直观地反映植物的光合系统是否运作正常。由图1可以看出, 随着光合有效辐射的增加, 不同盐度处理的幼苗叶片P均在低光合有效辐射(<600 μmol·m-2·s-1)下呈现出快速上升的趋势; 而在中高光合有效辐射(>600 μmol·m-2·s-1)下, 幼苗叶片P增速逐渐放缓; 且在高光合有效辐射(>1200 μmol·m-2·s-1)下P出现轻微回落的现象。回落的原因可能是光强超过了光饱和点, 舟山新木姜子幼苗出现了光抑制现象, 即光能超过植株的光合系统所能利用的数量时, 光合功能下降的现象[28]。在胁迫的各个阶段, 不同盐度处理幼苗的光响应曲线呈现出了明显的差异, 幼苗叶片P均表现出随着土壤盐度的增加而明显下降的趋势, 0.3%、0.6%、0.9%处理的植株叶片P均与CK存在显著差异(<0.05)。在相同光照强度下舟山新木姜子幼苗叶片的P随着土壤含盐量的升高出现了明显下降, 表明土壤含盐量越高, 舟山新木姜子幼苗生长受到的抑制越严重, 表现出与胁迫程度明显的相关性。P也同时表现出了随着土壤含盐量上升而大幅下降的趋势。P与P的变化说明盐胁迫极大地制约了叶片的光能转化效率, 对舟山新木姜子的光合作用有着严重的负面影响。同时, 舟山新木姜子在轻度盐胁迫下的光响应参数也说明了该植物在轻度盐胁迫下对光仍能保持较强的生态适应性。
3.2 舟山新木姜子幼苗叶绿素含量对盐胁迫的响应
植物叶绿素含量是衡量植物对胁迫环境抵抗程度的重要指标之一[29]。从一定程度上植物叶绿素含量的高低可以反映植物光合作用的强弱, 从而也能反应植物的生长状况[30]。植物处于盐胁迫逆境中, 一般会造成叶片的降低、P下降[31]。实验表明, 随着土壤含盐量逐渐增加, 不同盐度处理的存活植株的叶绿素含量在各个测量阶段均无显著差异。此现象说明舟山新木姜子幼苗的对盐胁迫可能存在反应但并不敏感, 不能用来反映舟山新木姜子幼苗对盐土壤环境的抗性。
3.3 舟山新木姜子幼苗叶绿素荧光对盐胁迫的响应
植物叶绿素荧光是一个很好的反映植物生理状态和环境之间关系的探针[32-33]。通过测定胁迫下植物的叶绿素荧光参数可以直接了解胁迫对植物细胞的伤害情况或间接了解光合作用过程[34]。经过充分的暗适应后, 非胁迫条件下的植物叶片变化不大, 一般在0.75—0.85之间, 不受物种及生长条件的影响[35]。本实验研究结果显示, 胁迫初期0.9%处理的显著低于CK、0.3%、0.6%处理, 其他处理之间差异不显著(>0.05)。在胁迫初期高浓度的盐环境对舟山新木姜子幼苗的光系统(II)产生了严重的伤害[36], 使其潜在活性与光能转换效率受到了明显的削弱。在20 d时, CK、0.3%与0.6%处理的均无显著变化, 0.9%处理植株死亡。随着胁迫时间的延长, 0.6%处理的均值在30d时下降为0.492, 下降幅度为35.2%, 表明舟山新木姜子幼苗在短时间内对中盐度的土壤环境有一定的抗性, 但随着胁迫时间的延长, 中盐度的土壤环境会对舟山新木姜子幼苗的II产生严重的伤害, 从而使II的光化学活性及能量转化率下降, 最终影响植物光合机构的作用, 导致了净光合速率的显著下降。虽然舟山新木姜子幼苗无法在中高盐度的土壤中长期存活, 但在轻度(0.3%)的盐胁迫下, 其植株始终生长正常,维持在0.74—0.78之间, 与CK处理组无显著差异, 较低的土壤含盐量没有对舟山新木姜子幼苗II反应中心造成损伤, 光抑制作用不明显, 表明舟山新木姜子幼苗对轻盐度土壤环境有一定的抗性。本研究表明, 舟山新木姜子幼苗在土壤含盐量为0.3%时能正常生长, 而土壤含盐量达到0.6%及以上时, 对舟山新木姜子幼苗生长和光合作用造成严重影响, 最终导致植物的死亡。舟山新木姜子幼苗对轻度土壤盐胁迫有良好的适应性, 可在土壤含盐量低于0.3%的区域种植。由于舟山新木姜子仅能在含盐量较低的土壤中存活, 在主要分布地东亚沿海岛屿的大量中高土壤含盐量的区域则无法扩散其种群。由此推断, 舟山新木姜子耐盐性较低可能是其濒危的原因之一。
[1] 叶波, 张玲, 王国明. 舟山海岛主要造林树种幼苗的光合特性[J]. 南京林业大学学报(自然科学版), 2018, 42(3): 105-110.
[2] 吴芹, 张光灿, 裴斌, 等. 不同土壤水分下山杏光合作用CO2响应过程及其模拟[J]. 应用生态学报, 2013, 24(6): 1517-1524.
[3] XU Y, IBRAHIM I M, HARVEY P J. The influence of photoperiod and light intensity on the growth and photosynthesis of(chlorophyta) CCAP 19/30[J]. Plant Physiology and Biochemistry, 2016, 106: 305-315.
[4] SILVA E N, RIBEIRO R V, FERREIRA-SILVA S L, et a1. Comparative effects of salinity and water stress on photosynthesis, water relations and growth ofplants[J]. Journal of Arid Environments, 2010, 74(10): 1130-1137.
[5] 张忠辉, 林士杰, 吕忠明, 等. 树木耐盐碱性研究进展[J]. 中国农学通报, 2011, 27(28): 9-14.
[6] 王兴军, 侯蕾, 厉广辉, 等. 黄河三角洲盐碱地高效生态利用新模式[J].山东农业科学, 2020, 52(8): 128-135.
[7] 秦景, 董雯怡, 贺康宁, 等. 盐胁迫对沙棘幼苗生长与光合生理特征的影响[J]. 生态环境学报, 2009, 8(3): 1031-1036.
[8] 周丹丹, 刘德玺, 李存华, 等. 盐胁迫对朴树和速生白榆幼苗光合特性及叶绿素荧光参数的影响[J]. 西北植物学报, 2016, 36(5): 1004-1011.
[9] 张川红, 沈应柏, 尹伟伦, 等. 盐胁迫对几种苗木生长及光合作用的影响[J]. 林业科学, 2002, 38(2): 27-31.
[10] 裘丽珍, 黄有军, 黄坚钦, 等. 不同耐盐性植物在盐胁迫下的生长与生理特性比较研究[J]. 浙江大学学报(农业与生命科学版), 2006, 32(4): 420-427.
[11] 范文才, 杜丽娟, 施钦, 等. 3种灌木对混合盐胁迫的生理和光合响应[J]. 中南林业科技大学学报, 2018, 38(8): 43-50.
[12] WANG Z, AN S, LIU H, et al. Genetic structure of the endangered plant(Lauraceae) from the Zhoushan archipelago using RAPD markers[J]. Annals of Botany, 2005, 95(2): 305-313.
[13] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社. 2004, 31: 348.
[14] 翟胜男. 东亚岛屿特有濒危植物舟山新木姜子()的亲缘地理学研究[D]. 杭州: 浙江大学, 2012.
[15] 傅立国. 中国植物红皮书:第1册[M]. 北京: 科学出版社, 1991.
[16] 高浩杰, 王国明, 高平仕. 浙江沿海地区舟山新木姜子群落及种群结构特征分析[J]. 植物资源与环境学报, 2016, 25(1): 94-101.
[17] 王中生, 安树青, 冷欣, 等. 岛屿植物舟山新木姜子居群遗传多样性的RAPD分析[J]. 生态学报, 2004, (3): 414-422.
[18] 牟静, 李秋霞, 高小刚, 等. 盐和干旱胁迫对欧李幼苗光合生理特性的影响[J]. 环境科学研究, 2020, 33(2): 478-484.
[19] 陈福明, 陈顺伟. 混合液法测定叶绿素含量的研究[J]. 浙江林业科技, 1984, (1): 19-23, 36.
[20] YE Z P. A new model for relationship between irradiance and the rate of photosynthesis in[J]. Photosynthetica, 2007, 45(4): 637-640.
[21] 张振文, 张保玉, 童海峰, 等. 葡萄开花期光合作用光补偿点和光饱和点的研究[J]. 西北林学院学报, 2010, 25(1): 24-29.
[22] JONES M D, HUTCHINSON T C. Nickel toxicity in mycorrhizal birch seedlings infected withorI: Effects on growth, photosynthesis, respiration and transpiration[J]. New Phytologist, 1988, 108(4): 451-459.
[23] MUNNS R, SCHACHTMAN D P, CONDON A G. The significance of a two-phase growth response to salinity in wheat and barley[J]. Australian Journal of Plant Physiology, 1995, 22: 561-569.
[24] LOVATO M B, LEMOS FILHO J P, MARTINS P S. Growth responses of(Fabaceae) populations saline stress[J]. Environmental and Experimental Botany, 1999, 41: 145-153.
[25] KATERJI N, HOORN J W V, HAMDY A,et al. Salinity effect on crop development and yield, analysis of salt tolerance according to several classification methods[J].Agricultural Water Management, 2003, 62(1): 37-66.
[26] 陆燕元, 马焕成, 李吴民, 等. 土壤干旱对转基因甘薯光合曲线的响应[J]. 生态学报, 2015, 35(7): 2155-2160.
[27] QIU Z Y, WANG L H, ZHOU Q. Effects of bisphenol A on growth, photosynthesis and chlorophyll fluorescence in above-ground organs of soybean seedlings[J]. Chemosphere, 2013, 90(3): 127-1280.
[28] BJORKMAN O. High-irradiance stress in higher plants and interaction with other stress factors[J]. Progress in Photosynthesis Research, 1987, 4: 11-18.
[29] Ben-asher J, Tsuyuki I, Bravdo B A, et al.. Irrigation of grapevines with saline water, I: Leaf area index, stomatal conductance, transpiration and photosynthesis[J]. Agricultural Water Management, 2006, 83(1): 13-21.
[30] 汪贵斌, 曹福亮. 盐胁迫对落羽杉生理及生长的影响[J]. 南京林业大学学报(自然科学版), 2003, (3): 11-14.
[31] 金星宇, 马佳, 冯美. 盐胁迫对酸柚苗光合作用和荧光特性的影响[J]. 江苏农业科学, 2020, 8(8): 159-163.
[32] KRAUSE G H, WEIS E. Chlorophyll fluorescence and photosynthesis: the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42: 313-349.
[33] ZHANG S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J]. Chinese Bulletin of Botany, 1999, 16(4): 444-448.
[34] 王加真. 盐胁迫对不同光处理沟叶结缕草光化学效率的影响[J]. 北方园艺, 2017, (24): 104-109.
[35] 吴甘霖, 段仁燕, 王志高, 等. 干旱和复水对草莓叶片叶绿素荧光特性的影响[J]. 生态学报, 2010, 30(14): 3941-3946.
[36] DAWSON S P, DENNISON W C. Effects of ultraviolet and photosynthetically active radiation on five seagrass species[J]. Marine Biology, 1996, 125(4): 629-638.
Responses of photosynthetic physiological characteristics ofseedlings to different salt stress
GU Yaxin1,2, YUE Chunlei2,*, ZHOU Xingyi3, LI Hepeng2
1. School of Forestry and Bio-technology, Zhejiang Agricultural & Forestry University, Lin’ an 311300, China 2. Zhejiang Academy of Forestry, Hangzhou 310023, China 3. School of Life Science, Nanjing Agricultural University, Nanjing 210095, China
The photosynthetic physiological characteristics ofseedlings stressed by soil salt were studied, in order to evaluate its salt tolerance. 2-year-old seedlings were used for the pot experiment. Four treatments of soil salt content (0, 0.3%, 0.6% and 0.9%) were set by adding sodium chloride solute with different concentrations. Determinations were implemented on chlorophyll content (), net photosynthetic rate (P), and maximum photochemical efficiency (/) of the treated seedlings on the 10th, 20th, 30thand 40thday. The results showed that there were no significant differences inat the same stress period among all treatments (>0.05).P,Pand light saturation point () decreased with increasing intensity of soil salt stress. Under 0.3% of soil salt content,ranged from 0.74 to 0.78, being non-significantly different with CK, but both moderate (0.6%) and severe (0.9%) salt stress significantly reduced. At the early stage of stress,nmaxof treatments under 0.3%, 0.6% and 0.9% of soil salt content were decreasedby 29.46%, 52.51% and 97.91%, respectively, compared with those of CK. At the early stage of stress,increased with increasing intensity of soil salt stress. Under 0.3% of soil salt content,had the tendency of declining at the beginning and rising by the end of the duration of salt stress. The research showed thathad certain tolerance to light soil salt stress (soil salt content was no more than 0.3%) and survived, but it could not survive in the conditions of moderate and severe soil salt stresses. The results provided a scientific basis for its ex-situ conservation and afforestation in coastal saline-alkali soil.
; salt stress;salt tolerance;photosynthetic characteristics; chlorophyll fluorescence parameter
10.14108/j.cnki.1008-8873.2022.06.002
S728.5
A
1008-8873(2022)06-011-08
2020-09-28;
2020-10-08
浙江省省院合作林业科技项目(2022SY06); 浙江省院所专项项目(2019F1065-1)
谷雅馨(1997—), 女, 河北张家口人, 硕士, 主要从事植物生态学研究, E-mail: 874243997@qq.com
通信作者:岳春雷, 男, 博士, 主要从事植物生态、湿地生态研究, E-mail: 1049876924@qq.com
谷雅馨, 岳春雷, 周星怡, 等. 舟山新木姜子()幼苗对不同盐胁迫的光合生理响应[J]. 生态科学, 2022, 41(6): 11–18.
GU Yaxin, YUE Chunlei,ZHOU Xingyi, et al. Responses of photosynthetic physiological characteristics ofseedlings to different salt stress [J]. Ecological Science, 2022, 41(6): 11–18.
