过渡金属催化合成菲啶酮类衍生物研究进展*
2022-09-17刘海龙田茂军周晓玉白明侠
刘海龙,田茂军,田 玲,周晓玉,白明侠
(1 六盘水师范学院化学与材料工程学院,贵州 六盘水 553004;2 贵州省煤炭洁净利用重点实验室,贵州 六盘水 553004)
天然产物化学在前几十年得到了充分的发展,分离、提取了一系列的天然产物,但是批量、快速的合成依然是一个艰难的挑战。随着偶联反应的发展,合成一些具有生物活性的天然产物的核心骨架的方法逐渐被科研工作者们开发出来,其中具有抗癌、抗病毒等活性的化合物备受关注,菲啶酮便是其中的一种。菲啶酮是一类含有三个六元环的稠环化合物,是石蒜科一种生物碱的骨架,该类化合物具有潜在的生物活性,例如,具有抗癌、抗病毒和抑制乙酰胆碱酯酶活性等作用[1],如图1所示。
目前,菲啶酮及其衍生物的合成方法的发展是一个备受关注的领域。然而,传统的合成方法通常需要较多的合成步骤或者较为复杂、苛刻的反应条件[2],如图2所示。因此需要开发出一种效率高、实用性强的合成方法。

图1 具有生物活性的菲啶酮衍生物举例Fig.1 Examples of phenanthridone derivatives with biological activity

图2 传统合成方法Fig.2 Traditional synthesis method
1 不同分子间的偶联反应合成菲啶酮骨架
近些年来,过渡金属催化的偶联反应发展迅速,尤其是钯催化的偶联反应在有机合成中已经成为一种十分重要的合成方法[3]。钯催化合成菲啶酮及其衍生物的方法也有少量报道。
2004年,M. Catellani课题组报道了一种利用降冰片烯导向的一锅法合成菲啶酮的骨架的方法,使用了碘代芳烃和邻溴苯甲酰胺作为底物,醋酸钯为催化剂,三呋喃基膦为配体,取得了中等以上的收率[4],如图3所示。该反应的特点是使用了降冰片烯作为导向试剂,使得反应得以发生,并且菲啶酮骨架的两个芳基结构可以不同,这样丰富了产物结构的多样性。
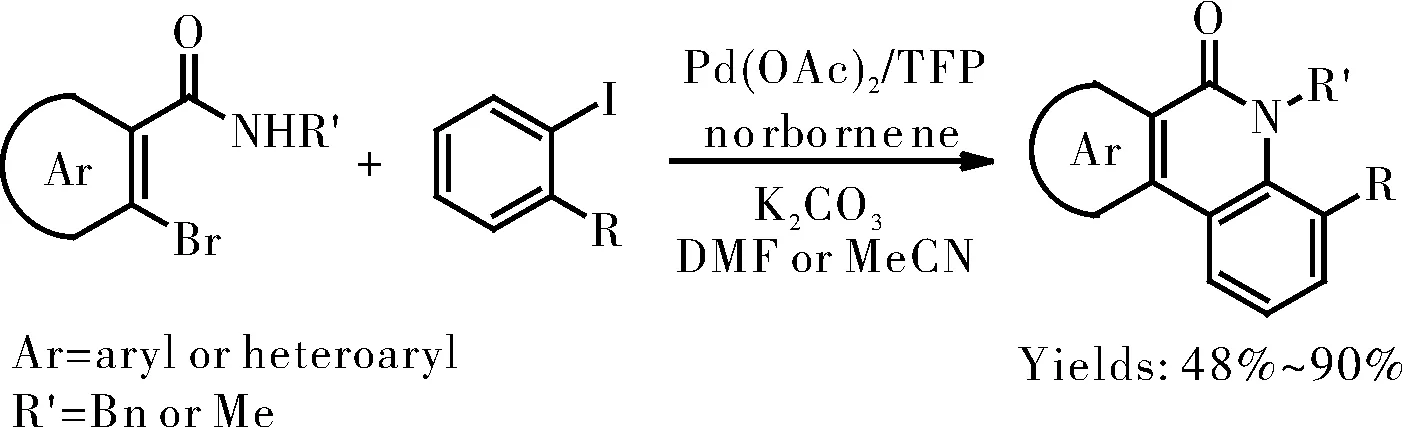
图3 降冰片烯导向一锅法合成菲啶酮Fig.3 Norbornene guided one-pot synthesis of phenanthridone
来自美国的R. C. Larock课题组在2012年报道了通过原位生成苯炔中间体的钯催化合成菲啶酮骨架的工作[5],如图4所示,使用了dppm[二(二苯基膦)甲烷)]作为膦配体,取得了中等到良好的收率,但是仍局限于溴代和碘代底物。

图4 苯炔中间体的钯催化合成菲啶酮Fig.4 Palladium-catalyzed synthesis of phenanthridone from phenylalkyne intermediates

图5 钯催化Suzuki偶联反应合成菲啶酮骨架Fig.5 Synthesis of phenanthridone skeleton by palladium- catalyzed Suzuki coupling reaction
2013年,S. Tannimori课题组报道了通过钯催化的Suzuki偶联反应构建菲啶酮骨架的方法[6],如图5所示,使用了Sphos作为膦配体,最高收率达到了96%,但是底物适用范围较小,仅有10例。
以上是通过不同的双分子间的偶联反应来构筑碳-碳键和碳-氮键进而合成含有菲啶酮类骨架化合物,下面对反应底物自身分子之间通过偶联反应合成菲啶酮类化合物进行综述。
2 相同分子间的偶联反应
S. Caddick课题组在2002年报道的一种钯催化分子内的Heck反应中,偶然发现了一种作为副产物生成的菲啶酮的衍生物[7],如图6所示,虽然作为副产物获得的产率并不理想,但是使用邻卤苯甲酰胺为原料通过自身分子间偶联反应合成菲啶酮的首例报道。
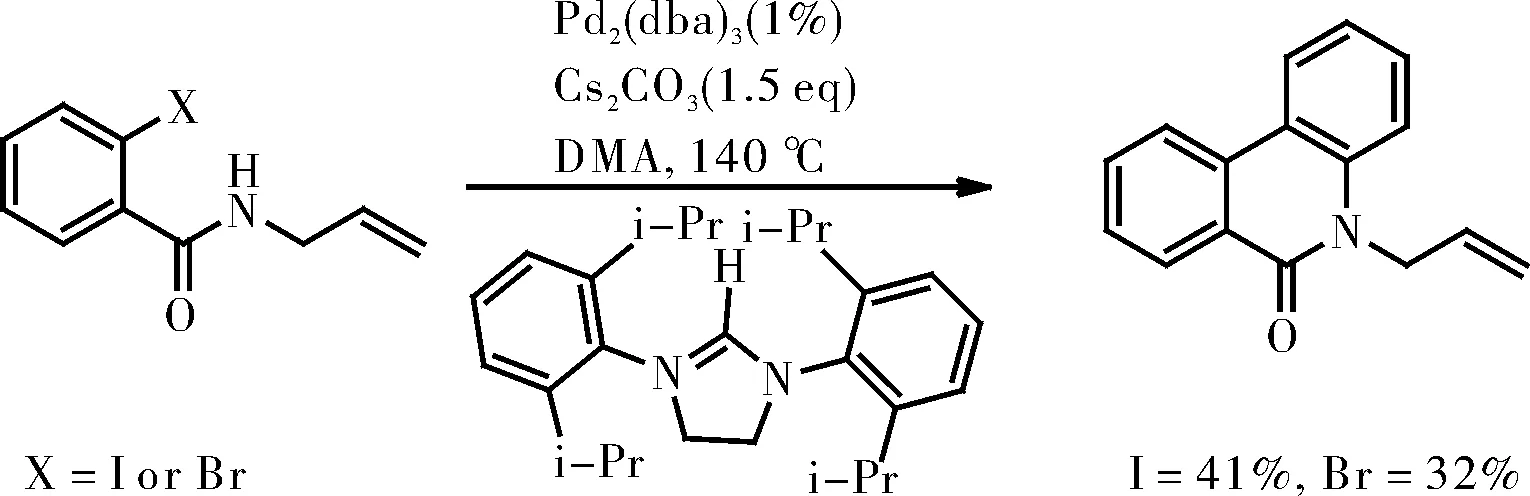
图6 钯催化分子内Heck反应合成菲啶酮Fig.6 Synthesis of phenanthridone by palladium-catalyzed intramolecular Heck reaction
2006年,M. Catellani课题组在其2004年报道的一篇工作的基础上[4],去掉了反应体系中的降冰片烯,令人惊讶的是,两分子邻溴苯甲酰胺通过并未预料到的反应途径生成了菲啶酮衍生物,这是该类型反应的首次系统性报道[8],研究结果发表在J. Am. Chem. Soc.上。该文还对反应机理进行了较为深入的研究,提出了最可能的反应机理,但是,该报道的底物适用范围仍然很小,并且产率不高,如图7所示,要获得实际应用尚需对反应体系进一步优化。
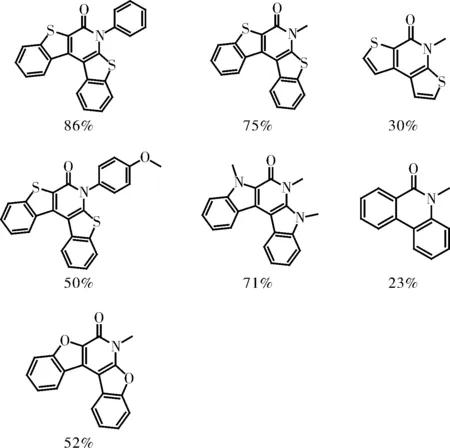
图7 反应式及底物范围Fig.7 Reaction and substrates scope

图8 反应式及单齿膦配体结构Fig.8 Reaction and structure of monodentate phosphine ligand
一年后,T. Furuta和其合作者在Org.Lett.上报道了同样的反应[9],如图8所示,只是在催化剂中使用了结构不同的单齿膦配体,底物中的R-为供电子基团时,反应活性较好,产率大于80%仅有2例,底物使用范围较小。反应底物中同时有-Cl和-Br取代时,得到含-Cl的产物,证明氯并不参与该反应。
2010年,F.-H. Porée课题组在Org.Lett.上报道了在不同的溶剂中,相同的钯催化剂催化的两分子邻溴苯甲酰胺衍生物的偶联反应可生成两种不同结构的菲啶酮类化合物,并可过得中等以上的收率。该文还对碳酸盐作为碱在反应体系中可能起到的作用进行了探讨[10],如图9所示。该课题组在2011年的Chem. Eur. J.上以全文的形式再次报道了这个反应,并且使用了原位核磁和质谱对反应机理进行了探究,然后利用DFT计算,证明了该反应在催化循环中通过Pd(IV)中间体机理进行的[11]。
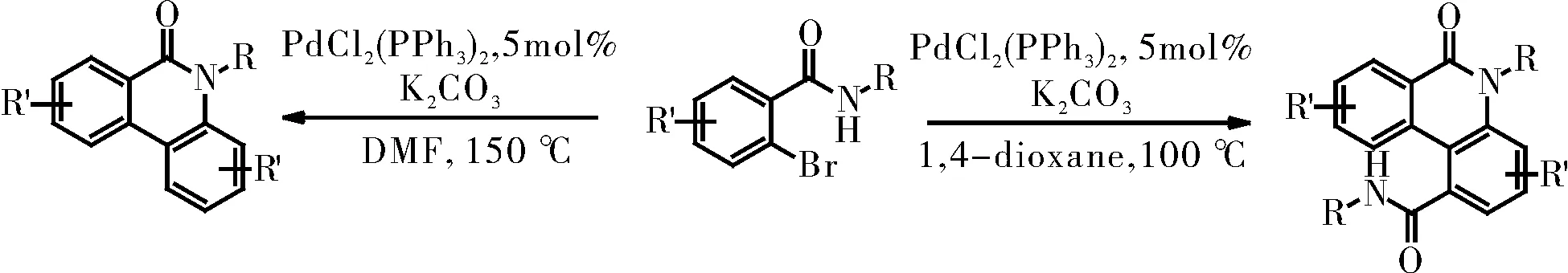
图9 溶剂控制合成菲啶酮Fig.9 Solvent-controlled synthesis of phenanthridone
以上是通过同一种底物的双分子间的偶联反应来构筑碳-碳键和碳-氮键进而合成含有菲啶酮类骨架的化合物,下面通过对目前研究比较热门的碳氢键活化的方法合成菲啶酮类化合物进行综述。
3 碳-氢活化构建菲啶酮骨架
碳氢键活化是近些年有机化学中的热门领域之一,直接选择性地断裂碳氢键并进一步发生其他反应,这样就可以高效地构建新的化合物,相比于传统的偶联反应,省去了底物预活化的步骤,这样就具有更好的原子经济性,但是碳氢键是有机化合物的基本组成,怎样有选择性地活化某一个或某几个碳氢键,仍是研究的难点,例如引入导向基团,定向地活化底物中的某个位点,但是导向基团的引入和去除会增加反应步骤,使得原子经济性变差。
Sandro Cacchi课题组报道了一种钯催化的分子内直接芳基化反应来合成菲啶酮骨架的方法[12],如图10所示。虽然合成方法较为简便,但是碘代底物的价格较高,并且需要使用不稳定的膦配体,使得该方法的适用范围较小。

图10 分子内C-H芳基化反应合成菲啶酮Fig.10 Synthesis of phenanthridone by intramolecular C-H arylation
Masahiro Murakami等[13]报道的方法,省去了底物先碘代活化的步骤,直接通过分子内的碳-氢活化氧化偶联反应来合成菲啶酮,如图11所示,使用氧气作为氧化剂,绿色环保,苯甲酸作为溶剂,取得了中等以上的收率。

图11 分子内C-H氧化偶联反应合成菲啶酮Fig.11 Synthesis of phenanthridone by intramolecular C-H oxidative coupling reaction
Qiang Zhu课题组在Chem. Commun.上报道了一种钯催化的C(sp2)-H羰基化反应合成菲啶酮衍生物的方法[14],如图12所示。该方法以三氟甲磺酸铜作为氧化剂、一氧化碳作为羰基化试剂,实现了多种2-芳基苯胺的羰基化反应合成菲啶酮的衍生物。

图12 羰基化反应合成菲啶酮Fig.12 Synthesis of phenanthridinone by carbonylation reaction
2011年Guan-Wu Wang课题组在Angew. Chem. Int. Ed.报道了一种利用钯催化的一锅法双碳氢键活化构建C-C和C-N的方法来合成菲啶酮衍生物[15],如图13所示,使用了2 eq的氧化银作为氧化剂,取得了中等以上的收率。

图13 钯催化双C-H键活化合成菲啶酮Fig.13 Synthesis of phenanthridinone by palladium- catalyzed double C-H activation
随后,Chien-Hong Cheng课题组在Angew. Chem. Int. Ed.报道了一种相似的反应[16],如图14所示,但是反应底物不需要使用较为昂贵的碘代芳烃,只需要较大量的(25 eq)苯、甲苯、二甲苯、氯苯或苯甲醚即可,并且反应在室温下即可进行,用较为廉价的过二硫酸钾(2 eq)代替氧化银作为氧化剂,同时加入了20 eq的三氟乙酸,该反应的底物适用范围广,且产率较高。

图14 反应式及底物范围Fig.14 Reaction and substrates scope

图15 钯催化一锅法碳碳和碳氮偶联合成菲啶酮Fig.15 Synthesis of phenanthridinones by palladium- catalyzed one-pot C-C and C-N coupling reaction
我们发展了一种实用的钯催化碳碳偶联和碳氮脱酰胺偶联一锅法合成菲啶酮类化合物的方法[17],如图15所示。该方法高效简便,在2mol%的催化剂量下,以邻卤苯甲酰胺为底物,在不使用膦配体的情况下合成了菲啶酮衍生物,并且首次使用廉价且活性差的氯代底物完成了该反应。该方法底物适用范围广泛,共计合成了36种酰胺类底物,通过碳碳偶联和碳氮偶联一锅法合成了31种菲啶酮衍生物,其中23种为新化合物,产率最高可达93%。同时我们还发现了在氯代底物中N上的取代基不同对反应有着明显的影响,并且发现了与文献不同的取代基效应。最后我们还使用了氯代底物完成了克级的规模放大量实验。
2019年Large等[18]研究了以酰胺作为导向基团的萘核选择性C-H官能化反应,如图16所示,钯催化的芳基化反应进一步合成菲啶酮。经过研究得到最优条件以PdCl2,Cu(OAc)2为实验条件,在140 ℃氧气气氛下,在二甲基亚砜中制备了多种取代的苯并菲啶酮,但产率只能达到中等。

图16 钯催化酰胺选择性C-H官能化反应合成菲啶酮Fig.16 Palladium catalyzed selective C-H functionalization of amides to phenanthridone
4 结 语
通过对菲啶酮骨架合成研究进展的简要总结可以看出,在国内外的菲啶铜合成方法中,其中以苯甲酰胺为原料通过过渡金属催化来实现碳氢键活化形成碳碳键和碳氮键的策略是常用的方法,而在这种方法中其底物大部分需要引入卤素原子。其次是通过C-H酰胺化反应来合成菲啶酮,不需要在底物苯环上引入卤素等离子化基团,是一种比较经济的方法。最后是使用过渡金属催化剂通过氧化插入一氧化碳来合成菲啶酮及衍生物骨架,其中一氧化碳气体是属于有毒气体,从安全性的角度出发没有以大气中的二氧化碳为羰基源更加的安全,同时二氧化碳作为造成温室效应的主要原因,较少空气中二氧化碳也是对环境的一种保护。在可见光条件下,用光催化剂催化N-苯基苯甲酰胺碳氮键活化的方法相比其它的方法较为更直接的合成菲啶酮。所有的研究者都在朝着低成本、原子经济性、简便性、安全性、高产率的方向进行着菲啶酮合成方法的研究,说明在这个领域还有更新、更广阔的研究前景。
