二氢杨梅素对小鼠淋巴瘤L5178Y细胞TK基因的致突变作用
2022-09-17马秀玲李逸飞李海山
马秀玲,李逸飞,孙 圣,李海山
(中检科健(天津)检验检测有限责任公司,天津 300309)
二氢杨梅素是一种存在于自然界的黄酮醇类化合物,属于天然膳食成分之一,可从蛇葡萄、杨梅科和藤黄科等植物的茎叶中分离得到,除具有抗氧化、抗血栓、消炎和清除自由基的功效外,还有预防酒精肝、脂肪肝和清除身体中的自由基等特殊功效[1-3]。剂量如果添加不当,就易引起一定的毒性反应,白倩[4]课题组研究结果表明:致癌物诱导的人正常乳腺MCF-10A细胞癌变发生可被AMP抑制,这一作用机理与其抑制DNMT1活性和表达水平,降低致癌物诱导的抑癌基因ATM启动子的甲基化增强,进而上调ATM表达有关联性[4]。二氢杨梅素因为成分多,易获取,在工业化生产中有充足的原料,所以被广泛应用在食品中,如乳制品中添加适量二氢杨梅素在保持乳制品原有口感与风味的同时,还可以增加养肝护肝的功能;在解酒产品应用上二氢杨梅素能抵抗酒精中毒和酒精依赖性,具有很好地预防治疗酒精性肝损伤效果[5]。笔者通过实验从藤茶中提取的二氢杨梅素对小鼠淋巴瘤L5178Y细胞TK基因位点是否具有致突变作用,为研究二氢杨梅素在后期的安全应用提供了一定的理论依据[6]。小鼠淋巴瘤L5178Y细胞基因突变实验(即MLA)是一种广泛使用的体外遗传毒理的致突变实验之一,检测的灵敏度较高[7-10]。可检测出包扩点突变、大的缺失、重组、染色体异倍性和其他较大范围基因组改变在内的多种遗传改变[11-13]。
1 材料与方法
1.1 材料与仪器设备
二氢杨梅素(CAS号:27200-12-0),购自西安天丰生物科技股份有限公司,批号:NF-20190314,质量浓度大于98%。
SW-CJ-1FD超净工作台,苏州苏洁;MCO-20AICCO2培养箱,三洋;DMi1倒置显微镜,莱卡;L90灭菌锅,GRE IRM;TD5A-WS离心机,赛特湘仪离心机仪器;SHKE4000-1CE摇床,赛默飞;Quintix224-1CN电子天平,赛多利斯。
1.2 试 剂
DMEM高糖培养基,批号:70040060,生产厂家:Biosharp;马血清,批号:925T051,生产厂家:Solarbio;环磷酰胺(CP),CAS号:6055-19-2,批号:A0355341,生产厂家:ACROS;甲磺酸乙酯(EMS),CAS号:62-50-0,批号:M18M11K109878,生产厂家:源叶生物;胸腺嘧啶核苷(T),批号WXBC8037V,生产厂家:Sigma;次黄嘌呤(H),批号:305A0414,生产厂家:SoLarbio;氨甲嘌呤(M),批号:H25J9Z66420,生产厂家:源叶生物;甘氨酸(G),批号:709T069,生产厂家:SoLarbio;三氟胸苷(TFT),批号:20190045,生产厂家:Sigma。
1.3 细胞概述
小鼠淋巴瘤L5178Y细胞是国际上广泛认可和使用并且可用于研究基因是否发生突变的细胞系,其来源于CGMCC。正式生产前,使用THMG培养基处理24 h,使用THG培养基处理48 h,并经突变清除测试证实已去除存在的突变细胞[14-15]。小鼠淋巴瘤L5178Y细胞如图1所示。

图1 小鼠淋巴瘤L5178Y细胞Fig.1 Mouse lymphoma cells L5178Y
1.4 代谢活化系统(大鼠肝S9)
代谢活化系统(大鼠肝S9)是指物质本身无毒或毒性较小,在人体内经过生物转化后,形成的代谢产物毒性增大,甚至产生致癌、致突变和致畸作用的过程。苯巴比妥钠和β-萘黄酮联合应用作为诱导剂制备的大鼠肝脏9 kg,经离心后所得上清液分装EP管中,-80 ℃保存备用[16-17]。实验S9购自天津市特福瑞环保科技有限公司,生产单位:MoLecuLar ToxicoLgy,Inc.(MOLTOX),保存在-80 ℃冰箱。S9中酶活检测[18]如表1所示,S9混合液由S9、MgCl2、KCl、6-磷酸葡萄糖纳(G-6-P)、辅酶Ⅱ(NADPNA2)和磷酸盐缓冲液(PBS)组成,其中S9占总体系的10%(即体积比),最终浓度分别为8 mmol/L的MgCl2、33 mmol/L的KCl、5 mmol/L的G-6-P和4 mmol/L的辅酶Ⅱ。
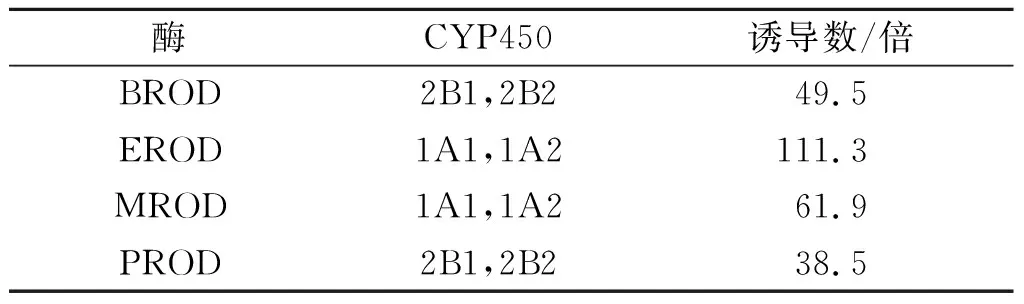
表1 大鼠肝S9中酶活检测
1.5 方 法
1.5.1 小鼠淋巴瘤L5178Y细胞给药质量浓度筛选
根据实验系统中的溶解度,选定组间距为2倍,质量浓度分别为5 000,2 500,1 250,625,312.5,156.25,78.13 μg/mL,包含最大细胞毒性至几乎无细胞毒性,同时增设阴性对照组(无菌水)[19],且每T25细胞瓶接种细胞数为2×105个/mL。细胞活力计数(即活细胞计数)使用台盼蓝染色体法,用计数板计数活细胞。各剂量组质量浓度的相对存活率=活细胞÷阴性对照组活细胞。
1.5.2 实验样品的配制
准确称量样品2.5 g,加入5 mL无菌水,混匀后过膜,临用现配,配制质量浓度为500 mg/mL,对应的终质量浓度为5 000 μg/mL。将配制好的样品按2倍梯度逐级稀释至配制质量浓度分别为250,125,62.5,31.25,15.63,7.81,3.91 mg/mL,对应的终质量浓度分别为2 500,1 250,625,312.5,156.25,78.13,39.06 μg/mL,加样过程中样品常温放置,加样过程应不超过12 h[20-22]。对照品甲磺酸乙酯(终质量浓度为10 μg/mL)、环磷酰胺(终质量浓度为3 μg/mL)溶于生理盐水。
1.5.3 分组给药
正式实验以每T25细胞瓶中加入5 mL的DMEM液(含马血清10%,双抗5%)为总体系,实验样品按总体系的1%作为加样量,即0.05 mL/T25细胞瓶。代谢活化系统为0.5 mL,同时增设阳性对照组,分别为环磷酰胺(CP)、甲磺酸乙酯(EMS)及阴性对照组(无菌水)。在50 mL无菌离心管中按照细胞所需个数,逐一稀释、对照品和10%的S9组分混合液。加样记录如表2所示,给药时间为3 h。
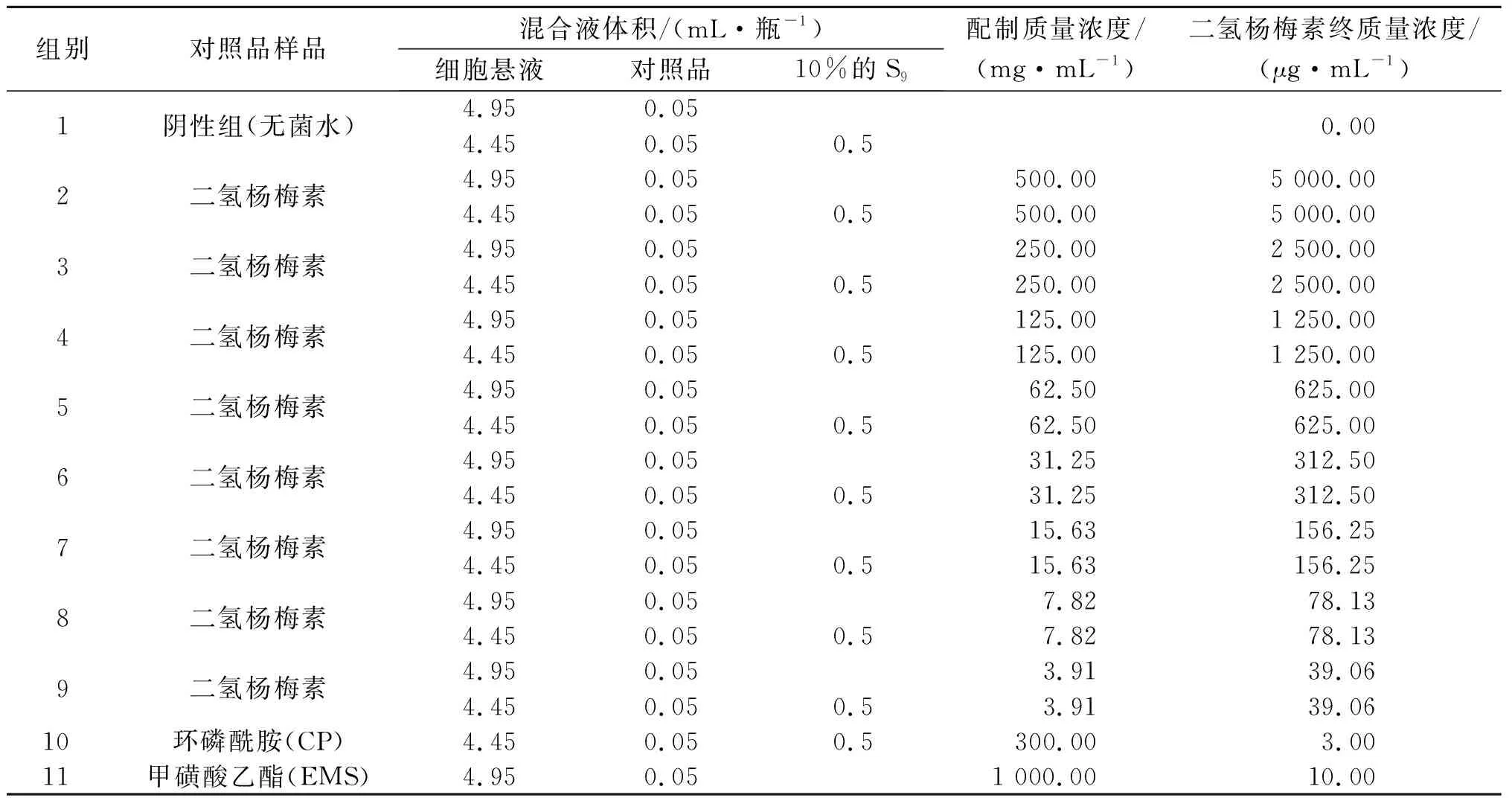
表2 加样记录表
取生长状态良好的细胞,每T25细胞瓶确保细胞数为5×105个/mL,在加入受试物或对照品后在代谢或非代谢活化条件下培养37 ℃、振摇18次/min处理3 h后,以速率为1 000 r/min离心5 min,弃上清,磷酸盐缓冲液(PBS)洗涤2次后重新加入完全培养液DMEM(含马血清10%,双抗5%),并将细胞调整为2×105个/mL[23-24]。
1.5.4PE0(即第0天的平板接种效率)测定
取培养至3 h后的细胞悬浮液,作梯度稀释,调整细胞数为8 个/mL,以每孔200 μL加样量接种在96孔板内,每个剂量接种2块平板,37 ℃、5%的二氧化碳培养箱内连续培养12 d,培养结束后观察并计录每块96孔板内大小集落数。
1.5.5 表 达
将培养3 h的细胞悬浮液(按1.5.4节所得细胞悬浮液)做2 d表达培养,每天计数,用培养液DMEM(含马血清10%,双抗5%)调整细胞数,确保每个剂量实验组的细胞数低于1×106个/mL,计算相对细胞活力(RSG)。
1.5.6PE2(即第2天的平板接种效率)测定
取适量按1.5.5节中表达结束的细胞悬浮液,作梯度稀释,调整细胞为8个/mL,以每孔200 μL加样量接种在96孔板内,每个剂量接种2块平板,37 ℃、5%的二氧化碳培养箱内连续培养12 d,培养结束后观察并计录每块96孔板内大小集落数。
1.5.7MF(即加入TFT后的细胞突变频率)测定
取适量按1.5.5节中表达结束的细胞悬浮液,调整细胞数为1×104个/mL,加入三氟胸苷(TFT),混合后以每孔200 μL加样量接种在96孔板内,每个剂量接种2块平板[25],37 ℃、5%的二氧化碳培养箱中培养12 d,培养结束后观察并计录每块96孔板内大小集落数[23]。
1.6 分析程序
1.6.1 实验成立条件
实验所用小鼠淋巴瘤L5178Y细胞的自发突变频率为50×10-6~200×10-6;阴性对照组的平板效率PE0为60%~140%,PE2为70%~130%;阳性对照组的MF与阴性对照组有较为明显的差异[23],即与对照组的比值至少达到3倍。
1.6.2 统计学处理
实验各组别大小集落数均采用SPSS软件TTEST检验进行统计分析,实验各组别与阴性对照组相比,P>0.05,则认为无显著性差异。阳性对照组与阴性对照组相比,*P<0.05,则具有显著性差异。
平板效率(PE0,PE2)计算公式为
(1)
式中:EW为无集落生长的孔数;TW为总孔数;1.6为每孔接种细胞数。
相对存活率(RS)计算公式为
(2)
式中:PEtg为处理组的平板效率;PEnc为阴性对照组的平板效率。
相对悬浮生长(RSG)计算公式为
(3)
式中:D2tg为处理组第2天表达与0天相比的细胞增殖倍数;D2nc为阴性对照组第2天表达与0天相比的细胞增殖倍数。
相对总生长(RTG)计算公式为
RTG=(RSG×RSn)×100%
(4)
式中RSn为第2天的相对存活率。
突变频率(MF)计算公式为
(5)
式中:EW为无集落生长的孔数;TW为总孔数;N为每孔接种细胞数;PE2为第2天的相对存活率。
1.6.3 阳性结果的判定
受试物组只要有一个剂量及以上(质量浓度)组的MF显著高于阴性对照组,或是阴性对照的3倍以上,并且具有剂量依赖性趋势,结果可判定为阳性。如果仅在相对存活率低于20%的高剂量情况下出现阳性,则结果就判为“可疑”[23]。
1.6.4 阴性结果的判定
样品在有或无代谢活化条件下,与阴性对照相比,各质量浓度突变频率均未见显著性升高,不能诱发小鼠淋巴瘤细胞基因的突变,故样品在小鼠淋巴瘤细胞的TK位点未发生突变,进一步对可疑结果应进行实验。
1.6.5 集落数判定
突变集落按照大集落(直径≥1/4孔径,密度低)和小集落(直径<1/4孔径,密度高)分别计数,极小集落再继续培养3 d后计数[26]。
2 结果与分析
2.1 小鼠淋巴瘤L5178Y细胞给药质量浓度的确定
与阴性对照组相比,二氢杨梅素对小鼠淋巴瘤L5178Y细胞无明显的细胞毒性,在代谢活化系统(+S9)下相对存活率为87.2%~98.4%,阴性对照组中活细胞数为1.25×106个/mL;在非代谢活化系统(-S9)下相对存活率为89.84%~93.75%,阴性对照组中活细胞数为1.28×106个/mL。根据二氢杨梅素的溶解度及细胞毒性结果,确定以5 000 μg/mL,组间距为2倍,共8个梯度作为正式实验剂量,结果如表3所示。
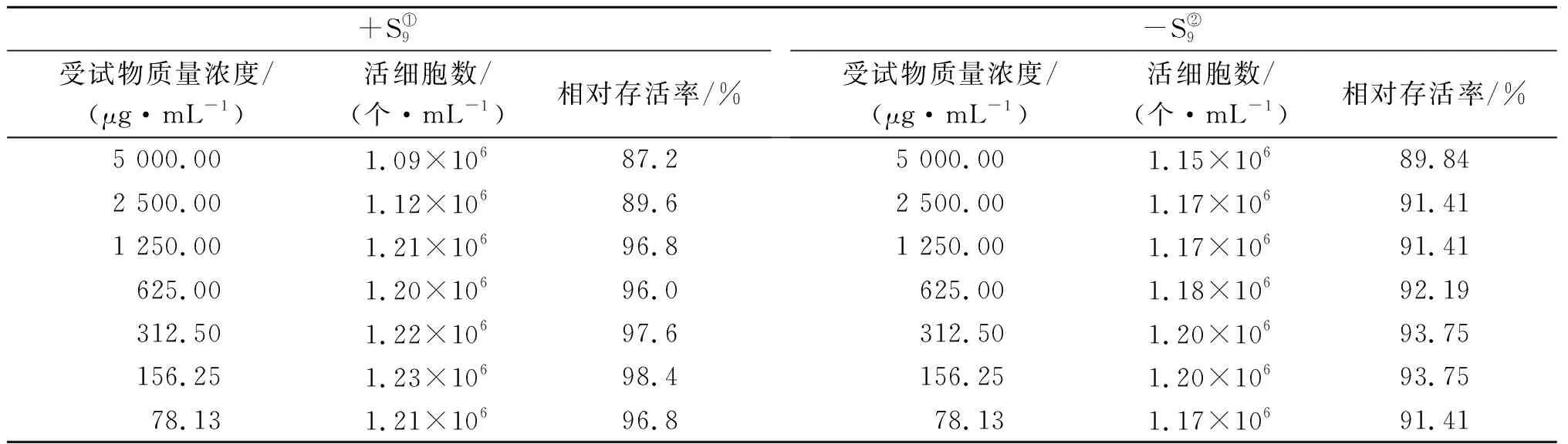
表3 受试物对细胞的毒性
2.2 代谢活化系统实验结果
在有S9条件下,3 h暴露后,实验样品二氢杨梅素质量浓度为39.06~5 000 μg/mL剂量范围内,样品二氢杨梅素与阴性对照相比,各质量浓度突变频率均未见显著性升高,不能诱发小鼠淋巴瘤细胞基因的突变,故在有代谢活化条件下样品二氢杨梅素体外哺乳动物细胞基因突变实验结果为阴性,结果如表4所示。
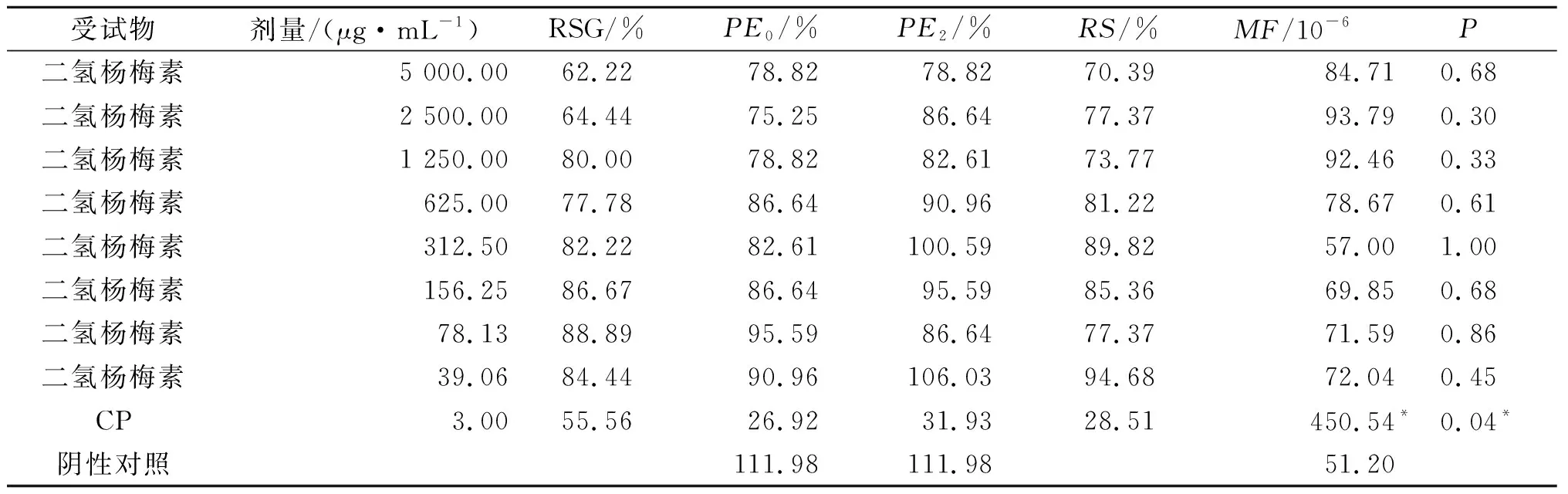
表4 代谢活化系统(+S9)实验结果
2.3 非代谢活化系统实验结果
在无S9,经3 h暴露,样品二氢杨梅素质量浓度为39.06~5 000 μg/mL的条件下与阴性对照相比,各质量浓度突变频率均未见显著性升高,不能诱发小鼠淋巴瘤细胞基因的突变。结果如表5所示。
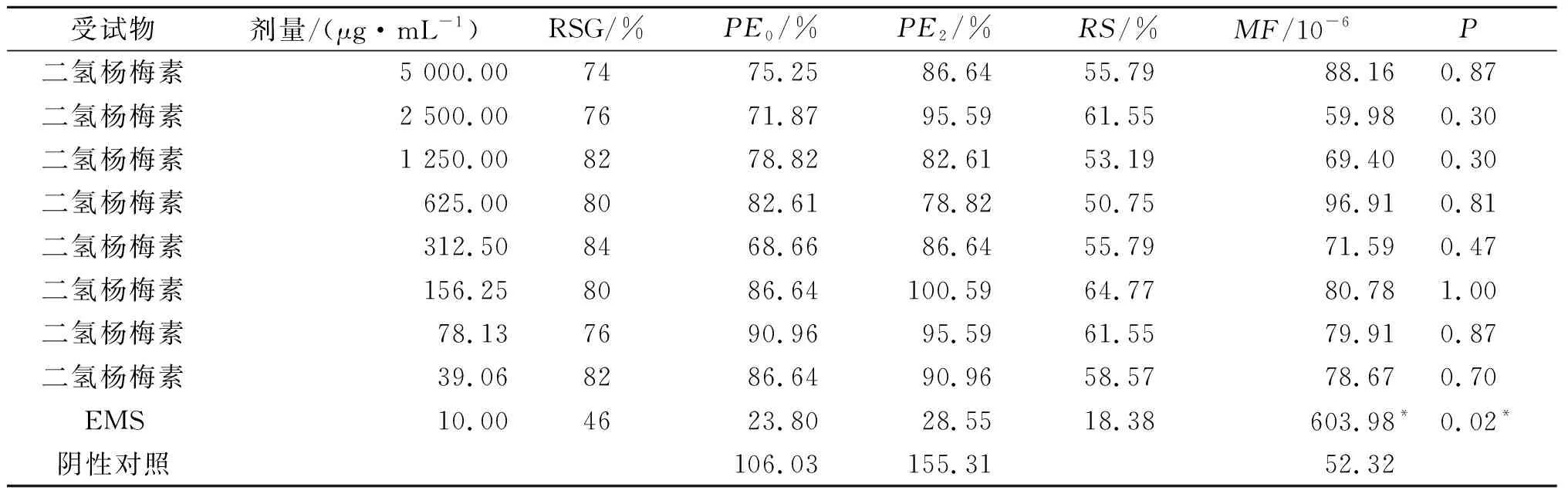
表5 非代谢活化系统(-S9)实验结果
在笔者实验条件下,阴性对照-S9的PE0为106.03%,+S9的PE0为111.98%,均在60%~140%;阴性对照-S9的PE2为155.31%,+S9的PE2为111.98%,均在70%~130%;阴性对照-S9的MF为52.32×10-6,+S9的MF为51.2×10-6。有代谢活化系统时阳性对照的MF是阴性对照的8.8倍,在无代谢活化系统时阳性对照的MF是阴性对照的11.5倍,故实验均满足成立的条件。
样品二氢杨梅素在有或无代谢活化生产条件下,与阴性对照相比,各质量浓度突变频率均未见显著性升高P均大于0.05,不能诱发小鼠淋巴瘤细胞基因的突变,故样品二氢杨梅素细胞基因突变结果为不具致突变性。
3 结 论
在进行MLA实验时,使用小鼠淋巴瘤细胞L5178Y在MF平板上可以观察到两类集落,即大集落和小集落,将直径大于微孔直径的1/4的集落称之为大集落,反之则为小集落。一般认为大集落和正常生长的集落的产生是由于TK基因位点及其附近小范围的遗传物质改变所引起的,如点突变和小的缺失等;而小集落和缓慢生长的集落则可能涉及较大范围的染色体改变,且损伤的范围可能涉及到较大范围的染色体改变。TK基因突变实验已被广泛用于检测外来化合物的遗传毒性。在前期预实验中,采用台盼蓝法检测在二氢杨梅素的质量浓度分别为5 000,2 500,1 250,625,312.5,156.25,78.13 μg/mL条件下对小鼠淋巴瘤L5178Y细胞的毒性作用,结果表明二氢杨梅素对小鼠淋巴瘤L5178Y细胞存活率均无显著性降低。根据预实验结果确定了二氢杨梅素的最高质量浓度设为5 mg/mL,作为正式实验最高剂量。结果表明:在实验中,随着给样质量浓度的增加,突变频率MF与阴性组比并未出现显著上升趋势,即P>0.05,表明二氢杨梅素质量浓度为39.06~5 000 μg/mL时未见诱导小鼠淋巴瘤L5178Y细胞突变率的增加,对该TK突变实验无致突变性。当前在遗传领域的评价方法中,通常采用体外和体内遗传毒性实验相结合的方法,以减少毒性受试物的假阴性结果。故对二氢杨梅素的致突变作用,还需要进一步通过体内或体外的毒理实验进行验证。
