老年高级别胶质瘤临床特点及预后分析
2022-09-17周江芬赖名耀蔡林波
周江芬 赖名耀 蔡林波
广东三九脑科医院肿瘤科,广东广州 510510
胶质瘤是指起源于神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,根据肿瘤恶性程度分低级别胶质瘤和高级别胶质瘤(high-grade glioma,HGG)。其中HGG 发病率随着年龄的增长而增加,如胶质母细胞瘤(glioblastoma,GBM),在75~84 岁的个体中发病率最高,中位发病年龄64 岁,年龄越大预后越差[1]。对老年患者的年龄界定国际上尚无统一标准,目前国内多以65 岁为年龄界限[2]。HGG 指南推荐治疗为最大安全范围手术切除联合术后同步放化疗及维持化疗,但对于老年患者,因需要考虑年龄因素、基础疾病情况及社会因素等[3],目前国内尚无统一的标准治疗模式。因此,本研究通过回顾广东三九脑科医院(以下简称“我院”)肿瘤科,年龄>65 岁的HGG 患者的临床特征、生存预后情况等信息,进行预后相关因素分析,拟总结老年HGG 的临床特点、预后预测因素及最佳治疗模式。
1 对象与方法
1.1 研究对象
收集2008 年1 月至2021 年1 月在我院有手术病理确诊的年龄>65 岁的WHO Ⅲ级和Ⅳ级的胶质瘤患者临床资料,共84 例。其中,男46 例,女38 例;中位年龄68(65~87)岁;术前中位卡氏功能状态(Karnofsky performance status,KPS)评分70(40~80)分,术后中位KPS 评分为70(20~90)分。
1.2 治疗情况
84 例患者均行手术治疗,术后根据KPS 评分、并发症情况及治疗意愿行观察、化疗、放疗或联合治疗。
1.3 随访及观察终点
所有患者通过电话或微信随访,随访截止至2021 年7 月23 日,随访率为100%,中位随访时间11.7(3.6~80.0)个月。观察主要终点为总生存期(overall survival,OS),定义为手术确诊时间至肿瘤相关死亡或末次随访时间。
1.4 统计学方法
采用R 语言软件(4.1.1 版本)对数据进行统计分析。计数资料以例数或百分比表示,采用χ2检验。采用Kaplan-Meier 方法计算OS,运用log-rank 检验进行单因素分析,Cox 回归模型进行多因素分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床特点及OS 单因素分析
根据2016 年第四版WHO 中枢神经系统肿瘤分类标准[4],GBM 62 例、间变星型细胞瘤12 例、间变少突胶质细胞瘤2 例、间变性多形性黄色星型细胞瘤4 例、间变节细胞胶质瘤4 例。异柠檬酸脱氢酶(isoc itratedehydrogenase,IDH)免疫组化阳性4 例、阴性44 例、不详36 例;O6-甲基鸟嘌呤-DNA 甲基转移(O6-methylguanine-DNA methyhransferase,MGMT)免疫组化阳性12 例、阴性26 例、不详46 例。活检术11 例、部分切除34 例、近全切除19 例、全切除20例。手术后有7 例选择观察、4 例治疗中途放弃治疗、11 例采用单纯化疗,中位化疗周期数为3(1~12)个周期。62 例采用放疗为主的治疗,其中46 例采用常规2 Gy/F 分割放疗、16 例采用3 Gy/F 分割放疗或常规分隔后局部立体定向放射外科(sterotactic radiosurgery,SRS)推量。放疗后有34 例采用不同周期数的维持化疗,中位化疗周期数为4(1~12)个周期。见表1。
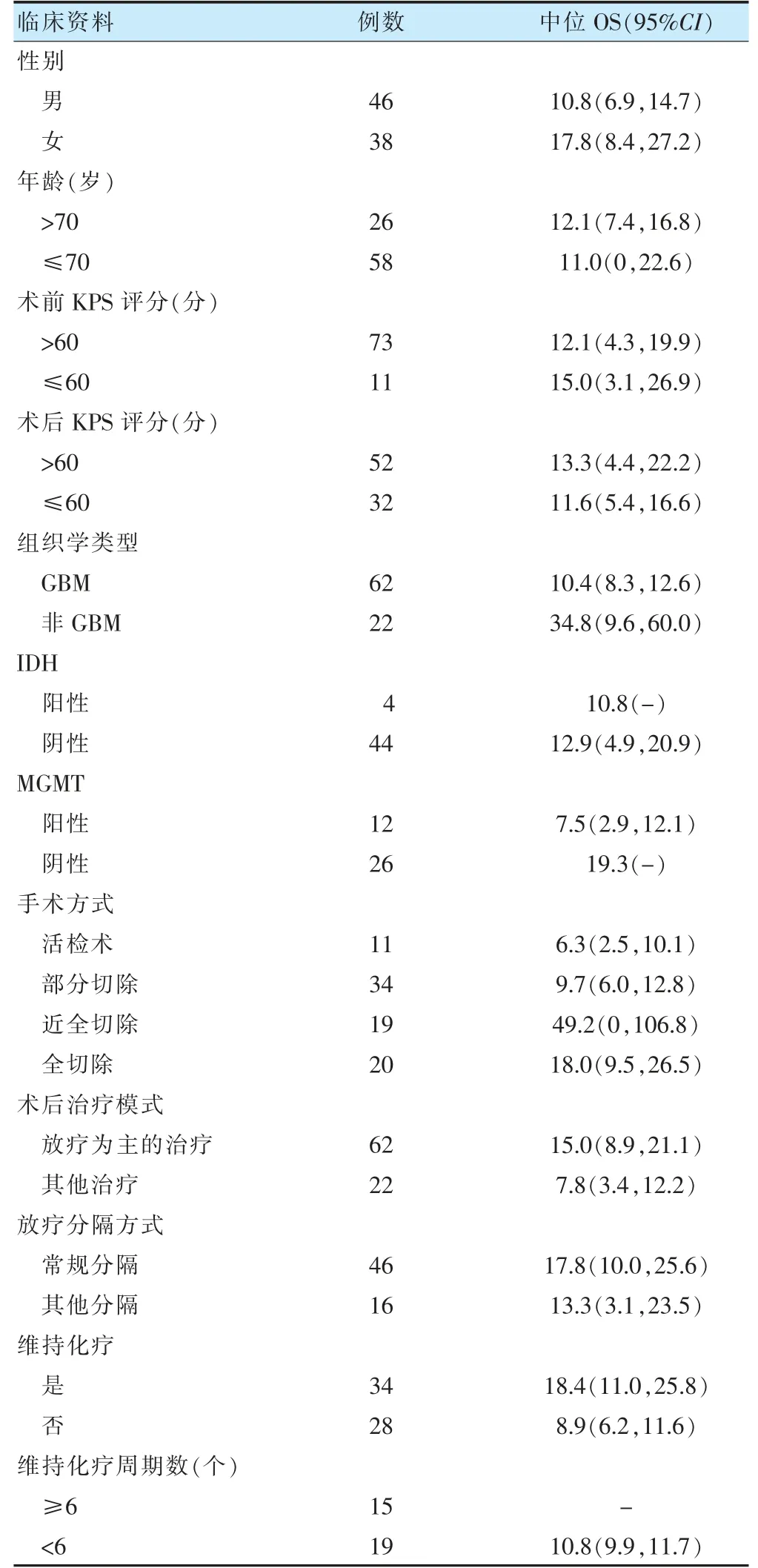
表1 84 例老年HGG 患者临床资料和中位OS(个月)
全组患者中位OS 为10.6 个月,1、2、3 年总生存率分别为44.1%、16.7%、8.3%。单因素分析显示,性别、年龄、术前KPS 评分、IDH 状态、放疗分割方式对OS 的影响,差异无统计学意义(P>0.05);术后KPS评分、组织类型、MGMT 状态、手术方式、术后治疗模式、维持化疗、维持化疗周期数是OS 的影响因素(P<0.05)。见表2、图1~2。
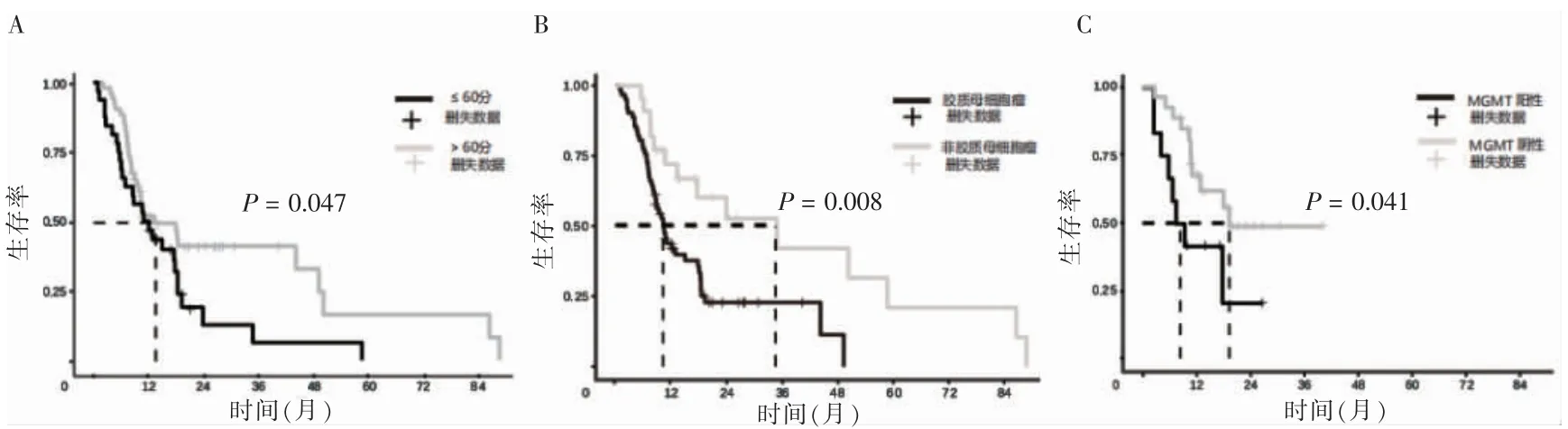
图1 术后KPS 评分、组织类型、MGMT 状态对OS 的影响
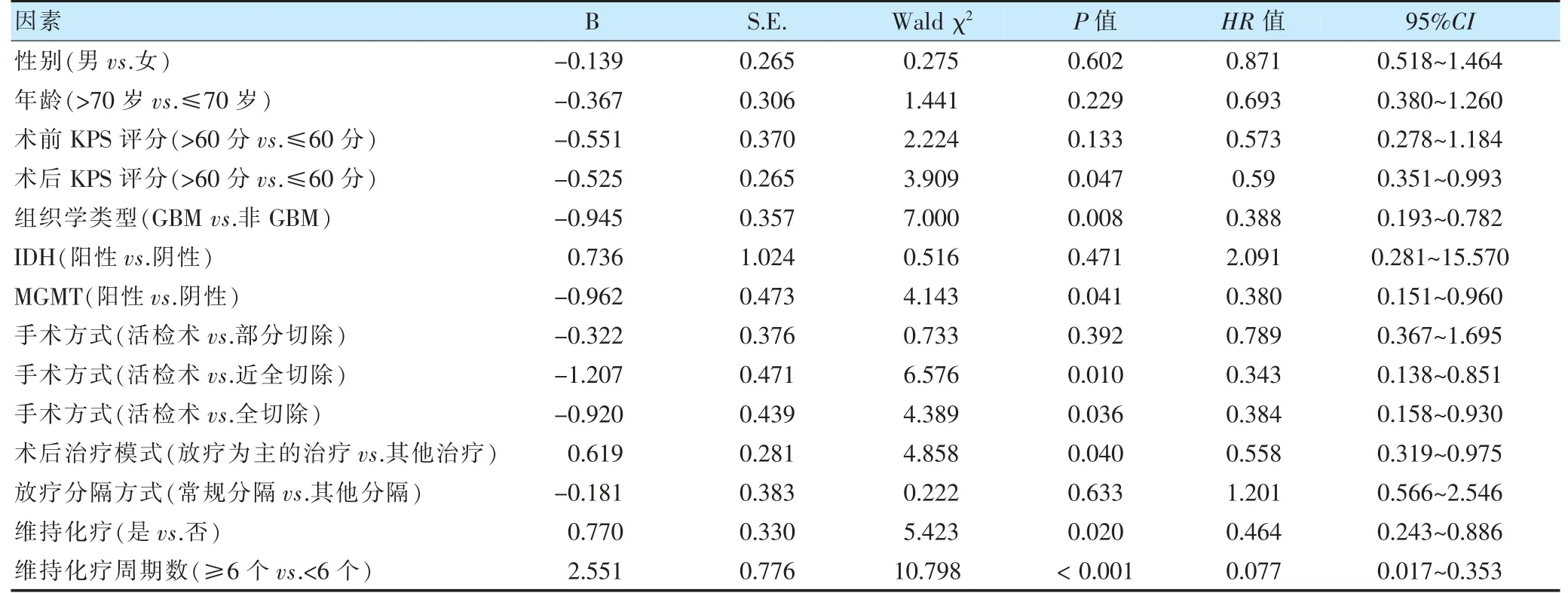
表2 84 例老年HGG 患者OS 的单因素分析
2.2 KPS 评分与放疗完成情况
术前KPS 评分与放疗完成情况无关(P>0.05);而术后KPS 评分与放疗完成情况有关(P<0.05)。见表3。
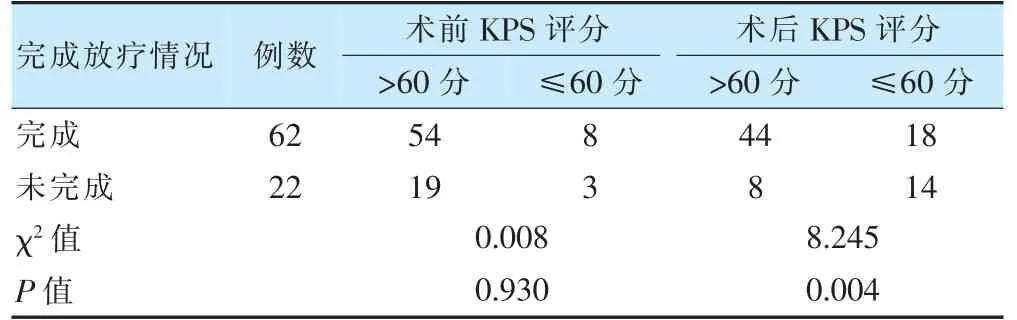
表3 KPS 评分和放疗完成情况(例)
2.3 老年HGG 患者OS 的多因素分析
多因素Cox 回归模型显示,MGMT 免疫组织化学阴性、维持化疗周期数≥6 个为预后良好因素(P<0.05)。见表4。
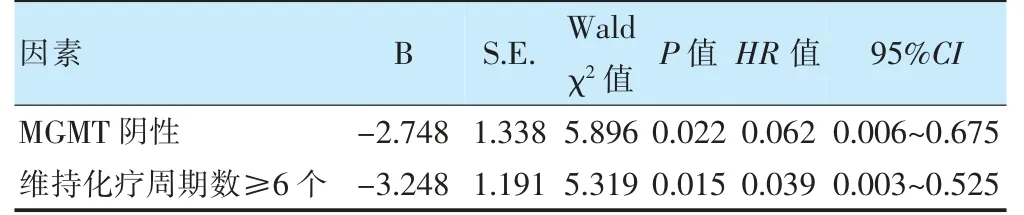
表4 老年HGG 患者OS 的多因素分析
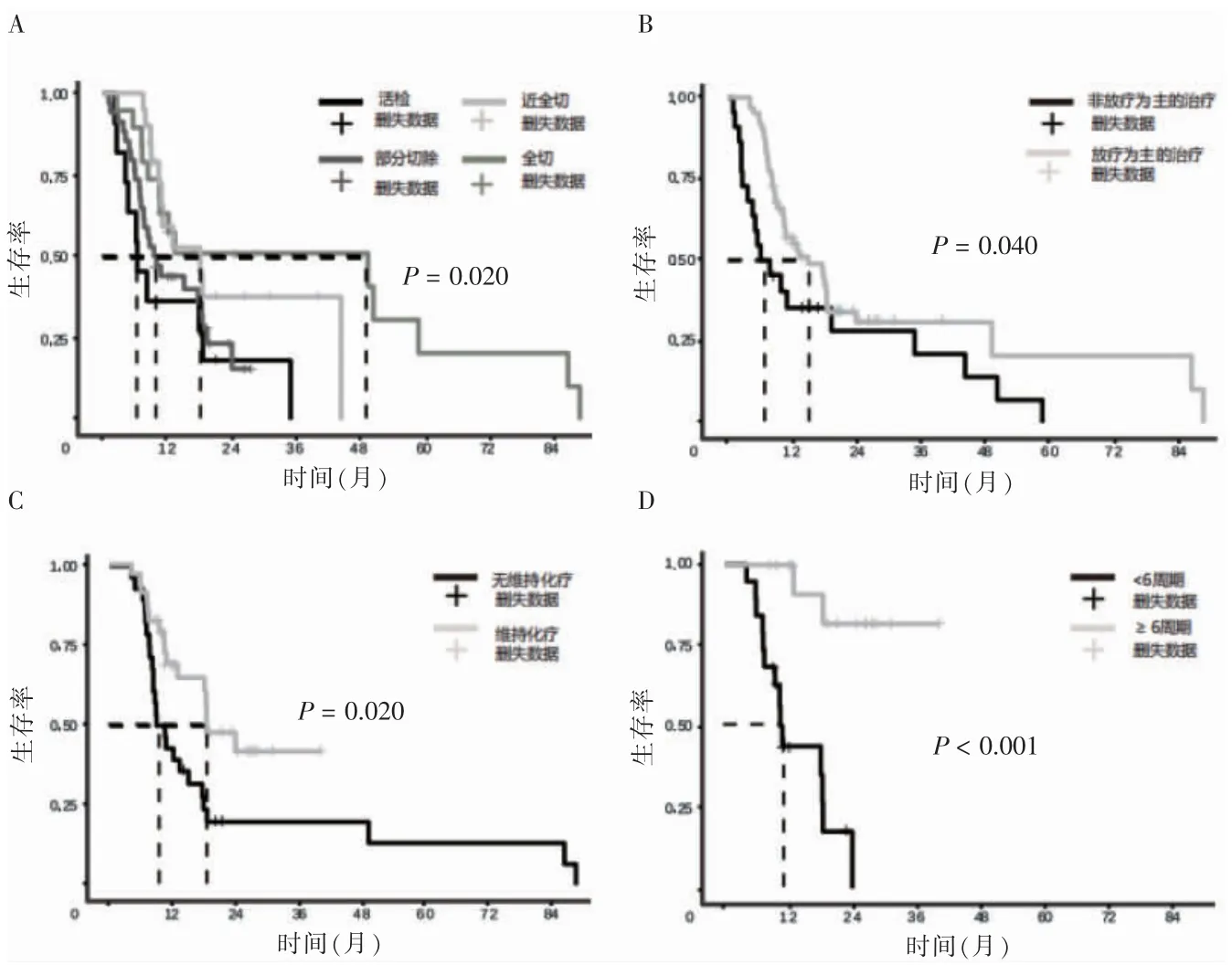
图2 手术方式、术后治疗模式、是否维持化疗、维持化疗周期对总生存期的影响
3 讨论
老年HGG 因本身合并有其他基础疾病,又担心治疗带来的相关毒副作用,往往在发现颅内占位或手术病理明确恶性肿瘤时就放弃了积极治疗,这可能是这部分人群生存预后不良的因素[5-6]。所有年龄层的GBM 群体,经过手术联合放化疗的中位OS 为14.6 个月[7],但随着发病年龄的增长生存预后明显变差,>70 岁老年GBM 总生存仅3.2 个月[8]。在制订老年患者的治疗方案时,除考虑疾病本身外,还应对一般功能状态及基础病等情况进行综合分析[9],制订最佳的治疗方案。胶质瘤的主要治疗手段包括手术、放疗和化疗,但对于老年HGG 患者,何种治疗模式最佳,目前尚无统一定论,因为大部分临床试验都排除了老年患者[10]。
胶质瘤呈浸润性生长,手术全切难度大,最大安全范围的手术全切能让患者获得更好的预后[11-12],在老年HGG 中,亦是如此[13-14]。值得强调的是,放疗或化疗等治疗本身并不会导致患者一般状态变差及生活质量下降,反而能带来生存获益[15]。近10 多年,Stupp方案仍为GBM 的标准治疗方案[16],放化疗可使死亡风险降低。近期的研究发现,老年患者采用低分隔(40 Gy/15 F、34 Gy/10 F)或大分隔(25 Gy/5 F)放疗[17],可与常规分隔获得相同的预后,且缩短治疗时间[18-19]。当然,这种超短疗程的放疗仍需要慎重选择,可能存在放射性水肿和放射性坏死。对于一般状态良好的老年患者,建议行积极治疗,推荐3 周方案的低分隔放疗联合替莫唑胺化疗,中位OS 为9.3 个月,比单纯放疗更能获益,同时并未增加治疗相关的毒副作用[20]。另有研究发现,放化疗基础上联合抗血管治疗能使老年HGG 患者生存获益[21]。2020 年发表的一篇系统综述,对7 个随机对照试验中的1 569 例患者的数据进行分析,结果显示3 周放疗方案(40 Gy/15F)联合替莫唑胺同步及维持化疗是老年GBM 中最佳和首选的辅助治疗方案[22]。遗憾的是,本研究只发现以放疗为主的治疗模式优于其他治疗模式,但何种放疗分隔方式最优尚无定论,可能与患者分隔方式过于个体化、每种分隔方式的患者例数较少有关。在统计分析时,仅能将常规分隔(2Gy/F)和其他分隔方式进行分组比较,结果差异无统计学意义。
2016 年中枢神经系统肿瘤分类已将基因表型和组织表型结合,将神经肿瘤的病理诊断带入“整合诊断”时代[3]。IDH 在HGG,特别是GBM 中,突变频率不高,约5%,但与预后良好相关[23]。本研究有4 例IDH免疫组化表达阳性,突变频率为4.8%,和文献报道相当,但在预后分析中,4 例IDH 阳性患者的中位生存11.5 个月,并未优于IDH 阴性患者,可能与患者例数过少有关,未来需要更大样本量的数据总结。MGMT启动子的甲基化状态已被发现具有重要的预后和预测意义。MGMT 启动子甲基化的老年患者,能从替莫唑胺化疗中获益[24-25]。本研究11 例患者术后选择单纯化疗,中位化疗周期数3(1~12)个周期,并未发现单纯化疗能让HGG 患者生存获益,可能和我们未筛选患者有关。我院2020 年前尚未开展MGMT 启动子甲基化的常规检测,遂本组患者收集的数据为MGMT免疫组化表达情况,在单因素和多因素分析中均发现,MGMT 免疫组化阴性,即启动子甲基化患者,预后更好,并能从长周期(≥6 个)替莫唑胺化疗中获益。
总之,年龄不是老年HGG 的治疗禁忌因素,应结合KPS 评分、基础疾病情况等,制订治疗方案。最大范围的安全切除能够让患者生存获益,术后建议行积极的放疗为主的综合治疗,但何种分隔方式最优仍需要进一步探索。MGMT 免疫组织化学阴性,即启动子甲基化可从替莫唑胺治疗中获益,长周期的维持化疗可能能使生存进一步延长。
