sST2在免疫检查点抑制剂相关不良反应风险预测中的价值
2022-09-17许宇辰程蕾蕾林瑾仪陈佳慧陈怡帆周宇红刘天舒葛均波
许宇辰,程蕾蕾,王 妍,林瑾仪,陈佳慧,陈怡帆,周宇红,刘天舒,葛均波
1.复旦大学附属中山医院心血管内科,上海 200032;
2.上海市心血管病研究所,上海 200032;
3.复旦大学附属中山医院心脏超声诊断科,上海 200032;
4.上海市影像医学研究所,上海 200032;
5.复旦大学附属中山医院肿瘤内科,上海 200032
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)在过去10年间深刻改变了抗肿瘤治疗的格局,其中针对程序性死亡[蛋白]-1(programmed death-1,PD-1)抗体、程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)抗体、细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)的ICI被越来越多地应用于多种恶性肿瘤的一线治疗方案中,但随着其在临床上的广泛使用,有关治疗导致的免疫相关不良反应(immune-related adverse event,irAE)的报道日益增多[1]。irAE的发生会影响后续抗肿瘤治疗的进程[2],同时部分严重的irAE可能直接导致患者的死亡。因此,如何准确预测irAE的发生风险显得至关重要。
肿瘤抑制因子2(suppression of tumorigenicity-2,ST2)是白细胞介素-1(interleukin 1,IL-1)受体家族成员,可分为膜结合型受体(ST2)和可溶性受体(soluble form of suppression of tumorigenicity-2,sST2)。其中ST2可与白细胞介素33(interleukin 33,IL-33)结合,参与多种疾病的发生、发展过程[3-4]。而sST2可与IL-33结合,抑制IL-33发挥下游调控作用,因此sST2也被称为IL-33的诱骗受体。研究[5-7]显示,血清中sST2的水平在一定程度上反映了机体炎症反应程度,目前已被应用于多种疾病的预测、危险分层及预后评估 。本研究分析了接受ICI治疗的肿瘤患者血清中sST2的水平、预后营养指数(prognostic nutritional index,PNI)及血小板与淋巴细胞比例(platelet to lymphocyte ratio,PLR),构建irAE的风险预测模型。
1 资料和方法
1.1 研究对象
入选2018年10月—2020年12月于复旦大学附属中山医院肿瘤内科住院治疗的恶性肿瘤患者,入选标准:①年龄大于或等于18岁;② 在本研究中心接受了PD-1、PD-L1及CTLA-4抑制剂治疗的恶性肿瘤患者;排除标准:①年龄小于18岁;② 治疗前血清sST2水平高于正常水平(35 ng/ mL)的患者;③既往有自身免疫性疾病史的患者;④ 合并明确心功能不全的患者(左心室射血分数小于40%)。最终共91例患者入组。
1.2 研究方法
对于患者在接受ICI治疗后是否发生irAE由包括2位肿瘤内科医师在内的多学科团队依据中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)发布的《免疫检查点抑制剂相关的毒性管理指南2021版》[8](下文简称指南)进行界定,将在接受ICI治疗过程中出现指南中定义的G2及以上级别毒性反应的患者纳入irAE组,其余患者纳入对照组。
收集并记录所有患者的人口统计学特点、恶性肿瘤类型、所用ICI类型及出现irAE的类型,同时收集患者在接受ICI治疗前基线及治疗后的血清sST2水平、外周血淋巴细胞计数、外周血嗜中性粒细胞计数、外周血血小板计数、外周血CD4+/CD8+T细胞比例、B细胞计数、白蛋白水平、D-二聚体水平以及治疗后血清sST2水平、心肌肌钙蛋白T水平、B型利钠肽水平,并计算嗜中性粒细胞与淋巴细胞比率(neutrophil to lymphocyte ratio,NLR)、PNI、PLR,其中PNI=血清白蛋白水平(g/L)+5×总淋巴细胞计数(×109个)。
所有irAE组患者均接受住院治疗,在住院治疗期间每3~ 5天进行1次上述指标的检测直至出院,并对患者进行随访直至irAE被治愈。对照组患者在首次接受ICI治疗后,每3周随访1次,检测上述指标,直至ICI治疗结束。
1.3 统计学处理
本研究采用太美EDC系统进行临床数据的采集及管理,使用R语言(R version 4.1.2)进行统计学分析及绘图。计量资料用x±s或百分比(%)表示。采用受试者工作特征(receiver operating characteristic,ROC)曲线对相关指标的预测价值进行分析并寻找最佳截断值;对于符合正态分布及方差齐性的组间数据比较采用Student’st-test检验,对于符合正态分布但方差不齐的组间数据比较采用separate variance estimationt-test检验。P<0.05为差异有统计学意义。
2 结果
2.1 入选患者基本情况
研究共入选的91例恶性肿瘤患者中,男性53例(58.2%),女性38例(41.8%),平均年龄(57.5±12.4)岁,肿瘤原发部位:胃恶性肿瘤26例,软组织肉瘤9例,胆囊恶性肿瘤8例,小细胞肺癌8例,结肠癌7例,肝癌6例,食管癌5例,胰腺癌4例,胆管癌3例,鼻咽癌3例,原发部位不明及其他肿瘤共12例。其中,患者接受一线免疫治疗53例,二线16例,三线及新辅助治疗共22例。ICI种类:特瑞普利单抗30例、卡瑞利珠单抗23例、帕博利珠单抗13例、纳武利尤单抗11例、信迪利单抗10例、度伐利尤单抗2例、替雷利珠单抗例1例、cadonilimab(AK104)1例。
2.2 免疫检查点抑制剂相关不良事件发生情况
91例患者中共有13例患者确诊为irAE(均使用PD-1单抗),PD-1相关的irAE发生率为14.7%,共记录免疫相关不良事件21次,其中免疫性心肌炎7次,内分泌毒性事件6次,肝脏毒性事件5次,骨骼肌系统毒性事件3次,中位随访时间为201 d(48~ 665 d),中位暴露时间43 d(13~ 164 d)。
2.3 irAE组与对照组患者生物学指标的比较
irAE组患者基线血小板计数、B细胞计数、外周血CD4+/CD8+T细胞比例、D-二聚体、NLR及血清sST2水平与对照组差异无统计学意义(P>0.05),而两组患者基线PNI及PLR水平差异有统计学意义(P<0.05,表1)。
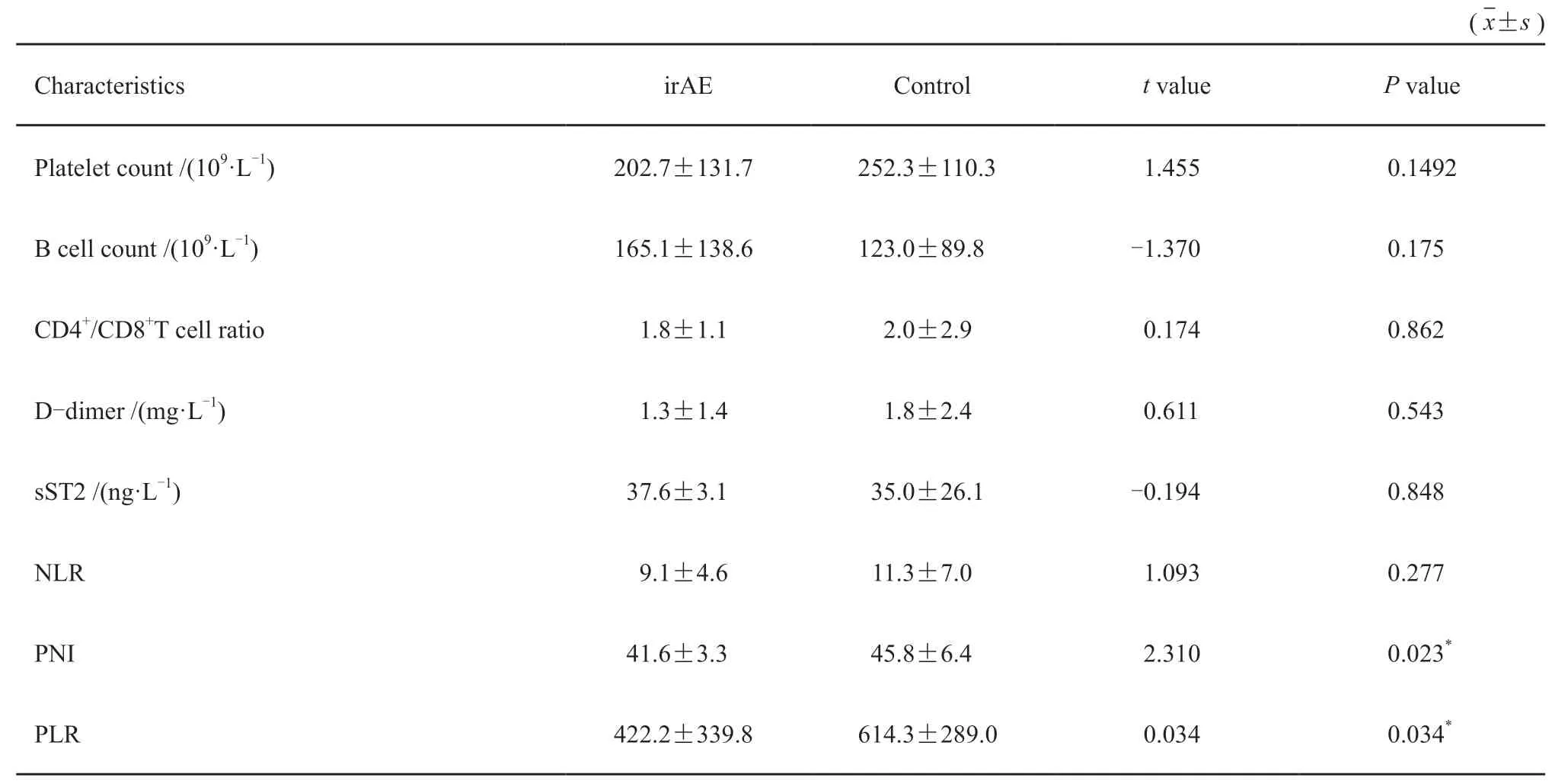
表1 irAE与对照组患者基线生物学指标情况Tab.1 Baseline biological indicators of patients in irAE group and control group
2.4 irAE组与对照组治疗后血清sST2、心肌肌钙蛋白T及B型利钠肽水平的比较
ir AE组患者在治疗后心肌肌钙蛋白T 及B型利钠肽水平与对照组差异无统计学意义(P> 0.05),而两组患者治疗后sST2峰值水平差异有统计学意义(P<0.05)。由于irAE组及对照组两组心肌肌钙蛋白T及B型利钠肽水平数据方差不齐,故采用separate variance estimationt-test检验(表2)。
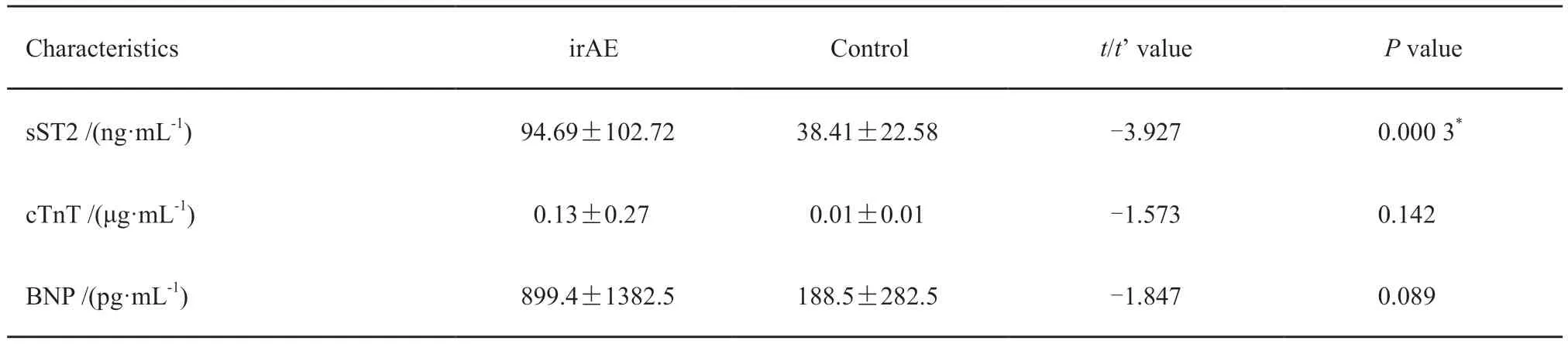
表2 irAE与对照组治疗后血清sST2峰值、心肌肌钙蛋白T及B型利钠肽水平Tab.2 Peak value of sST2,cardiac troponin T and Brain natriuretic peptide levels in irAE group and control group after treatment
2.5 患者接受ICI治疗后发生irAE风险的多因素logistic回归模型
以患者是否发生G2及以上级别irAE为二分类结局因变量(未发生=0,发生=1),将在irAE组及对照组患者两组间差异有统计学意义的指标基线PNI水平(X1)、基线PLR水平(X2)及治疗后sST2峰值(X3)共3个因素作为协变量构建logistic回归模型,其模型表达式为:logit(P)=9.041-0.224X1-0.003X2+0.001 3X3,即患者接受ICI治疗后发生irAE风险P=1/(1+e-9.041-)。结果显示,较低的基线PNI水平、基线PLR水平及较高的治疗后血清sST2峰值为患者接受ICI治疗后发生irAE的独立危险因素(P<0.05,表3)。绘制此模型用于预测irAE发生风险的ROC曲线。结果显示,该模型用于预测irAE发生风险的ROC曲线下面积0.857,其约登指数为0.695,取P=0.184作为cut-off值时,其灵敏度和特异度分别为84.6%和84.9%(图 1)。
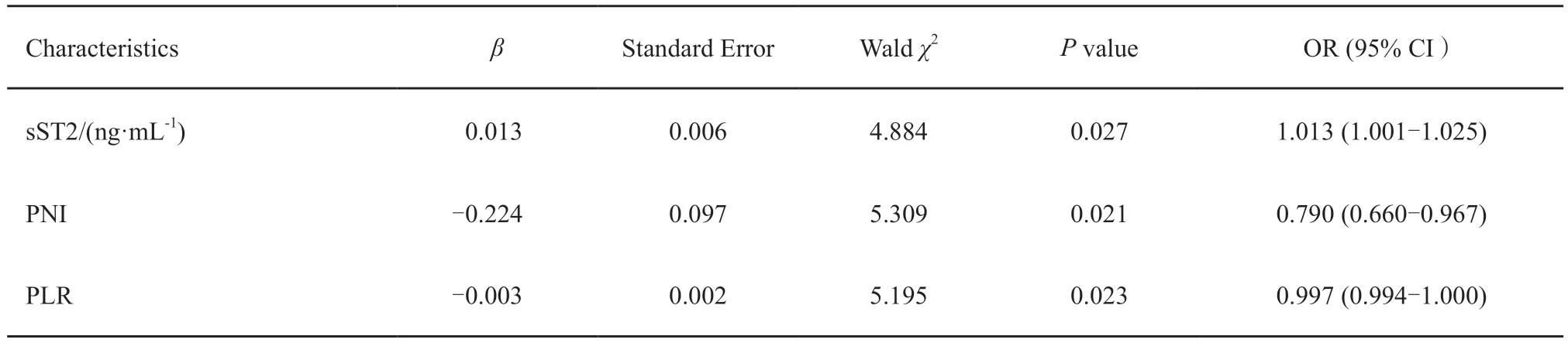
表3 患者接受ICI治疗后发生irAE风险的多因素logistic回归模型Tab.3 Multivariate logistic regression analysis of irAE risk after ICI treatment
3 讨 论
ICI近年来被广泛应用于多种恶性肿瘤的一线治疗方案中,其通过特异性结合细胞表面的免疫检查点,解除其抑制作用,使机体的免疫细胞得到激活从而发挥抗肿瘤的作用。然而ICI的使用可能会破坏免疫系统的稳态从而引发irAE,可累及各个系统脏器或组织。既往研究表明,ICI治疗常见的不良反应为肺毒性、肝脏毒性、内分泌毒性及胃肠道毒性,而心脏毒性较为少见[9]。本研究结果显示,ICI相关的心脏毒性事件较为常见(发生率为7.7%),这可能是回顾性研究的选择偏倚及观察偏倚所致,即本研究纳入了较多的接受ICI治疗后出现心血管毒性事件的患者。同时本中心的医师对于患者心功能的监测更为重视,一定程度上导致了我们观察到更多的心血管毒性事件。此外,本研究结果显示,irAE组患者的中位暴露时间为43 d,这与之前的研究结果相吻合,即irAE多于第一次接受ICI治疗后的1~ 2个月内出现[8,10]。
ST2是白细胞介素1(interleukin 1,IL-1)受体家族成员,其具有两种形式,跨模型受体ST2和可溶性受体sST2。既往研究在心肌细胞中发现了IL-33/ST2信号转导通路的存在,其可抑制心肌细胞肥大和纤维化,当心肌受到机械性牵张时,心肌细胞中sST2水平明显升高,而sST2作为“诱饵受体”可与ST2竞争性结合IL-33,抑制IL-33/ST2信号转导通路的心脏保护作用,因此sST2的水平一定程度上反映受损组织情况,是心肌细胞肥厚和纤维化的标志。在临床研究中,sST2、肌钙蛋白T及B型利钠肽等生物学标志物被广泛应用于包含急性冠脉综合征及心力衰竭等多种心血管疾病的诊断与预后判断[11-13]。本研究发现,irAE组患者治疗后血清sST2峰值与未发生irAE组患者之间差异有统计学意义(P=0.000 3),而肌钙蛋白T及B型利钠肽水平在两组间差异无统计学意义(P=0.142;P=0.089),这可能是由于肌钙蛋白T特异性地表达于心肌细胞内,而B型利钠肽主要由心室肌细胞合成和分泌,当irAE相关的损伤不涉及心血管系统时,肌钙蛋白T及B型利钠肽水平不会发生显著的变化,而ST2在包括肿瘤细胞、免疫细胞及神经细胞在内的多种细胞中均有表达,其在炎症、肿瘤和肾脏疾病中的重要性和作用已得到评估与证实[14-15],因此当ICI治疗引起免疫稳态破坏后,免疫细胞中ST2的表达水平可能会受到影响而发生改变,然而目前尚未见临床或基础研究阐述sST2与irAE之间的关系。本研究发现治疗后升高的sST2水平是irAE发生的独立危险因素(OR=1.013,95% CI:1.001~ 1.025)。目前主流观点认为irAE的发生主要与ICI治疗导致的T细胞活性异常有关[2],而ICI治疗后体内炎性细胞因子水平的上升同样也可促进irAE的发生[16]。动物实验表明,通过单克隆抗体靶向中和sST2可以显著降低血浆中的炎性细胞因子同时增加抗炎因子的水平[17],因此,sST2水平的升高可能通过促进体内炎性细胞因子的增多并抑制抗炎因子的释放从而促进irAE的发生、发展。此外,IL-33/ST2的信号转导通路在多种疾病模型中均被证实可以通过激活组织中的调节性T细胞(regulatory T cells,Treg)发挥炎症抑制作用,防止过度激活的免疫反应造成组织损伤[18-19],而sST2由于缺乏ST2的跨膜结构域及细胞质结构,与IL-33结合后会抑制IL-33/ST2信号转导通路进而影响Treg细胞的抗炎作用,这可能进一步促进了irAE的进展。然而sST2在irAE的发生、发展过程中究竟扮演着怎样的角色还有待进一步的研究去证实。
既往多项有关irAE的临床研究显示,多种生物学指标可能与irAE的发生相关,其中包括:患者接受ICI治疗前基线的外周血血小板计数、外周血CD4+/CD8+T细胞比例、B细胞计数、铁蛋白水平,D-二聚体水平、NLR、PNI和PLR等[20-23]。我们从中选取了本中心已开展的检验指标进行了验证。结果显示,irAE组与对照组患者在接受ICI治疗前的基线PNI及PLR差异有统计学意义(P=0.023和P=0.034),这与Liu等[23]及Egami等[24]的研究一致,但其背后的机制尚未被阐明,其可能与ICI导致的T淋巴细胞激活有关。
此外,我们还构建了包括患者基线PNI、PLR以及治疗后sST2峰值水平3个因素在内的logistic回归模型,用于预测肿瘤患者在接受ICI治疗后发生irAE的风险,该模型展现了较好的预测能力(ROC曲线下面积为0.857),模型所需的三项指标的临床检测成本低,相关的检测技术手段成熟且稳定,具有较好的转化前景。
本研究仍存在以下不足:①本研究为单中心的回顾性研究,存在选择偏倚及观察偏倚,缺乏外部数据对结果进行验证,后续仍需进行多中心的前瞻性研究对本研究的结果进行进一步的验证。② 该模型包含的三个指标均为外周血指标,部分irAE相关的组织及器官损伤可能仅表现为受累脏器、组织的微环境变化,而部分皮肤、胃肠道及神经毒性反应并不会引起外周血指标的显著变化,因此仅包含外周血指标的模型无法全面、准确地反映此类免疫损伤情况。③由于部分患者的ICI治疗在门诊进行,部分症状较轻的不良反应(如皮疹或腹泻)可能被忽略。
本研究首次证明了接受ICI治疗后较高的sST2水平是发生irAE的独立危险因素,同时联合sST2、PNI及PLR构建了logistic回归模型,该模型对患者接受ICI治疗后发生irAE的风险具有较好的预测能力。
利益冲突声明:所有作者均声明不存在利益冲突。
