体重指数与年龄交互作用对乳腺癌患者预后影响的研究
2022-09-17肖佳龙周昌明王泽洲余科达柳光宇沈镇宙邵志敏
肖佳龙,莫 淼,周昌明,王泽洲,沈 洁,袁 晶,余科达,柳光宇,吴 炅,沈镇宙,邵志敏,郑 莹
1.复旦大学附属肿瘤医院肿瘤预防部,复旦大学上海医学院肿瘤学系,上海 200032;
2.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺癌居于全球女性恶性肿瘤发病首位,也是全球女性癌症相关死亡的主要原因之一。2018年中国女性乳腺癌新发病例和死亡病例预计为36.8万和9.8万[1]。对于乳腺癌患者而言,体重管理对改善预后具有重要的意义[2]。已有研究表明诊断时体重指数(body mass index,BMI)与乳腺癌患者预后相关,呈现“U”型或“J”型的关联[3-5]。一项对上海乳腺癌患者的研究表明,BMI与晚期全因死亡率呈U型关联,最低风险对应的BMI为25.0 kg/m2[5]。一项meta分析研究汇总了82项研究,结果显示,肥胖、超重及体重不足的女性死亡风险均高于正常体重的女性[4]。
既往的许多研究[6-7]将体重不足的女性与正常体重的女性合并为非肥胖组进行分析,由于体重不足的女性相较于正常体重的女性可能具有更差的预后结局,会导致肥胖组与非肥胖组之间的预后差异被掩盖,从而得到假阴性的结论。因此,需要适宜的研究设计,以分析BMI与乳腺癌预后的关系[8]。
年轻乳腺癌患者相较于老年患者有更强的肿瘤细胞增殖活性和更高的死亡率[9],并且在诊断时通常疾病分期较晚、肿瘤直径较大、三阴性和人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)过表达亚型比例较多[10]。在病因和生物学上,年轻患者与老年患者有所不同[9,11]。而对于年龄是否影响BMI对于乳腺癌预后的作用,目前尚缺乏研究证实。
本研究基于复旦大学附属肿瘤医院就诊的乳腺癌患者诊疗和长期随访数据进行回顾性分析,旨在采用BMI作为影响预后的指标,评估对于诊断时处于不同年龄阶段的乳腺癌预后的影响,并重点讨论年龄与BMI之间可能的交互作用,以期对乳腺癌患者进行合理分类,并据此为患者长期生存管理提供更多依据。
1 资料和方法
1.1 研究设计及对象
纳入对象为2008年1月1日—2016年12月31日在复旦大学附属肿瘤医院住院治疗且具有结构化临床病理学资料的初诊乳腺癌患者,共计25 629例。排除标准:①男性患者。② 双侧乳腺癌患者。根据上述排除标准,本研究共纳入25 267例患者。本研究已获得复旦大学附属肿瘤医院伦理委员会审批(审批号:YF-2021-01)。
1.2 资料收集
患者的社会人口学信息和临床病理学特征信息来源于复旦大学附属肿瘤医院乳腺癌单病种科研平台,随访信息来源于复旦大学附属肿瘤医院随访数据库。收集的社会人口学信息包括年龄、BMI、绝经状态,临床病理学特征包括肿瘤侧性、是否为原位癌、是否多发、Ki-67增殖指数、雌激素受体(estrogen receptor,ER)表达、孕激素受体(progesterone receptor,PR)表达、HER2表达以及pTNM分期,随访信息包括是否死亡以及死亡时间。
1.3 随访计划
本研究随访统计时间截至2021年3月1日。患者出院1年后对其进行首次生存随访,出院5年内每年随访1次,出院5年后每2年随访1次,直至患者死亡后终止随访。具体随访计划参见本团队前期发表的文章[12]。
1.4 变量定义
年龄分类参照2019年《年轻乳腺癌诊疗与生育管理专家共识》[13]以及世界卫生组织(World Health Organization,WHO)对于年龄的划分[14],发病年龄<35岁的患者定义为年轻乳腺癌患者,发病年龄≥35且<60岁的患者定义为中年乳腺癌患者,发病年龄≥60岁定义为老年乳腺癌患者。BMI分类参照《中国成人超重和肥胖症预防与控制指南》[15]。pTNM分期参照美国癌症联合会(American Joint Committee on Cancer,AJCC)TNM第7版分期标准[16]。ER、PR表达阳性率≥1%记为“+”、“++”、“+++”时,定义状态阳性;表达阳性率<1%记为“弱+”、“少量+”、“个别+”,定义状态阴性。免疫组织化学HER2记为“+++”或荧光原位杂交(fluorescenceinsituhybridization,FISH)检测阳性时定义为HER2状态阳性,HER2记为“-”、”-/+”、“+”或FISH检测阴性时定义为HER2状态阴性;当免疫组织化学检测结果与FISH检测结果冲突时,以FISH检测结果为准;HER2记为“++”且FISH未检测或结果不确定时,HER2状态归为未知。
1.5 统计学处理
终点事件定义为全死因死亡,总生存时间定义为从患者在复旦大学附属肿瘤医院首次治疗的时间至终点事件发生的时间。对于尚未发生终点事件以及未知终点事件的患者,在末次随访时间点按删失数据处理。
利用SPSS 20.0和R 4.0.5软件进行统计学分析。利用卡方检验比较BMI组间的临床特征分布。采用log-rank法进行单因素分析,为了评估BMI与年龄对于乳腺癌患者预后的交互作用,使用Cox比例风险回归模型进行多因素分析,调整已知的预后因素,包括Ki-67、ER、PR、HER2、T分期、N分期以及M分期,并向模型中加入BMI与年龄的相乘交互项以探索BMI与年龄的交互作用。通过年龄进行分层,使用Cox比例风险回归模型探索BMI与乳腺癌患者预后的关联。利用R软件的rms程序包(version 6.2.0)使用限制性立方样条Cox比例风险回归模型分析在不同年龄亚组中BMI与乳腺癌患者预后之间的非线性关系,样条函数节点数选为4个,参考点分别定义为中位数和各年龄组风险最低点。限制性立方样条分析进行了两项统计学显著性检验,分别为针对变量的线性项和非线性项的回归系数均为0的假设检验以及变量的非线性项的回归系数为0的假设检验。统计学显著性检验均为双侧检验,取α=0.05。P<0.05为差异有统计学意义。
2 结果
2.1 患者一般情况
根据入组标准共纳入25 267例患者,所有患者中位随访时间为68.9个月,3年和5年总生存率(overall survival,OS)分别为96.7%(95% CI:96.5%~ 96.9%)和93.9%(95% CI:93.6%~ 94.2%)。在不同BMI亚组中,年龄、绝经状态、是否为原位癌、ER、PR、HER2、T分期、N分期、M分期和分子亚型的分布差异有统计学意义。所有患者的基线资料见表 1。

表1 不同BMI分组乳腺癌患者的临床病理学特征分布情况Tab.1 Distribution of clinicopathological features of patients with breast cancer between the different BMI groups
2.2 BMI与年龄的交互作用
单因素分析结果显示年龄、BMI、是否绝经、是否为原位癌、Ki-67、ER、PR、HER2、T分期、N分期以及M分期对乳腺癌患者生存时间的影响差异有统计学意义(P<0.05)。考虑到变量之间的共线性,选取Ki-67、ER、PR、HER2、T分期、N分期以及M分期作为调整因素,将调整因素与BMI、年龄以及BMI和年龄的相乘交互项一同纳入Cox模型中。结果显示,年龄、BMI以及BMI与年龄的交互项对乳腺癌患者预后影响差异有统计学意义(P<0.05,表2)。
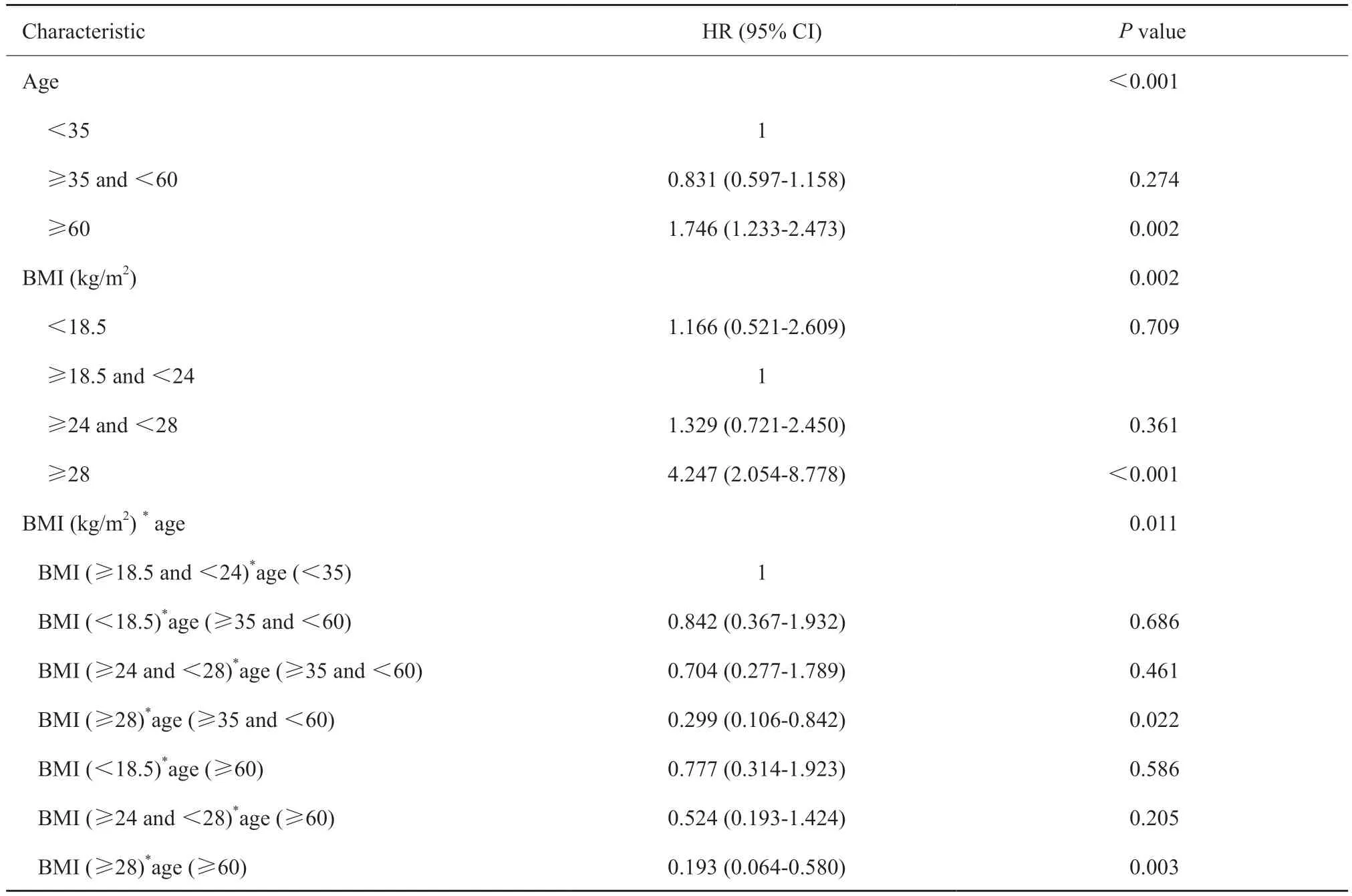
表2 BMI与年龄的相乘交互作用分析Tab.2 Analysis of the interaction between BMI and age
2.3 不同年龄组中BMI与患者死亡风险的非线性关系
根据年龄分组,分析乳腺癌患者的死亡风险比与BMI的非线性关联(图1)。年龄小于35岁组(P=0.002)和35~ 60岁组(P=0.001)患者的BMI与死亡风险的关联有统计学意义,年龄小于35岁组(P=0.016)和大于60岁组(P=0.038)患者的BMI与死亡风险的非线性关联有统计学意义。不同年龄组患者的死亡风险与BMI的关联有所不同,主要体现在死亡风险最低对应的BMI以及死亡风险对BMI变化的敏感程度上(图1、表3)。在年龄小于35岁组观察到死亡风险与BMI呈现“J”型的关联,BMI为20.16 kg/m2的患者死亡风险最低。在年龄35~ 60岁组观察到BMI在23 kg/m2以下的患者死亡风险随着BMI的增加没有明显的变化,BMI在23 kg/ m2以上的患者死亡风险随着BMI的增加而增加。而在年龄大于60岁组观察到死亡风险与BMI呈现“U”型的关联,BMI为23.86 kg/m2的女性死亡风险最低。为了评估各年龄组女性的死亡风险对BMI变化的敏感程度,分别以BMI为22.94 kg/m2(中位数)和各年龄组最低死亡风险对应的BMI为参照,得到BMI为17.19 kg/m2、18.50 kg/m2、24.00 kg/m2、28.00 kg/m2和31.25 kg/m2的患者的死亡风险比(表3)。结果显示,年龄小于35岁组患者的死亡风险对BMI变化的敏感程度相较于另外两组更高,其BMI第99百分位数(31.25 kg/m2)相对于最低死亡风险的死亡风险比为3.996(95% CI: 1.836~ 8.695),而年龄35~ 60岁组和大于60岁组分别为1.783(95% CI: 0.980~ 3.243)和1.420(95% CI:0.999~ 2.019)。

表3 不同年龄组乳腺癌患者不同BMI值对应的死亡风险比Tab.3 Hazard ratios of mortality of breast cancer patients for different value of BMI compared to the median BMI grouped by age
3 讨 论
本研究通过对25 629例乳腺癌患者的回顾性分析,发现BMI与年龄对乳腺癌预后的影响有显著的交互作用,进一步以年龄为分层条件,利用限制性立方样条Cox回归方法分析患者死亡风险与BMI的非线性关联。结果显示,不同年龄组患者的死亡风险与BMI的关联模式有所不同:对于不同年龄的乳腺癌患者,其理想的BMI可能略有不同,对于年轻患者,其理想的诊断时BMI约在20 kg/m2,而对于60岁以上患者,其理想的诊断时BMI约在24 kg/m2,同时年龄小于35岁组患者的死亡风险对BMI变化的敏感程度相较于另外两组更高。
对于患者BMI与死亡风险的关系,本研究的结果与既往一些研究的结果类似,即BMI与全因死亡风险呈现“U”型或“J”型关联[4-5]。一项对上海乳腺癌患者的研究[5]表明,BMI与晚期全因死亡率呈“U”型关联,最低风险对应的BMI为25.0 kg/m2。一项meta分析研究汇总了82项研究,结果显示对于诊断前的BMI,与正常体重女性(BMI 18.5~ 25.0 kg/m2)相比,肥胖(BMI >30.0 kg/m2)、超重(BMI 25.0~30.0 kg/m2)、体重不足(BMI<18.5 kg/m2)的死亡相对风险为1.41倍(95% CI:1.29~ 1.53)、1.07倍(95% CI:1.02~ 1.12)和 1.10倍(95%CI:0.92~ 1.31)[4]。肥胖一直被认为是乳腺癌预后的危险因素,而本研究和来自亚洲人群的其他研究[8,17]结果显示,体重不足患者相对于正常体重患者同样具有更差的预后结局。
关于体重不足与乳腺癌患者不良预后的可能潜在关联机制,有研究[18]提出肿瘤细胞从致癌到转移的过程中,通过各种分子信号与循环免疫细胞相互作用。通过全身和局部的相互作用,免疫细胞可以促进或抑制肿瘤的进展[19-20],对于慢性营养不良的患者,细胞因子反应和免疫系统激活受到损害,这可能会影响远处器官的肿瘤-免疫系统相互作用[21]。
目前尚无针对BMI与年龄的交互作用的研究,仅有部分学者对于BMI与绝经状态是否存在交互作用进行了研究,且尚无定论,而患者的绝经状态往往与年龄密切相关。一项临床试验的回顾性分析结果显示,在已绝经女性中,肥胖患者与非肥胖患者的无病生存期和总生存期均存在显著差异,而在未绝经女性中没有观察到这种差异[22]。一项meta分析则得出相反的结论,在未绝经女性中,肥胖患者的总生存期与非肥胖患者差异有统计学意义,而在已绝经女性中差异无统计学意义[4]。以上研究均以绝经状态作为分层条件,相较于以年龄作为分层条件而言,主要的区别是无法对于年轻女性和中年女性的BMI与死亡风险的关联模型进行区分。本研究的结果显示,BMI和年龄在对乳腺癌患者预后的影响上存在交互作用,不同年龄段的患者其BMI与预后的关联模式不同,主要体现在死亡风险最低对应的BMI以及死亡风险对BMI变化的敏感程度上。
本研究的结果对于乳腺癌高危人群的体重管理具有一定的参考价值。有指南[2]指出,对于乳腺癌患者,超重和肥胖不仅会对癌症特异性结局产生不利影响,还会对整体健康和生活质量产生不利影响,因此达到理想的体重是一项非常重要的有关生活方式的追求。
本研究的优势在于较大的样本量和较长的随访时间,在一定程度上保证了结果的可靠性。同时限制性立方样条方法能够检测并描述出BMI与预后的非线性关联以及最低风险对应的BMI。然而研究仍然具有一定的局限性。首先,本研究属于以医院为基础的单中心回顾性研究,限制了结论的外推性。其次,本研究没有收集腰臀比数据,有研究[23]表明,肥胖的不利影响与身体脂肪的分布密切相关,中心性肥胖尤其有害,腰臀比相较于BMI能够更好地预测肥胖相关健康风险。同时,本研究未观测患者BMI的动态变化,仅分析了诊断时患者的BMI,无法对诊断后BMI变化所造成的预后改变进行分析[24]。
总之,本研究结果显示,在校正了相关预后因素后,BMI与年龄对乳腺癌预后的影响有显著的交互作用,不同年龄组患者的死亡风险与BMI的关联模式有所不同,仍需要进一步的研究来评估诊断后BMI与患者预后的关系,从而为乳腺癌患者的体重管理提供更详尽的参考。
利益冲突声明:所有作者均声明不存在利益冲突。
