前哨淋巴结时代乳腺癌的精准区域处理:演进与展望
2022-09-17邱鹏飞王永胜
邱鹏飞,王永胜
山东省肿瘤防治研究院(山东省肿瘤医院),山东第一医科大学(山东省医学科学院),山东 济南250117
作为乳腺癌重要的预后指标之一,区域淋巴结状况可以指导分期和辅助治疗策略的制定,因此区域淋巴结精准诊断与个体化处理始终是乳腺癌研究的热点。腋窝淋巴结(axillary lymph node,ALN)和内乳淋巴结(internal mammary lymph node,IMLN)同是乳腺淋巴引流的“第一站”淋巴结,均有独立的预后意义[1-2],联合ALN和IMLN分期可以为乳腺癌的区域淋巴结分期、预后评估及术后辅助全身/局部区域治疗方案的确定提供更可靠的依据。20世纪90年代,乳腺癌前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)成为乳腺外科领域里程碑式的进展。目前,腋窝SLNB已成为临床ALN阴性患者的标准腋窝处理模式,内乳SLNB(internal mammary SLNB,IM-SLNB)微创评估IMLN转移的循证医学证据也在逐渐积累,早期乳腺癌的区域处理在升降阶梯的不断平衡和优化下逐渐走向精准。
1 乳腺癌区域淋巴引流模式
乳房淋巴引流包括浅表和深部淋巴网,乳头乳晕区、皮内、皮下等浅表淋巴管网只引流到ALN,起始于腺泡深部的淋巴管穿过腺体组织可以引流到ALN和IMLN,乳腺浅表淋巴网与可以引流到内乳区的深部淋巴网无交通支。Chagpar等[3]对3 961例患者的多中心研究显示,将示踪剂注射在乳腺不同部位的腋窝SLNB成功率和假阴性率差异均无统计学意义。基于腋窝前哨淋巴结(sentinel lymph node,SLN)的引流模式,Cong等[4]提出了内乳SLN同样是接受整个乳腺腺体淋巴引流的假说,将核素和荧光示踪剂注射到不同象限的腺体可以定位至相同的内乳SLN。Cao等[5]将99mTc-低分子右旋糖酐注射到乳腺腺体后立即行单光子发射计算机体层成像(single photon emission computed tomography,SPECT)/计算机体层成像(computed tomography,CT)动态显像,观察到示踪剂由注射点向第一站IMLN引流,并由此淋巴结向次级IMLN逐级引流,进一步证实了内乳SLN的概念。乳腺癌淋巴引流模式的一系列研究改变了SLN的概念:从最初的接受肿瘤部位的淋巴引流,到现在的腋窝SLN是引流整个乳腺器官、内乳SLN是引流整个乳腺腺体的第一站淋巴结;基于这一概念的转变可以个体化设计示踪剂注射部位,由此促进了SLNB的推广应用。
2 乳腺癌区域处理新理念
腋窝外科手术的目的主要是改善患者生存、增加局控率和提供分期。在优效全身治疗和精准放射治疗的大背景下,区域外科处理对患者生存和局控率的贡献日趋降低,对患者预后及辅助全身治疗策略的影响也逐渐减少。但在分子分型时代,随着全身治疗效果的不断提高,合理的乳腺癌局部区域控制可以转化为生存的获益。Poortmans[6]于2014年提出了乳腺癌局部区域控制新理念:乳腺癌局部区域控制应该综合考虑乳腺肿瘤远处转移风险、全身治疗的效果与不良反应以及局部区域治疗(手术/放疗)的效果与不良反应。在新的全身辅助治疗理念和局部区域控制理念背景下,通过SLNB初步了解患者的区域淋巴结分期,结合乳腺原发肿瘤大小和分子分型确定辅助全身治疗策略、对腋窝低肿瘤负荷患者采用放疗替代腋窝淋巴结清扫术(axillary lymph node dissection,ALND),区域处理可以在保证肿瘤安全性的前提下,最大程度地保障患者的生活质量。
3 腋窝精准处理
乳腺癌外科治疗经历100多年的发展,腋窝处理的理念已经发生很大的变化。1894年Halsted等首次报道了乳腺癌根治术,ALND成为随后近100年乳腺癌标准的腋窝处理模式。Halsted时代ALND的目的是改善患者生存和增加局控率,但同时也伴随较多的淋巴水肿、感觉缺失、活动受限和脉络综合征等并发症。自1993年Krag等[7]提出乳腺癌SLN概念后,乳腺癌的ALN诊疗开始迈向微创时代,乳腺癌外科治疗的理念从最大的、可耐受的局部区域处理转向最小的、有效的局部区域处理;SLNB替代ALND的适应人群也在不断扩展;在系统治疗和放射治疗的有效支持和补充下,乳腺癌ALN区域处理模式正以“降阶梯”趋势发展。
3.1 临床ALN阴性患者腋窝处理
循证医学Ⅰ类证据支持SLNB是一种微创、准确和安全的腋窝分期技术。NSABP-B32、ALMANAC和米兰临床试验奠定了SLNB在临床ALN阴性(cN0)早期乳腺癌患者中的地位,证实其在SLN阴性患者中可以安全替代ALND,显著降低相关并发症[8-10]。2005年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)SLNB指南(ASCO SLNB指南)首次认可了SLNB在ALN分期中的价值[11],推荐SLNB作为cN0患者的标准腋窝处理模式,SLN阴性患者可以安全免除ALND。
既往SLN阳性患者均推荐行ALND,这一观点在过去20年间发生了重大转变,尤其是对于SLN低肿瘤负荷的患者。IBCSG 23-01、ACOSOG Z0011和AMAROS等试验为SLN微转移乃至1~ 2枚宏转移的腋窝低肿瘤负荷患者豁免ALND提供了证据支持[12-14]。尽管IBCSG 23-01[12]和ACOSOG Z0011试验[13]中豁免ALND患者均不接受单独的腋窝放疗,但绝大多数患者接受辅助全身治疗和全乳放疗,这一点尤为重要,因为腋窝控制也将从全身治疗和全乳放疗中获益。IBCSG 23-01试验SLNB组中未接受局部区域干预的患者(乳房切除无放疗、保乳手术仅术中放疗)同侧腋窝复发风险仍高达4.48%,提示SLN低肿瘤负荷患者仍需区域控制[15]。另外,基于Z0011试验结果部分放疗专家推荐1~ 2枚SLN阳性保乳患者仅行全乳放疗,但该试验并未解答这部分患者最佳放疗策略的问题,因此区域淋巴结照射仍然是目前合理选择之一。对于乳房切除手术患者,由于前瞻性随机临床试验纳入的数据有限,且均来自为保乳手术患者设计的临床试验,目前的循证医学证据尚不足以支持SLN低肿瘤负荷(包括微转移)患者接受乳房切除术同时免除ALND和腋窝放疗。
20世纪70~80年代有关cN0患者ALND对比腋窝放疗的前瞻性随机临床试验——NSABP B04试验[16](1971—1974年,1 079例乳房切除患者,中位随访25年)及法国居里研究所试验[17](1982—1987年,658例保乳手术患者,中位随访15年)显示,腋窝放疗和ALND长期生存差异无统计学意义,区域控制率相似,并发症更少;但腋窝放疗并未成为该类患者的标准腋窝处理模式,主要原因在于SLNB应用于临床之前,ALND的目的不仅是治疗(强化区域控制和改善生存),更重要的是获取ALN转移信息以制定辅助治疗策略,且上述两项研究中全身治疗的不足(低于10%)与现行临床实践相去甚远,因此ALND在当时仍是乳腺癌患者的标准腋窝处理模式。AMAROS试验[14]随访10年结果显示,腋窝放疗组和ALND组腋窝复发率仅为1.82%和0.93%,两组的局部复发率、无病生存率(disease-free survival,DFS)和总生存率(overall survival,OS)差异均无统计学意义,但腋窝放疗组的上肢淋巴水肿发生率显著低于ALND组。实际上,不仅是在1~ 2枚SLN阳性患者中,即使SLN阳性数≥3枚,腋窝放疗和ALND仍然是等效的,因此两种腋窝治疗策略都可作为该类患者的选择,腋窝放疗应成为优选策略。
3.2 新辅助治疗(neoadjuvant systemic treatment,NST)与腋窝处理
NST最初是为了服务于局部区域处理,以达到降期手术的目的;不仅可使乳腺原发肿瘤降期以增加保乳手术机会,也可使40%~ 70%的ALN阳性患者降期为阴性。随着SLNB在cN0患者的ALN分期中取得巨大成功,可否将其应用于NST后ALN降期患者越来越受到关注,如能对这部分患者免除ALND防止并发症,则可使乳腺癌患者自NST的获益最大化。与初始手术SLNB相比,NST后SLNB循证医学证据级别偏低、临床实践中仍存在许多问题需要解决:cN0患者NST与SLNB的时机、临床ALN阳性(cN+)患者经NST转为ycN0后SLNB的假阴性阈值设定、准确性及豁免ALND的肿瘤安全性。
cN0患者NST与SLNB的时机曾备受关注,原因在于不同分子分型乳腺癌患者NST后腋窝病理学完全缓解(pathological complete response,pCR)率差异有统计学意义[18],2021年之前的SLNB指南与专家共识要求NST后SLN阳性患者均需行ALND,而初始手术患者1~ 2枚SLN阳性可以参考ACOSOG Z0011和AMAROS试验模式有条件地避免ALND。这一观点在2021年St.Gallen专家共识中发生转变,多数专家认可初始cN0患者NST后1枚SLN宏转移、微转移或孤立肿瘤细胞可考虑腋窝放疗替代ALND[19]。在此之后,国内外SLNB指南与专家共识推荐首选NST后SLNB;需要明确初始腋窝分期指导NST治疗方案时,亦可选择NST前SLNB,这部分患者如仅有1~ 2枚SLN阳性可考虑腋窝放疗替代ALND[20]。
规范、准确的SLNB对初始cN1患者NST降期后腋窝处理有重要意义。ACOSOG Z1071试验[21]和SENTINA试验[22]显示cN+乳腺癌患者NST后SLNB成功率,特别是假阴性率仍不能满足临床需求。由于NST后残留肿瘤对化疗和靶向治疗耐药,可能也对辅助放疗不敏感,因而具有更高的复发风险;另外,辅助强化全身治疗可以显著改善NST后未达到pCR患者的预后,NST后的放疗适应证和区域淋巴结靶区设计也部分地依赖对NST疗效的准确评价;因此,对cN+患者NST后的SLNB,我们可能需要设定远低于10%的假阴性率阈值。
一项纳入20项研究2 217例患者的meta分析[23]显示:cN+患者NST降期后SLNB成功率为89%,假阴性率为17%(<3枚和≥3枚SLN分别为22%和8%);使用碘125粒子标记ALN并于术中检出(marking ALN with radioactive iodine seed,MARI)的成功率为97%,假阴性率为7%;联合SLNB和标记夹技术的靶向腋窝淋巴结清除(targeted axillary dissection,TAD)成功率为100%,假阴性率为2%~ 4%。MSKCC[24]入组610例cT1-3N1M0患者,如NST后使用双示踪技术(核素+染料)检出≥3枚SLN且病理学检查阴性(未要求使用标记夹)则免除ALND,234例免除ALND患者中仅1例(0.4%)拒绝放疗患者发生同侧ALN复发同时局部复发(中位随访40个月)。有研究[25]回顾性分析688例接受NST的cT1-3N0-2M0患者,未采用TAD技术、不要求≥3枚SLN;NST后ycN0患者SLN阴性不行ALND,腋窝放疗亦非必需;222例cN1/2患者NST后降期为ycN0,中位SLN数为2枚,74.3%的患者SLN少于3枚;123例SLN阴性患者免行ALND,中位随访9.2年仅有2例(1.6%)腋窝复发。因此,通过改善外科SLNB技术,如使用TAD技术(不要求SLN检出数目)、联合双示踪技术和检出≥3枚SLN有助于降低SLNB假阴性率,目前的单中心研究证据支持在保证SLNB质量(标记夹技术)和(或)数量(双示踪和≥3枚SLN)的前提下,初始cN1患者NST降期后SLNB可以替代ALND。cN1患者NST后SLN仍然阳性者ALND仍是最佳选择,是否可以尝试有条件地免除ALND,我们期待Alliance A11202等前瞻性随机临床试验给予解答。
3.3 豁免腋窝手术的探索
尽管SLNB是乳腺癌微创的腋窝分期技术,但仍存在一定的创伤性及并发症,其术后18个月内出现上肢淋巴水肿及感觉异常的比例可达7.0%和8.7%[26]。除了导管原位癌(ductal carcinomainsitu,DCIS)、预防性乳房切除患者不需要腋窝处理以外,2019年St.Gallen专家共识提出年龄>70岁的cT1N0/luminal A拟接受内分泌治疗/有伴发疾病患者,可考虑豁免SLNB等腋窝处理。尽管免除SLNB对患者生存[OS、DFS、乳腺癌特异性死亡率(breast cancer-specific mortality,BCSM)]没有影响,同时可以显著降低手术相关并发症,但其与局部复发风险增加相关;因此,豁免腋窝处理的选择应与患者的伴发疾病和死亡风险相平衡。
随着术前影像学诊断准确性的提升,筛选出部分早期临床ALN阴性患者豁免腋窝手术是否可以有相似的预后,我们期待SOUND、BOOG 2013-08、INSEMA、NAUTILUS和SOAPET等前瞻性随机临床试验给予解答。另外,NST患者如初始肿瘤负荷较低(cT1-2N0)且分子分型为HER2阳性/三阴性,同时乳房原发灶达pCR,其ALN non-pCR风险不足2%[27],临床上是否可以接受该亚组患者免除腋窝手术,从而完全保留腋窝功能,仍然需要权衡手术并发症、局部复发风险和对辅助治疗决策的影响及前瞻性临床试验的证据支持[28]。
3.4 区域处理与全身治疗双降阶梯
SLNB时代,1~ 2枚SLN阳性豁免ALND已成为临床ALN阴性早期乳腺癌患者腋窝标准处理模式,但也使我们无法对ALN转移状况进行全面完整的评估。精准医学时代,Oncotype DX21基因和MammaPrint70基因等多基因检测可以准确地预测HR+/HER2-早期乳腺癌患者的复发风险,其在1~ 3枚ALN阳性患者中避免化疗正在推广应用。根据RxPONDER试验的纳入标准,SLN阳性的患者不强制要求ALND,且腋窝手术方式不会影响患者的iDFS,这提示Oncotype DX可能适用于1~ 2枚SLN阳性未行ALND患者。但同时我们应该注意到,RxPONDER试验中1~ 2枚SLN阳性未行ALND患者占比为37.4%,对于可能存在3枚以上ALN转移的患者(既往研究显示15%的1~ 2枚SLN阳性患者的ALN总转移数目>3),由于3枚以上ALN转移的患者绝对占比太低(37.4%×15%=5.6%)、导致统计学效力不足以检测到具有显著性意义的差异。因此,多基因模型更需要适应人群的精准预测。Bi等[29]通过中国多中心数据库构建了1~ 2枚SLN阳性未行ALND患者总ALN转移个数≤3枚的预测模型,有助于筛选出该部分患者中适宜进行多基因检测以豁免化疗的人群。SLNB与精准医学时代,多基因检测和ACOSOG Z0011/AMAROS标准的结合,不仅可以使腋窝区域处理降阶梯,还可以使全身治疗降阶梯,从而实现精准的区域处理与辅助全身治疗的双降阶梯。
4 内乳区精准处理
我们对乳腺癌腋窝处理已经趋于个体化,针对IMLN的处理也经历了激进处理-完全忽略-重新评估-精准处理的演变过程:20世纪40~50年代乳腺癌扩大根治术时期,针对IMLN的局部处理理念为最大限度的外科干预,但在缺乏有效全身治疗支持的时代背景下,增加创伤的IMLN清除术并未改善预后。随着乳腺癌改良根治术和保乳手术逐渐兴起,IMLN渐渐淡出了外科医师的手术野。近年来,在优效全身治疗和精准放疗支持下,IMLN的微创诊断和精准处理再次受到关注。
4.1 内乳清扫手术的摒弃与思考
1952年,Carey和Kirlin首次报道了乳腺癌扩大根治术,但该术式在增加损伤的同时并未显著改善患者的OS,主要原因在于当时乳腺癌患者缺乏有效的全身治疗支持,使得针对IMLN的局部区域处理未能转化成远期生存获益。目前乳腺癌的全身治疗已经进入分子分型时代,对多数患者而言,优效的全身治疗能够降低远处转移导致的死亡风险,但更重要的是全身治疗之后合理的局部区域处理,这对患者的生存获益有更大作用,因此IMLN的局部区域处理能否转化成生存获益需要我们重新考量。胸腔镜技术在乳腺癌领域的应用为IMLN清扫术提供了新的途径[30],能够以较小的损伤评估IMLN状况、切除范围更广,可能有助于进一步优化肿瘤分期、预后评估和治疗方案的选择。但是,在所有早期乳腺癌患者中开展双腔管麻醉、进行胸腔镜手术会限制其临床推广应用。
4.2 放射治疗临床获益凸显
20世纪末的多项研究显示,局部区域(包括IMLN)放疗可以改善乳腺癌患者生存,EORTC 22922/10925试验[31]分析Ⅰ~ Ⅲ期乳腺癌患者术后内乳和锁骨上内侧淋巴结放疗的生存结局,15年研究结果显示,内乳和锁骨上内侧淋巴结放疗可以显著降低乳腺癌死亡和乳腺癌复发风险,但对OS、DFS和远端无病生存期无显著改善。对比French[32]、MA.20[33]和DBCG-IMN试验[34]的研究结果(表1),随着有效全身治疗的实施和IMLN转移风险的增高,患者更可能由IMLN放疗获益。基于上述大型临床试验结果的陆续发布,2016年起NCCN指南在IMLN照射方面也进行了相应更新,无论接受乳房切除还是保乳手术,≥4枚ALN阳性的患者均推荐IMLN-RT(Ⅰ类证据)、1~ 3枚ALN阳性者强烈考虑IMLNI(ⅡA类证据)。
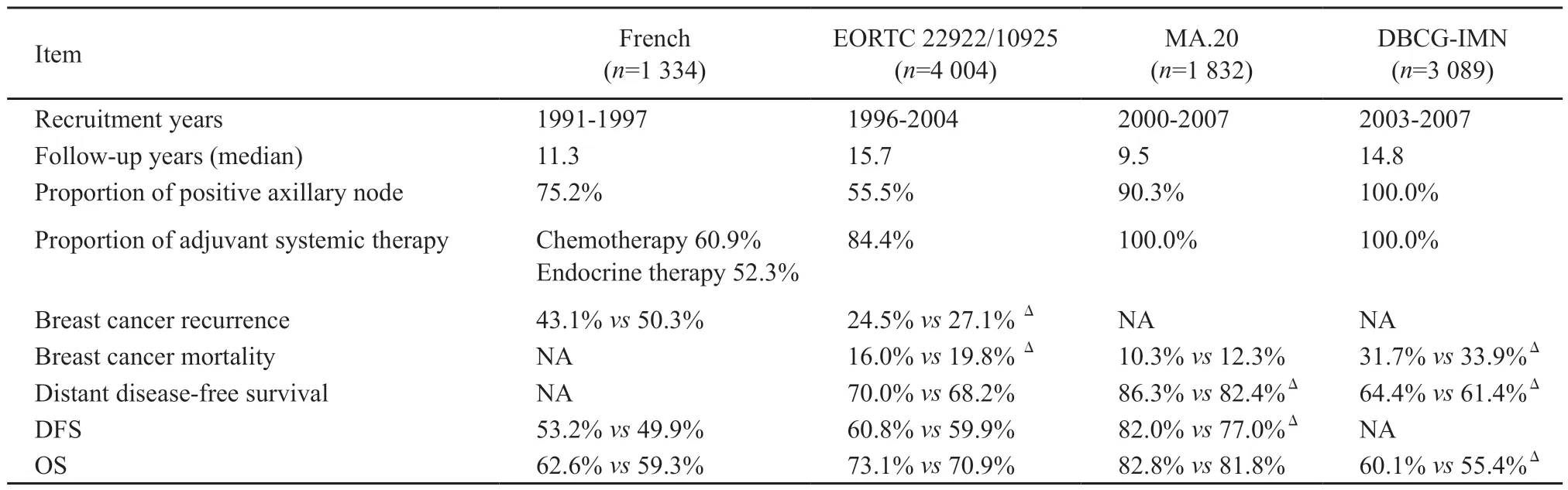
表1 IMLN放疗的生存获益Tab.1 Survival benefit of IMLN radiotherapy
但国际上放射肿瘤学家对于乳腺癌IMLN照射(IMLN radiotherapy,IMLN-RT)的态度不尽相同。一项比较不同国家指南IMLN-RT标准的研究显示,48 095例接受辅助放疗的英国乳腺癌患者中满足不同国家IMLN-RT标准的比例:英国皇家放射学会为13%,英国NIH为18%,德国为32%,爱尔兰为56%,美国为59%[35]。
4.3 微创诊断引导精准处理
SLNB在乳腺癌外科领域具有里程碑式的意义,IM-SLNB可能以最小的风险评估IMLN状况并进一步完善乳腺癌的淋巴结分期。虽然第6版美国癌症联合会(American Joint Committee on Cancer,AJCC)指南就已经开始纳入IM-SLNB概念,但应否常规开展IM-SLNB仍存在很大争议。通过分析既往乳腺癌IM-SLNB相关研究发现:一方面,常规核素示踪技术内乳SLN显像率很低(平均13%,0%~ 37%);另一方面,目前绝大多数IM-SLNB临床研究仍然沿用腋窝适应证(仅在cN0患者中实施),较低的内乳转移率(8%~15%)导致其对淋巴结分期、局部区域/系统治疗决策的影响很小,显著降低了临床应用价值。Qiu等[36]通过改良核素示踪剂注射技术(乳晕周边腺体内、大体积、超声引导)较传统注射技术显著提高了内乳SLN显像率(70.9%vs13.8%,P<0.001),同时不影响腋窝SLN显像率。多项研究[37-39]进一步指出,内乳SLN转移率在临床ALN阴性患者中较低且对治疗决策影响较小,IM-SLNB的适应证不应该参照腋窝手术经验仅在cN0患者中进行,更应该尝试在cN+患者中实施。Cong等[40]和Qiu等[41]提出通过IMSLNB获取IMLN的组织学诊断,由此可能指导更为精准的IMLN-RT策略。Bi等[42]发现,NST后IM-SLN阳性率为7.1%,IM-SLNB可以进一步完善NST后淋巴结pCR的定义。上述乳腺癌IMSLNB相关技术和理念为IM-SLNB的深入研究和临床应用奠定了基础,相信随着大样本前瞻性多中心验证试验的入组完成(CBCSG026/027试验未发表数据:新型示踪技术IM-SLN显像率为66.0%,IM-SLNB成功率为97.2%,假阴性率为2.9%,准确度为98.9%),可以为IM-SLNB的临床应用提供高级别的循证医学证据,实现乳腺癌患者IMLN的微创诊断和精准处理。
5 结语与展望
随着全身治疗效果的不断提高,合理的乳腺癌局部区域控制可以转化为生存的获益,乳腺癌的区域处理理念和模式也发生了重大转变。目前生物学指标已经取代ALN状况成为制定辅助治疗策略的主要因素。但需要指出的是,在ALN外科降阶梯的探索道路上,我们需要权衡手术并发症、区域复发风险、淋巴结状态对辅助治疗决策必要性,以及降阶手术可能导致的其他(全身/放疗)升阶治疗。多数乳腺癌患者接受多种手段治疗,一种治疗手段疗效的提高可明显降低其他治疗手段的绝对获益,但系统治疗后基于精准诊断的IMLN局部区域治疗也将改善预后。因此,SLNB时代我们需要精准衡量乳腺癌患者所需的治疗强度,确立个体化治疗策略,以达到乳腺癌区域淋巴结精准处理的目的。
利益冲突声明:所有作者均声明不存在利益冲突。
