2015—2018年北京市东城区甲型H1N1pdm09亚型流感病毒分子流行病学特征分析
2022-09-17李艳宇李姗姗杜嘉鑫韩营营
李艳宇,李姗姗,杜嘉鑫,韩营营
北京市东城区疾病预防控制中心微生物检验科,北京 东城 100050
甲型流感病毒属正黏病毒科,依据其表面血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的不同可分为多种亚型,至今已发现18种HA亚型(H1~H18)和11种NA亚型(N1~N11)[1]。甲型H1N1pdm09流感病毒最早出现于2009年3月墨西哥和美国,2009年5月在我国四川出现第1例美国输入性甲型H1N1pdm09流感患者,现已于全球广泛传播。目前,研究多以HA基因进化特征来反映甲型流感病毒的进化变异,HA蛋白包括5个抗原表位,其中A簇和B簇氨基酸替换频繁,类别广泛,BUSH等[2]推测这是由于A、B区位于HA蛋白的头区,尤其是位于抗原表位最顶部的B区更易被免疫蛋白识别,发生这种变异的毒株成为新亚型流行株的几率最大。周小东等[3]对甲型H1N1流感毒株HA基因序列分析发现,其裂解位点碱性氨基酸的数量和附近糖基化位点的缺失均可能改变HA蛋白对宿主细胞体内水解酶的敏感性,从而使流感病毒致病性发生改变。闫丽萍等[4]对2009年3月 —2010年5月甲型H1N1流感毒株与疫苗株A/Colifornia/07/2009(H1N1)比对,发现病毒株第338位氨基酸与疫苗株不同,但致病性仍较低。
北京市东城区疾病预防控制中心为国家流感网络监测实验室,需全年进行流感监测,本研究以2015—2018年北京市东城区流感监测数据为基础,进行甲型H1N1pdm09流感毒株HA和NA基因序列特征分析,以期为北京市东城区流感流行预警及防控奠定基础。
1 材料与方法
1.1 样本2015年1月1日—2018年12月31日从北京市东城区两家哨点医院采集符合流感样病例的咽拭子,4~8℃条件下于24 h内运送至北京市东城区疾病预防控制中心。
1.2 细胞MDCK细胞购自中国疾病预防控制中心。
1.3 主要试剂RT-PCR检测试剂盒购自江苏硕世生物科技有限公司;标准血清由中国疾病预防控制中心提供;TaKaRa Prime-Scriptone Step RT-PCR KitVer.2.0试剂盒购自宝生物工程(大连)有限公司;核酸提取试剂盒购自美国ABI公司。
1.4 核酸检测及病毒分离 参照《全国流感监测方案(2017版)》[5],采用RT-PCR检测试剂盒对咽拭子样本进行核酸检测。核酸检测阳性的样本立即接种至MDCK细胞进行病毒分离,并检测血清滴度,血凝滴度≥8的毒株用标准血清进行血凝抑制试验鉴定流感亚型,毒株于-80℃保存,具体操作方法参照《流行性感冒病毒及其实验技术》[6]。
1.5 分离毒株HA及NA基因分析 参考WHO推荐的新甲型H1N1流感测序引物设计HA和NA序列引物[7]。随机选取30株甲型H1N1pdm09毒株,采用核酸提取试剂盒提取病毒RNA,通过TaKaRa PrimeScriptone Step RT-PCR KitVer.2.0试剂盒逆转录合成cDNA,以其为模板,进行RT-PCR扩增,扩增产物送生工生物工程(上海)股份有限公司测序,应用DNASTAR 5.0软件将所得HA、NA序列进行拼接。从GenBank中下载流感疫苗参考株和国内代表参考株,应用MEGA 6.0软件构建系统进化树,进行核苷酸及氨基酸同源性分析,并以WHO推荐的北半球疫苗株A/Michigan/45/2015为参比序列,进行抗原受体结合位点分析。利用Net NGlyc1.0(http://www.cbs.dtu.dk/services/NetNGlyc)在线预测HA、NA基因上糖基化位点。
2 结果
2.1 流感监测总体情况2015年1月1日—2018年12月31日北京市东城区共检测流感样病例样本7 533份,其中994份为核酸阳性,阳性率为13.20%。阳性样本中甲型H1N1pdm09亚型231份,占阳性样本的23.24%(231/994);H3N2亚型352份,占阳性样本的35.41%(352/994);B型411份,占阳性样本的41.35%(411/994)。2015年主要以B型流行为主,甲型H1N1pdm09亚型呈较低水平;2016—2018年期间,3种亚型流感病毒交替混合流行。见表1。流感病毒在人群中的各年龄组均可发病,其中14岁以下年龄组发病率最低,为12.27%,≥60岁年龄组检出率最高,为15.58%,见表2。

表1 2015—2018年北京市东城区流感监测情况Tab.1 Monitoring of influenza in Dongcheng District,Beijing City from 2015 to 2018
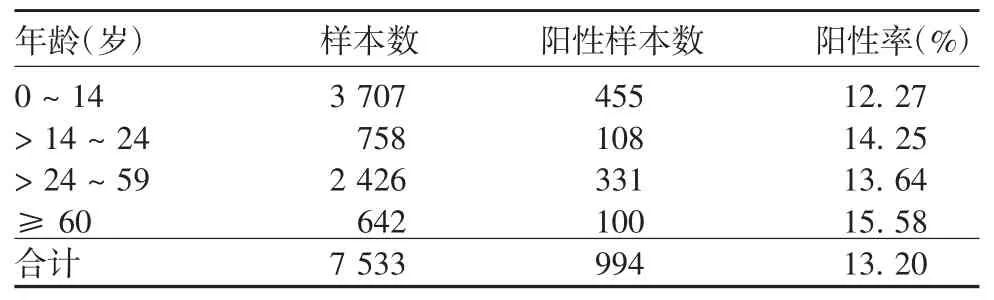
表2 2015—2018年北京市东城区流感样本的年龄分布Tab.2 Age distribution of patients with influenza from whom samples were taken in Dongcheng District,Beijing City from 2015 to 2018
2.2 系统进化树分析
2.2.1 HA基因HA基因系统进化树中,分离的北京市东城区甲型H1N1pdm09亚型毒株主要分布在2个大分支上,且随着时间的推移,甲型H1N1pdm09亚型毒株与2009年的毒株偏移越来越远;2017和2018年大部分分离毒株聚在一起,在进化关系中最近,且与WHO推荐的北半球疫苗株A-Brisbane-02-2018在同一大分支上;2017年大部分分离毒株与疫苗株A/Michigan/45/2015距离较近,毒株ABJDC-SWL1369-2017-HA与2017年其他分离毒株不在一个小分支上;2016年分离毒株则与2013年的毒株A/LongYan/SWL1734/2013和A/FuZhou/SWL34/2013在同一分支上,且与A/Beijing-huairou/SWL120/2016不在同一小分支上。见图1。
2.2.2 NA基因 随着时间的推移,东城区甲型H1N1pdm09亚型毒株在NA基因系统进化树中偏移越来越大。2018年的分离株与WHO推荐的北半球疫苗株A-Brisbane-02-2018在同一大分支上;2017年的毒株与疫苗株A/Michigan/45/2015距离较近,且在进化树上的分布较分散;2016年的毒株则与疫苗株A/Michigan/45/2015较远。见图1。
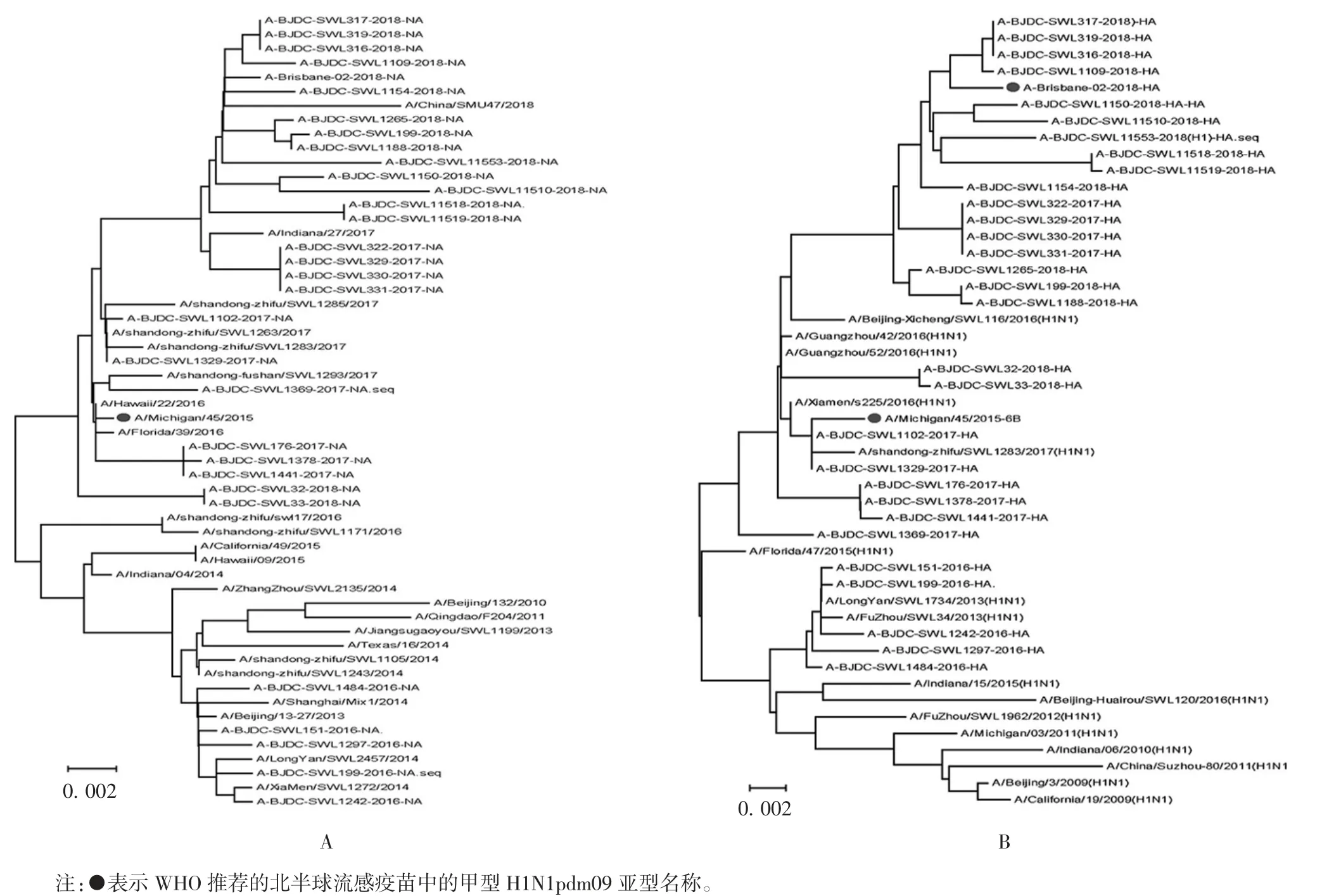
图1 2015—2018年北京市东城区甲型H1N1pdm09毒株HA基因(A)及NA基因(B)进化树Fig.1 Phylogenetic tree based on HA gene(A)and NA gene(B)of H1N1pdm09 strain in Dongcheng District,Beijing City from 2015 to 2018
2.3 同源性分析30株甲型H1N1pdm09亚型病毒HA基因核苷酸序列同源性为97.81%~100.00%,氨基酸序列同源性为98.13%~100.00%;NA基因核苷酸序列同源性为98.01%~100.00%,氨基酸序列同源性为97.42%~100.00%。30株毒株与疫苗株A/Brisbane/02/2018相比较,其HA基因核苷酸序列同源性为97.42%~99.53%,氨基酸序列同源性为97.40%~99.32%;NA基因核苷酸序列同源性为98.11%~99.74%,氨基酸序列同源性为97.72%~99.80%。
2.4 抗原受体结合位点分析 与疫苗株A/Michigan/45/2015比较,共有16个氨基酸位点发生改变,但5个抗原决定簇位点[位点A位于140~146位氨基酸形成的突出环上及133~137位氨基酸,位点B位于155位上主环(156~160氨基酸)及球区末端围绕α螺旋结构的187~198位氨基酸,位点C位于球区末端的53、54、275和278位氨基酸,位点D位于HA三聚体交界处的207、172~174位氨基酸,位点E由63、78、81、83位氨基酸形成的表面区域]未发生改变。2017年的A-BJDC-SWL322-2017-HA、A-BJDC-SWL329-2017-HA、A-BJDC-SWL330-2017-HA、A-BJDC-SWL331-2017-HA 4株毒株同时发生了S164T、T185N、I295V改变;2018年的多数毒株发生了S164T、S183P、I295V改变,与2019—2020年推荐疫苗株A-Brisbane-02-2018氨基酸相同。R327与G328之间是HA1与HA2的裂解点,30株分离株在裂解点未出现变异,较稳定,决定流感毒株毒力的D222主要位点也未出现变异。HA基因序列中未出现新的半胱氨酸,二硫键稳定性也未发生改变。见表3。
2.5 耐药位点分析 与疫苗株A/Michigan/45/2015比较,共有10个氨基酸位点发生改变,包括V34I、F74L、G77R、V81A、K84T、I163T、P198S、D199N、S200N、M314I。2018年的大部分毒株和2017年的A-BJDCSWL322-2017-HA、A-BJDC-SWL329-2017-HA、A-BJDCSWL330-2017-HA、A-BJDC-SWL331-2017-HA这4株毒株均发生了G77R和V81A改变,与疫苗株A-Brisbane-02-2018一致,且2017年的这4株毒株发生了I163T改变。NA蛋白主要NA催化活性位点R118、D151、R152、R224、E276、R292、R371、Y406、H275、I223、V241等均未发生改变。见表4。
2.6 糖基化位点分析 北京市东城区甲型H1N1 pdm09亚型流感病毒HA基因潜在糖基化位点有8个,分别为27(N-N-S)、28(N-S-T)、40(N-V-T)、104(N-G-T)、293(N-T-T)、304(N-T-S)、498(N-G-T)、559(N-G-S),NA基因潜在糖基化位点有7个,分别为42(N-Q-S)、50(N-Q-S)、58(N-N-T)、63(N-Q-T)、68(NI-S)、88(N-S-S)、146(N-G-T)。均未发生改变。
3 讨论
病原学监测结果表明,北京市东城区在2015—2018年期间,流感病毒以甲型H1N1pdm09亚型与B型和H3N2亚型交替流行,该结果与国内其他地区监测结果相同[8-11]。甲型H1N1pdm09亚型在北京市东城区流行高峰在2017—2018年,刘笑洁等[12]研究发现,2017年,洛阳市流感病毒流行毒株以甲型H1N1pdm09和BYamagata型别为主。该结果与本研究结果不同,这可能与两地哨点医院监测到的人群不同有关,因此,应尽可能扩大监测范围,尽量减少偏差;其次可能与天气及流感疫苗接种情况有关。
流感病毒抗原性频繁变异是不断引起流感暴发流行的主要原因[13],HA是其主要表面抗原,遗传进化最为活跃。本研究建立的HA基因进化树显示,随着时间推移,毒株遗传距离越来越大,表明甲型H1N1pdm09亚型流感的HA基因不断发生变异,体现了疫苗株的更替过程,与陈玲霞、颜文娟和孙小强等研究结果一致[14-16]。本研究结果还表明,2016年毒株与同年北京怀柔地区分离的毒株不在一个小分支上,证明不同地区的毒株在分子水平上有差异;2017年的毒株与疫苗株A/Michigan/45/2015较近,且分成多个小分支,表明该年度甲型H1N1pdm09亚型流感病毒发生了变异;2018年毒株与WHO推荐的北半球疫苗株A-Brisbane-02-2018系统进化树距离较近,未发生较大变异,与疫苗的匹配性较高。
抗原受体结合位点即抗原决定簇是流感病毒HA基因所特有的,共有5种抗原决定簇,其与宿主细胞表面受体结合是流感病毒感染的关键环节,一般认为HA1蛋白分子的氨基酸替换发生4个以上并分布于至少2个抗原决定簇上才具有流行病学意义[17]。车飞虎[18]研究发现,2013—2015年浙江地区的甲型H1N1流感病毒HA蛋白关键位点发生了变异(D222G)。本研究结果表明,30株毒株抗原受体结合位点均未发生改变,因此认为本地区该病毒的毒力未发生改变。糖基化位点是保障HA蛋白正常折叠所必需的,在病毒进化过程中产生新的糖基化位点会影响病毒的抗原性、致病力和受体结合能力。本研究结果表明,30株分离株均未发生糖基化位点变异,提示推荐的疫苗株仍具有免疫保护作用。
目前常用的抗流感药物有两类,其中一类是NA抑制剂,如奥司他韦、扎那米韦,这类药物均可与流感病毒的NA结合,从而抑制病毒颗粒扩散。奥司他韦的作用位点主要为NA催化活性位点氨基酸(R118、D151、R152、R224、E276、R292、R371)和一些辅助位点(E119、R156、W178、S179、D198、I222、E227、H275、E277、N294)氨基酸,若这些位点发生改变,会影响药物与病毒的相互作用,从而使病毒耐药。本研究结果表明,30株毒株未发生耐药位点改变,未产生耐药毒株,NA类药物抗流感仍有效,这与曹蓝等[19]研究结果不同,该研究检测的流感毒株中出现了H275Y位点突变,其原因及是否会逐渐发展成优势耐药株有待进一步监测。2017年的A-BJDC-SWL-322-2017-HA、A-BJDC-SWL329-2017-HA、A-BJDC-SWL-330-2017-HA、A-BJDC-SWL331-2017-HA这4株毒株是在一次聚集性疫情中分离到的毒株,从基因水平分析显示,其变异位点相同,但这些变异的位点与流感聚集性疫情发生是否有关还有待进一步深入研究。
综上所述,2015—2018年北京市东城区甲型H1N1pdm09亚型流感病毒与疫苗株A-Brisbane-02-2018相比,其HA、NA基因出现了一定程度的变异,但抗原位点、耐药位点未发生改变,与WHO推荐的北半球疫苗株A-Brisbane-02-2018有较好的匹配性,对人群有较好的保护作用。本实验为北京东城区评价疫苗保护效果及制定流感防治措施提供了实验依据,应长期实时监测流感病毒优势毒株的分子特征。
