柯萨奇病毒A组6型中和抗体检测用毒株病毒滴度标定及其专属性和适用性评价
2022-09-17陈磊孟庆敏张改梅孙光卫耿丽娜金加洪赵丽丽谢学超徐颖之顾美荣卞莲莲刘建凯
陈磊,孟庆敏,张改梅,孙光卫,耿丽娜,金加洪,赵丽丽,谢学超,徐颖之,顾美荣,卞莲莲,刘建凯
1.北京民海生物科技有限公司研发中心 北京市新型联合疫苗工程技术研究中心,北京 102600;2.江苏省连云港市赣榆区疾病预防控制中心,江苏 连云港 210000;3.江苏省新沂市疾病预防控制中心,江苏 新沂 221400;4.江苏省盐城市射阳县疾病预防控制中心,江苏 盐城 224300;5.中国食品药品检定研究院肝炎病毒疫苗室,北京 102600
手足口病(hand,foot and mouth disease,HFMD)是一种丙类传染性疾病,常见于5岁以下婴幼儿,主要临床表现为发热及手、足、口腔等部位出现斑丘疹、疱疹[1],部分病例可并发脑膜炎、心肌炎和神经系统症状等重症,甚至死亡[2]。HFMD的主要病原体为肠道病毒71型(enterovirus,EV71)、柯萨奇病毒A组16型(coxsackievirus A16,CA16)和柯萨奇病毒A组6型(coxsackievirus A6,CA6)等[3],属于小RNA病毒科肠道病毒属。近年,CA6在全球范围内流行,在我国大陆及其他国家部分地区,CA6甚至取代EV71和CA16成为HFMD病原谱中占比最高的病原体[4-12]。CA6感染儿童引起的HFMD表现出一系列非典型症状或后遗症,如非典型部位的皮疹疱疹、皮肤损伤、脱甲症等[13],且可导致成年人罹患HFMD,甚至可能导致长期后遗症[14-16],给公共卫生安全带来较大负担,加强对其防控具有重要意义。
目前,HFMD尚无有效预防措施和治疗方法,接种疫苗是控制HFMD流行的重要手段。中和抗体效价是评价疫苗免疫原性的关键指标之一[17-20],其检测结果的准确性对疫苗研发和应用均具有重要意义。本研究对北京民海生物科技有限公司(简称北京民海)研发中心从人横纹肌肉瘤细胞(RD细胞)自行分离获得的CA6毒株作为中和抗体候选检测毒株进行病毒滴度标定,并评价该毒株的专属性和适用性,以期用于后续疫苗的质量控制。
1 材料与方法
1.1 毒株及细胞CA6候选检测毒株由北京民海研发中心采自中国大陆HFMD流行区患儿的咽肛拭子,样本经RD细胞分离、蚀斑纯化、适应性传代培养后,分装(0.5 mL/支,500支),建立工作种子批,-60℃以下保存;RD细胞由该中心保存。
1.2 主要试剂MEM培养基购自日本日水制药株式会社;胎牛血清、谷氨酰胺、青霉素和链霉素购自美国Gibco公司。
1.3 血清CA6、EV71、CA16、CA10病毒收获液免疫NIH小鼠获得的血清(分别标记为A6-S1、71-S1、A16-S1、A10-S1)及其阴性对照血清(病毒维持液免疫NIH小鼠获得的血清,标记为Z)由北京民海研发中心研发一室提供;人血清为江苏和广东地区的EV71和CA16等血清流行病学调查及EV71疫苗Ⅲ期临床试验前HFMD病例监测的自然感染人血清。
1.4 CA6候选检测毒株的检测 根据《中国药典》三部(2020版)“生物制品生产检定用菌毒种管理及质量控制”的要求,对工作种子批进行鉴别试验、无菌检查、支原体检查、分子生物学鉴定等[21]。
1.5 CA6候选检测毒株病毒滴度的测定 将1.5×105个/mL的RD细胞接种至96孔板中,0.1 mL/孔;接种CA6候选检测毒株病毒液(10-3~10-10稀释),100 μL/孔,每个稀释度设8个复孔,同时设8孔细胞对照(仅补加病毒维持液),于(35±0.5)℃,5%CO2培养箱中放置7 d,观察细胞病变(cytopathic effect,CPE)情况。以能使50%细胞孔发生CPE的最高稀释度为终点,1个视野下出现CPE即判为阳性(+),否则判为阴性(-),并按下式计算病毒滴度[22]。由3名实验员(A、B、C)于3 d分别进行3次独立测定,根据27次检测结果标定该毒株的病毒滴度。
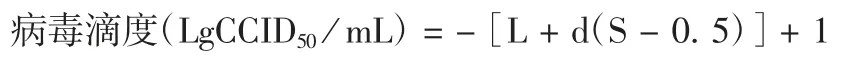
式中L为病毒最低稀释度的对数值,d为稀释度系数对数值,S为CPE阳性孔比率总和。
1.6 中和抗体检测 参照文献[23-24]方法,建立CA6中和抗体检测方法。待测样品(1∶8稀释)经56℃灭活30 min;加至96孔板中,0.05 mL/孔,进行2倍系列稀释(1∶8~1∶16 384),加入100 CCID50/50 μL的CA6病毒悬液,50 μL/孔,于37℃中和2 h;加入1.5×105个 /mL的RD细胞悬液,0.1 mL/孔,置(35±0.5)℃,5%CO2培养箱中培养7 d。每次试验均设病毒回滴试验,结果在32~320 CCID50/孔判为试验成立。以能抑制50%细胞病变最高稀释度的倒数作为CA6抗体中和效价,≥1∶8判为CA6中和抗体阳性,<1∶8判为阴性。
1.7 CA6候选检测毒株的专属性评价 将血清A6-S1、71-S1、A16-S1、A10-S1和Z用CA6候选检测毒株分别进行中和抗体效价测定,方法同1.6项,每份血清重复测定2次。
1.8 CA6候选检测毒株的适用性评价 分别取12份CA6小鼠免疫血清(编号为M1~M12)和12份CA6自然感染人血清(P1~P12),用CA6候选检测毒株进行中和抗体测定,方法同1.6项,每份血清重复测定6次,并计算中和抗体效价的几何平均值(geometric mean titer,GMT)。CA6抗体中和效价为阴性时,按1∶4计算,CA6抗体中和效价>1∶16 384时,按1∶24 576计算。
1.9 统计学分析 应用SPSS 20.0和EXCEL 2020进行统计学分析,不同实验员对CA6候选检测毒株病毒滴度检测结果的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 CA6候选检测毒株工作种子批检测结果CA6候选检测毒株工作种子批无菌检查、支原体检查均符合要求;分子生物学鉴定属D3亚型;CA6候选检测毒株感染RD细胞3 d后发生明显CPE,见图1。
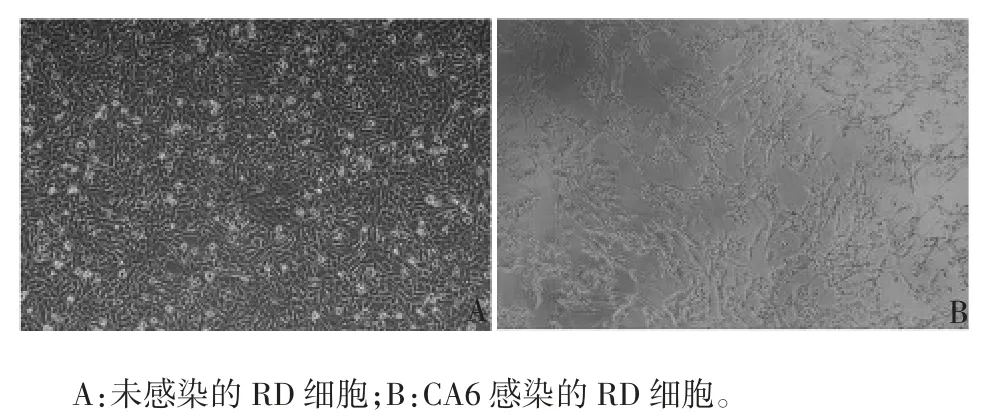
图1 CA6候选检测毒株致RD细胞CPE的镜下观察(×100)Fig.1 Microscopy of CPE of RD cells infected with candidate CA6 strain(×100)
2.2 CA6候选检测毒株的病毒滴度A、B、C实验员测定病毒滴度均值分别为(7.861±0.075)、(7.819±0.110)、(7.875±0.140)LgCCID50/mL,95% CI分别为(7.803~7.919)、(7.735~7.904)、(7.768~7.875)LgCCID50/mL,CV分别为0.96%、1.41%、1.77%,3名实验员的检测结果差异无统计学意义(F=0.605,P>0.05),见表1。最终标定该毒株病毒滴度为7.852 LgCCID50/mL(95% CI:7.808~7.895 LgCCID50/mL)。
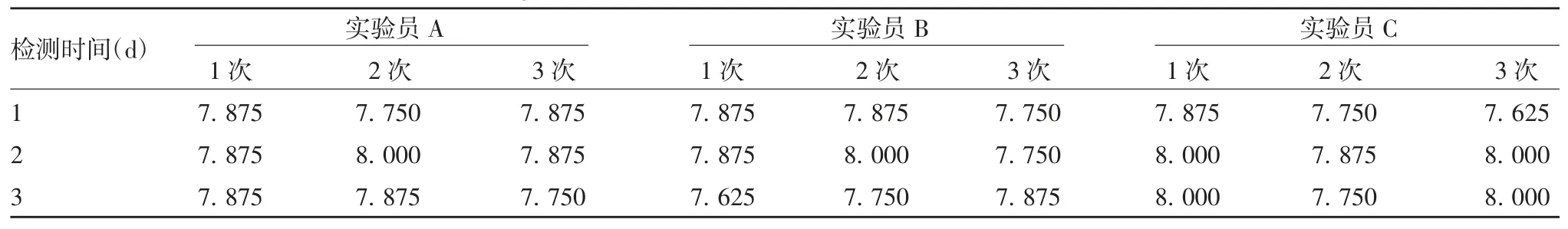
表1 病毒滴度检测结果(LgCCID50/mL)Tab.1 Determination result of virus titer(LgCCID50/mL)
2.3 CA6候选检测毒株的专属性 重复2次测定A6-S1的中和抗体效价分别为1∶3 072和1∶4 096,为阳性;71-S1、A16-S1、A10-S1和Z的中和抗体效价均<1∶8,为阴性。表明CA6候选检测毒株具有良好的专属性。
2.4 CA6候选检测毒株的适用性12份小鼠血清中和抗体GMT为1∶82~1∶22 970,12份自然感染人血清中和抗体GMT为1∶41~1∶22 970。每份血清重复检测中和抗体效价的最大值与最小值(MAX/MIN)比值均 <4,CV在1.65%~12.44%之间。见表2,表明CA6候选检测毒株具有良好的适用性。
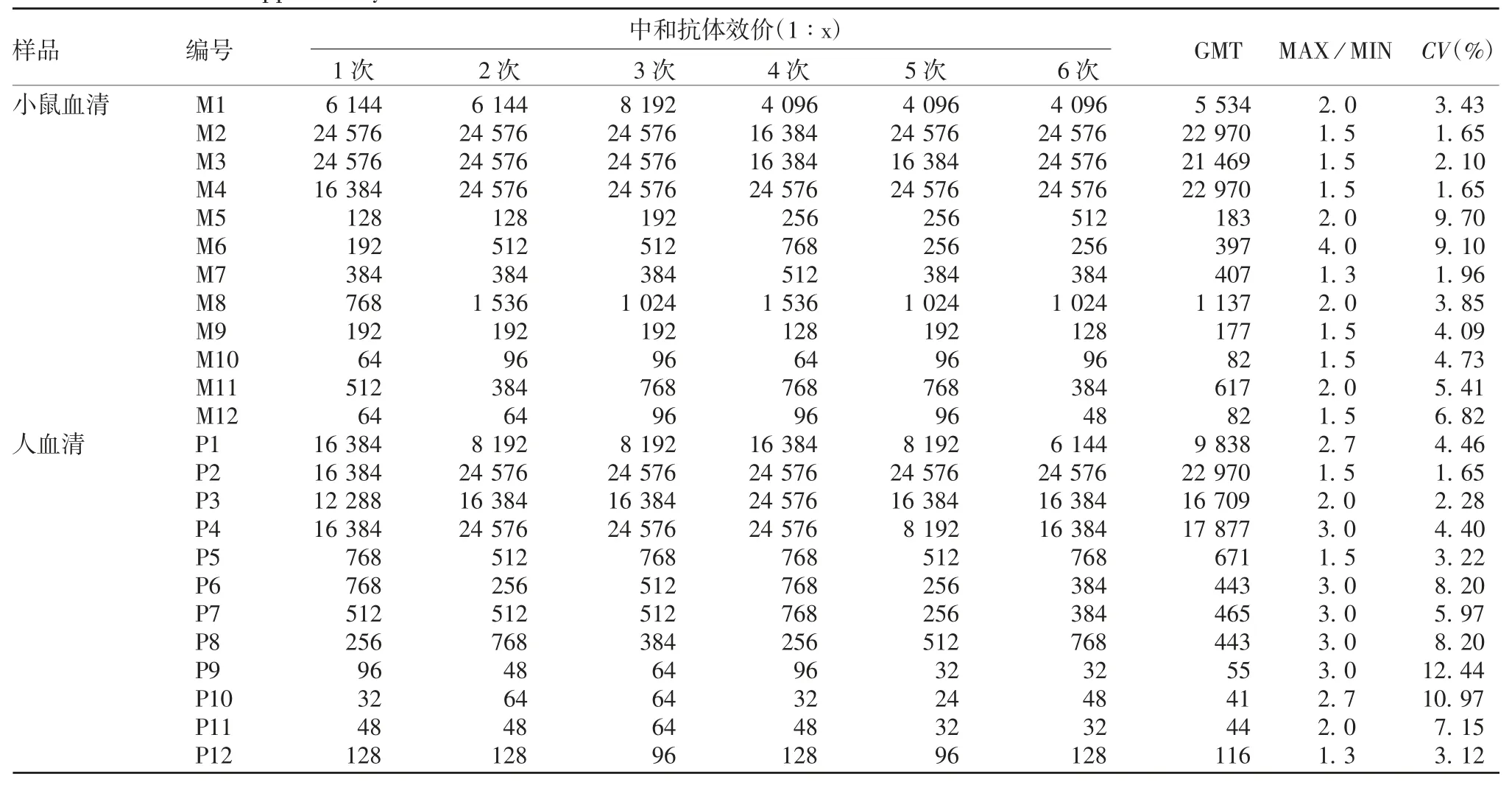
表2 CA6候选检测毒株适用性评价结果Tab.2 Evaluation of applicability of candidate CA6 strain
3 讨论
HFMD是一种常见传染病,目前已成为亚太地区尤其是中国严重的公共卫生问题。全球范围内,该病的流行病原在不断变化,自2008年以来,CA6型HFMD在芬兰暴发[25],随后该型HFMD在多个国家及地区迅速流行[26-29]。近年,根据获得的HFMD流行病学和病原学调查数据,认为CA6与EV71和CA16一样,可通过接种疫苗进行预防[30]。目前,EV71疫苗已上市,CA16单价疫苗及重组EV71/CA16双价疫苗处于临床前试验阶段[31-32],其对CA6均无交叉保护,因此急需进行CA6疫苗或多价疫苗的研制。
在CA6单价疫苗或多价疫苗的研制过程中,CA6中和抗体效价检测是疫苗研制中的重要检测指标,检测方法的建立至关重要。CA6候选检测毒株由北京民海研发中心采用RD细胞自行分离,建立了工作种子批,本研究对工作种子批进行相关检测,结果显示,工作种子批无菌检查、支原体检查均符合要求,分子生物学鉴定属D3亚型。该毒株与同为肠道病毒属的EV71、CA16、CA10免疫血清均无交叉,仅被CA6免疫血清中和,具有良好的专属性。由3名实验员对工作种子批进行滴度标定,平均滴度为7.852 LgCCID50/mL,CV为1.40%。用该毒株对12份CA6小鼠免疫血清和12份自然感染人血清进行6次中和抗体效价检测,中和抗体效价的MAX/MIN均 <4,CV均 <13%,表明该毒株具有良好的适用性,可用于临床前免疫原性研究中小鼠血清中和抗体效价测定,也有望应用于临床研究中人血清中和抗体效价测定。
综上所述,该CA6候选检测毒株可作为CA6中和抗体效价测定方法的检测毒株,但本研究未进行CA6中和抗体效价检测方法的验证,今后将进行深入研究。本研究为CA6单价疫苗或多价疫苗的质量控制研究提供了实验依据。
