基于临床及影像组学资料建立模型预测前列腺癌生化复发的初步研究
2022-09-16杨浩施颉
杨浩 施颉
随着我国经济和生活水平的提高,富集饮食、吸烟或过量饮酒等所导致的前列腺癌(prostate cancer, PCa)发病率逐年升高,达6.63%。据统计,PCa在治疗后3~5年内的复发率约为28%~34%,其主要特征表现为血清前列腺特异性抗原(prostate-specific antigen, PSA)的升高,即生化复发(biochemical recurrence, BCR)。目前,美国泌尿外科协会(American Urological Association, AUA)指南认为BCR是PCa临床复发的前兆,在缺乏有效医疗干预的状况下,约46%的病人会在BCR后12~24个月转化为临床复发甚至骨转移。据报道,PCa的临床分期、PSA梯度、根治方法、Gleason分级是PCa病人BCR的风险因素。但Mortezavi-hermanns等[1]认为即便PCa病人有≥5个以上与BCR有关的风险因素,其术后24~72个月的BCR率仅为32.9%,人群的假阴性率达47.5%,这代表以上这些风险因素预测BCR效果不佳。因此,针对个体差异较大的病人研发新的预测模型极为重要[2]。本研究采用超声造影联合剪切波弹性成像技术提取PCa病人BCR的数据,结合磁共振放射组学方法及临床数据建立模型预测BCR,获得了较好的收益,为临床针对个体差异病人精准评估BCR提供了契机。
1 材料与方法
1.1 入组病例筛选标准 回顾性分析2018年1月至2020年2月181例在泰州市中医院经超声造影引导前列腺穿刺活检或术后病理检查确诊为PCa病人的临床及影像学资料,年龄65~91岁,平均(72.6±16.7)岁。纳入标准:(1)符合欧洲泌尿外科协会及美国泌尿外科协会指南的PCa诊断标准;(2)磁共振及超声可见的单发病灶;(3)未治疗的原发性PCa;(4)临床以及影像数据完备,依从性好。排除标准:(1)合并其他肿瘤病人;(2)合并先心病、心力衰竭、肝肾功能不全或过敏史等造影禁忌者;(3)认知功能障碍病人。本研究已获得病人或家属知情同意并签署知情同意书。
1.2 研究方法
1.2.1 临床病史资料收集:评估并收集PCa病人入院后完整的临床病史资料,主要包括年龄、有无淋巴结转移、有无远处转移、BMI、PSA等实验室参数和肿瘤的TNM分期。
1.2.2 磁共振检查:采用荷兰飞利浦Achifa Nova双源1.5T MRI扫描仪,具备6通道相控阵体线圈。病人采用仰卧位,首先定位中下腹部和盆腔,然后获取膀胱及前列腺的横向、矢状面、冠状面T2WI和矢状面T1WI图像。扫描范围为膀胱底上方约2 cm到外阴。T2WI序列由单次激发快速自旋回波(SSTSE)和平衡式稳态自由进动梯度回波序列(balance FFE)获得。
影像组学分析过程:本研究采用3D slicer version 4.11.20210226(https://www.slicer.org/)或ITK-snap 3.8.0(http://www.itksnap.org/pmwiki/pmwiki.php)图像分割软件进行磁共振图像感兴趣区(ROI)划定,然后进行纹理分析及数据提取。在确定firstorder、glcm、shape、ngtdm等候选纹理数据后,基于R语言对上述纹理数据进行lasso回归分析,提取有效纹理数据。
1.2.3 超声造影过程:采用迈瑞昆仑 Resona R9和美国GE LOGIQ E9 扫描仪,经直肠电子凸阵探头(频率范围4.5~9.5 MHz)。嘱病人简易灌肠清洁肠道后,以医用安全套或者探头套包裹探头,然后伸入直肠。首先进行经直肠前列腺常规检查,观察前列腺密度分布、血流信号,测量前列腺内外腺三径大小、肿瘤直径,存图标记其位置及血供程度等,然后再进行弹性成像分级评分。病人无明显不适后,采用意大利博莱科(Bracco)公司SonoVue超声造影剂行造影检测,取病灶最大截面积切面作为基点并不时切换观察方位,经肘部正中静脉脉冲式注射2.4~3.0 mL造影剂,然后用5~15 mL的9 mg/mL氯化钠溶液快速冲洗,在推注同时进行造影检查并实时观测记录PCa超声造影增强强度(低-中-高)、增强均匀性(均匀强化,边缘强化,中央强化或渐进性强化)。约观察3~5 min,期间将原生dicom图像及视频存入东软pacs系统,机载视频存储后启动造影分析软件(TIC analysis),记录ROI时间强度曲线的峰值强度(PI)、升支斜率(∑)、降支斜率(γ)、达峰时间(TTP)、到达时间(AT)、AUC。所有检查由2位超声副主任医师独立进行,若有分歧,请第三位高级职称超声医师商量一致后出具报告[3]。
1.2.4 病理取材分级:病人经直肠超声穿刺活检取材3~6块送病理检查,确诊PCa后进行Gleason评分。
1.2.5 PCa治疗方法:采用PCa根治手术,全麻后,分离前列腺后直肠间隙暴露前列腺尖部、膀胱前间隙及耻骨后间隙,切除前列腺后重建膀胱颈并吻合尿道。随后进行内分泌治疗:常规药物去势附加抗雄激素或睾丸手术,然后接受戈舍瑞林联合比卡鲁胺治疗[4-5]。
1.2.6 随访与预后观察:随访截至2022年3月。术后嘱病人定期门诊复查PSA:2年内于术后第1个月并之后每隔3个月复查并随访;2年后每半年复查并随访,必要时行磁共振检查。随访期间PSA升高≥2次且PSA≥0.2 ng/mL纳入BCR组(研究组),其余病例纳入对照组。
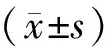
2 结果
2.1 随访结果 随访结束时,181例PCa病人中失访3例,拒绝随访2例,合并其他肿瘤或肝肾功能不全7例;65例病例临床诊断为BCR(研究组),104例无BCR(对照组),PCa病人BCR率为38.46%(65/169)
2.2 影像组学纹理结果分析 基于3D slicer软件勾画的ROI共提取了874组纹理数据,然后基于R语言的Lasso回归法共筛选出了14组有用数据(一阶特征-中位数、灰度共生矩阵特征-均方差、灰度相关矩阵特征-小依赖强调区域、灰度共生矩阵特征-平均差、灰度共生矩阵特征-和熵、灰度共生矩阵特征-小依赖高灰度强调区域、一阶特征-最大值、一阶特征-方差、灰度区域大小矩阵特征-逆差矩、灰度共生矩阵特征-逆方差、灰度区域大小矩阵特征-小区域高灰度强调范围、灰度行程矩阵特征-行程方差、邻域灰度差矩阵特征-信噪比对比度、邻域灰度差矩阵特征-信噪比强度),然后进行正态分布检验和独立样本t检验、Logistic回归,最终筛选出了3组有意义数据,即灰度区域大小矩阵特征-小区域高灰度强调范围[OR(95%CI)= 1.419(1.052~1.906)]、灰度行程矩阵特征-行程方差[OR(95%CI)= 0.442(0.227~0.861)]和邻域灰度差矩阵特征-信噪比对比度[OR(95%CI)= 0.746(0.571~0.977)]。
2.3 一般临床资料分析 单因素分析显示,研究组临床T分期、淋巴结转移、远处转移、肿瘤大小、Gleason分级、术前PSA浓度、治疗方式与对照组比较,差异有统计学意义(P<0.05);多因素分析显示,淋巴结转移、术前PSA浓度、治疗方式是PCa病人BCR的独立风险因素,见表1。
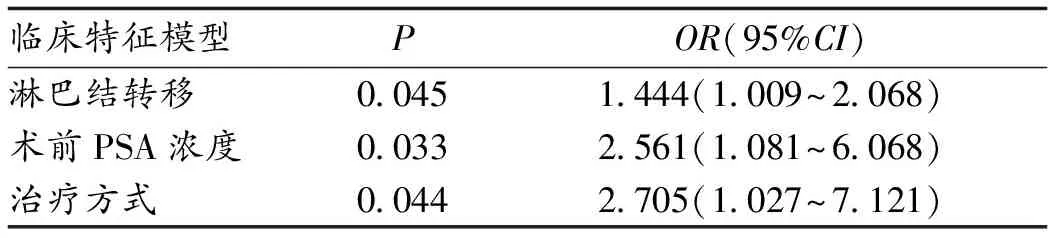
表1 基于临床特征预测BCR的多因素回归分析
2.4 超声结果分析 单因素分析显示,研究组超声造影时间强度曲线的PI、AT、TTP以及弹性成像分级与对照组比较,差异有统计学意义(P<0.05)。多因素分析显示,弹性成像分级是PCa病人BCR的独立风险因素,见表2。

表2 基于超声造影特征预测BCR的多因素回归分析
2.5 术前超声-磁共振成像特征及临床资料建立的组合模型预测BCR的多因素分析 多因素Logistic回归分析结果提示:肿瘤直径、术前PSA浓度、治疗方式、弹性成像分级、灰度区域大小矩阵特征-小区域高灰度强调范围、灰度行程矩阵特征-行程方差是 PCa病人BCR的独立影响因素,见表3。

表3 基于术前超声-磁共振成像特征及临床资料预测BCR的多因素回归分析
2.6 建立多种预测模型和外部验证 基于上述风险因素在训练集中建立一般资料模型、超声造影模型、磁共振组学模型和组合模型,并比较四种模型的预测效能,结果提示组合模型预测价值最大[AUC:0.907(95%CI:0.844~0.969)],明显高于一般资料模型[AUC:0.792(95%CI:0.698~0.885)]、超声造影模型[AUC:0.741(95%CI:0.641~0.841)]、磁共振组学模型[AUC:0.729(95%CI:0.626~0.831)],见图1。R语言决策曲线也证实组合模型净收益明显高于其他模型;最终,预期结果也在测试集中获得了验证:组合模型预测效能(AUC=0.917)明显高于一般资料模型(AUC=0.737)、超声造影模型(AUC=0.680)和磁共振组学模型(AUC=0.752),见图2。
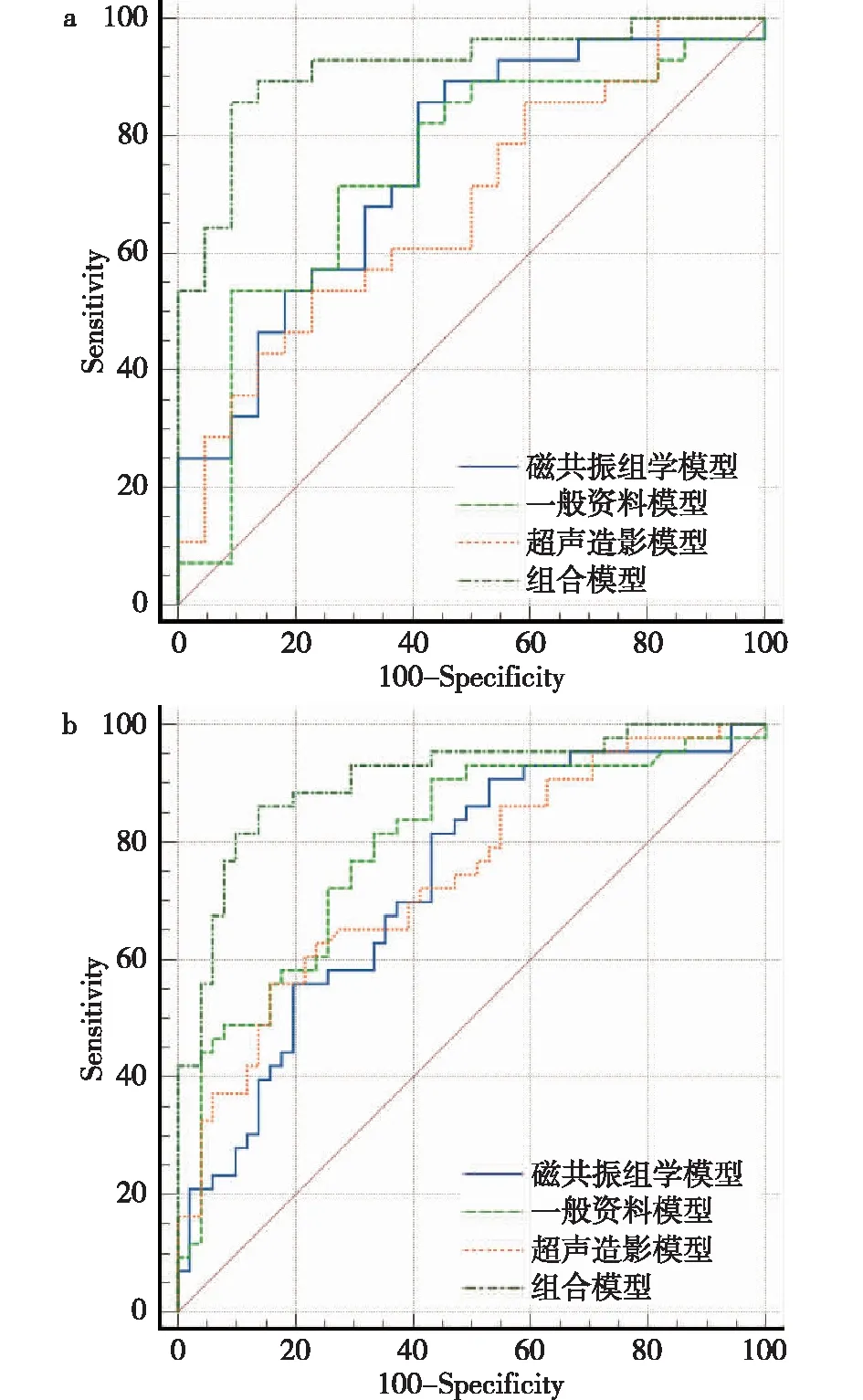
图1 训练集(a)和测试集(b)的不同预测模型的ROC曲线
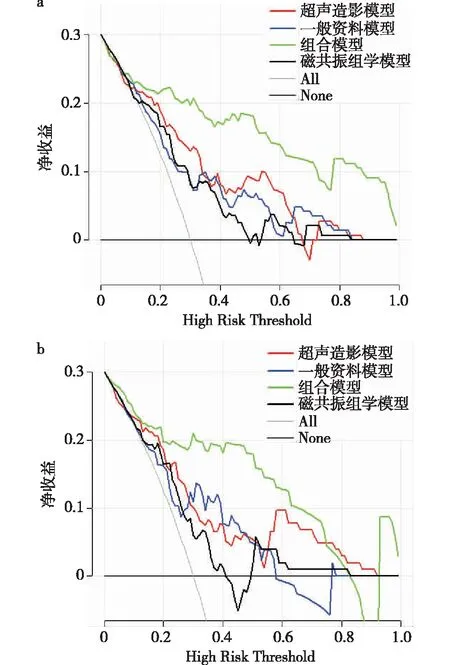
图2 基于风险因素在训练集(a)和测试集(b)的不同预测模型的决策曲线分析
3 讨论
据报道,早期诊断PCa术后病人的BCR并采取有效的医疗干预能明显阻止或降低其临床复发及转移的发生率[6-7]。本研究基于临床-超声-磁共振组学参数建立的预测模型获得了良好的预测收益,基于上述影响因素建立的组合模型也明显优于其他模型。
本研究随访了泰州市中医院169例PCa病人的病历资料,结果提示PCa病人3~5年内的BCR率高达38.46%,故在PCa手术后长期密切随访病人的预后且探索早期预测BCR的模型十分有必要。本研究多因素Logistic回归分析结果显示,肿瘤直径、术前PSA浓度、治疗方式、弹性成像分级、灰度区域大小矩阵特征-小区域高灰度强调范围、灰度行程矩阵特征-行程方差是PCa病人BCR的独立危险因素。据报道,治疗方法、Gleason评分、术前PSA浓度和淋巴结远处转移是目前已知的PCa病人BCR的重要危险因素。但在本研究中,上述因素的独立预测能效均较差,更无法对某些个体差异较大的病人提供有效的预警信息,这与临床影像诊断误差、治疗方式取舍不同或者疾病的演变也有关系。治疗前PSA浓度是可用的定量指标,但其特异度较差,受试剂灵敏度、年龄或其他附加疾病的影响(泌尿系感染、前列腺炎、内分泌代谢性疾病等),因此PSA单独预测BCR较为单薄。
弹性成像值作为潜在预测指标,客观反映了肿瘤的硬度或密度等,从而与肿瘤病理亚成分关联,极大地描述了PCa内在特性,与文献报道类似[8]。影像组学概念最早由荷兰学者Lambin在2012年提出并首先应用于X线方面,而且计算机视觉处理明显优于人眼识别系统。目前哈佛大学等高校合作开发的3D slicer及ITK-snap软件已经将组学概念扩展到超声、CT、磁共振及病理等方向。因此,本研究引入了影像组学参数并获得了良好的收益,在勾画169例PCa术前MRI资料的ROI并经过筛选后,我们共提取了3组可靠的影像组学数据:灰度区域大小矩阵特征-小区域高灰度强调范围、灰度行程矩阵特征-行程方差和邻域灰度差矩阵特征-信噪比对比度,这些数据分别代表病灶的磁共振信号强度、组织密度/硬度、灰度增强区域以及灰阶图像差值等,系统地区分了肿瘤的纹理特性。笔者基于上述所有风险因素建立了4种预测模型,并选择了训练集和测试集进行了训练-验证,获得了一致性的结果;最后,DCA结果证实组合模型预测效果佳,AUC明显高于其他模型。这可能是由于组合模型结合了临床-超声-磁共振组学指标从而获取了基于PCa病人个体化差异的参数,因而提高了预测的准确率。预测模型将有助于临床早期预测BCR,及早调整干预治疗方案,减少BCR的恶性进展,提高病人的生存质量和生存率[9-10]。局限性:本研究数据较少,将来需要多中心研究以完善结果;没有加入病理组学数据,没有基于超声造影的结果进行影像组学提取,因而对于超声-病理数据的挖掘不够完美。
总之,基于临床-超声-磁共振组学参数建立的组合模型为预测PCa病人BCR提供了契机,为临床个体化病例及早调整干预治疗方案提供了依据。
