Galectin-3对蛛网膜下腔出血后早期脑损伤的影响
2022-09-16韩雨薇王晨辰梁国标李晓明
韩雨薇,王晨辰,梁国标,李晓明
早期脑损伤(early brain injury,EBI)被认为是蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后预后不良的关键因素[1]。炎症是早期脑损伤的重要机制之一[2]。半乳糖结合蛋白-3(Galectin-3,Gal-3)属于β-半乳糖苷结合凝集素超家族,由1或2个碳水化合物识别域(carbohydrate recognition domains,CRDs)组成[3],与碳水化合物结合并影响细胞功能的蛋白质。Galectin-3广泛分布于人体各处,可在细胞核、细胞质、细胞外间隙中发现,并可分泌到血液中[4]。它参与细胞粘附、增殖、凋亡、细胞激活、细胞的迁移和吞噬[5-7]。Galectin-3是一种促炎蛋白,与癌症、系统性红斑狼疮、类风湿关节炎、慢性心力衰竭和系统性硬化的发生和进展密切相关[8-10]。
在脑缺血和脑创伤实验模型中表明,Galectin-3由胶质细胞分泌,作为Toll like receptor 4(TLR)4配体激活小胶质细胞,诱导促炎细胞因子上调[11-13]。最近发现,Galectin-3水平与SAH的严重程度和不良预后之间存在关联[14]。研究表明,蛛网膜下腔出血后1~3 d血浆Galectin-3水平升高是非严重动脉瘤性SAH患者发生迟发性脑缺血的独立预测因子。然而,Galectin-3在SAH中的功能作用及分子机制尚不清楚。故本研究将探讨Galectin-3在SAH小鼠模型中的作用影响,并证实其可能的作用机制。
1 方法与材料
1.1 实验动物本研究是根据1996年修订的“美国国立卫生研究院实验动物护理和使用指南”(NIH NO.80-23号)进行的。C57BL/6雄性成年小鼠(10~12周龄,体质量25~30 g)购自北部战区总医院实验动物中心,许可证号SCXK(辽)2020-0001。动物在12 h的光暗循环环境中饲养的,给予充足的食物和水。
1.2 动物模型用40 mg/kg戊巴比妥钠麻醉后,将小鼠放入加热毯中,将直肠温度保持在37±0.5℃。然后暴露颈内动脉、颈外动脉和左颈总动脉,结扎并切割左颈外动脉,留下3 mm的动脉残端。通过大脑中动脉分支将尼龙缝线插入左侧,并将缝线进一步推进约3~5 mm以刺穿动脉,持续时间为10 s。假手术小鼠用相同的程序处理,但不刺血管。
1.3 动物分组及侧脑室注射实验分为4组,每组32只小鼠,分别为假手术+control-siRNA组(sham+si-con),SAH模型+control-siRNA组(SAH+si-con),假 手术+Gal-siRNA组(sham+si-Gal),SAH模 型+Gal-siRNA组(SAH+si-Gal)。参照[15]方法进行脑室内注射操作,在颅骨上钻一个1.0 mm的孔,不刺破硬脑膜。然后,将10 µL Hamilton注射器(Hamilton公司,美国)的针头立体垂直地插入孔中,位于前囟的水平面下方3.0 mm处,进入左侧脑室。总共2 µL体积的Gal-siRNA(500 pmol,Santa Cruz公司,美国)在SAH诱导前48 h以相同的速率注入,在输液后10 min缓慢取出注射器。
1.4 神经功能评分在SAH造模24 h后进行神经功能评分。采用改良的Garcia评分[16],分别进行了以下六项测试:自发活动、肢体运动的对称性、前爪伸展、攀登、身体本体感觉和对触碰的反应。将所有测试的所有单项得分相加后,神经行为得分最低为3分,代表小鼠神经功能严重受损,最高得分为18分,代表小鼠神经功能正常。
1.5 SAH分级参照文献[17]对SAH严重程度进行分级评分。根据蛛网膜下腔凝血量将基底池分为6个区域,每个区域0~3分。0级:无蛛网膜下腔血;1级:微量蛛网膜下腔血;2级:中度凝血;3级:血块覆盖所有动脉。总分由6个部分(0~18分)相加而得。
1.6 脑水含量大脑样本被迅速取出,分成左右大脑半球和小脑。大脑的这三个部分分别称重(湿重),然后将大脑样本在105℃的烤箱中烘干72 h,然后再次称重(干重)。含水量公式为:(湿重-干重)/湿重×100%。
1.7 伊文思蓝渗出小鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉。SAH 24 h后注射伊文思蓝染料(2%,5 mL/kg;Sigma公司,美国)左股静脉注射,循环60 min。通过心内灌PBS对小鼠实施安乐死。取脑,快速分为左右大脑半球和小脑,称重,用甲酰胺(10 mL/g)浸泡,60℃孵育24 h。然后,离心收集上清液,在620 nm处用酶标仪测定量吸光值。
1.8 Western blot每组8只大鼠,SAH 24 h后,PIRA裂解液(碧云天生物技术有限公司)提取样品蛋白,将等量的样品蛋白(50 μg)上样到聚丙烯酰胺凝胶(碧云天生物技术有限公司)进行电泳分离后转移到PVDF膜上。将膜在5%BSA室温下封闭1 h,并在4℃下与以下一抗孵育过夜:Galectin-3(1:800,Abcam),紧密连接蛋白ZO-1(1:500,Cell signaling technology),紧密连接蛋白claudin-5(1:500,Cell signaling technology),闭合蛋白Occludin(1:500,cell signaling technology),白介素-1β(interleukin-1β,IL-1β,1:500,Cell signaling technology),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,1:500,Cell signaling technology),β-actin(1:1000,Santa Cruz)孵育过夜。用TBS-T洗涤后,将膜与辣根过氧化物酶偶联的山羊抗兔、山羊抗小鼠IgG二抗在室温下孵育1 h。使用ECL化学发光试剂盒(碧云天生物技术有限公司)凝胶成像系统(上海天能科技有限公司)显影,Image J软件统计条带灰度值。
1.9 ELISA检测提取SAH 24 h后各组蛋白样品,采用ELISA试剂盒(南京建成生物工程研究所)对TNF-α和IL-1β含量进行检测,具体方法参照说明说书。
1.10 统计学处理采用SPSS软件(17.0版)对数据进行统计学分析。符合正态分布的连续性变量以均数±标准差()表示,多组间比较采用单因素方差分析。以P<0.05表示差异具有统计学意义。
2 结果
2.1 Galectin-3对SAH后EBI的影响在SAH后24 h以内,假手术+control-siRNA组和假手术+GalsiRNA组 无 小 鼠 死 亡,SAH模 型+control-siRNA组小 鼠24 h死 亡 率(14/46,30.43%),SAH模 型+GalsiRNA组小鼠24 h死亡率(9/41,21.95%)。与假手术组比较,SAH模型+control-siRNA组SAH评分显著增加,而SAH模型+Gal-siRNA组SAH评分显著降低(P<0.01,F=32.47,图1A),说明干扰Galectin-3的表达可以显著减少SAH后的出血量。SAH模型+control-siRNA组小鼠神经功能评分显著低于假手术组,而SAH模型+Gal-siRNA组神经功能评分显著提高,说明干扰Galectin-3的表达能够改善SAH后的神经功能(P<0.01,F=40.68,图1B)。

图1 Galectin-3对SAH后(A)SAH评分和(B)神经功能评分的影响。
2.2 Galectin-3对SAH后血脑屏障的影响Western blot结果显示,与假手术组比较,SAH模型+control-siRNA组Galectin-3的蛋白表达量增加,紧密连接蛋白ZO-1、claudin-5和occludin的蛋白表达量显著降低。与SAH模型+control-siRNA组比较,而SAH模型+Gal-siRNA组Galectin-3表达降低,并且紧密连接蛋白ZO-1、claudin-5和occludin的蛋白表达量显著增加(P<0.01,F=24.23,图2A)。脑水肿和依文思蓝渗出实验结果显示,SAH模型+GalsiRNA组抑制Galectin-3表达能够显著减少脑水含量和降低依文思蓝的渗出含量(P<0.01,F=25.98,图2C)。以上实验结果提示,抑制Galectin-3的表达能够保护血脑屏障的破坏。

图2 Galectin-3对蛛网膜下腔出血后血脑屏障的影响
2.3 Galectin-3对SAH后炎症的影响与假手术组比较,SAH后TLR4表达增加,而抑制Galectin-3后TLR4的表达显著降低(P<0.01,F=31.55,图3A)。ELISA实验结果显示,与假手术组比较,SAH模型+control-siRNA组IL-1β和TNF-α的蛋白水平显著升高,而抑制Galectin-3后IL-1β和TNF-α的蛋白水平明显降低(P<0.01F=40.02,图3)。提示抑制Galectin-3能够抑制SAH后炎症反应的发生。

图3 Galectin-3对蛛网膜下腔出血后炎症的影响
2.4 Galectin-3对SAH后凋亡的影响与假手术组相比较,SAH+si-con组TUNEL阳性细胞数目显著增加,说明神经元凋亡数量增多。而SAH+si-Gal组中,抑制Galectin-3能够显著减少TUNEL阳性细胞数目。提示抑制Galectin-3能够显著抑制凋亡的发生。
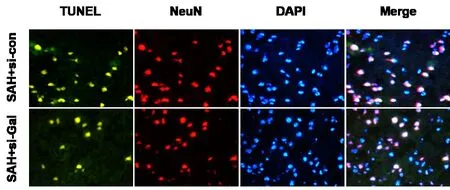
图4 Galectin-3对SAH后凋亡的影响(×400倍)
3 讨论
SAH被认为是中枢神经系统最具破坏性的疾病之一。在过去的几十年里,对SAH的研究主要集中在防止SAH后迟发性脑缺血和改善预后的脑血管痉挛。然而,越来越多的证据表明,早期脑损伤是导致迟发性脑缺血、脑血管痉挛和预后不良的重要机制。最近的研究表明,SAH急性期血浆中基质细胞蛋白Galectin-3水平升高与SAH程度、迟发性脑梗死和SAH患者预后差密切相关[14,18]。报道显示[19],检测120例中国动脉瘤性SAH患者的血浆Galectin-3水平,并与同等数量的对照组进行比较,患者血清Galectin-3水平高于对照组。Galectin-3是6个月病死率和不良预后的独立预测因子,但Galectin-3在SAH中具体分子机制尚未报道。Galectin-3在脑损伤中的可能作用和分子机制,特别是SAH后的EBI。
本研究证实Galectin-3在小鼠实验性SAH后蛋白表达上调,而小RNA干扰抑制Galectin-3的表达后,Galectin-3表达减少,脑出血量减少,神经功能评分增加。并且与SAH模型组比较,抑制Galectin-3表达后,紧密连接蛋白ZO-1、claudin-5、occludin表达量显著增加,从而减轻脑水肿和血脑屏障破坏。此外,Galectin-3可能通过TLR4引起SAH后血脑屏障的破坏。以上实验结果提示抑制Galectin-3的表达能够保护SAH后的早期脑损伤。
最初人们认为Galectin-3在健康的大脑中正常情况下不会强烈表达,而最近的研究表明,Galectin-3在脑组织的星形胶质细胞中表达,在脑发育过程中起着神经母细胞迁移的作用[20]。脑损伤后Galectin-3的表达增加[21],主要来自小胶质细胞,部分来自少突胶质细胞和星形胶质细胞[22-23]。在神经疾病中,Galectin-3与各种形式的缺血性脑血管病的关系研究最多,但也有些研究表明它与广泛的神经病理学有关。在小鼠缺血模型中,释放的Galectin-3作为内源性旁分泌TLR4配体,而去除Galectin-3则发挥了神经保护作用[12],这与我们的结果相一致。我们的研究为Galectin-3作为SAH后脑损伤潜在的新的治疗或研究靶点提供基础依据。
