3 种拮抗酵母菌组合处理对水蜜桃贮藏品质的影响
2022-09-16王雅歆李建龙
王雅歆,颜 菲,李建龙
(1. 南京大学 生命科学学院,江苏 南京 210093;2. 南京市长乐农业科技有限责任公司,江苏 南京 211200)
水蜜桃(Prunus persicaL.)是蔷薇科桃属植物,原产于中国并广泛种植于国内各省。其果实滋味甘甜,且富含多种糖类、维生素C 等营养成分,有清胃、润肺等功效。水蜜桃上市时正值夏季,气候适宜微生物生长和繁殖,故水蜜桃采摘后极易因致病真菌感染而腐烂变质,货架期缩短,影响销售,并由此引发了极大的经济损失[1]。因此,水蜜桃采摘后的保鲜方法对于延长水蜜桃果实贮藏时间举足轻重。
目前,国内对水蜜桃保鲜的措施以低温或气调贮藏等各项物理方法以及化学保鲜法为主[2‑3]。其中,低温贮藏仍是目前应用最为广泛的保鲜方法,低温状态下桃果实的呼吸被显著抑制,各类酶活性和细胞内的化学反应速率也显著降低。气调贮藏则是应用环境中二氧化碳和氧气调控果实呼吸作用并延长贮藏期的方法,该技术效果好,且相较于冷藏,降低了果实冻伤的风险[4]。化学杀菌剂能有效干预病原菌细胞的生长和代谢,如扰乱有丝分裂时微管蛋白的组装等,进而减少果实采后损失[5]。但目前应用的技术中,物理保鲜能源消耗较大,化学保鲜无法保证绝对安全。因此,寻找新的保鲜技术十分重要。生物保鲜技术是指利用动植物或微生物来源的小分子、酶类或生物体本身进行保鲜的方法[6]。该方法选用的材料具有抑制果蔬中致病菌类或其次级代谢产物的效用,且大多对人体有益。该技术安全性更高、能耗更低,但在国内应用较少。
拮抗酵母菌保鲜技术是一种新兴的生物防治方法,可通过多种机制发挥作用,包括竞争营养和空间、寄生、诱导宿主抗性、产生挥发性有机化合物等[7]。对碳源、氮源和铁离子等营养和空间的竞争是拮抗酵母菌发挥效用的主要模式[8]。寄生是指拮抗酵母菌附着并食用病原真菌菌丝,分泌水解酶破坏或溶解真菌结构的现象。拮抗酵母菌还可增强宿主防御相关基因的表达,进而增强防御相关酶的活性[9]。此外,一些拮抗酵母菌可以产生挥发性有机物,它们的混合物在密闭条件下可控制采后病原体的菌丝生长和产孢作用[10]。拮抗酵母菌保鲜技术具有无毒无害、无特殊气味的优点,在食品工业中有着悠久的应用历史[11‑12]。王晨等[13]从桃果实表皮分离得到1株对桃褐腐病菌抑制率较好的葡萄汁有孢汉逊酵母,活体抑菌率可达50.30%。张俊杰等[14]从葡萄果实表面分离出1株对黄瓜枯萎病病菌抑菌率达到52%的葡萄汁有孢汉逊酵母。张晓云等[15]建立了基于膜醭毕赤酵母的喷雾干燥固体制剂制备技术,可加速酵母在桃果实采后病害防治中的应用进程。几种拮抗酵母菌混合使用是提高保鲜效果的途径之一,SHARMA 等[16]研究发现哈茨木霉和异常毕赤酵母混合使用可以有效控制芒果炭疽病。目前,拮抗酵母菌组合处理方法在水蜜桃保鲜领域鲜有报道。鉴于此,选取罗伦隐球酵母悬浮液、喜橄榄假丝酵母悬浮液及间型假丝酵母悬浮液对凤凰水蜜桃进行组合处理,研究其对凤凰水蜜桃采后贮藏品质的影响,旨在为水蜜桃常温贮藏保鲜提供参考。
1 材料和方法
1.1 主要材料
水蜜桃:于2021 年8 月采摘自张家港市凤凰镇,所选桃子约八成熟,色泽相近,发育正常,果实质量均匀,外形一致,无病虫害和机械损伤。
拮抗酵母菌:罗伦隐球酵母(Cryptococcus laurentii)、喜橄榄假丝酵母(Candida oleophila)、间型假丝酵母(Candida intermedia)均购自中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC)。
1.2 主要仪器与设备
XB-K-25 血球计数板:上海市求精生化试剂仪器有限公司;SW-CJ-1FD 型无菌操作台:苏净安康空气技术有限公司;BIO2 光学显微镜:伯拉莫贝林(上海)精密仪器有限公司;THZ-C 恒温振荡培养箱:太仓市华美生化仪器厂;BS124S电子天平:北京赛多利斯仪器系统有限公司;HS-6 数显恒温水浴锅:贵阳科学仪器研究所;756MC 紫外-可见分光光度计:上海菁华科技仪器有限公司;TGL1650-WS台式高速离心机:上海卢湘仪器有限公司;GY-3 型硬度仪:浙江托普仪器有限公司;VBR-18 型手持式折光仪:泉州市万达实验仪器设备公司。
1.3 试验方法
1.3.1 拮抗酵母菌的活化 分别向罗伦隐球酵母、喜橄榄假丝酵母和间型假丝酵母冻干粉中加入少量无菌水混匀,取少许涂布于PDA 固体培养基上,培养至获得单菌落。挑一单菌落于100 mL YPD 培养基(水100 mL、酵母膏1 g、蛋白胨2 g、葡萄糖2 g)中,于恒温振荡培养箱(150 r/min,28 ℃)中培养48 h。用无菌水稀释得到5×108cfu/mL 喜橄榄假丝酵母悬浮液(P1)、1×108cfu/mL 间型假丝酵母悬浮液(P2)、5×108cfu/mL 罗伦隐球酵母+5×108cfu/mL喜橄榄假丝酵母悬浮液(P3)、5×108cfu/mL 罗伦隐球酵母+1×108cfu/mL 间型假丝酵母悬浮液(P4)以及5×108cfu/mL 罗伦隐球酵母+5×108cfu/mL 喜橄榄假丝酵母+1×108cfu/mL 间型假丝酵母悬浮液(P5)[17]。通过预试验筛选喜橄榄假丝酵母菌悬浮液及间型假丝酵母菌悬浮液的群落总数。
1.3.2 试验分组及处理 取成熟度约八成且一致、外形色泽接近、外表无机械损伤和霉变的水蜜桃果实,随机分为6 组,设置5 个处理组:喜橄榄假丝酵母组(P1)、间型假丝酵母组(P2)、罗伦隐球酵母+喜橄榄假丝酵母组(P3)、罗伦隐球酵母+间型假丝酵母组(P4)、罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组(P5);设置1 个对照组(CK);每组8 个果实。分别置于各菌悬液中浸泡2 min,取出后放置晾干,对照组不做处理,置于常温(25~30 ℃)环境下,每日测定并记录相关数据,重复3次。由于取样时仅取水蜜桃的一小部分,故单个水蜜桃可测全部的8个指标。试验期8 d。
1.4 测定项目与方法
1.4.1 腐烂等级 将果面的腐烂程度划分为5个等级。0 级为果实完好;按果面腐烂面积分为1~4 级,1 级:极小(3 个以下斑点);2 级:不超过1/2;3 级:1/2~3/4;4级:大于3/4[18]。
1.4.2 失重率 处理前果实的质量记为W0,每次测定时果实的质量记为W,计算失重率:失重率=(W0-W)/W0×100%。
1.4.3 硬度 采用GY-3 型硬度仪测定硬度[19]。在果实中间最大横径处削去果皮,测定3 次,取平均值。硬度仪的最小量程为4.75 N。
1.4.4 呼吸强度 采用静置法测定呼吸强度[19]。
1.4.5 可溶性固形物含量 采用VBR-18型手持折光仪测定可溶性固形物含量[19]。
1.4.6 相对电导率 采用DDS-11A 型电导率仪测定电导率,计算相对电导率:相对电导率=(活组织浸出液电导率/失活组织浸出液电导率)×100%[19]。
1.4.7 丙二醛含量 采用硫代巴比妥酸法测定丙二醛含量。利用三氯乙酸提取果实中的丙二醛,后加硫代巴比妥酸煮沸测定吸光度[19]。
1.4.8 可溶性蛋白含量 采用考马斯亮蓝法测定可溶性蛋白含量[20]。
1.5 数据处理
使用Excel 2019 进行数据统计,使用SPSS 25.0软件进行标准偏差的计算和差异显著性分析,利用Origin 2018软件进行图形绘制。
2 结果与分析
2.1 3种拮抗酵母菌组合处理对水蜜桃腐烂等级的影响
从图1 可以看出,8 d 时,对照组果实腐烂等级最高,罗伦隐球酵母+喜橄榄假丝酵母组、罗伦隐球酵母+间型假丝酵母组和罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组腐烂等级均显著低于对照组(P<0.05)。

图1 不同处理对水蜜桃果实腐烂等级的影响Fig.1 Effects of different treatments on the decay grade of peach fruit
2.2 3种拮抗酵母菌组合处理对水蜜桃失重率的影响
从图2 可以看出,水蜜桃果实的失重率在采后呈现上升趋势,对照组果实失重率在贮藏期内均高于各处理组。贮藏8 d 时,对照组失重率上升到23.14%,喜橄榄假丝酵母组、间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母组、罗伦隐球酵母+间型假丝酵母组和罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组分别为15.75%、19.40%、18.45%、16.09%和17.69%。与对照组相比,各处理组果实失重率均显著降低(P<0.05),其中喜橄榄假丝酵母组最低,下降7.39个百分点。
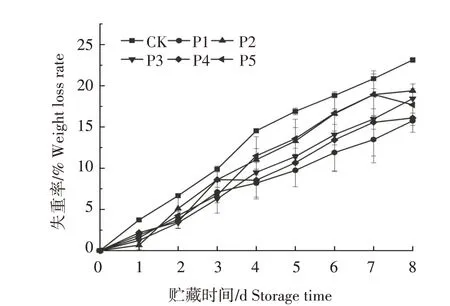
图2 不同处理对水蜜桃果实失重率的影响Fig.2 Effects of different treatments on weight loss rate of peach fruit
2.3 3种拮抗酵母菌组合处理对水蜜桃硬度的影响
从图3 可以看出,水蜜桃果实硬度在采后呈下降趋势,贮藏2 d 时下降速度最快;贮藏5 d 时,与贮藏0 d时相比,对照组果实硬度下降86.72%,喜橄榄假丝酵母组、间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母组、罗伦隐球酵母+间型假丝酵母组和罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组分 别 下 降85.83%、84.52%、85.83%、83.17% 和84.94%,其中罗伦隐球酵母+间型假丝酵母组显著低于对照组(P<0.05)。

图3 不同处理对水蜜桃果实硬度的影响Fig.3 Effects of different treatments on fruit hardness of peach fruit
2.4 3种拮抗酵母菌组合处理对水蜜桃呼吸强度的影响
从图4 可以看出,果实在采后3 d 时出现第1 次呼吸峰,7 d 时达到第2 次呼吸峰,对照组果实的呼吸强度峰值明显高于处理组,罗伦隐球酵母+间型假丝酵母组的呼吸强度峰值最低。贮藏8 d 时,对照组果实的呼吸强度为13.75 mg/(kg·h),喜橄榄假丝酵母组、间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母组、罗伦隐球酵母+间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组分别为7.24、5.13、7.58、4.35、6.01 mg/(kg·h)。各处理组果实呼吸强度均显著低于对照组(P<0.05),说明它们均能有效降低果实的呼吸强度,延缓果实衰老。其中罗伦隐球酵母+间型假丝酵母组对果实呼吸的抑制作用最强,与对照组相比,显著下降68.36%。

图4 不同处理对水蜜桃果实呼吸强度的影响Fig.4 Effects of different treatments on respiration intensity of peach fruit
2.5 3种拮抗酵母菌组合处理对水蜜桃可溶性固形物含量的影响
从图5 可以看出,果实中可溶性固形物含量在采后呈先上升后下降的趋势。贮藏7 d 时,对照组的可溶性固形物含量骤降;贮藏8 d 时,与贮藏0 d时相比,对照组果实的可溶性固形物含量上升14.0%,喜橄榄假丝酵母组、间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母组、罗伦隐球酵母+间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组分别上升17.0%、27.3%、12.5%、14.8%、15.6%。经过单因素方差分析发现,贮藏8 d 时,各处理组之间及与对照组相比均无显著性差异。
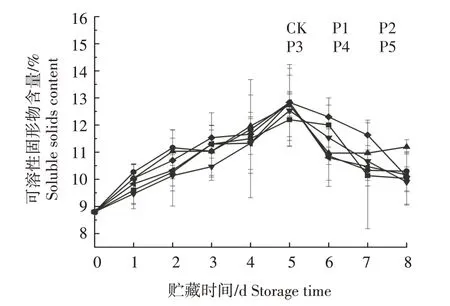
图5 不同处理对水蜜桃果实可溶性固形物含量的影响Fig.5 Effects of different treatments on soluble solids content of peach fruit
2.6 3种拮抗酵母菌组合处理对水蜜桃相对电导率的影响
从图6 可以看出,果实采后相对电导率呈缓慢上升趋势,各处理组果实始终低于对照组。贮藏8 d 时,对照组果实相对电导率达到84.8%,显著高于各处理组(P<0.05),单种拮抗酵母菌与复合处理之间无显著差异。

图6 不同处理对水蜜桃果实相对电导率的影响Fig.6 Effects of different treatments on relative conductivity of peach fruit
2.7 3种拮抗酵母菌组合处理对水蜜桃丙二醛含量的影响
从图7 可以看出,果实采后丙二醛含量呈上升趋势,处理组果实丙二醛含量始终低于对照组。贮藏8 d 时,对照组果实丙二醛含量达到2.356 μmol/L,显著高于各处理组(P<0.05);贮藏8 d时,罗伦隐球酵母+间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组果实丙二醛含量分别上升至1.692、1.855 μmol/L,与对照组相比,分别显著下降28.28%、21.26%。说明罗伦隐球酵母+间型假丝酵母混合菌悬浮液和罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母混合菌悬浮液能够有效抑制水蜜桃果实的膜脂过氧化,有效保护细胞膜结构完整。

图7 不同处理对水蜜桃果实丙二醛含量的影响Fig.7 Effects of different treatments on MDA content of peach fruit
2.8 3种拮抗酵母菌组合处理对水蜜桃可溶性蛋白含量的影响
从图8 可以看出,果实采后可溶性蛋白含量呈缓慢下降趋势,整个贮藏期内,处理组果实可溶性蛋白含量始终高于对照组。贮藏8 d 时,对照组果实的可溶性蛋白含量降至0.276 7 mg/g;与对照组相比,间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母组和罗伦隐球酵母+喜橄榄假丝酵母+间型假丝酵母组分别显著上升36.14%、40.95%和37.33%。

图8 不同处理对水蜜桃果实可溶性蛋白含量的影响Fig.8 Effects of different treatments on soluble protein content of peach fruit
3 结论与讨论
果实的各项理化指数,如失重率、硬度、呼吸强度、可溶性固形物含量、相对电导率、丙二醛含量及可溶性蛋白含量等均可反映果实采后品质。果实采后失重主要由呼吸作用带来的水分蒸发引起。水蜜桃果皮较薄,水分流失速度较快,果皮皱缩、色泽变暗、口感变差往往发生于短时间内。控制失重是果品保鲜的第一步[21]。本试验中,单个拮抗酵母菌及各混合菌悬浮液均能够在常温下有效控制果实失重,这可能源于拮抗酵母菌对果实呼吸作用的抑制。这与MENG等[22]利用罗伦隐球酵母和壳聚糖涂层复合处理采后葡萄的研究结果一致。
果实采后硬度降低源于果实细胞壁水解酶的活性增强[23]。硬度降低后,果实遇到机械冲击或压缩会产生瘀伤,进而霉变、腐烂[24]。本试验中,罗伦隐球酵母+间型假丝酵母组硬度保持最佳,这可能与2 种酵母菌对果实细胞壁水解酶活性的抑制相关。OU 等[25]以UV-C 和热带假丝酵母复合处理菠萝的研究也有相似结果。
水蜜桃是典型的呼吸跃变型水果,通常会出现2个呼吸峰,水蜜桃采后呼吸作用明显加强,不断消耗储存的有机物质[26]。本试验中,单个拮抗酵母菌及混合菌悬浮液均能显著降低采后水蜜桃果实的呼吸强度。LI等[27]利用大黄提取物和海藻酸钠涂层处理水蜜桃的研究中也有类似结果。
可溶性固形物是果实组织中所有溶解于水的化合物的总称,可溶性糖是其中的主要成分[28]。由于后熟过程,采后可溶性固形物会稍有积累;同时果实持续的呼吸作用也在不断消耗这些可溶性的营养成分[29]。本试验中,拮抗酵母菌处理显著延缓可溶性固形物含量的降低,与WIJESINGHE 等[30]采用棘孢木霉处理菠萝的研究结果一致。
果实霉变会引发细胞膜的受损,致使其透性增强,细胞内的各类电解质向外扩散,果实组织浸提液的电导率增大[31]。相对电导率是判断细胞膜完整性的重要标准之一,相对电导率增大可能意味着酶和底物的分离[32]。本试验中,单个拮抗酵母菌及混合菌悬浮液均可显著降低相对电导率。ZHAO 等[32]以热空气和季也蒙毕赤酵母联合处理水蜜桃时也有相同结果。
丙二醛是植物细胞膜脂过氧化的产物。丙二醛含量越高,膜脂过氧化程度越大,细胞膜结构损伤程度越大[33]。本试验中,罗伦隐球酵母+间型假丝酵母组和罗伦隐球酵母+喜橄榄假丝酵母组+间型假丝酵母组果实丙二醛含量均显著降低,这可能与拮抗酵母菌对膜脂过氧化的抑制作用相关。FENG 等[34]利用3 种拮抗酵母菌处理扁豆的研究也得到了相同结果。
可溶性蛋白能以小分子状态溶于水,更易于人体吸收,是重要的营养成分之一,同时它们能起到渗透调节作用,对生物膜及其中的物质起到保护作用。可溶性蛋白含量可作为反映水蜜桃的养分含量和部分抗性的主要指标之一[35]。本试验中,间型假丝酵母组、罗伦隐球酵母+喜橄榄假丝酵母组和罗伦隐球酵母+喜橄榄假丝酵母组+间型假丝酵母组果实可溶性蛋白含量均显著上升。这可能源于拮抗酵母菌对果实中防御相关酶基因的激活。WU等[36]在利用枯草芽孢杆菌和热处理联合作用桃的研究中也有类似结果。
水蜜桃果实在贮藏期极易感染霉菌,致使果实腐烂变质。一旦霉变发生,由于微生物繁殖极快,单个果实的病变面积会迅速扩大,甚至感染未发生霉变的果实[37]。本试验采用拮抗酵母菌组合处理方法,其综合保鲜效果优于单一拮抗酵母菌悬液处理,这可能是因为单个拮抗酵母菌对不同致病真菌的抑菌强度不同,多种拮抗酵母菌组合后能更好地覆盖抗菌谱,从而达到广谱抗菌效果。整体上,罗伦隐球酵母+间型假丝酵母菌悬液处理后的水蜜桃各项指标均表现较好,说明这一处理抑制水蜜桃致病真菌生长的效果最佳。将来,利用日益成熟的组学和分子生物学技术以及工程策略,可以开发稳定高效的保鲜剂,或是以酵母菌干粉的形式开发保鲜纸[15]。综上,罗伦隐球酵母+间型假丝酵母混合菌悬浮液处理是一种经济有效的水蜜桃保鲜方法,有一定的应用前景,可为将来水蜜桃保鲜剂的商品开发和生产提供理论依据。
