黄淮产区地黄种质遗传多样性分析及SSR指纹图谱构建
2022-09-16李春鑫张永战陈国参杨铁钢张英涛董诚明
李春鑫,张永战,陈国参,杨铁钢,张英涛,李 春,董诚明
(1. 河南省科学院生物研究所有限责任公司,河南 郑州 450008;2. 河南省农业科学院 经济作物研究所,河南 郑州 450002;3. 河南省农业科学院 芝麻研究中心,河南 郑州 450002;4. 河南中医药大学 药学院,河南 郑州 450046)
地 黄(Rehmannia glutinosa)为 玄 参 科(Scrophulariaceae)地黄属(Rehmannia)多年生草本植物,其根茎肉质,鲜时呈黄色,因而得名[1‑2]。地黄在我国主要分布在河南、河北、山东、天津、陕西、山西、四川、安徽及江浙等地[3]。作为一种传统大宗中药材,地黄具有清热凉血、养阴生津的功效,《神农本草经》认为地黄“味甘寒,主治折跌绝筋伤、逐血痹、填骨髓、长肌肉;作汤,除寒热积聚,除痹”。现代药理学研究也表明,地黄在提高机体免疫力、抗癌、防癌等方面具有积极作用[4‑7]。我国最早地黄栽培品种记载见于1 000 余年前的《图经本草》,第一个近代地黄品种是崔大毛于1917年选育的四齿毛,李开寿随后培育的金状元在很长一段时间内都是国内的主栽品种[8],同一时期较为著名的农家品种还有小黑英、郭里锚、邢疙瘩等[9]。21 世纪60 年代,河南省温县农业科学研究所、中国医学科学院药用植物所等单位选育出了以85-5 系列为代表的怀地黄及北京1 号、北京3 号等现代地黄品种[9],这些品种逐渐取代了早期的农家种,在地黄生产中开始占据主导地位[9‑10]。随着无性繁殖品种占比逐渐提高,地黄品种遗传基础狭窄、亲本材料来源单一、形态相似度高等问题开始凸显。在品种选育、品种验真和资源鉴定等工作中普遍采用的形态观察和农艺性状考种鉴别,存在受环境影响大、性状鉴定主观性强、对亲缘关系较近的品种鉴别效果差等问题,严重限制了地黄遗传改良进度和品种更新。同时,形态学等常规鉴别方法还使得外形相似的品种在种植、收储等环节中难以提纯、去杂,进而导致药材质量产生较大波动,制约了地黄功效的发挥。因此,亟需开发一种高效的鉴定方法,实现对现有种质快速、精准区分,以便于后续引入更多优良类型亲本材料。
分子标记具有不受时空、环境限制,多态性丰富等特点,被逐渐应用于植物品种的鉴定、验真领域。RAPD(Random amplified polymorphic DNA)标记是最早应用于地黄的分子标记,其主要被应用于地黄种质的遗传多样性分析[11]、遗传背景检测[12]、种群划分[13]、亲缘关系和遗传特点分析等[14]。RAPD标记由于试验稳定性和重复性较差,无法检测共显性基因型,在结果精度方面存在不足。随后,AFLP(Amplified fragment length polymorphism)和ISSR(Inter‑simple sequence repeat)相继被应用于地黄品种基因型与有效成分关联分析[15]、分子标记扩增体系优化[16]、遗传多样性分析[17‑18]等研究。但以上研究尚无法实现对每个供试品种的单独区分,且新类型标记的应用相对滞后。
SSR(Simple sequence repeats)分子标记具有特异性强、共显性及多态性好、对DNA 浓度要求低的优点,广泛应用于品种鉴定、遗传分析和指纹图谱构建等研究,但目前SSR 用于我国地黄品种遗传解析的报道较匮乏。鉴于此,拟利用108 对SSR 引物对当前我国黄淮产区的17 个地黄材料(主栽品种、地方品种和野生种质资源)进行遗传多样性分析和聚类分析,明确种质间遗传关系,并构建其指纹图谱,为地黄种质鉴定、遗传评估和品种选育提供支持。
1 材料和方法
1.1 材料
共17 个地黄种质,其中6 个为主栽品种:金九、85-5、太空育种、北京3号、脱毒北京3号、怀中1号;6 个为地方品种:怀丰、吨王、金线钓鱼、小黑英、沁怀、红薯王;5 个为野生种质:大田选育野生、野生1号、野生2号、金九野生、修武野生。以上地黄种质均由河南中医药大学药学院董诚明教授提供,并统一种植于武陟县大封镇驾部村(34.995 2°N,113.261 6°E)。以上材料经过董诚明教授连续多年的提纯和鉴定,种质名称正确无误,种质纯合、无杂株。每个种质种植小区面积1 m2,小区间隔60 cm。所有种质于2020 年5 月初以条播方法种植,行距30 cm、株距30 cm。于当年7月采摘种质幼嫩叶片,经干冰处理后,置超低温冰箱保存备用。
1.2 试剂
PCR 扩增用的常规引物由上海生工生物工程技术服务有限公司合成;M13 荧光引物由美国赛默飞科技公司合成;dNTP(10 mmol/L)购自上海生工生物工程技术服务有限公司;Buffer(10×)、Taq酶(2.5 U/μL)购自天根生化科技有限公司;甲酰胺、PCR 板、封膜、LIZ500 内标、POP7 胶购自美国赛默飞科技公司。
1.3 仪器
PCR 仪为德国Eppendorf 公司的Mastercycler Pro S(Eppendorf AG,Hamburg,Germany);利 用JXFSTPRP-64L 型研磨仪(上海净信实业发展有限公司)研磨样品;利用Avanti JXN-26 型离心机(美国贝克曼公司)进行离心;利用微量分光光度计(美国,ThermoFisher 公司,型号ND-1000)测定DNA 浓度;利用ABI3730遗传分析系统(美国赛默飞科技公司)检测电泳产物。
1.4 样品采集与DNA提取
每个种质选取长势和大小一致的地黄3 株,每株选取幼嫩叶片3~5片用干冰暂存,采用CTAB法[19]提取样品总DNA,采用0.8%琼脂糖电泳和微量分光光度计测定DNA 的纯度和浓度。所有样品稀释至50 ng/μL,-20 ℃保存、备用。
1.5 引物的制备
根 据LIU 等[4]、JIAO 等[20]、LI 等[21]、HUANG 等[22]开发的108对SSR 引物(表1),在上游引物5′端加入TP-M13 序列(CACGACGTTGTAAAACGAC),将引物稀释至1 μmol/L(上游)和10 μmol/L(下游)备用。TP-M13 引物分别引入FAM、PET、VIC 和NED 荧光基团,M13荧光引物稀释至10 μmol/L备用。

表1 108对地黄SSR引物名称、序列及参考文献Tab.1 Name,sequence and references of 108 pairs of Rehmannia glutinosa SSR primers
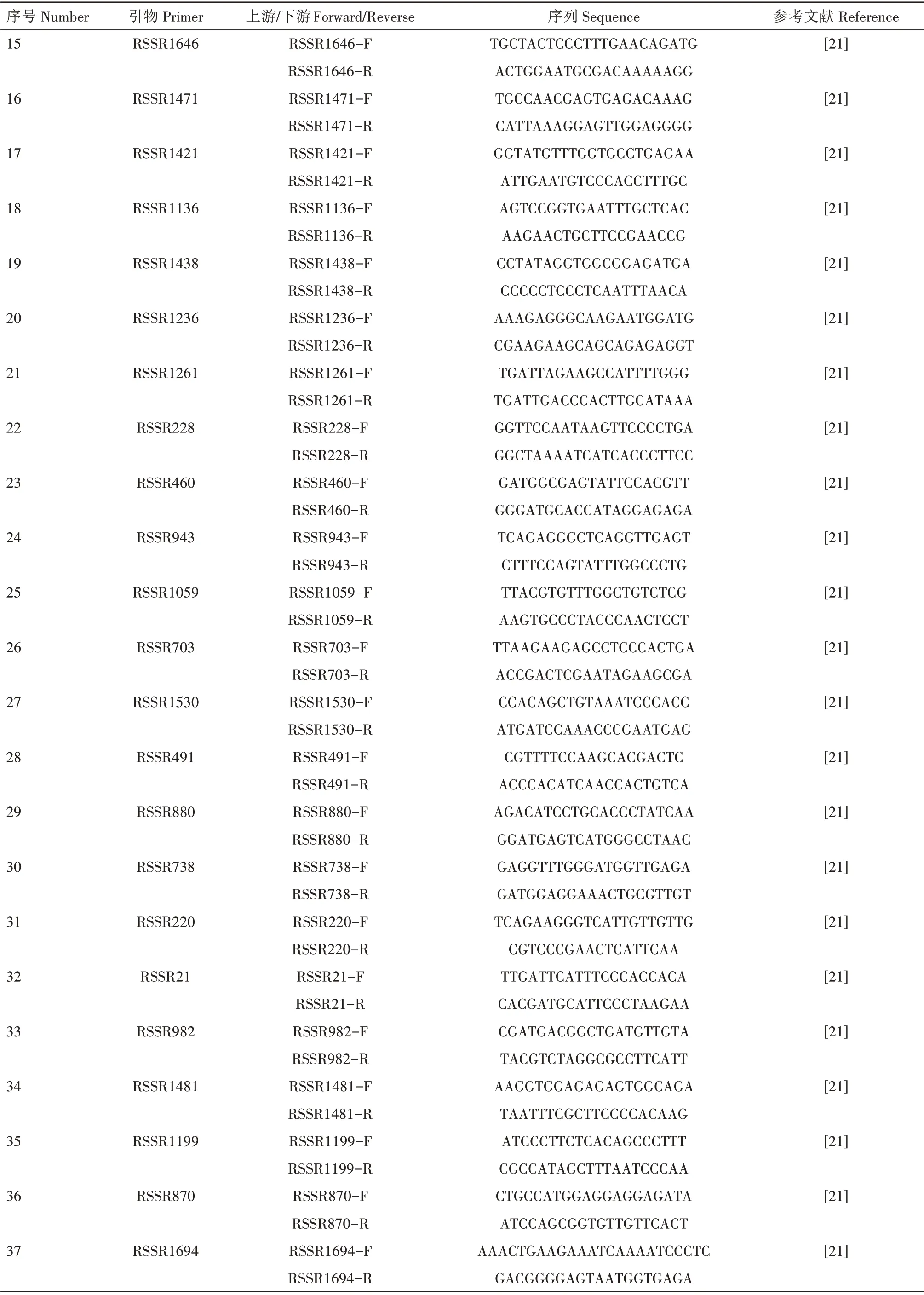
续表1 108对地黄SSR引物名称、序列及参考文献Tab.1(Continued) Name,sequence and references of 108 pairs of Rehmannia glutinosa SSR primers

续表1 108对地黄SSR引物名称、序列及参考文献Tab.1(Continued) Name,sequence and references of 108 pairs of Rehmannia glutinosa SSR primers

续表1 108对地黄SSR引物名称、序列及参考文献Tab.1(Continued) Name,sequence and references of 108 pairs of Rehmannia glutinosa SSR primers
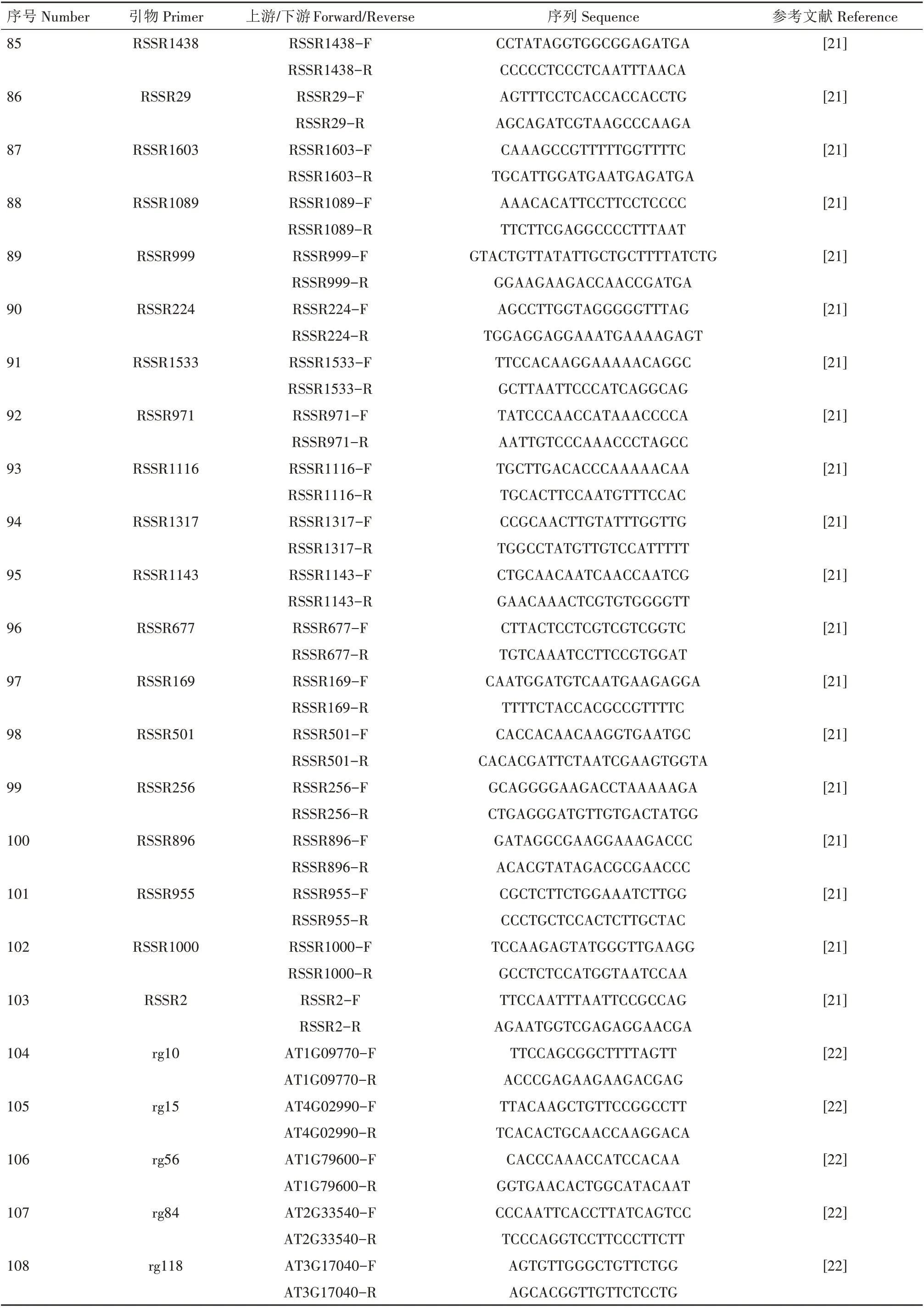
续表1 108对地黄SSR引物名称、序列及参考文献Tab.1(Continued) Name,sequence and references of 108 pairs of Rehmannia glutinosa SSR primers
1.6 PCR扩增
PCR 反应体系:DNA 2.0 μL、Buffer(10×)1.2 μL、dNTP(10 mmol/L)0.2 μL、上游引物(1 μmol/L)1.0 μL、下 游 引 物(10 μmol/L)0.38 μL、M13 荧 光 引 物(10 μmol/L)0.28 μL、Taq酶(2.5 U/μL)0.1 μL、无菌水6.84 μL,总体积为12.0 μL。PCR 扩增程序:95 ℃变性5 min;94 ℃变性30 s,68~58 ℃或65~55 ℃或62~52 ℃(视具体引物定退火温度)退火60 s;72 ℃延 伸45~60 s,36 个 循 环;最 终72 ℃延 伸10 min。
1.7 PCR产物分析和数据处理
将0.5 μL PCR 产物加至10 μL 甲酰胺(含1%LIZ500 内标)中混匀,95 ℃变性6 min,冰浴冷却10 min,离心(2 000 r/min、2 min),电泳检测。利用Genemarker 软件进行扩增片段电泳结果分析,每个样品的SSR 扩增条带以0 和1 记录,在相同的迁移位置上,有带记为1,无带记为0。种质的遗传相似系数(Genetic similarity,GS)根据公式GS=m/(m+n)[23]计算。式中,m表示基因型间共有带型数目,n为基因型间差异带型数目。SSR 引物的多态性信息量(Polymorphic information content,PIC)利 用 公 式PIC=1-∑fi2[24]计算。式中,fi为i位点的基因频率。标记索引系数(Marker index,MI)根据公式MI=等位基因数×PIC25]计算。 SSR 引物的鉴别力(Discriminatory power,DP)表示每对SSR 引物能分辨种质的最大值[26]。利用软件Fig Tree(V 1.4.3)进行聚类分析。
2 结果与分析
2.1 黄淮产区地黄种质PCR扩增结果
在108 对SSR 引物中,有101 对能够在17 个种质间获得有效扩增,扩增成功率达93.52%。其中,50对引物可以在种质间扩增出有效多态性,多态性比例为49.51%,且多态性引物扩增的特异片段中多峰带型占绝大多数(图1)。在50 对多态性扩增引物中,只有RSSR1613 和RSSR1151 在17 个种质间扩增代型为单峰类型,片段长度在107(RSSR1025)~365(Rg17381)bp。
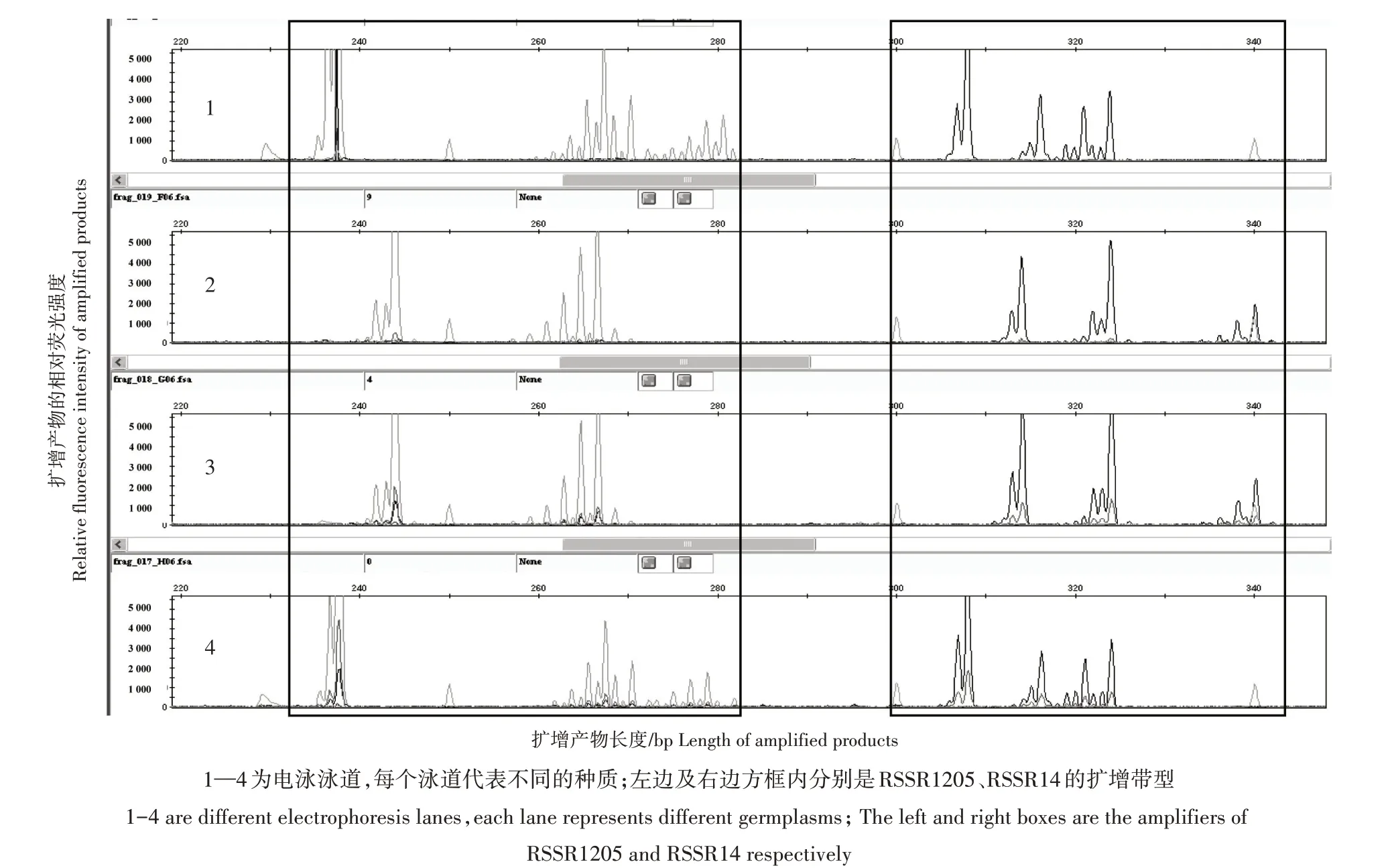
图1 多态性SSR引物在黄淮产区地黄种质间特异性扩增产物的检测Fig.1 Specific amplification products of Rehmannia glutinosa germplasms in Huang-Huai production area by polymorphic SSR primers
2.2 黄淮产区地黄种质聚类分析
50 对多态性引物扩增片段进行汇总后,利用软件TASSEL 3.0 和Fig Tree(V 1.4.3)对地黄种质进行聚类分析和作图。结果(图2)显示,17 个地黄种质共聚为3 个一级群,分别是亚群Ⅰ(含怀中1 号1 个地黄品种)、亚群Ⅱ(含怀丰、吨王和金线钓鱼3个地黄品种)、亚群Ⅲ(含小黑英等13 个种质)。亚群Ⅱ的3 个种质均为地方品种。其中,吨王和金线钓鱼亲缘关系较近。在亚群Ⅲ的13 个种质中,北京3 号和脱毒北京3 号聚为1 个二级分支;剩余的11 个种质中,金九单独为1 个三级分支,另外10 个种质归为1个分支。其中,小黑英、金九野生、修武野生、野生2号和大田选育野生聚为1个四级分支;野生1号、沁怀、红薯王、太空育种和85-5归为1个四级分支。

图2 黄淮产区17个地黄种质的聚类Fig.2 Cluster diagram of 17 Rehmannia glutinosa germplasms in Huang-Huai production area
2.3 黄淮产区地黄种质遗传相似性分析
根据50 对多态性引物在种质间的带型统计结果,计算两两种质间的GS,结果见表2。两两种质间GS 在0.552~0.984,平均为0.729,表明黄淮产区当前种质间遗传背景相似度较高。具体到种质,怀中1 号和脱毒北京3 号GS 最高,遗传差异最大的为修武野生和沁怀。具体到种质的GS 平均值,最低的是修武野生,GS平均为0.634;最高的是脱毒北京3 号,GS 平均为0.791(表3)。5 个野生种质的平均GS为0.679,6个地方品种的平均GS为0.729,6个主栽品种的平均GS 为0.750,表明3 个群体间存在明显的遗传差异。5 个野生地黄种质中,金九野生和修武野生GS 达到0.904,大田选育野生和野生2 号为0.960,只有野生1 号(GS 最大值为0.756)呈现较好的遗传多样性。

表2 黄淮产区17个地黄种质的GSTab.2 GS of 17 Rehmannia glutinosa germplasms in Huang-Huai production area

表3 黄淮产区17个地黄种质GS极值和均值Tab.3 Extreme and mean values of GS of 17 Rehmannia glutinosa germplasms in Huang-Huai production area
2.4 黄淮产区地黄种质指纹图谱和引物特征分析
通过对50 对多态性引物特异片段大小的比较和其在17个种质间分布情况的分析发现,单一引物无法实现对全部种质的区分,而多个引物组合可实现对任一种质的鉴别。50 对多态性引物经去冗余处理,并结合检测稳定性和可靠度,最终选取15 对引物用于17 个种质的特异性区分(表4)。15 对引物扩增片段在107~354 bp,普遍具备扩增稳定、重复性好、带型判读简单的特点。在这一引物组中,每个种质都拥有特异的扩增片段组合,从而构建了地黄种质的SSR 指纹图谱。15 对多态性引物在种质间的带谱均为多峰型。其中,引物RSSR1025 是扩增长度片段数最多的引物,该引物共扩增15条多态性条带。

表4 黄淮产区17个地黄种质的SSR指纹图谱Tab.4 SSR fingerprints among 17 Rehmannia glutinosa germplasms in Huang-Huai production area
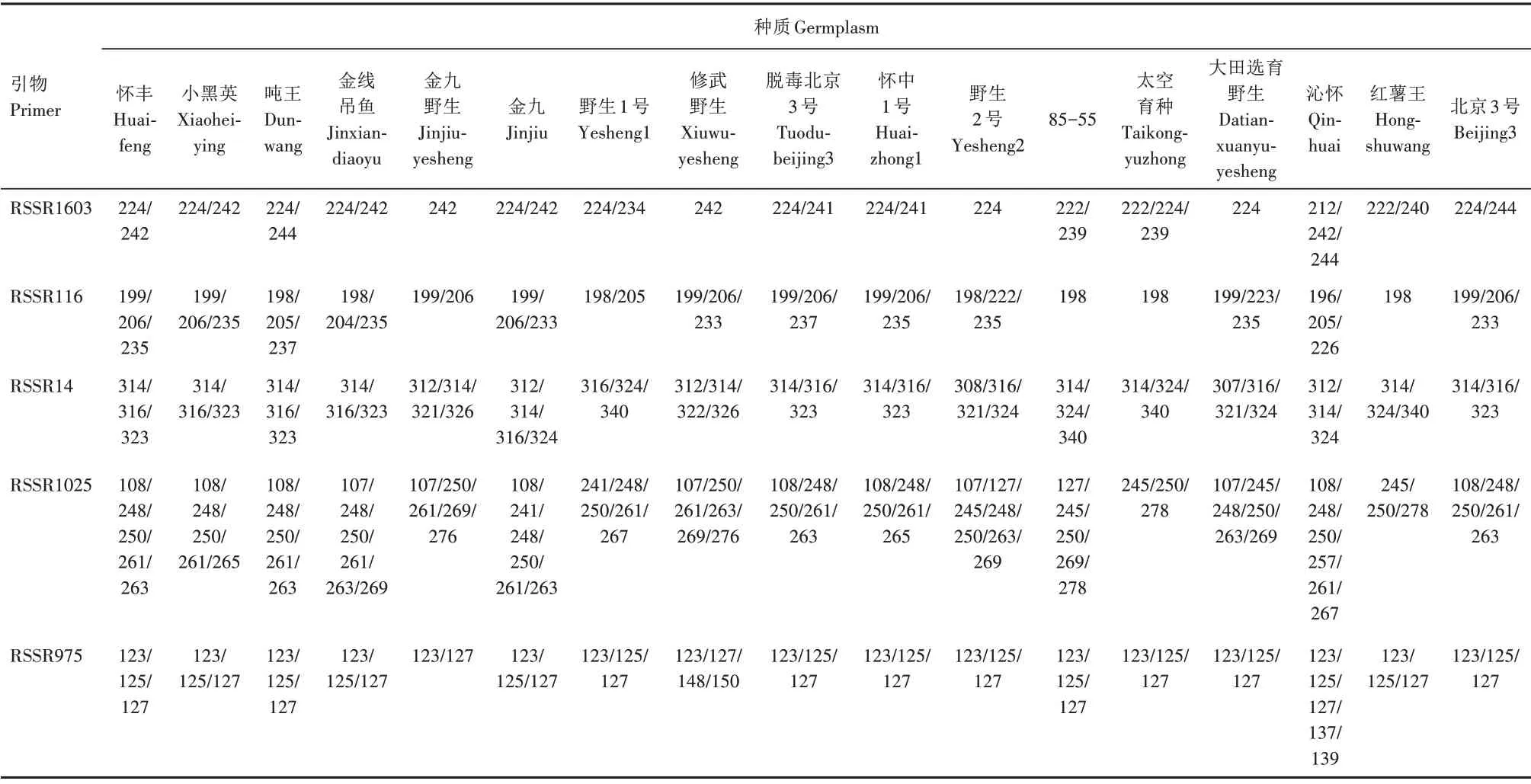
续表4 黄淮产区17个地黄种质的SSR指纹图谱Tab.4(Continued) SSR fingerprints among 17 Rehmannia glutinosa germplasms in Huang-Huai production area
该SSR 指纹图谱的PIC 平均为0.748。其中,引物RSSR158 的最小,为0.574;引物RSSR1025 的最大,为0.890。引物的扩增等位基因数最高为RSSR1025,在种质中可检测到15 个等位基因。在指纹图谱的MI 中,最高的是引物RSSR1025,MI 为13.346。引物RSSR2 和RSSR158 的扩增等位基因数仅有3个,其相应的MI分别为1.843、1.723。15对引物DP为3~12,平均为7(表5)。

表5 黄淮产区地黄种质指纹图谱引物的多态性信息统计结果Tab.5 Statistical results of polymorphism information of fingerprint primers of Rehmannia glutinosa germplasms in Huang-Huai production area
3 结论与讨论
系统选育是当前地黄种质选育的主要策略之一,随着地黄种质的增多,需要将表型和DNA 分子标记相结合才能完成对种质的鉴定。本研究结果显示,全部种质的平均GS为0.729,表明这些种质遗传背景较为相近。从具体种质看,单个种质的平均GS为0.634(修武野生)~0.791(脱毒北京3号)。5个野生地黄材料中金九野生和修武野生GS 达到0.904,大田选育野生和野生2 号为0.960,只有野生1 号(GS 最大值为0.756)呈现较好的遗传多样性。总体看,这5 个材料的平均GS 仍明显低于育成品种,该结果为下一步地黄种质遗传背景的拓宽指明了方向。12 个育成品种中,脱毒北京3 号、怀中1号和北京3 号亲缘关系最近,显示了3 个品种中存在明显的衍生关系。太空育种和85-5 的遗传相似系数达0.980,表明了二者间存在演进关系。12 个主栽/地方品种间的平均GS 也存在明显的分化,地方品种小黑英和沁怀是其中遗传差异较大的品种,拥有和5 个野生种质接近的平均GS,表明在该地区过去的品种选育中,其利用率较低,但二者都具有较好的生产抗逆特性[9‑10],可以在今后的育种中加以重点利用。
地黄作为我国传统中药材,拥有深厚的栽培和药用历史积淀,但其研究基础相比模式植物则明显滞后。目前,地黄种质的分子鉴定研究基本以RAPD、AFLP、SRAP(Sequence‑related amplified polymorphism)及ISSR 标记为主[11‑18]。石海霞等[27]采用10 对SRAP 标记对21 个地黄种质遗传多样性进行分析发现,地黄种质遗传多样性水平为中等偏低水平;赵楠等[28]使用ISSR 标记分析了地黄居群间的基因流和进化关系;LI 等[21]利用开发的7 对SSR 引物对36 份地黄品种和野生品系开展多态性分析发现,地黄品种和野生品系遗传差异明显,且野生品系间存在明显的亲缘关系。上述研究受限于标记种类、数量及检测技术,其分析结果局限于对品种或居群进行遗传多样性评价和聚类,未实现对单个种质的特异鉴别,无法构建种质的指纹图谱。DNA条形码是另一类地黄分子鉴定技术,但由于地黄属种间遗传差异较小,难以实现对地黄种质间的鉴定[29]。
本研究利用108对SSR 引物对黄淮产区主栽品种、地方品种和野生种质进行遗传多样性分析,明确了种质间遗传相似系数和聚类关系。首次解析该地区主栽/地方品种与种植地野生种质间的亲缘关系,构建了种质的SSR 指纹图谱,实现了对17个种质中任意种质的分子鉴别。在对黄淮产区17 个种质进行分子鉴定时,选用了在共显性、重现性和变异性方面效果更优的SSR 标记。在扩增检测时,首次引入了灵敏度高、重现性好的毛细管电泳技术,实现了单一泳道的多标记多重检测及单碱基差异的稳定重现,提高了地黄分子检测的精准度、重现性和高通量。该检测技术灵敏性和分辨率高,因此,本研究SSR 引物多态性比例接近50%。同时,对于种质分析所用引物,本研究基本涵盖了目前已公开发表的SSR 引物,进一步提高了研究结果的准确性。
本研究为地黄种质鉴定、指纹图谱构建等方面研究提供了参考,明确了黄淮产区大部分主栽品种存在遗传背景相近的特点。在今后育种亲本选择时,应更多考虑野生来源和地方品种来源的种质材料。同时,未来应在更多引物开发和新一代分子标记开发方面深入发掘,以便为种质鉴定和遗传改良提供更精确的参考。
