多羧酸受体荧光探针的识别位点设计与机制研究*
2022-09-15成昭,徐玥,郑蕾,何昊
成 昭,徐 玥,郑 蕾,何 昊
(西安医学院 药学院,陕西 西安 710021)
过渡金属Zn、Cu、Hg广泛分布于生命体,参与多种生理过程,同时,表现与氧化还原相关生理活动的较高活性。除作为多种酶、蛋白质的必要组成之外,Zn、Cu、Hg的动态分布与动态变化,还被证明与神经生理学、神经病理学研究紧密相关。现阶段已有多项研究显示,Zn、Cu的异常积累,可能引发生命体中不受控制的氧化还原反应,导致认知活跃度降低、行动障碍[1,2],与阿尔茨海默氏病(AD,Alzheimer's Disease)、帕金森氏病(PD,Parkinson's Disease)等神经退行性疾病密切相关[3,4]。此外,空气、土壤、水体中过量分布的Cu和Hg,不仅影响生态环境,通过食物链富集、经食源性摄入后,还将危及人体健康[5]。因此,实现Zn2+、Cu2+和Hg2+的快速、有效检测,将具有广泛的应用和研究前景[6,7]。
本文基于能够实现目标物快速、直观可视检测的小分子荧光探针技术[8,9],设计苯乙烯类发色团苯并咪唑作为荧光基团、苯胺类受体作为识别基团,定向构筑荧光探针的识别基团与识别位点,合成得到一系列结构相似的多羧酸受体荧光探针。分别以苯胺、2-氨基苯酚、3-氨基苯酚等作为起始原料,通过溴乙酸甲酯对羟基、氨基中氢的取代,分别在识别基团中引入了两个识别位点、邻位3个与间位3个识别位点,合成了识别位点有差异的3种荧光探针T1~T3(图1)。差异性设计识别位点数目与空间排布,从而调控探针与目标物结合能力,期望能够初步阐明探针-目标物识别过程的可能作用机制。
图1 S1,S2与S3的结构Fig.1 Structures of S1,S2 and S3
1 实验部分
1.1 主要仪器与试剂
XT-4型显微熔点仪(北京泰克);TENSOR T-27型傅里叶变换红外光谱仪(美国布鲁克);AVANCE III 400MHz型超导核磁共振波谱仪(美国布鲁克);microTOF-QⅡESI-Q-TOF LC/MS/MS型飞行时间-质联仪(美国布鲁克);UV-1700型紫外分光光度计(日本岛津);LS-55型荧光分光光度计(美国铂金埃尔默)。
苯胺、2-氨基苯酚、3-氨基苯酚、溴乙酸甲酯、三氯氧磷、邻苯二胺、无水K2CO3、还原铁粉,均为化学纯,国药集团化学试剂有限公司;N,N-二甲基甲酰胺(DMF)、甲醇、乙醇、乙腈、乙酸乙酯、石油醚,均为化学纯,天津市天力化学试剂有限公司。
1.2 实验方法
以苯胺、2-氨基苯酚、3-氨基苯酚、邻苯二胺、溴乙酸甲酯、二异丙基乙胺、三氯氧磷等为反应物,合成得到多羧酸受体荧光探针S1~S3,合成路线(以S1为例)见图2。
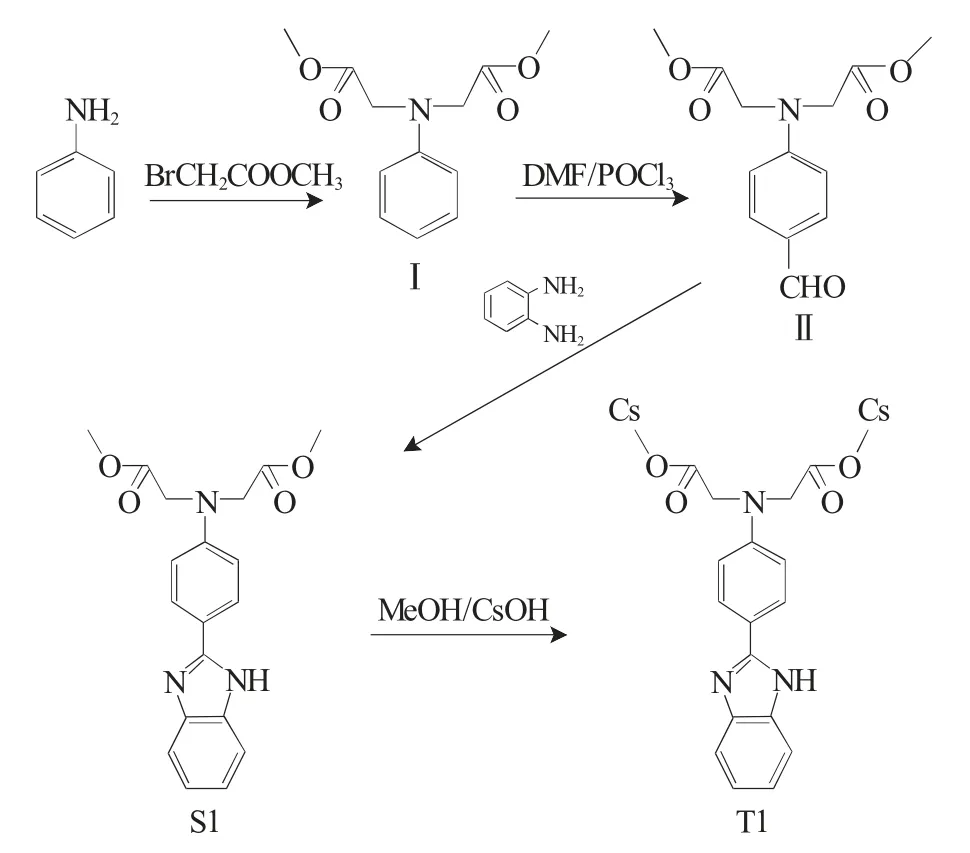
图2 S1的合成路线Fig.2 Synthetic route of S1
1.2.1 N,N-二乙酸甲酯基苯胺(化合物I)的合成将二异丙基乙胺(21.75mL,0.125mol)、溴乙酸甲酯(11.75mL,0.125mol)分 别 加 入 苯 胺(2.28mL,0.025mol)的25mL乙腈溶液中,80℃下反应12h。待反应结束、冷却,以冰水稀释后,进行反应混合物有机相的萃取(二氯甲烷,100mL×3次),干燥、真空旋干溶剂,柱分离,V乙酸乙酯∶V石油醚=1∶3为洗脱剂,得到N,N-二乙酸甲酯基-苯胺(化合物I)。
合成S2、S3的中间体1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚、1-O-3-N,N-三乙酸甲酯基-3-氨基苯酚的合成方法 类似于化合物I,反应物投入量为2-氨基苯酚/3-氨基苯酚(1.09g,0.01mol),二异丙基乙胺(13.05mL,0.075mol),溴乙酸甲酯(7.05mL,0.075mol)。
N,N-二乙酸甲酯基苯胺(化合物I)淡黄色油状物,5.23g,产率88%。1H NMR(CDCl3,400MHz),δ:6.75(t,J=8.0Hz,2H,Ar-H),6.31(t,J=7.3Hz,1H,Ar-H),6.14(d,J=8.4Hz,2H,Ar-H),3.67(s,4H,2×-CH2-),3.28(s,6H,2×-CH3)。IR(KBr),ν,cm-1:3031.33(ν=C-H);2952.76,2849.55(νC-H);1742.01(νC=O);1601.25,1504.75(νC=C);1270.22(νC-O);1204.01(νC-N);752.82,693.38(δ=C-H)。ESI-MS,m/z:260.0891[M+Na]+。
1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚 白色粉末,产率89%,m.p.65~66℃。1H NMR(CDCl3,400MHz),δ:6.92(d,J=3.9Hz,2H,Ar-H),6.81(d,J=7.7Hz,2H,Ar-H),4.67(s,2H,-CH2-),4.22(s,4H,2×-CH2-),3.79(s,3H,-CH3),3.73(s,6H,2×-CH3)。IR(KBr),ν,cm-1:2991.62,2953.79(νC-H);1750.68(νC=O);1590.23,1511.35(νC=C);1202.91(νC-O);750.34(δ=C-H)。ESI-MS,m/z:348.1055[M+Na]+。
1-O-3-N,N-三乙酸甲酯基-3-氨基苯酚 淡黄色油状物,产率90%。1H NMR(CDCl3,400MHz),δ:7.12(t,J=8.2Hz,1H,Ar-H),6.27(t,J=9.2Hz,2H,Ar-H),6.21(s,1H,Ar-H),4.58(s,2H,-CH2-),4.12(s,4H,2×-CH2-),3.79(s,3H,-CH3),3.74(s,6H,2×-CH3)。IR(KBr),ν,cm-1:3004.70(ν=C-H);2954.02,2851.92(νC-H);1744.41(νC=O);1609.38,1502.83(νC=C);1177.36(νC-O);890.34,756.98,688.95(δ=C-H)。ESI-MS,m/z:348.1051[M+Na]+。
1.2.2 4-甲酰基-N,N-二乙酸甲酯基苯胺(化合物II)的合成 保持反应温度为5~10℃,将2.4mL三氯氧磷缓慢滴加至20mL DMF中,再将上述所得的POCl3/DMF混合物滴加至化合物I(2.37g,0.01mol)的20mL DMF溶液中,75℃下反应4h。待反应结束、冷却,以冰水稀释、抽滤,滤渣进行柱分离,V乙酸乙酯∶V石油醚=1∶1为洗脱剂,得到4-甲酰基-N,N-二乙酸甲酯基苯胺(化合物II)。
合成S2、S3的中间体4-甲酰基-N,N-二乙酸甲酯基苯胺、5-甲酰基-1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚的合成方法 类似于化合物II,反应物投入量为1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚/1-O-3-N,N-三乙酸甲酯基-3-氨基苯酚(3.25g,0.01mol)。
4-甲酰基-N,N-二乙酸甲酯基苯胺(化合物II) 淡黄色粉末,0.23g,产率85%,m.p.58~60℃。1H NMR(CDCl3,400MHz),δ:9.79(s,1H,-CHO),7.76(d,J=7.8Hz,2H,Ar-H),6.66(d,J=8.0Hz,2H,Ar-H),4.23(s,4H,2×-CH2-),3.79(s,6H,2×-CH3)。IR(KBr),ν,cm-1:2824.47,2743.11(ν-CHO);1746.67(νC=O);1599.54,1523.10(νC=C);1207.48(νC-O);814.96(δ=C-H)。ESI-MS,m/z:288.0847[M+Na]+。
5-甲酰基-1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚 淡黄色粉末,产率82%,m.p.91~92℃。1H NMR(CDCl3,400MHz),δ:9.78(s,1H,-CHO),7.41(d,J=8.2Hz,1H,Ar-H),6.80(d,J=8.2Hz,2H,Ar-H),4.67(s,2H,-CH2-),4.29(s,4H,2×-CH2-),3.81(s,3H,-CH3),3.79(s,6H,2×-CH3)。IR(KBr),ν,cm-13078.89(ν=C-H);1747.87,1681.41(νC=O);1600.55,1519.89(νC=C);1212.84,1168.57(νC-O);869.87,801.79,760.94(δ=C-H)。ESI-MS,m/z:376.1000[M+Na]+。
6-甲酰基-1-O-3-N,N-三乙酸甲酯基-3-氨基苯酚 白色粉末,产率86%,m.p.103~104℃。1H NMR(CDCl3,400MHz),δ:10.31(s,1H,-CHO),7.77(d,J=8.8Hz,1H,Ar-H),6.28(d,J=8.8Hz,1H,Ar-H),5.92(d,J=2.0Hz,1H,Ar-H),4.71(s,2H,-CH2-),4.18(s,4H,2×-CH2-),3.83(s,3H,-CH3),3.79(s,6H,2×-CH3)。IR(KBr),ν,cm-1:2961.48,2855.48(νC-H);1735.75(νC=O);1602.36,1522.61(νC=C);1205.76(νC-O);812.40,735.56(δ=C-H)。ESI-MS,m/z:376.0998[M+Na]+。1.2.3探针S1~S3的合成 将化合物II(0.27g,1mmol)、邻苯二胺(0.11g,1mmol)溶于20mL乙醇中,80℃下反应6h。待反应结束、冷却、真空旋干溶剂,柱分离,V乙酸乙酯∶V石油醚=2∶1为洗脱剂,得到4-苯并咪唑基-N,N-二乙酸甲酯基苯胺(探针S1)。
5-苯并咪唑基-1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚(探针S2)、6-苯并咪唑基-1-O-3-N,N-三乙酸甲酯基-3-氨基苯酚(探针S3),合成方法类似于探针S1,反应物投入量为5-甲酰基-1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚/6-甲酰基-1-O-3-N,N-三乙酸甲酯基-3-氨基苯酚(0.35g,1mmol)。
4-苯并咪唑基-N,N-二乙酸甲酯基苯胺(探针S1) 白色粉末,0.25g,产率71%,m.p.202~204℃。1H NMR(CD3OD,400MHz),δ:7.86(d,J=8.6Hz,2H,Ar-H),7.48(dd,J=5.7,3.1Hz,2H,Ar-H),7.13(dd,J=5.8,3.0Hz,2H,Ar-H),6.61(d,J=8.7Hz,2H,Ar-H),4.13(s,4H,2×-CH2-),3.70(s,6H,2×-CH3),3.27(s,1H,-NH-)。IR(KBr),ν,cm-1:3599.68(νN-H);1740.71(νC=O);1614.33,1504.57,1446.39(νC=C);1207.37(νC-O);836.18(δ=C-H)。ESI-MS,m/z:354.1445[M+H]+。
5-苯并咪唑基-1-O-2-N,N-三乙酸甲酯基-2-氨基苯酚(探针S2)红色油状物,产率72%。1H NMR(CD3OD,400MHz),δ:7.61~7.53(m,4H,Ar-H),7.21(s,2H,Ar-H),6.88(d,1H,J=8.0Hz,Ar-H),4.87(s,2H,-CH2-),4.25(s,4H,2×-CH2-),3.78(s,3H,-CH3),3.73(s,6H,2×-CH3),3.29(s,1H,-NH-)。IR(KBr),ν,cm-1:3445.35(νN-H);1745.70(νC=O);1611.25,1509.17(νC=C);1200.25(νC-O);881.69,811.55(δ=C-H)。ESI-MS,m/z:442.1605[M+H]+。
6-苯并咪唑基-1-O-3-N,N-三乙酸甲酯基-3-氨基苯酚(探针S3)黄色粉末,产率71%,m.p.173~174℃。1H NMR(CD3OD,400MHz),δ:7.88(s,2H,Ar-H),7.51(d,J=8.8Hz,2H,Ar-H),7.23(t,J=7.6Hz,2H,Ar-H),6.36(d,J=8.6Hz,1H,Ar-H),4.82(s,1H,-NH-),4.22(s,2H,-CH2-),3.68(s,4H,2×-CH2-),3.22(s,3H,-CH3),2.76(s,6H,2×-CH3)。IR(KBr),ν,cm-1:3333.04(νN-H);1741.61(νHC=O);1666.41,1615.33(νOC=O);1571.80,1497.46,1443.78(νC=C);1208.96(νC-O);852.76,813.78(δ=C-H)。ESI-MS,m/z:442.1606[M+H]+。
1.2.4 探针T1~T3的合成
直接合成得到的荧光探针S1~S3,其多羧酸受体部分为乙酸甲酯,由于酯水溶性有限,致使S1~S3在水系离子识别实验中应用受限,需将乙酸甲酯形探针S1~S3水解为其羧酸盐形式T1~T3。
将S1(0.0353g,0.1mmol)、CsOH·H2O(0.1679g,1mmol)溶解于10mL乙醇中,回流反应12h。待反应结束、冷却、真空旋干溶剂,得到探针T1。T2/T3的合成方法类似,反应物用量为S2/S3(0.0441g,0.1mmol)。
1.3 结构表征
由探针S1~S3的1H NMR、IR与MS等表征数据可知,探针结构正确,符合实验预期设计,可以进行进一步的光学性质研究。
2 结果与讨论
2.1 探针的荧光激发与发射光谱
进行200~500nm波段探针S1~S3的光谱扫描,得到其最大荧光激发与发射波长为S1:λex,max=325nm,λem,max=380nm;S2:λex,max=329nm,λem,max=390nm;S3:λex,max=333nm,λem,max=379nm,斯托克位移分别为55、61、46nm。相较于探针S1结构,S2/S3受体部分中,邻位/间位羟基的引入与羟基氢的后续修饰,致使S2/S3吸收、发射谱峰均表现红移。取代基改变与探针分子的荧光光谱调控,对于未来工作中进行荧光探针结构设计、具有一定的指导意义。
2.2 探针对金属离子的选择性
设计以一价碱金属(Na+)、二价碱土金属(Mg2+、Ca2+、Ba2+),以及过渡金属(Fe3+、Cu2+、Zn2+、Cd2+、Cr3+、Hg2+、Ag+)及Sn2+、Al3+等14种常见金属离子,考察T1~T3的金属离子选择性。向1号比色管中仅加入探针,向2~14号比色管中,分别加入Tris-HCl、探针与各金属离子(图3d,横坐标1-14:T2、Ag+、Al3+、Ba2+、Ca2+、Cr3+、Cu2+、Fe3+、Hg2+、Mg2+、Na+、Sn2+、Zn2+),使探针与金属离子的终浓度均为1.0×10-5mol·L-1,进行350~550nm波段光谱扫描,得到图3。
由图3可知,图3(a)各荧光谱线均重合在一起,说明T1对金属离子均无响应;探针T2对Zn2+、Cu2+/Hg2+呈现选择性增强、减弱响应,其它金属离子则未引起探针T2荧光强度的明显变化;上述各金属离子与T3混合时,T3荧光信号呈现整体猝灭趋势。综合离子选择实验结果,可知探针T1、T2、T3识别基团中两个识别位点、邻位3个识别位点与间位3个识别位点的结构差异,影响了识别位点所形成的离子包合空腔尺寸,表现为离子选择性的显著差别。T2的N、N、O所连接的3个乙酸根柔性链能够形成合适的包合空腔,实现对Zn2+/Cu2+/Hg2+离子的选择性识别,结合探针分子的电子效应变化,将能够进一步分析和解释T2进行离子识别的作用机制。
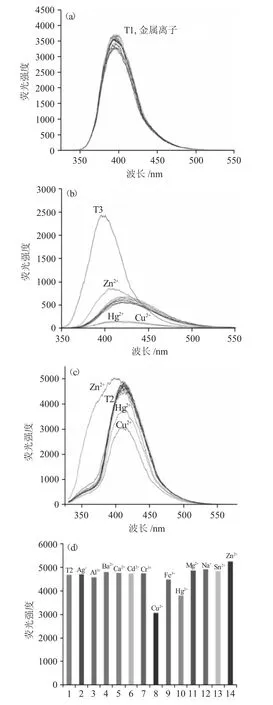
图3 探针(a)T1、(b)T3与(c)、(d)T2的离子选择性Fig.3 Selectivity of probes(a)T1,(b)T3 and(c),(d)T2 towards various metal ions
2.3 Zn2+/Cu2+对探针T2的荧光滴定曲线
将浓度依次递增的Zn2+/Cu2+溶液分别加入探针T2中,使T2终浓度为1.0×10-5mol·L-1、Zn2+/Cu2+终浓度为0~1000μmol·L-1,进行350~550nm波段T2-Zn2+与T2-Cu2+的光谱扫描,结果见图4。
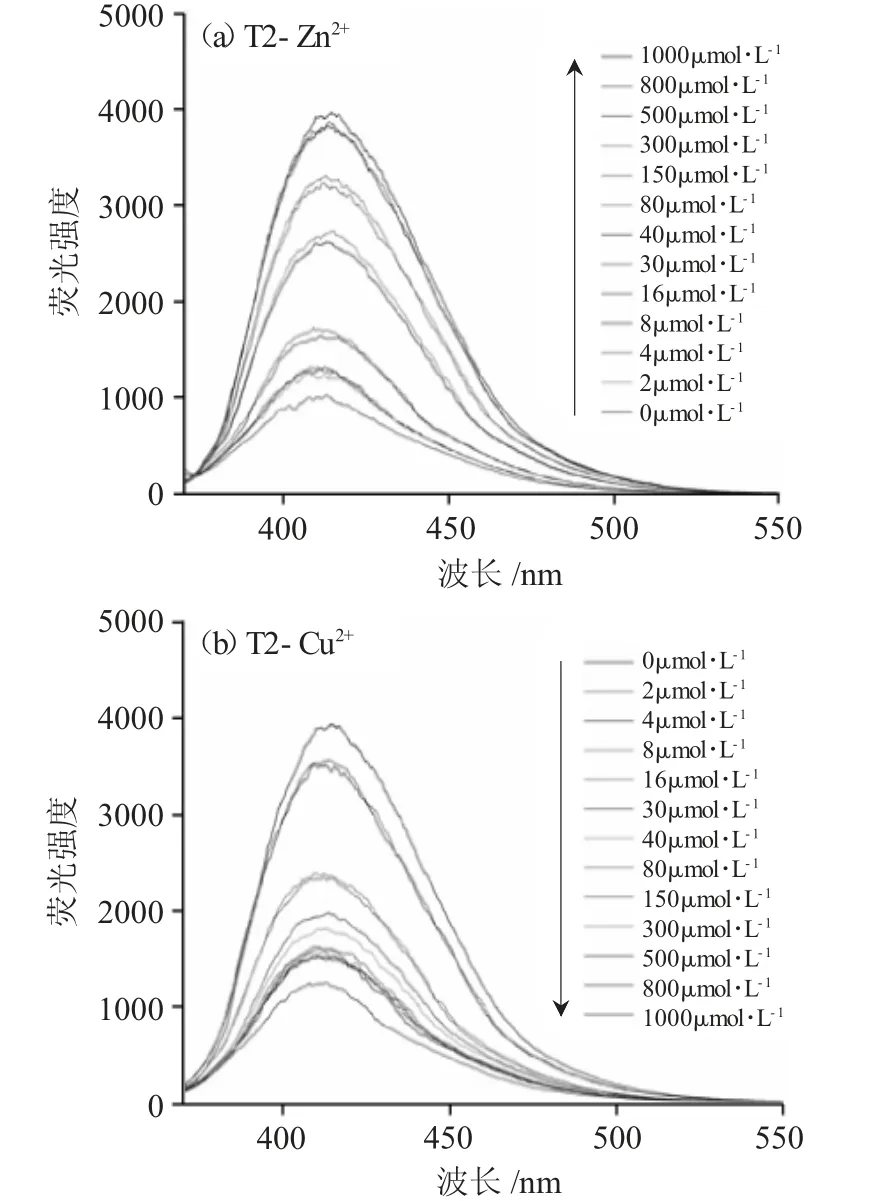
图4 (a)T2-Zn2+与(b)T2-Cu2+的荧光滴定曲线Fig.4 Fluorescence titration curves of(a)T2-Zn2+and(b)T2-Cu2+
由图4可知,Zn2+/Cu2+浓度递增时,T2荧光强度随Zn2+浓度升高而增强,随Cu2+浓度升高而减小。对T2荧光强度F(T2-Zn2+/Cu2+在390nm处的荧光强度峰值)与Zn2+/Cu2+浓度进行相关性分析[11],得到荧光强度F(y)与[Zn2+]/[Cu2+](x)的线性方程,分别为T2-Zn2+(0~40μmol·L-1):y=40.443x+1011.9(R2=0.9958),T2-Cu2+(0~40μmol·L-1):y=-60.67x+3659.3(R2=0.9928)。当Zn2+/Cu2+浓度处于0~40μmol·L-1范围时,探针荧光强度与[Zn2+]/[Cu2+]均呈现准确的定量关系,初步满足浓度数量级为μmol·L-1的生理Zn2+/Cu2+检测。
2.4 探针T2与Zn2+/Cu2+的络合比
进行10mL比色管编号,保持1#~11#管中T2与Zn2+的总浓度为1.0×10-5mol·L-1,使Zn2+摩尔分数依次递增,分别为0、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%,进行荧光强度与相应离子摩尔分数的分析,得到图5(a)所示的Job's曲线。
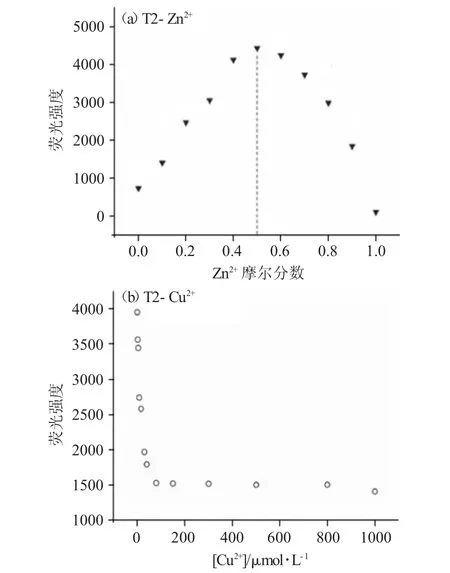
图5 (a)T2-Zn2+与(b)T2-Cu2+的络合比Fig.5 Complexation stoichiometry of(a)T2-Zn2+and(b)T2-Cu2+
图5(a)T2-Zn2+体系荧光强度最高点所对应的Zn2+摩尔分数为0.5,即代表了T2与Zn2+的最优结合比例,说明探针T2与Zn2+的定量结合比例是1∶1。
对比图5(b)T2-Cu2+荧光猝灭型响应,当Cu2+与T2浓度达到一致、两者1∶1结合时,图5(b)出现拐点。此后,T2荧光几乎完全猝灭,T2荧光不再随Cu2+加入而改变。说明T2与Cu2+的络合比为1∶1。
2.5 探针识别机制
探针T2对Zn2+、Cu2+/Hg2+表现差别性荧光响应,可能主要基于以下因素:(1)ICT(intramolecular charge transfer,分子内电荷转移)识别机制[12,13],T2分子内氮原子的孤对电子作为电子给体,不饱和环作为电子受体,构成了探针T2的ICT路径,使其呈现荧光。当T2通过弱配位作用识别Zn2+/Cu2+/Hg2+时,T2的氮原子与羧基氧原子则需提供其孤对电子,与Zn2+/Cu2+/Hg2+的空轨道形成配位键,供电子能力被大幅削弱,T2的ICT过程也被完全阻断或大幅削弱,T2-Cu2+/Hg2+体系因此荧光强度降低、甚至猝灭,出现T2对Cu2+/Hg2+的猝灭型荧光响应。(2)过渡金属离子通过自旋-轨道耦合、电子或能量转移使荧光基团荧光猝灭[14],可导致荧光猝灭型响应。但由Irving-Williams规则可知,Zn2+配位稳定性明显弱于Cu2+、Hg2+,且极化能力与变形性较弱、空轨道较少、还原性远大于Cu和Hg,导致Zn2+作为电子受体的能力较弱、较难接受孤对电子配位,致使探针-Zn2+呈现与探针-Cu2+/Hg2+相反的识别方式。
离子识别实验显示,T1对金属离子均无响应;T3荧光信号因金属离子的加入呈现整体猝灭趋势,对金属离子亦无响应;而探针T2分别对Zn2+表现特异性荧光增强,对Cu2+/Hg2+表现荧光猝灭型响应。T1~T3在识别性能上的差异性与其识别位点设计具有直接关系,其识别基团结合Zn2+/Cu2+/Hg2+的可能识别机制见图6。
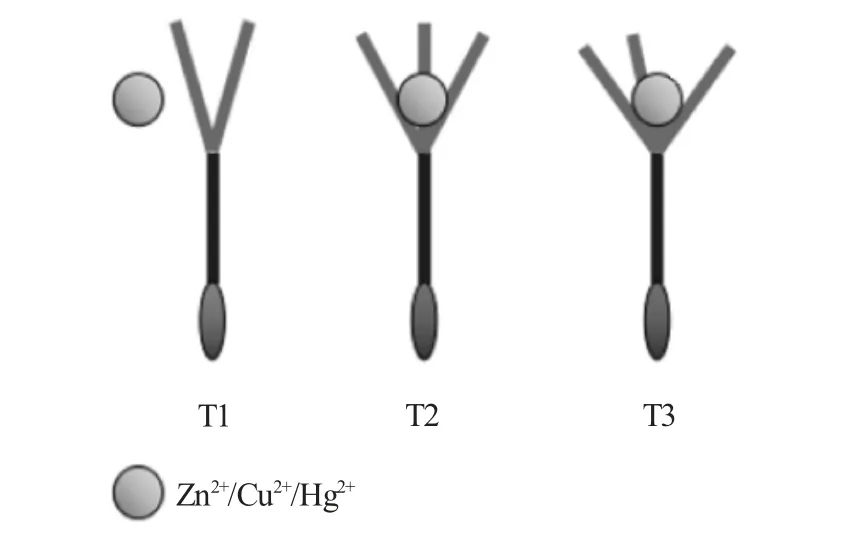
图6 探针T1~T3的识别位点与识别性能差异Fig.6 Differences in recognition sites and recognition properties of probes T1~T3
由图6可知,T1~T3以包合空腔[15,16]结合Zn2+/Cu2+/Hg2+,T1的两条羧酸柔性链仅构成两个识别位点,无法有效包合Zn2+/Cu2+/Hg2+。T3分子中处于间位的3条柔性羧酸链,形成的包合空隙过大,无法稳定包合,受到电子或能量转移等因素影响时,使其表现整体荧光猝灭、无识别响应[14]。而邻位三位点的探针T2,邻位3条羧酸链形成了尺寸合适的包合空腔,能够容纳Zn2+/Cu2+/Hg2+,且受到Zn2+/Cu2+/Hg2+电子效应、配位能力差异性的影响,进一步对Zn2+、Cu2+/Hg2+表现荧光增强、荧光猝灭的差别性响应。
3 结论
经识别位点的差别性设计,构筑得到二位点探针T1、邻位三位点探针T2与间位三位点探针T3,因T2结构中处于邻位的3条羧酸柔性链所形成的包合空腔,T2与Zn2+、Cu2+、Hg2+表现特征响应与定量结合,能够初步满足浓度数量级为μmol·L-1的生理Zn2+、Cu2+、Hg2+检测。结合荧光、紫外等光谱学手段与识别位点的差别性设计,初步阐明了探针T2对Zn2+、Cu2+/Hg2+的识别机制差异,为探针结构优化与识别性能筛选等研究工作提供了参考。
