石灰在垃圾焚烧烟气中的失活热力学研究*
2022-09-15吴泳霖何永美幸家艳
姜 琦,吴泳霖,何永美,幸家艳,蒋 明
(云南农业大学 资源与环境学院,云南 昆明 650201)
随着社会经济的发展,生活垃圾的产出与日俱增,处理方法主要有焚烧、填埋、堆肥和回收利用等,其中焚烧产生的高温烟气脱除有害气态污染物后可以作为热能进行回收利用,因此,生活垃圾处理的主要方式为焚烧法[1]。垃圾焚烧烟气中气体成分复杂,由于当前生活垃圾中存在大量的含氯塑料和厨余垃圾,垃圾焚烧烟气中气态污染物主要以氯化氢(HCl)为主[2],此外还存在SOx、NOx、CO2、O2和其他有机气态污染物,其中SOx以SO2为主,NOx以NO为主[3,4]。
垃圾焚烧烟气中的HCl会腐蚀垃圾焚烧设备,不仅对焚烧设备的寿命造成影响,还会增加维修费用。此外,HCl的存在还会促进烟气中氯代有机污染物的产生[5],因此,在对垃圾焚烧烟气进行回收利用之前需要对HCl进行脱除。当前针对垃圾焚烧烟气中HCl的脱除净化方法主要有干法、半干法和湿法,现阶段关于这3种方法脱除材料的研究,主要以钙基材料为主,以CaO为主要成分的石灰因其来源广、价格低成为众多学者的研究对象[6,7]。
在垃圾焚烧烟气中,SO2、NO、CO2和O2的存在会对CaO的活性产生影响,因此,有必要从化学反应热力学的角度对CaO的失活机理进行研究。在现阶段研究中,干法脱除垃圾焚烧烟气温度通常在100~1000℃[8,9],故本文通过采用HSC Chemistry化学热力学软件,计算分析了在100~1000℃的温度范围内,CaO分别与垃圾焚烧烟气的主要单一组分(SO2、NOx、CO2和O2)共存时发生化学反应的可能性,并讨论了可能生成的失活产物。
1 热力学计算基础
根据纯物质的热化学属性和物理属性及吉布斯自由能(ΔG)最小原理,使用HSC Chemistry 6.0计算化学反应达到化学平衡时在热力学上是否能够自发。在计算前,分析查询反应中推测生成的化学产物是否现实存在;在计算时,默认压力为常压,100~1000℃的温度范围,100℃的升温步长。
2 结果与讨论
2.1 CaO-HCl体系
在CaO与HCl单独存在的情况下,有可能进行的非均相反应见式(1)~(4)。
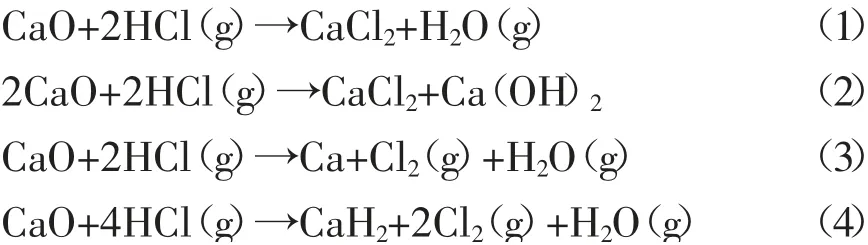
图1为使用HSC Chemistry热力学数据库软件计算得出的反应式(1)~(4)吉布斯自由能(ΔG)与温度(T)的关系。
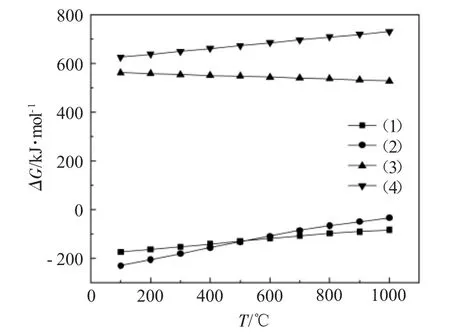
图1 式(1)~(4)的吉布斯自由能与温度的关系Fig.1 Relationship between Gibbs energy and temperature of Eq.(1)~(4)
由图1可知,在100~1000℃的温度范围内,化学反应(1)、(2)的ΔG小于零,化学反应(3)、(4)的ΔG大于零,说明这些化学反应式中仅有反应(1)、(2)可自发向右进行,生成的固态产物有CaCl2和Ca(OH)2。
2.2 CaO-HCl-SO2体系
SO2存在时,有可能进行的反应见式(5)~(11)。
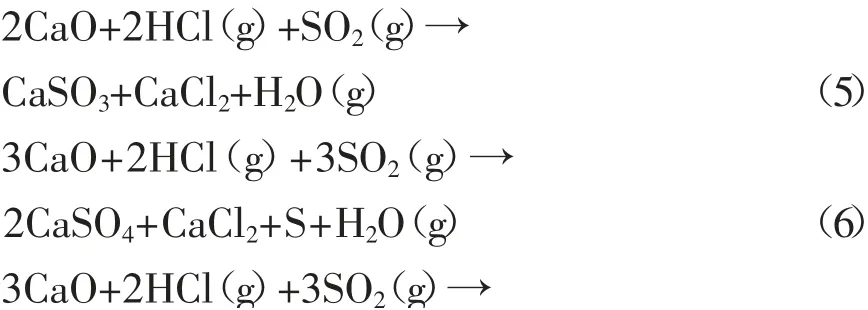
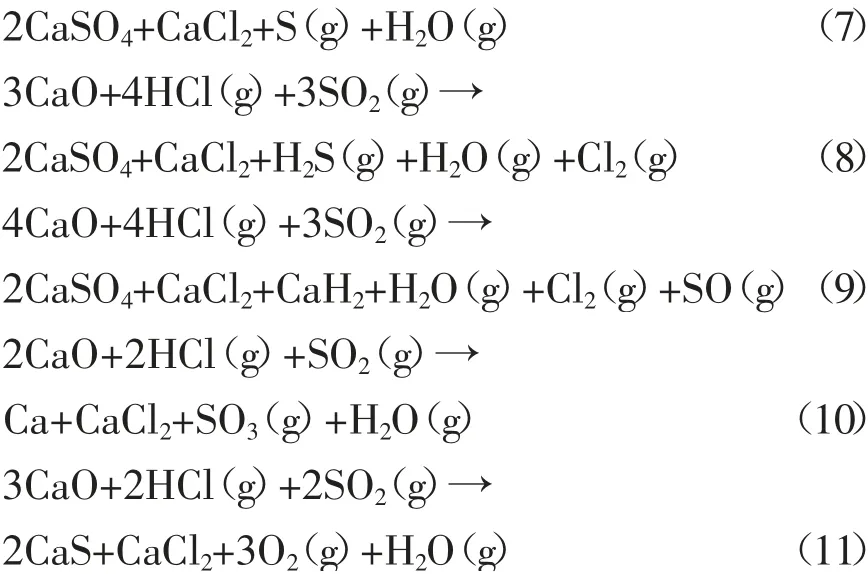
图2为式(5)~(11)的吉布斯自由能与温度的关系。
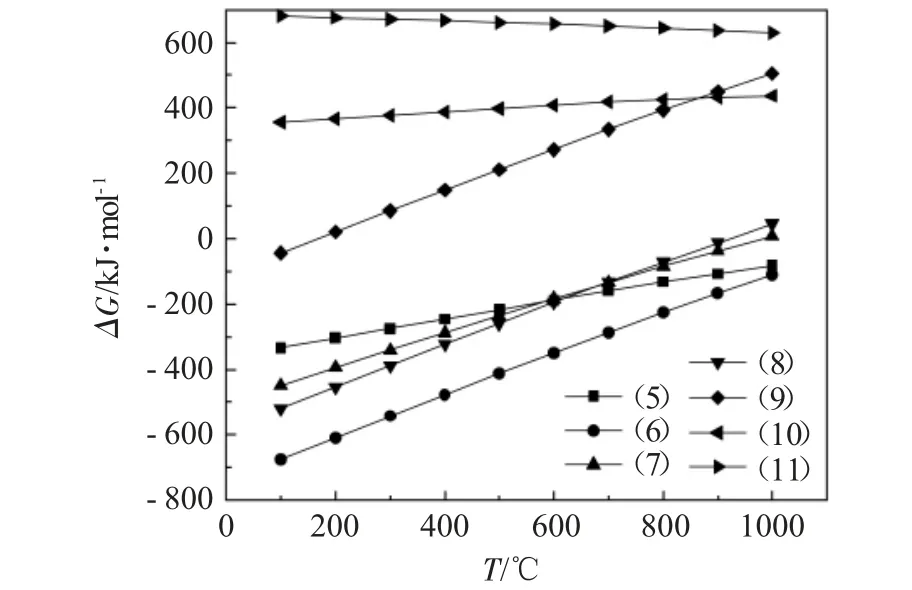
图2 式(5)~(11)的吉布斯自由能与温度的关系Fig.2 Relationship between Gibbs energy and temperature of Eq.(5)~(11)
由图2可知,反应(10)、(11)在100~1000℃温度范围内的ΔG均大于零,说明这些反应无法自发进行,其余所有反应在100~1000℃温度范围内ΔG均为负值,说明这些反应在石灰净化垃圾焚烧烟气过程中,均存在可自发进行的温度区间,此外,这些可自发进行反应的ΔG均随温度的升高而增加,当温度达到200℃时,反应(9)的ΔG大于零,此时该反应无法自发进行,当温度达到1000℃时,反应(7)、(8)无法自发进行。
在该体系中生成的固态产物有CaCl2、CaSO3、CaH2、CaSO4和单质S。比较可自发进行的5个化学反应的ΔG能绝对值可以发现,反应(6)更容易进行,是该体系中CaO失活的主导反应。
2.3 CaO-HCl-NO体系
当气体体系中存在NO时,有可能进行的反应见式(12)~(18)。
图3为式(12)~(18)的吉布斯自由能与温度的关系。
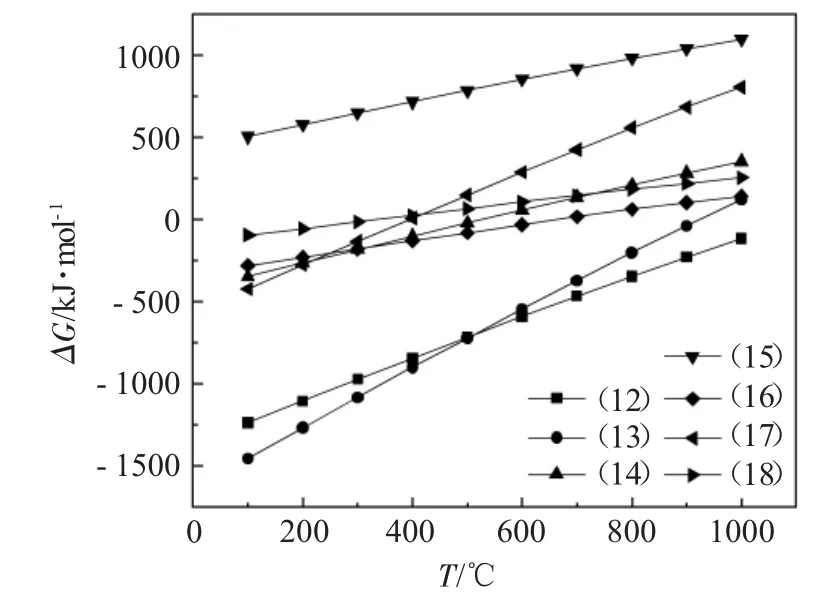
图3 式(12)~(18)的吉布斯自由能与温度的关系Fig.3 Relationship between Gibbs energy and temperature of Eq.(12)~(18)
由图3可知,在规定温度范围内仅反应(15)的ΔG大于零,且仅反应(12)的ΔG小于零,说明在100~1000℃的温度范围内反应(15)无法自发进行,反应(12)可以自发向右进行。反应式(13)、(14)、(16)、(17)、(18)的ΔG分别于1000、600、700、400、400℃达到正值,将无法继续自发向右进行。
此外,当有NO加入时,温度升高,所有可自发进行的反应的ΔG均呈上升趋势,对CaO的失活起到了抑制作用。反应(12)、(13)为该体系下的主导反应,主要生成的固态失活产物为Ca(NO3)2和CaCl2。
2.4 CaO-HCl-CO2体系
CO2存在时,有可能进行的化学反应见式(19)~(21)。
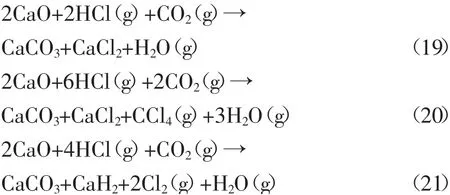
图4为式(19)~(21)的吉布斯自由能与温度的关系。
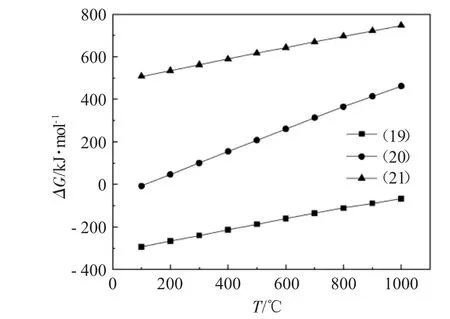
图4 式(19)~(21)的吉布斯自由能与温度的关系Fig.4 Relationship between Gibbs energy and temperature of Eq.(19)~(21)
由图4可知,反应式(20)的ΔG仅在100℃时小于零,式(19)的ΔG在100~1000℃的温度范围内均小于零,说明在该体系下存在反应(19)、(20)可自发向右进行,但温度超过100℃时,仅式(19)可自发反应。因此,在100~1000℃的温度范围内生成的固态失活产物以CaCO3和CaCl2为主。
2.5 CaO-HCl-O2体系
当气体体系中存在O2时,有可能进行的反应见式(22)~(25)。
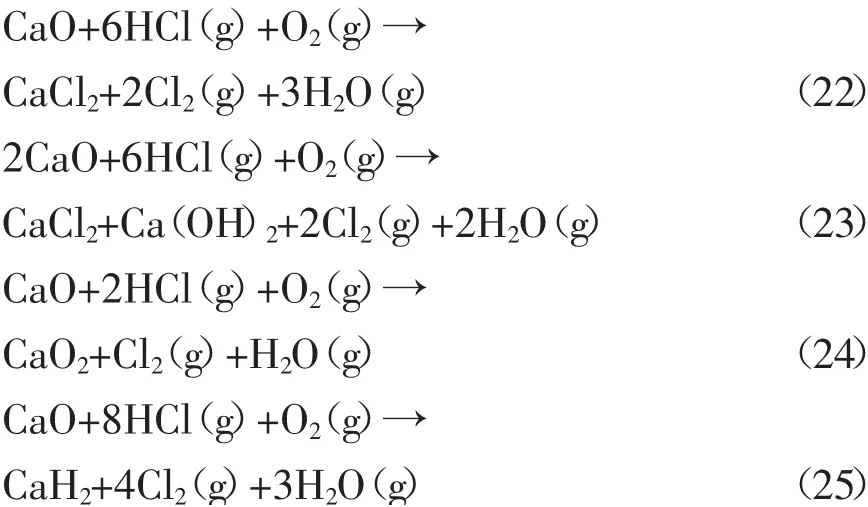
图5为式(22)~(25)的吉布斯自由能与温度的关系。
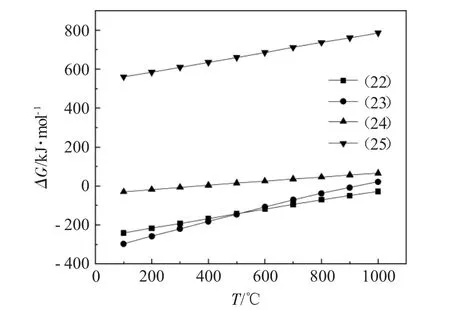
图5 式(22)~(25)的吉布斯自由能与温度的关系Fig.5 Relationship between Gibbs energy and temperature of Eq.(22)~(25)
由图5可知,除式(25)的ΔG大于零外,其余所有反应在100~1000℃温度范围内均存在可自发进行的温度区间,这些反应的ΔG均随温度的升高而增加,当温度达到400℃时,反应(24)的ΔG大于零,此时该反应无法自发进行,当温度达到1000℃时,反应(23)无法自发进行。因此,温度的升高不利于这些反应的自发进行,生成的固态产物为CaCl2、CaO2和Ca(OH)2。
比较ΔG小于0的3个化学反应的ΔG绝对值可以发现,反应式(22)、(23)是该体系中CaO失活的主导反应,因此,该体系下固态失活产物主要为CaCl2和Ca(OH)2。
3 化学反应平衡分析
化学反应平衡常数是用来表示化学反应进行的程度,其值的大小可以用来判断一个反应自发进行的程度[10]。当一个化学反应达到动态平衡时,生成物的浓度越大,反应物剩余的浓度越小,则表示一个化学反应的K值越大,表明该反应越容易自发进行,其热力学竞争力越强,反之亦然。图6为根据上文中讨论的5个体系的热力学研究中可完全自发或部分自发反应(1~2、5~9、12~14、16~20、22~24)的18个化学反应方程式的化学平衡常数随温度的变化趋势所绘制的点线图。
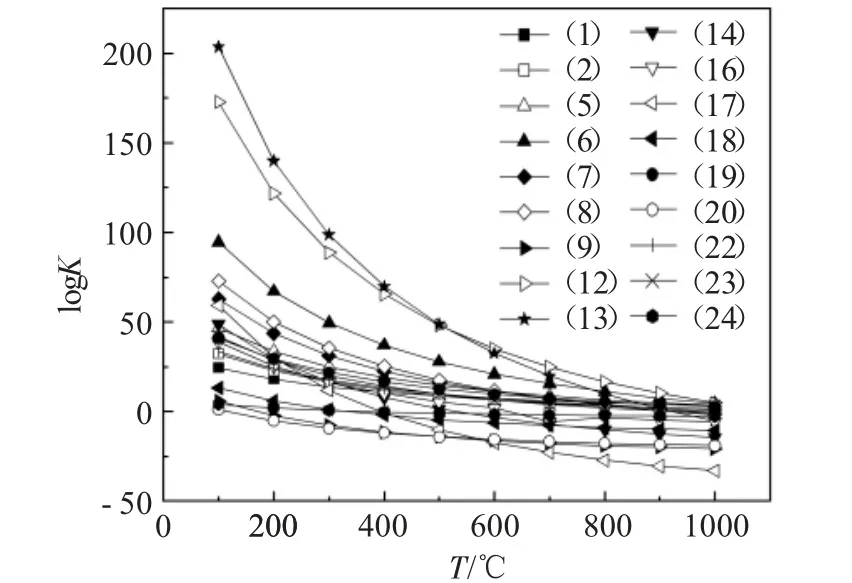
图6 化学反应平衡常数与温度的关系Fig.6 Relationship between equilibrium constant of chemical reaction and temperature
在规定温度范围内,logK值小于零时,表示反应将无法自发进行。由图6可知,在100~1000℃温度范围内,可自发进行的所有反应的logK均随温度升高而降低,均属于放热反应。其中反应式(13)的logK值最大,表明该反应的热力学竞争力最强,反应式(12)、(6)次之,其他化学反应的热力学竞争力相对来说比较弱。因此,CaO在垃圾焚烧烟气中的失活作用主要是生成了Ca(NO3)2、CaCl2、CaSO4等固态失活产物。此外,当温度超过400℃后,logK的下降趋势变缓,因此,石灰在净化垃圾焚烧烟气中HCl的适宜温度应在400℃以上。
4 结论
(1)垃圾焚烧烟气对石灰(CaO)的失活作用与原料气的组分密切相关,SO2、NO、CO2和O2均会使石灰失活,能够生成的固态失活产物有CaCl2、Ca(OH)2、CaCO3、CaH2、Ca(NO3)2、CaO2、CaSO3和CaSO4。
(2)由于在高温下,部分失活产物可重新分解为CaO,如Ca(OH)2、CaCO3、Ca(NO3)2和CaO2,除此之外的CaCl2、CaH2、CaSO3和CaSO4为永久失活产物,因此,SO2对石灰失活的影响最大,对垃圾焚烧烟气中SO2的提前脱除尤为重要。
(3)各体系中可自发向右进行的反应均为放热反应,且根据化学反应平衡常数与温度的关系,温度升高会降低各失活反应的热力学竞争力,并可使部分失活产物重新分解为CaO,因此,可以将垃圾焚烧烟气处理温度增加至400℃以上,以减少对石灰的失活作用。
