液相色谱-四极杆-静电场轨道阱高分辨质谱法测定牛奶中8种氨基糖苷类抗生素残留
2022-09-15刘善菁宋慧敏陆桂萍刘雨昕
刘善菁,宋慧敏,曲 斌,陆桂萍,刘雨昕
(江苏省兽药饲料质量检验所,南京 210036)
氨基糖苷类抗生素(Aminoglycosides,AGs)是以碱性环己多元醇为苷元,与氨基糖缩合而成的苷。自1944年科学家从链霉菌中分离出第一个氨基糖苷类药物链霉素开始,20年间,其他氨基糖苷类药物先后从链霉菌(新霉素)和绛红小单孢菌(庆大霉素)中分离出来并逐步开发出了半合成衍生物,包括阿米卡星、卡那霉素等[1]。AGs具有较强的耳毒性和肾毒性,其中链霉素的耳毒性最大,新霉素的肾毒性最大[1]。因其毒性作用,AGs一般被用来治疗严重感染。新霉素和链霉素制剂可用于治疗牛犊细菌性肠炎、牛乳腺炎等[1-2]。
基于AGs显著的毒副作用,我国在GB 31650-2019[3]中对链霉素、双氢链霉素、卡那霉素、庆大霉素、安普霉素以及大观霉素6种AGs的限量作出了明确规定,牛奶中AGs最大残留限量在150~1500 μg/kg之间。AGs的测定一直是兽药残留分析的难点之一。由于AGs自身无发色基团,无紫外吸收,需要进行衍生化反应才能通过液相色谱法测定。因此,前处理更加简便的液相色谱-串联质谱法在AGs残留分析中应用非常普遍。
AGs分子结构中存在多个羟基与氨糖基,碱性和极性较强,在普通C18柱上几乎没有保留。如果想通过反相色谱法分析AGs,只能引入离子对试剂如七氟丁酸[4-5]或者衍生化试剂如异氰酸苯酯[6]。这些离子对试剂的引入会导致质谱检测器污染,引发离子抑制、灵敏度降低、峰形变差等诸多问题。因此,适合分析强极性、强亲水性化合物且无需使用离子对试剂的亲水作用色谱(HILIC)法得到了广泛应用。Federica L等[7-9]应用HILIC方法分别测定了鸡肉、牛奶、猪肉与猪肾中的AGs。但是HILIC色谱法也有一定的局限性,需要在流动相中引入较高浓度的缓冲盐(通常为甲酸铵或乙酸铵)以增强保留,而高盐浓度的流动相同样会影响检测器灵敏度[10]。
本文选用的Obelisc R色谱柱是一种采用了新型“液态分离池技术(Liquid Separation Cell technology, LiSC) ”的混合型离子交换色谱柱。据文献报道[8,11-12],应用Obelisc R色谱柱分离氨基糖苷类药物,可以在不使用缓冲盐流动相的情况下获得满意的分离度和灵敏度。与此同时,本文采用分子印迹固相萃取小柱对氨基糖苷类化合物进行特异性保留与净化。本文研究建立了同时测定牛奶中8种氨基糖苷类药物的液相色谱-四极杆-静电场轨道阱高分辨质谱方法,在避免离子对试剂、缓冲盐流动相对质谱损伤的基础上,有效提高了方法灵敏度,提供了一种快速、灵敏测定牛奶中AGs的新方案。
1 材料与方法
1.1 仪器和设备 Thermo Q-ExtractiveTM液相色谱-四极杆-静电场轨道阱高分辨质谱联用仪、Heraeus Multifuge X1R离心机,美国ThermoFisher公司;MS3 basic 涡旋仪、KS501 振荡器,德国IKA公司;MV5全自动氮吹仪,美国LabTech公司;LINK BLOW 氮气发生器,金浪科技有限公司。
1.2 试剂与材料 乙腈(色谱纯),德国Merck公司;乙酸(色谱纯)、乙酸铵(色谱纯),美国Anaqua Chemicals Supply公司;三氯乙酸(分析纯)、二水合乙二胺四乙酸二钠(Na2EDTA·2H2O,分析纯)、氢氧化钠(分析纯)购自南京化学试剂有限公司;所用水为超纯水。SupelMIP Aminoglycosides分子印迹固相萃取柱,50mg/3mL,美国Supelco公司;Oasis WCX固相萃取净化柱,60mg/3mL, 美国Waters公司;Bond Elut CBA, 100mg/3mL,美国Agilent公司;聚丙烯离心管,美国ThermoFisher公司;聚丙烯进样瓶,美国Agilent公司。
标准品纯度及来源:硫酸链霉素(Streptomycin sulfate, STR)90.3%;硫酸双氢链霉素(Dihydrostreptomycin sesquisulfate, DHSTR)93.2%;庆大霉素(Gentamicin, GEN)94.4%,含GEN C1 29.1 %、GEN C1a 21.3 %、GEN C2 49.6 %;硫酸安普霉素(Apramycin Sulfate, APR)81.5%;大观霉素(spectinomycin,SPC)98.0%;硫酸卡那霉素(Kanamycin, KANA)90.1%;阿米卡星(Amikacin, AMK)99.1%;硫酸新霉素(Neomycin sulfate, NEO)86.5%;标准品均购于Dr. Ehrenstorfer公司。
1.3 溶液的配制
1.3.1 标准溶液的配制 精密称取各氨基糖苷类标准品约10 mg,分别于100 mL量瓶中,用水溶解并定容,制成100 μg/mL的标准储备液,转移至塑料瓶中,于4 ℃冷藏保存。精密量取各氨基糖苷储备液1 mL分别于100 mL量瓶中,用水稀释成1 μg/mL的标准工作液,转移至塑料瓶中,于4 ℃冷藏保存。
1.3.2 氨基糖苷类提取液(5%三氯乙酸,10 mmol/L乙酸铵,0.4 mmol/L EDTA) 取三氯乙酸50 g,乙酸铵0.771 g,Na2EDTA·2H2O 0.149 g,用水溶解并稀释至1000 mL。
1.3.3 5 mol/L氢氧化钠溶液 取氢氧化钠20 g,用水溶解并稀释至100 mL。
1.3.4 氨基糖苷类洗脱液(100 mmol/L乙酸铵,pH3)
取乙酸铵7.708 g,加入800 mL水溶解,用乙酸调节pH至3,用水定容至1000 mL。
1.4 仪器条件
1.4.1 色谱条件 色谱柱为SiELC Obelisc R色谱柱(150 mm×2.1 mm,5 μm,美国SIELC公司)。流动相A为1%甲酸水溶液,流动相B为1%甲酸乙腈溶液,梯度洗脱:0~2 min保持95% B;2~2.5 min线性变化到20% B;2.5~5.5 min保持20% B;5.5~6 min线性变化到95% B;6~10 min保持95% B。流速:0.4 mL/min,柱温:30 ℃,进样量:10 μL。
1.4.2 质谱条件 高能电喷雾离子源(high-electro spray ionization, H-ESI);正离子模式;喷雾电压:4000 V;雾化气:40 L/h;辅助气:15 L/h;离子传输温度:350 ℃;辅助加热温度:400 ℃;检测方式为平行反应监测模式(parallel reaction monitoring, PRM);分辨率:17500 (FMWH) (m/z200);AGC target:5×104;C-trap最大注入时间:50 ms。目标物及其定量子离子的精确质量数、碰撞能量见表1。

表1 氨基糖苷类化合物及其定量子离子信息Tab 1 Qualitative and quantitative imformation of AGs
1.5 样品前处理
1.5.1 样品的提取 称取试料(2±0.02) g于50 mL聚丙烯离心管中,加入10 mL氨基糖苷类提取液,涡旋使之充分混合,振荡提取15 min,4 ℃下10000 r/min离心10 min。将上清液转移至另一离心管中,用5 mol/L氢氧化钠溶液调节pH至7.0±0.5,涡旋混匀,4 ℃下10000 r/min离心5 min,移取全部上清液,备用。
1.5.2 样品的净化 SupelMIP Aminoglycosides分子印迹固相萃取柱依次用3 mL甲醇,3 mL水活化,取1.5.1中备用液上样,控制流速约1 mL/min,用3 mL水淋洗后真空抽干1 min。用2 mL氨基糖苷类洗脱液洗脱,过0.22 μm水相微孔滤膜于聚丙烯进样瓶中,待测。
1.6 基质匹配标准曲线绘制 精密量取适宜浓度的氨基糖苷类标准工作液适量,用1%甲酸水溶液稀释成不同浓度的系列标准工作液(STR为1、2、4、10、20、50 ng/mL;DHSTR、GEN C1、GEN C1a、GEN C2、KANA为0.2、0.5、1、2、5、10 ng/mL;SPC为10、20、40、100、200、500 ng/mL;NEO、AMK、APR为2、5、10、20、50、100 ng/mL),从中各取2.0 mL,分别加入到空白牛奶经提取、净化和吹干后的残余物中,充分溶解,过微孔滤膜,作为系列基质匹配标准溶液上机测定。以特征离子质量色谱峰面积为纵坐标,基质匹配标准溶液浓度为横坐标,绘制标准曲线,并计算回归方程和相关系数。
1.7 方法灵敏度 添加适量浓度的氨基糖苷类混合标准工作液于空白牛奶中,经前处理后测定,观察药物特征离子质量色谱峰信噪比(S/N)和对应药物浓度,以S/N>3作为方法的检测限,S/N>10作为方法的定量限。
1.8 方法准确度及精密度 采用标准添加法,通过向空白牛奶中添加不同浓度(LOQ、2LOQ、10LOQ或LOQ、1/2MRL、MRL、2MRL的氨基糖苷类混合标准工作液进行回收率试验,各浓度进行5个样品平行试验,分别考察3批次,按照1.5项样品前处理方法处理后上机测定,基质匹配标准溶液外标法定量,计算回收率,并用相对标准偏差值(relative standard deviation,RSD)评价批内和批间精密度。
2 结果和分析
2.1 定性分析 本文采用高分辨模式下PRM监测方式,选择一个母离子和一个子离子进行定性和定量分析,获得的高质量精度离子可以有效排除干扰离子的影响,定性定量结果准确可靠。100 ng/mL标准溶液色谱图及对应高分辨质谱图见图1,空白牛奶色谱图及对应高分辨质谱图见图2,空白牛奶添加试样色谱图及对应高分辨质谱图见图3。
根据图1可确定标准溶液中各化合物丰度最大的子离子,并与图3(添加试样)综合考虑,可确定用于定量的子离子:除大观霉素外,其余化合物标液与添加图中丰度最大的子离子完全一致,可以确认为定量离子。大观霉素标液中响应最大的离子依次为333(分子离子峰)、98和207;分子离子峰不适合作为定量离子,因而需从98和207中选择一个,添加图中98响应较小,可能与基质导致的离子抑制有关,而207依然保持较高响应,综合考虑选择了207作为大观霉素定量离子。根据各化合物子离子精确质量数及同位素离子丰度比等信息,仪器自带软件可推导出定量子离子的元素组成(表1);根据元素组成、母离子结构和裂解规律,可以推导出各化合物定量子离子可能的裂解位置(图4)。

表TR:2 μg/kg;DHSTR、GEN C1、GEN C1a、GEN C2、KANA:0.5 μg/kg;SPC:20 μg/kg;NEO、AMK、APR:5 μg/kg
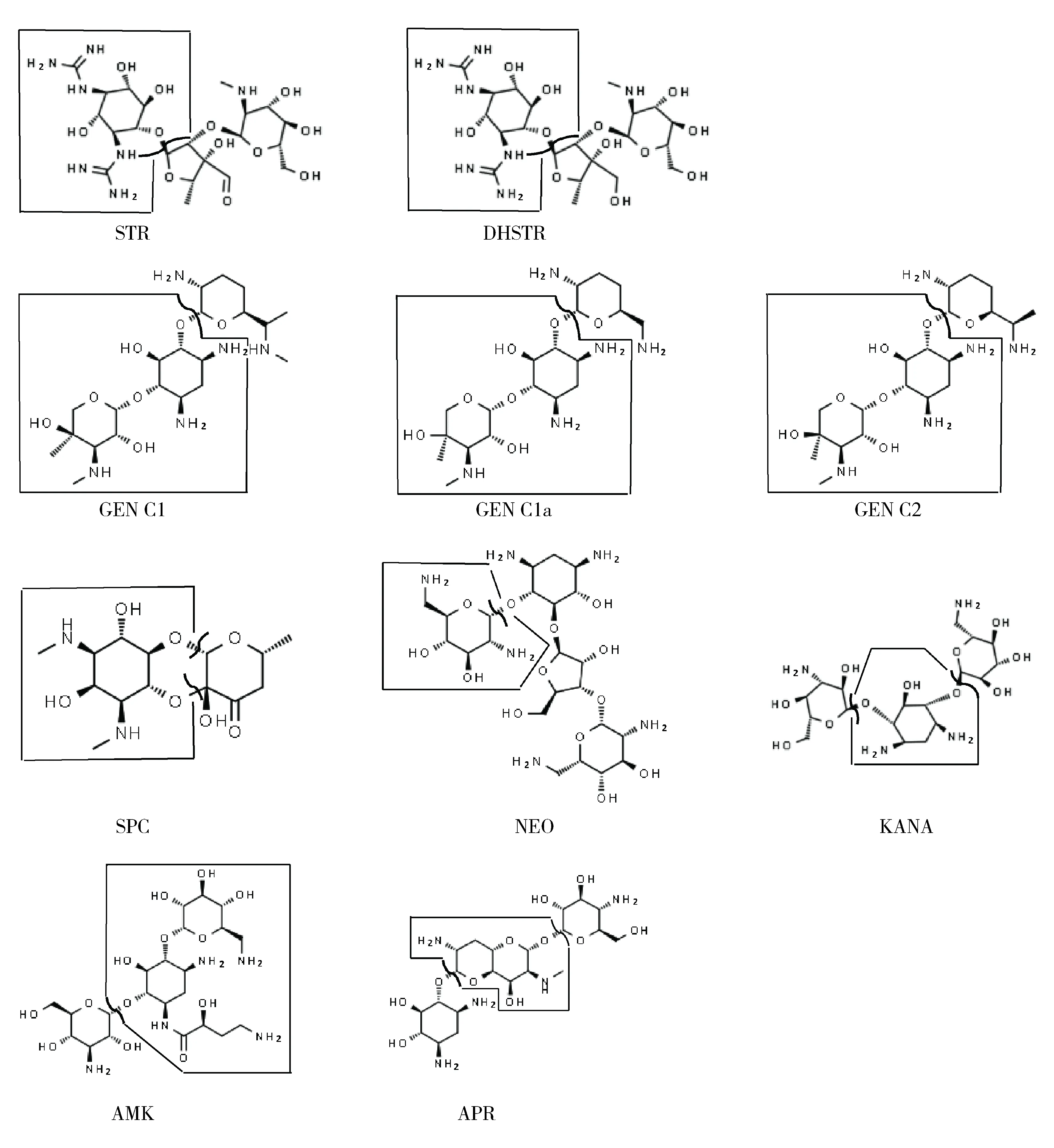
图4 8种氨基糖苷类化合物定量子离子可能断裂位置Fig 4 The most likely fracture positions of eight aminoglycosides quantitative product ion
2.2 基质匹配标准曲线 以氨基糖苷类各化合物的特征离子质量色谱峰面积与其对应的基质匹配标准溶液浓度作图,得到相应的标准曲线,线性范围、线性回归方程及相关系数(R2)见表2。结果表明:链霉素、双氢链霉素、庆大霉素(GEN C1、GEN C1a、GEN C2)、安普霉素、大观霉素、卡那霉素、阿米卡星和新霉素在各自线性范围内,线性关系良好,R2均大于0.990。

表2 空白牛奶中氨基糖苷类药物基质匹配标准曲线、线性范围、相关系数、定量限和检测限Tab 2 Matrix-matched standard curve, limit of quantitative (LOQ) and limit of detection (LOD) of aminoglycosides in milk
2.3 方法灵敏度 按1.5项中所述方法进行处理,当添加浓度STR 2 μg/kg,DHSTR、GEN C1、GEN C1a、GEN C2、KANA 0.5 μg/kg,SPC 20 μg/kg;NEO、AMK、APR 5 μg/kg时,测得各化合物S/N>10;当添加浓度STR 0.5 μg/kg,DHSTR、GEN C1、GEN C1a、GEN C2、KANA 0.2 μg/kg,SPC 5 μg/kg NEO、AMK、APR 2 μg/kg时,测得各化合物S/N>3;牛奶中各氨基糖苷类化合物的定量限和检测限见表2。
2.4 方法的准确度和精密度 在空白牛奶中添加不同浓度的各氨基糖苷类药物的标准工作液(LOQ、2LOQ、10LOQ或LOQ、1/2MRL、MRL、2MRL)进行回收率实验,结果见表3。牛奶中8种氨基糖苷类药物回收率在68.0%~104.6%范围内,批内与批间RSD均不高于11.3%。

表3 空白牛奶中氨基糖苷类药物的添加回收率(n=5)Tab 3 Recoveries of aminoglycosides in milk spiked samples
3 讨论与结论
3.1 提取溶液的选择 AGs与样品基质中的蛋白结合很紧密并且会与金属离子反应形成螯合物,因此AGs提取液中应加入一定量的EDTA以释放出待测物。据报道[8,12-14],AGs提取溶液通常含有2%~10%三氯乙酸、低浓度的EDTA以及乙酸铵或磷酸氢二钾缓冲溶液。本文参考文献[11]提取方法,选择三氯乙酸、0.4 mmol/L EDTA、10 mmol/L乙酸铵溶液作为提取液,并比较了不同浓度的三氯乙酸对提取效果的影响。实验中发现,当三氯乙酸浓度为2%时,离心后的上清液较浑浊,影响后续固相萃取过程;当三氯乙酸浓度提高至5%时,上清液澄清,且提取效率已达峰值,若继续强度,可能会影响后续净化过程,因此最终确定提取液为5%三氯乙酸、0.4 mmol/L EDTA、10 mmol/L乙酸铵溶液。
此外,由于氨基糖苷类药物易被玻璃和滤纸吸附[10],因此整个实验过程中不仅要避免使用玻璃器皿,还需避免过滤操作。
3.2 净化条件的选择 AGs的净化方法与其较强极性和碱性的性质密切相关。文献报道中多选用C18小柱、HLB小柱[11]、离子交换小柱[8,12-14]、分子印迹固相萃取小柱[10]。分子印迹固相萃取小柱是利用分子印迹聚合物特异性锁定目标物,再将目标物洗脱下来从而实现净化与富集。
考虑到C18小柱和HLB小柱净化时通常会引入易对离子源造成污染的离子对试剂七氟丁酸,因此本文选择了2种阳离子交换固相萃取柱Oasis WCX (60mg/3mL, Waters)、Bond Elut CBA(100mg/3mL, Agilent),以及1种分子印迹固相萃取柱SupelMIP Aminoglycosides (50mg/3mL,Supelco),进行了净化效果的比较。具体操作如下:称取空白牛奶3份,按20 μg/kg添加混合标准溶液,按1.5项样品前处理方法处理,分别经3种不同柱净化。由图5可见,分子印迹固相萃取柱对待测物的净化效果最好,回收率最高。当使用WCX小柱净化时,STR、DHSTR回收较高,但GEN和NEO几乎无回收;当使用CBA小柱净化时,各待测物都有一定程度保留但均低于分子印迹固相萃取柱。因此,本文选择了能够特异性保留氨基糖苷类化合物的分子印迹固相萃取柱进行净化。

图5 不同净化方式对分析物响应的影响Fig 5 Purification method effect on response
3.3 洗脱溶液的选择 文献报道中涉及的AGs洗脱溶液通常有3类:含少量七氟丁酸的缓冲溶液;含5%甲酸的甲醇或乙腈溶液;酸性乙酸铵或甲酸铵缓冲溶液(缓冲盐浓度在50~175 mmol/L之间,溶液pH3)。本文比较了5%甲酸乙腈[4,14]和175 mmol/L乙酸铵溶液(pH3)[11]的洗脱效果,结果如图6所示:当乙酸铵溶液作为洗脱液时,各AGs洗脱效率明显更高,说明乙酸铵溶液(pH3)的洗脱效果远优于5%甲酸乙腈。随后又通过实验比较了不同浓度乙酸铵洗脱液(20、50、100、125、175 mmol/L)对结果的影响,结果如图7所示:当乙酸铵浓度达到100 mmol/L时,各化合物洗脱效率基本达到峰值,其后即便加大缓冲盐浓度,回收率也只在一个稳定范围内略有波动,基本达到平衡状态,而此时继续加大洗脱液中盐浓度反而会增大上机溶液的离子强度从而造成质谱端的不稳定,综合考虑提取效率与离子强度两个因素,最终选择100 mmol/L乙酸铵溶液(pH3)作为洗脱溶液。

图7 不同浓度乙酸铵对牛奶中AGs洗脱效果研究Fig 7 Research on different concentrations of ammonium acetate solution of AGs in milk
3.4 色谱柱的选择 本文选择了适合强极性样品分析的亲水作用色谱(HILIC)法。HILIC色谱柱固定相包括硅胶、氨基、酰胺基、磺酸甜菜碱两性离子型等[13]。Waters公司 BEH HILIC柱是代表型硅胶分析柱[11],其固定相仅为BEH杂化颗粒,被称为“裸柱(bare silica)”,相关文献[12,15]及实验[13]表明,AGs与固定相之间的强氢键作用会导致大部分AGs难以洗脱、峰形较差,因此能够分析的化合物非常有限[8,14]。Phenomenex公司Luna NH2柱、Waters公司BEH Amide柱的固定相上分别键合了氨基和酰胺基团,主要通过亲水分配作用对氨基糖苷类药物进行分离,流动相中通常含有较高浓度的甲酸铵[11]。Merck公司的ZIC-HILIC两性离子色谱柱固定相上带有共价键合的永久型磺酸甜菜碱型两性离子官能团。实验表明[12-13],ZIC-HILIC柱可同时分析多种氨基糖苷类药物并获得良好的分离度,峰形和灵敏度;但是这种色谱柱仍有一定欠缺:在酸性流动相条件下,碱性的氨基糖苷类化合物带正电,此时需要引入高浓度的NH4+作为流动相(甲酸铵或乙酸铵),以竞争抑制带正电的AGs与带负电的固定相磺酸根阴离子基团之间的作用,从而加快待测物的洗脱,因此通常需要盐浓度为100~200 mmol/L的流动相。高盐流动相引发的盐沉积现象会导致色谱峰对称性差,检测器灵敏度降低等问题[5,16]。本文选用的SiELC Obelisc R色谱柱有效避免了上述3种色谱柱的不足,这种色谱柱采用新型化学修饰方法形成一个液态分离池,类似于活细胞与外界环境之间的平衡,液态分离池存在于一个与流动相不断平衡的环境中,内部分离池环境与外部(流动相)有很大不同。即使外部流动相为低浓度缓冲盐,也能实现带电分析物快速进出分离池的高通量转换。随着外环境的变化,液态池内部会变化出新的长疏水链或亲水链,离子化程度、电荷分布和反离子特性都会发生变化,被长的有机链分开的分离池配合基正负离子可以使正负电荷同时参与静电作用,从而实现低浓度缓冲盐流动相条件下对AGs有效分离。
因此,本文选择了Obelisc R色谱柱对待测物进行分离,并在此基础上对方法进一步优化。
3.5 流动相的选择 本文分别比较了体积分数为0.1%、0.5%、1%甲酸水溶液和乙腈作为流动相时AGs色谱保留情况。实验中发现,当甲酸体积分数为0.1%时,仅STR、DHSTR、SPC可以获得良好的峰形,NEO难以洗脱,其余4种化合物拖尾严重;当甲酸体积分数为0.5%时,STR、DHSTR、SPC、APR出现双峰,其余化合物均有不同程度拖尾现象;当甲酸体积分数为1%时,各化合物均获得满意的保留和峰形。因此最终选取1%甲酸水溶液和1%甲酸乙腈溶液作为流动相。
3.6 基质效应 质谱分析过程中,样品基质中的干扰组分会对目标待测物产生影响,从而产生基质增强或基质抑制效应。本文中评价基质效应的方法是:基质效应=空白基质配制标液响应值/溶剂配制标液响应值×100%。当基质效应在80%~120%之间时,可用标准曲线定量;当基质效应小于80%,为基质抑制效应;当基质效应大于120%时,为基质增强效应,可用基质匹配标准曲线定量。
本文在20 μg/kg添加水平考察了牛奶中AGs基质效应,结果见表4。由表中数据可以看出,STR、DHSTR、SPC、KANA、AMK表现为显著的基质抑制,GEN、NEO和APR表现为显著的基质增强。因此,本文选用基质匹配标准曲线进行定量。

表4 氨基糖苷类化合物在牛奶中的基质效应Tab 4 The matrix effect of AGs in milk
3.7 实际样品分析 运用本文建立的方法进行分析,对本实验室采集的200批次牛奶样品进行测定,检出链霉素2批次,含量在37.4~85.2 μg/kg范围内,其余氨基糖苷类化合物未检出,检出样品符合GB 31650-2019相关规定,未超出限量范围,200批次样品均合格。
本文采用 “液态分离池”Obelisc R色谱柱,建立了牛奶中8种氨基糖苷类药物的液相色谱-四极杆-静电场轨道阱高分辨质谱方法。该方法灵敏度高、专属性强,适用于牛奶中氨基糖苷类药物的定性筛查和定量测定。
